Teoria orbitali molekularnych (MO) (Molecular Orbitals)
Metoda orbitali molekularnych (MO) -
jest to metoda przybliżonego rozwiązywania równania Schrödingera dla cząsteczek mająca za podstawę przybliżenie jednoelektronowe;
stan każdego elektronu opisywany jest jednoelektronową funkcją falową φk(i) (spinorbitalem molekularnym);
całkowitą funkcję falową zakładamy w postaci wyznacznika spinorbitali molekularnych
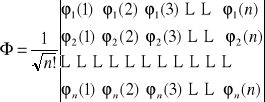
Uwagi:
ponieważ najdokładniejsze orbitale w przybliżeniu jednoelektronowym, to orbitale Hartree-Focka, a więc metoda MO jest (w swoim optymalnym wariancie) faktycznie metodą HF zastosowaną do cząsteczek (układów wieloatomowych);
w odróżnieniu od metody HF zastosowanej do atomów, wprowadzane orbitale (lub spinorbitale) są w metodzie MO orbitalami molekularnymi, czyli są zdelokalizowane na całą cząsteczkę (tzn. są wielocentrowe - każdy z nich opisuje elektron poruszający się w polu wszystkich jąder i pozostałych elektronów).
Konstrukcja orbitali molekularnych (przybliżenie LCAO MO)
W podejściu LCAO MO (Linear combination of atomic orbitals) każdy orbital molekularny (MO) zakładamy w postaci kombinacji liniowej orbitali atomowych (AO).
Uwaga: alternatywnie, każdy MO może być skonstruowany z dowolnych jednoelektronowych funkcji klasy Q
Jon H2+
orbitale 1s dwóch atomów wodoru można zastosować do obliczenia (budowy) orbitali molekularnych układu H2+.
Otrzymujemy wówczas dwa orbitale MO:
ψ+ = N+∙ (1sa+1sb) oraz ψ- = N-∙ (1sa-1sb)
gdzie N+ i N- to współczynniki normalizacyjne:
![]()
(całka S = ∫1sa∙1sbdτ nazywana jest całką nakrywania AO)
W stanie podstawowym jonu H2+ obsadzony jest pojedynczo orbital ψ+, natomiast orbital ψ- pozostaje nieobsadzony.
/patrz również rozdział 13.1. z podręcznika Kołosa, dotyczący H2+/
Wiązanie chemiczne w dwuatomowej cząsteczce homojądrowej (wg teorii MO). Orbitale wiążące i antywiążące.
Jeżeli znamy orbitale molekularne ψ+ i ψ- to możemy obliczyć odpowiadające im energie (jako wartości średnie hamiltonianu):
![]()
Po podstawieniu określonych poprzednio funkcji do ww. równania otrzymujemy:
![]()
![]()
Całka Hab nazywana jest całką rezonansową i zawsze jest Hab ≤ 0
oraz Hab → 0 gdy R → ∞
Uproszczona postać wyrażenia na E±, czyli E± = EH ± Hab prowadzi do ważnych obserwacji:
- energia E+ będzie zawsze mniejsza lub równa energii EH
- energia E- będzie zawsze większa lub równa energii EH
Wnioski:
Elektron w układzie H2+ ma energię niższą niż w atomie H jeżeli jest opisywany orbitalem ψ+
Elektron w układzie H2+ ma energię wyższą niż w atomie H jeżeli jest opisywany orbitalem ψ-
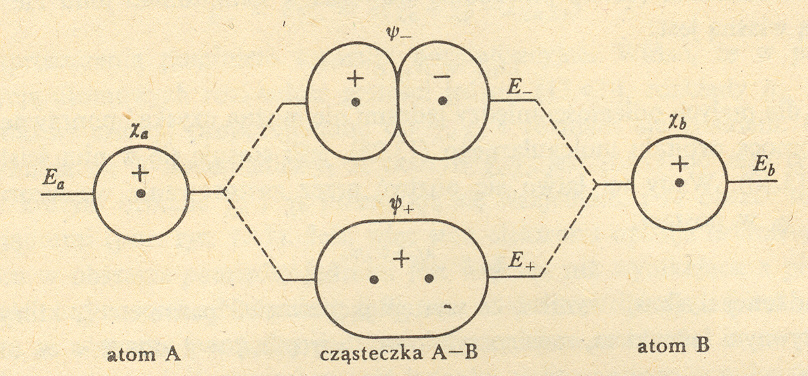
Dlatego orbital ψ+ nazywany jest orbitalem wiążącym, natomiast orbital ψ- nazywany jest orbitalem antywiążącym
Ogólnie: orbitalem wiążącym nazywamy orbital molekularny, któremu odpowiada energia niższa od energii każdego z orbitali atomowych tworzących ten orbital molekularny.
Analogicznie: orbitalem antywiążącym nazywamy orbital molekularny, któremu odpowiada energia wyższa od energii każdego z orbitali atomowych tworzących ten orbital molekularny.
/patrz również powierzchnie węzłowe (lub ich brak) orbitali na rysunku/
Klasyfikacja orbitali molekularnych. Symetria orbitali.
Zazwyczaj rozpatrując tworzenie wiązań chemicznych rozróżnia się orbitale wiążące i antywiążące.
Kolejnym ważnym kryterium jest symetria orbitali:
Orbitale symetryczne względem obrotów o dowolny kąt dokoła osi wiązania nazywamy orbitalami σ (tzw. symetria osiowa).
Orbitale antysymetryczne względem odbicia w płaszczyźnie przechodzącej przez oś wiązania nazywamy orbitalami π
Dokładniejsza klasyfikacja orbitali molekularnych wymaga znajomości teorii grup.
Wiązania jedno-, dwu- i trójelektronowe
Wiązanie jednoelektronowe (takie jak np. w jonie H2+) umożliwia istnienie różnych układów pomimo, iż zaledwie jeden elektron opisywany jest orbitalem wiążącym /tzw. wiązania połówkowe/.
Typowe wiązania chemiczne zapewniające największą trwałość (najsilniejsze wiązania) są wiązaniami dwuelektronowymi - dwa elektrony opisywane są orbitalem wiążącym (np. w cząsteczce H2)
/tzw. wiązania pojedyncze/.
Wiązanie trójelektronowe jest z reguły słabsze niż wiązanie dwuelektronowe, gdyż stablizujący efekt pochodzący od umieszczenia dwóch elektronów na wiążącym orbitalu molekularnym jest osłabiany przez destabilizujący efekt pochodzący od trzeciego elektronu opisywanego antywiążącym orbitalem molekularnym. Z tego powodu jon H2- jest niestabilny (następuje samorzutne oderwanie elektronu po około 10-12-10-14 sekundy). Znane są jednak również stabilne układy z wiązaniami trójelektronowymi, takie jak (NH4)2-
137
Wyszukiwarka
Podobne podstrony:
wykladChK-03, Chemia UŁ, teoretyczna wykład
wykladChK-10, Chemia UŁ, teoretyczna wykład
wykladChK-11, Chemia UŁ, teoretyczna wykład
wykladChK-15, Chemia UŁ, teoretyczna wykład
wykladChK-12, Chemia UŁ, teoretyczna wykład
wykladChK-13, Chemia UŁ, teoretyczna wykład
wykladChK-07, Chemia UŁ, teoretyczna wykład
wykladChK-04, Chemia UŁ, teoretyczna wykład
wykladChK-09, Chemia UŁ, teoretyczna wykład
wykladChK-05, Chemia UŁ, teoretyczna wykład
wykladChK-01, Chemia UŁ, teoretyczna wykład
wykladChK-02, Chemia UŁ, teoretyczna wykład
14 chemiaogolna wyklad 171109, Stała dysocjacji K zależy od temperatury
wyklad 1 1 2008, CHEMIA UŁ, 3 rok, Fizyczna, różne
14. Metody nauczania, Teoretyczne podstawy wychowania
Ćw. 14, chemia fizyczna, Nowy folder
równowagi protolityczne aminokwasów, CHEMIA UŁ, 3 rok, Biochemia
Cwiczenie 6a, Chemia UŁ, Elektrochemia
sciaga I koło, CHEMIA UŁ, 4 rok, Krystalografia
więcej podobnych podstron