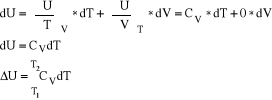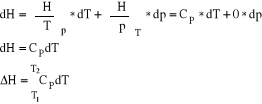WYKŁAD 1_1
1. Układ - otoczenie
Układ to część świata, która jest przedmiotem naszych zainteresowań (w danej chwili ). Reszta świata to otoczenie.
Układ ma ściśle zdefiniowane granice - niekoniecznie rzeczywiste powierzchnie, czasem tylko powierzchnie pomyślane.
UKŁAD IZOLOWANY |
|
|
UKŁAD ZAMKNIĘTY |
|
|
UKŁAD OTWARTY |
|
Δm=0; ΔU=0 |
|
|
Δm=0; ΔU≠0 |
|
|
Δm≠0; ΔU≠0 |
|
Stan układu to jego sytuacja opisana zespołem informacji umożliwiających odtworzenie go dowolną ilość razy.
Ten zespół informacji to parametry stanu ( n1, n2, T, p )
2. Równowaga termodynamiczna czyli wszystkie właściwości układu stałe w czasie dowolnie długim:
-równowaga mechaniczna - nie ma sił niezrównoważonych -tłok się nie porusza, ciśnienia wyrównane;
-równowaga termiczna - nie ma różnic temperatur;
-równowaga chemiczna - stężenia wszystkich składników stałe w czasie i we wszystkich miejscach.
3. Zerowa zasada termodynamiki.
Dwa różne układy kontaktują się przez ściankę: sztywną( nie dopuszczającą do wyrównywania ciśnień),
nieprzepuszczalną (nie ma wymiany masy), diatermiczną (pozwalającą na wymianę ciepła). Jeśli zetknąć takie wybrane dwa układy, to początkowo zachodzić będzie proces wymiany ciepła, potem wszystkie właściwości się ustalą i już nic dziać się nie będzie. Układy będą w równowadze termicznej.
Jeśli układ A jest w równowadze termicznej z układem P(próbnik), oraz jeśli układ D jest w równowadze termicznej z układem P(próbnik), to ( bez sprawdzania można być pewnym ) układ A jest w równowadze termicznej z układem D.
Stąd wniosek - jest jedna wielkość charakteryzująca stan równowagi termicznej. Nazwano ją TEMPERATURA.
Różnica temperatur to miernik oddalenia od stanu równowagi termicznej.
4. Termodynamiczna skala temperatur
Zaobserwowano, że dla wszystkich gazów granica iloczynu pV zależy od temperatury - jest do niej wprost proporcjonalna.
![]()
Doświadczenia wyglądały następująco:
- Cylinder z tłokiem zawierający 1 mol gazu zanurzony był w łaźni zawierającej wodę stałą, ciekłą i gazową (punkt potrójny wody służący jako wzorzec ) i zmierzono iloczyn pV dla trzech różnych położeń tłoka czyli dla trzech
różnych ciśnień p1, p2, p3.
- Powtórzono doświadczenie dla cieplejszej łaźni.
temperatura łaźni T temperatura łaźni Tppw
Sporządzono wykresy pV=f(p) i odczytano przez ekstrapolację![]()
oraz ![]()
(jakaś liczba, tutaj większa od ![]()
bo łaźnia żółta cieplejsza od niebieskiej).
Sytuacja współistnienia wszystkich trzech stanów skupienia wody
(punkt potrójny wody) niech będzie wzorcowa dla tej wielkości - temperatury.
![]()
czyli ![]()
gdzie 2271 to wartość eksperymentalna.
Przypisano tej temperaturze(Tppw) wartość 273,16K, wtedy stała proporcjonalności R ma wartość 8,314J/molK.
Przypisanie ![]()
powoduje, że K (kelvin, jednostka na skali temperatury termodynamicznej) to taka sama
różnica temperatur jak stopień Celsjusza ( ΔT= Δt) I to jest wygodne - dlatego przyjęto arbitralnie Tppw =273,16K.
Orientacyjne punkty na skali temperatur: 273,16K - punkt potrójny wody (0,01ºC); 273,15K - temperatura topnienia lodu pod ciśnieniem 1atm (0ºC); 373,15K - temperatura wrzenia wody pod ciśnieniem 1atm (100ºC)
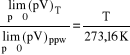
TERMODYNAMICZNA DEFINICJA TEMPERATURY
5. Przemiany - podział na trzy typy. - najpierw przykłady potem uogólniona nazwa typu
1.Stan początkowy: H2O stała, 0°C, 1atm - stan końcowy: H2O ciekła, 0°C, 1atm Przemiana polega na stopieniu się lodu. |
1.Gaz w ilości 1mola zamknięty w zbiorniku (T1 ,p1 ,V ) ogrzano do temp. T2 (T2 , p 2 , V). PRZEMIANA IZOCHORYCZNA
|
1. W stałej temperaturze i pod stałym ciśnieniem w miejsce substratów pojawiają się produkty
|
2.Para wodna o temp. 100°C i o p=1atm skrapla się i na końcu jest ciecz o temp.100°C i p=1atm
. |
2.Gaz (T1 ,p ,V1 ) w ilości 1mola zamknięty w zbiorniku z ruchomym tłokiem ogrzewano aż jego objętość wzrosła do V2 (T2 ,p ,V2). PRZEMIANA IZOBARYCZNA |
2. W stałej temperaturze i w stałej objętości w miejsce substratów pojawiają się produkty
|
itd |
3.Gaz (p1 ,V1 , T) w stałej temp. ulega sprężeniu do p2 (T, V2). PRZEMIANA IZOTERMICZNA
|
itd |
|
4.Gaz (p1 ,V1 , T1 ) bez wymiany ciepła z otoczeniem (izolacja albo b.szybki proces ) ulega rozprężeniu do p2 (T2 , V2). PRZEMIANA ADIABATYCZNA
|
|
|
5.Ciecz podgrzana od T 1 do T 2 .
|
|
|
itd.
|
|
PRZEMIANY FAZOWE
|
PRZEMIANA TYPU PVT. |
REAKCJE CHEMICZNE |
6. Przemiany typu pVT - podział według sposobu prowadzenia.
|
Jeśli chcemy, aby w ustalonej temperaturze gaz powiększył swą objętość, to z zewnątrz musi być trochę niższe ciśnienie niż wewnątrz. Wtedy gaz się rozpręży. Jeśli teraz chcemy ze stanu (2) wrócić do stanu (1), czyli aby tłok przesunął się w dół ciśnienie na zewnątrz musi być trochę wyższe niż w środku. Fakt, że ciśnienie na zewnątrz jest inne niż wewnątrz oznacza, że nie ma równowagi termodynamicznej. TAKIE PRZEMIANY TO PRZEMIANY NIEODWRACALNE Gdyby niedomiar ciśnienia przy rozprężaniu (1-2) i nadwyżka ciśnienia przy sprężaniu (2-1) była tak mała, że aż zerowa, to obie przemiany -(1-2) i (2-1) - szłyby przez te same punkty na wykresie, te same stany pośrednie. TO BYŁABY PRZEMIANA ODWRACALNA. Ale sprężanie gazu przy zerowej nadwyżce ciśnienia szłoby nieskończenie długo. Ale rozprężanie gazu przy zerowej niedomiarze ciśnienia szłoby nieskończenie długo. Przemiana odwracalna to model graniczny, nie realna przemiana. Przemiana odwracalna ma zerową siłę napędową. ( dp, dT, dc,....) Przemiana odwracalna to ciąg kolejnych stanów równowagi. |
7. Energia wewnętrzna układu. U mierzona w J/mol
jest to suma wszystkich rodzajów energii w układzie.
energia jądrowa, elektronowa, energia wiązań chemicznych,
energia ruchu translacyjnego cząsteczek,
energia ruchu rotacyjnego cząsteczek,
energia ruchu oscylacyjnego cząsteczek,
energia oddziaływań międzycząsteczkowych, itd., itp.
Absolutna wartość energii wewnętrznej nieznana (nie do zmierzenia), ale do zmierzenia są zmiany energii wewnętrznej.
ΔU→w całej przemianie od 1 do 2; dU→w różniczkowym fragmencie przemiany
U(V,T) energia wewnętrzna jako funkcja dwu zmiennych.
ΔU = U2 -U1 stan końcowy minus stan początkowy.
Bez względu jaką drogą dokonuje się przejście od (1) do (2) ΔU jest ciągle takie samo
ENERGIA WEWNĘTRZNA JEST FUNKCJĄ STANU.
8. Pierwsza zasada termodynamiki ΔU=Q+w dU=Qel +wel
Q - energia wymieniona między układem a otoczeniem na sposób ciepła
w - energia wymieniona między układem a otoczeniem na sposób pracy
Ani Q ani w nie jest funkcją stanu - na różnych drogach mogą być różne wartości Q i w.
Choć ich suma jest zawsze taka sama.
Rodzaje pracy (przykłady)
-praca zmiany objętości,
-praca elektryczna,
-praca powiększania powierzchni (np.emulgowanie),
-itd. LISTA NIE JEST ZAMKNIĘTA
W przemianach gazów typu pVT ograniczamy się tylko do pracy objętościowej.
IwelI = siła ∗ przesunięcie = p ∗ S ∗ dl =p ∗ dV
Umowa, że gdy układ wykonuje pracę rozprężając się przeciw ciśnieniu zewnętrznemu, to wel <0
Z punktu widzenia układu była to strata energii.
Gdy dV>0 i zawsze p>0 to wel <0 → wel = -p∗dV definicja pracy objętościowej.
9. Entalpia H J/mol, H = U + p∗V ,
ΔH→w całej przemianie od 1 do 2; dH→w różniczkowym fragmencie przemiany
ΔH = H2 -H1 stan końcowy minus stan początkowy. ENTALPIA JEST FUNKCJĄ STANU.
Bez względu jaką drogą dokonuje się przejście od (1) do (2), ΔH jest ciągle takie samo.
Dla przemiany izochorycznej gdy dV=0 z I zasady termodynamiki dU=Qel -pdV wynika dU=Qel
Ilość wymienionego ciepła w przemianie izochorycznej jest miarą zmian energii wewnętrznej.
Dla przemiany izobarycznej gdy dp=0 z I zasady termodynamiki i z definicji entalpii wynika:
dH = dU + pdV + Vdp dH = Qel - pdV + pdV + Vdp dH = Qel + Vdp
dH = Qel. Ilość wymienionego ciepła w przemianie izobarycznej jest miarą zmian entalpii.
10. Molowe pojemności cieplne.
![]()
![]()
H(p,T) U(V,T)
Wykres wg Ellwella pojemności cieplnej gazu dwuatomowego w funkcji temperatury - „schodki”
ZASADA EKWIPARTYCJI ENERGII
Doświadczalne dane molowej pojemności cieplnej gazów jako funkcji temperatury układają się w wykres schodkowy ( powyżej).
Wyjaśnienie tego fenomenu znajdujemy w kwantowej naturze energii:
po pierwsze - energii dostarczanej w trakcie ogrzewania |
po drugie- energii odbieranej przez układ |
ciepło dostarczane w temperaturze niskiej popakowane jest w małe paczki - jest strumieniem małych kwantów |
gaz może konsumować dostarczaną energię przyspieszając ruch translacyjny (odległości między kolejnymi dozwolonymi stanami są bardzo małe, więc nawet maleńkie kwanty dostarczanej energii są tutaj użyteczne) „sito translacyjne wyłapujące energię ma maleńkie otwory”
|
jest w średnie paczki - jest strumieniem średnich kwantów;
|
gaz może konsumować dostarczaną energię przyspieszając ruch rotacyjny (odległości między kolejnymi dozwolonymi stanami są średnie, więc maleńkie kwanty dostarczanej energii są nieużyteczne, dopiero od pewnego rozmiaru dostarczanych kwantów może następować konsumowanie energii przez ruch rotacyjny) „sito rotacyjne wyłapujące energię ma średnie otwory”
|
|
gaz może konsumować dostarczaną energię, przyspieszając ruch oscylacyjny (odległości między kolejnymi dozwolonymi stanami są duże, więc maleńkie kwanty i średnie kwanty dostarczanej energii są nieużyteczne, dopiero przy dużym rozmiarze dostarczanych kwantów może następować konsumowanie energii przez ruch oscylacyjny ), „sito oscylacyjne wyłapujące energię ma duże otwory”
|
Jak można wyobrazić sobie proces ogrzewania UKŁAD - u ?
DESZCZ KWANTÓW małych, bo temperatury niskie
Temperatury niskie: Strumień kwantów energii zatrzymuje się tylko w „sicie translacyjnym”, Sito rotacyjne i sito oscylacyjne mają za duże dziury
|
DESZCZ KWANTÓW średnich , bo temperatury średnie:
Temperatury średnie: Strumień kwantów energii zatrzymuje się w „sicie translacyjnym” I w „sicie rotacyjnym”. Pobieranie energii dla ruchu rotacyjnego zaczyna się od takiej temperatury, przy której kwanty energii są dostatecznie duże, aby przenieść rotor z poziomu 0 na poziom 1
|
Deszcz kwantów dużych, bo temperatury wysokie:
Temperatury wysokie: Strumień kwantów energii zatrzymuje się w „sicie translacyjnym” , w „sicie rotacyjnym” i w „sicie oscylacyjnym”. Pobieranie energii dla ruchu oscylacyjnego zaczyna się od takiej temperatury, przy której kwanty energii są tak duże, że wystarczają do przeniesienia cząsteczek jako oscylatorów z poziomu 0 na poziom 1.
|
Jaki gaz |
t ilość stopni swobody ruchu translacyjnego |
r ilość stopni swobody ruchu rotacyjnego |
osc ilość stopni swobody ruchu oscylacyjnego |
cząsteczki jednoatomowe |
3 |
0 |
0 |
cząsteczki dwuatomowe |
3 |
2 |
1 |
cząsteczki trójatomowe liniowe |
3 |
2 |
4 |
cząsteczki trójatomowe nieliniowe |
3 |
3 |
3 |
cząsteczki n-atomowe liniowe |
3 |
2 |
(3n-5) |
cząsteczki n-atomowe nieliniowe |
3 |
3 |
(3n-6) |
Udziały w CV na jeden stopień swobody w rozważanym rodzaju ruchu |
|
|
|
Przykładowe substancje i ich CV oszacowane wg zasady ekwipartycji energii
w trzech przedziałach temperatur.
Substancja |
temperatury niskie
|
temperatury średnie
|
temperatury wysokie
|
He |
|
|
|
H2 |
|
|
|
CO2 |
|
|
|
H2O |
|
|
|
CS2 |
|
|
|
C2H2 |
|
|
|
CH4 |
|
|
|
NH3 |
|
|
|
Wnioski: 1. Najłatwiej ze wszystkich ogrzewa się hel
2.W średnich temperaturach tylko trzy możliwości CV =1,5R; CV =2,5R albo CV =3R
3. W wysokich temperaturach CV substancji bardzo się różnicuje.
ZASADĘ EKWIPARTYCJI ENERGII STOSOWAĆ TYLKO PRZY BRAKU INNYCH INFORMACJI
11. Parametry stanu (p, V, T) nie są wszystkie zmiennymi niezależnymi.
Dwa spośród nich można dowolnie wybrać. Wtedy trzeci wyniknie już z tego wyboru.
Istnieje związek, czyli równanie wiążące te TRZY parametry. Jest to równanie stanu.
Dla gazu doskonałego ma ono postać: ![]()
albo ![]()
12. Energia wewnętrzna i entalpia to funkcje dwu zmiennych. Których spośród trzech?
Rzecz umowna. Wybieramy tutaj U(V,T), oraz H(p,T).
|
|
|
|
Pochodna cząstkowa
zgodnie z pierwszym termodynamicznym równaniem stanu (wyprowadzenie na wykładzie 2_2) |
Pochodna cząstkowa
zgodnie z drugim termodynamicznym równaniem stanu (wyprowadzenie na wykładzie 2_2) |
Ta pochodna w zastosowaniu do gazu doskonałego wynosi zero, bo
|
Ta pochodna w zastosowaniu do gazu doskonałego wynosi zero, bo
|
Wracając do pierwszego wiersza
|
Wracając do pierwszego wiersza
|
Oprócz dwu termodynamicznych równań stanu, które były w użyciu powyżej, jest jeszcze trzecie:
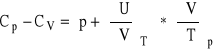
Wyprowadzenie trzeciego termodynamicznego równania stanu:
Różniczkę dU wyrażam raz z I zasady termodynamiki, raz jako różniczkę zupełną funkcji U(V,T).
![]()
czyli ![]()
Obie strony równania dzielę przez dT przy p=const
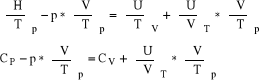
→ ![]()
Dla gazu doskonałego, dla którego pV = RT, czyli ![]()
trzecie termodynamiczne równanie stanu sprowadza się do zależności: ![]()
13. Znajdowanie. kompletu parametrów stanu początkowego (p1 , V1 , T1 ) i stanu końcowego (p2 , V2 , T2 ).
Przemiana |
Przydatne w obliczeniach równania |
||||
izochoryczna |
|
|
|
||
izobaryczna |
|
|
|
||
izotermiczna |
|
|
|
||
adiabatyczna odwracalna |
|
|
|
|
|
adiabatyczna nieodwracalna ciśnienie zewn. stałe ( p2) |
|
|
|
||
7
Opracowanie: dr inż. B. Andruszkiewicz
Wyszukiwarka
Podobne podstrony:
wykladChK-03, Chemia UŁ, teoretyczna wykład
wykladChK-10, Chemia UŁ, teoretyczna wykład
wykladChK-11, Chemia UŁ, teoretyczna wykład
równowagi protolityczne aminokwasów, CHEMIA UŁ, 3 rok, Biochemia
wykladChK-15, Chemia UŁ, teoretyczna wykład
sciaga I koło, CHEMIA UŁ, 4 rok, Krystalografia
krystalografia kolokwium I LAB, CHEMIA UŁ, 4 rok, Krystalografia
Kryształki lab ściąga, CHEMIA UŁ, 4 rok, Krystalografia
AK-REACTIVITY, CHEMIA UŁ, 3 rok, Biochemia
spektroskopia ściągi, CHEMIA UŁ, 4 rok, Spektroskopia
Spektroskopia LAB kolokwium, CHEMIA UŁ, 4 rok, Spektroskopia
wykladChK-12, Chemia UŁ, teoretyczna wykład
wykladChK-13, Chemia UŁ, teoretyczna wykład
wykladChK-07, Chemia UŁ, teoretyczna wykład
wykladChK-14, Chemia UŁ, teoretyczna wykład
AK-BIOSYNTEZA, CHEMIA UŁ, 3 rok, Biochemia
wykladChK-04, Chemia UŁ, teoretyczna wykład
wykladChK-09, Chemia UŁ, teoretyczna wykład
Prawo karne 2008, Prawo UŁ, rok II 2012, Prawo karne
więcej podobnych podstron