
chemia stosowana I
temat:
związki kompleksowe

tworzenie hydratów soli
MgCl
2
·6H
2
O [Mg(H
2
O)
6
2+
](Cl
–
)
2
FeCl
3
·6H
2
O [Fe(H
2
O)
6
3+
](Cl
–
)
3
KAl(SO
4
)
2
·12H
2
O [K(H
2
O)
6
+
][Al(H
2
O)
6
3+
]
(SO
4
2–
)
2
NiSO
4
·7H
2
O [Ni(H
2
O)
6
2+
](SO
4
2–
)(H
2
O)
Mg
2+
Cl
pojęcia podstawowe
Fe
3+
+ 6 CN
–
[Fe(CN)
6
]
3–
ligand - L
atom
centralny,
metal - M
[Fe(CN)
6
]
3–
– jon kompleksowy
K
3
[Fe(CN)
6
] – związek kompleksowy,
koordynacyjny, zespolony

struktura przestrzenna kompleksów
LK - liczba koordynacyjna
•
•
•
LK = 2, liniowa
•
•
•
•
•
LK = 4, tetraedryczna
•
•
• •
•
LK = 4, płasko-kwadratowa
• •
•
• •
•
•
LK =6, oktaedryczna
zdolność do tworzenia kompleksów
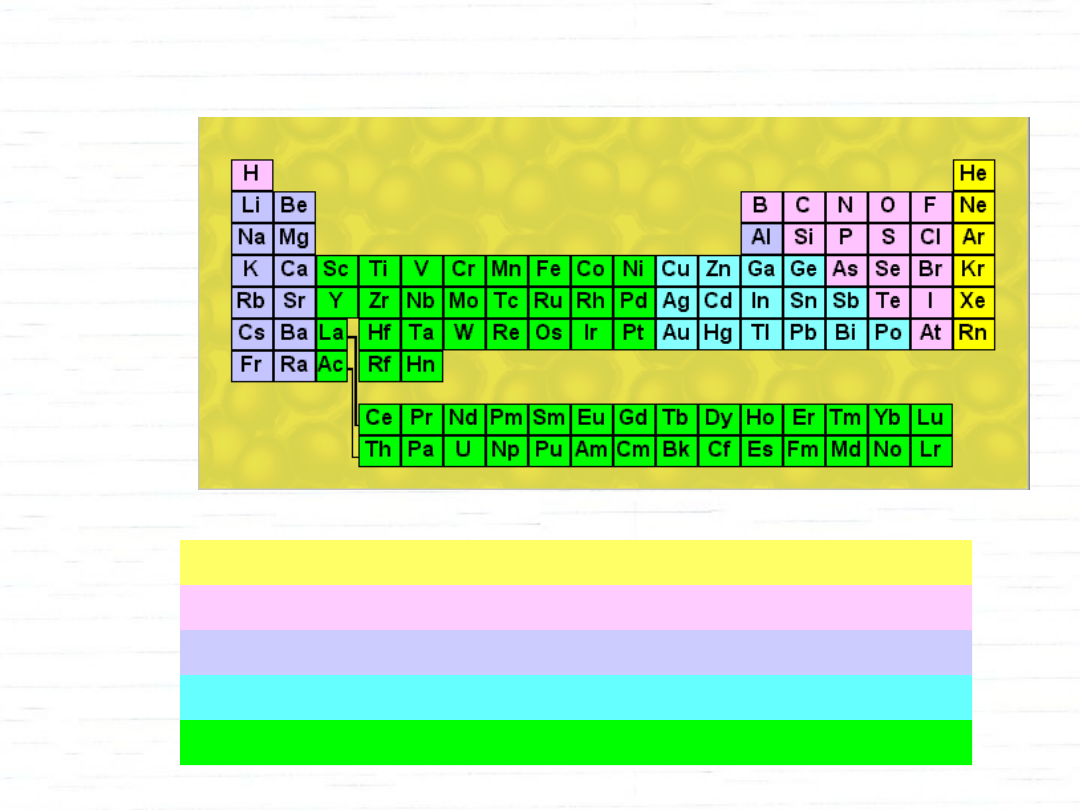
gazy szlachetne - nie tworzą kompleksów
niemetale - nie tworzą kompleksów
metale I - tworzą jedynie nieliczne kompleksy
metale II - tworzą kompleksy
metale III - szczególnie łatwo tworzą liczne kompleksy

przegląd ligandów
Ligandami mogą być obojętne cząsteczki lub aniony
zawierające atomy z wolnymi parami elektronowymi.
W szczególności S, N, O, fluorowce (F, Cl, Br, I),
a nawet C i H.
Ligandy z fluorowcami (tylko proste aniony):
jony fluorkowe (F
–
):
[FeF
6
]
3–
, [BF
4
]
–
,
[SiF
6
]
2–
jony chlorkowe (Cl
–
): [SnCl
6
]
2–
, [AuCl
4
]
–
,
[PtCl
6
]
2–
jony jodkowe (I
–
):
[CdI
4
]
2–
, [BiI
4
]
–
,
[HgI
4
]
2–
Ligandy z wodorem:
jony wodorkowe (H
–
): [AlH
4
]
–
, [BH
4
]
–
silne reduktory LiAlH
4
, NaBH
4
rozpuszczanie metali szlachetnych przez wodę
królewską (HNO
3
+ HCl)

przegląd ligandów
Ligandy z tlenem:
woda (H
2
O)
jony hydroksylowe (OH
–
):
[Al(OH)
4
]
–
, [Sn(OH)
3
]
–
, [Zn(OH)
4
]
2–
jony węglanowe (CO
3
2–
), jony fosforanowe (PO
4
3–
),
jony siarczanowe(VI) (SO
4
2–
), jony siarczanowe(IV) (SO
3
2–
)
jony azotanowe(III) (nitrito-O) (ONO):
[Co(ONO)
6
]
3–
jony karboksylanowe (RCOO
–
):
[Pb(CH
3
COO)
4
]
2–
jony tlenkowe (O
2–
):
[CrO
4
]
2–
, [MnO
4
]
–
nadtlenek wodoru (H
2
O
2
):
[TiO(H
2
O
2
)]
2+
jony nadtlenkowe (O
2
2–
):
[CrO(O
2
)]

przegląd ligandów
Ligandy z siarką:
jony tiosiarczanowe (S
2
O
3
2–
): [Ag(S
2
O
3
)
2
]
3–
,
stosowany jako utrwalacz fotograficzny
jony siarczkowe (S
2–
):
[AsS
3
]
3–
, [SbS
3
]
3–
,
[SnS
3
]
2–
jony rodankowe (tiocyjano-S) (SCN
–
)
[Fe(SCN)
6
]
3–
, [Co(SCN)
4
]
–
Ligandy z węglem:
jony cyjankowe (CN
–
):
[Ag(CN)
2
]
–
, [Au(CN)
2
]
–
,
[Au(CN)
4
]
–
,
[Cd(CN)
4
]
2–
,
[Fe(CN)
6
]
3–
,
[Fe(CN)
6
]
4–
ważne zastosowanie w galwanotechnice, ekstrakcja złota

przegląd ligandów
Ligandy z azotem:
amoniak (NH
3
):
[Ag(NH
3
)
2
]
+
, [Cu(NH
3
)
4
]
2+
,
[Zn(NH
3
)
4
]
2+
odczynnik Schweitzera (rozpuszcza celulozę):
Cu(OH)
2
+ 4NH
3
[Cu(NH
3
)
4
]
2+
(OH
–
)
2
hydrazyna (N
2
H
4
), hydroksyloamina (NH
2
OH),
jony rodankowe (tiocyjano-N) (SCN
–
), jony azydkowe (N
3
–
)
jony azotanowe(III) (nitrito-N) (NO
2
)
etylenodiamina (en = NH
2
CH
2
CH
2
NH
2
):
[Cu(en)
2
]
2+
,
[Cd(en)
2
]
2+
odczynniki do rozpuszczania celulozy:
CUEN
[Cu(en)
2
]
2+
(OH
–
)
2
CADOXEN
[Cd(en)
2
]
2+
(OH
–
)
2
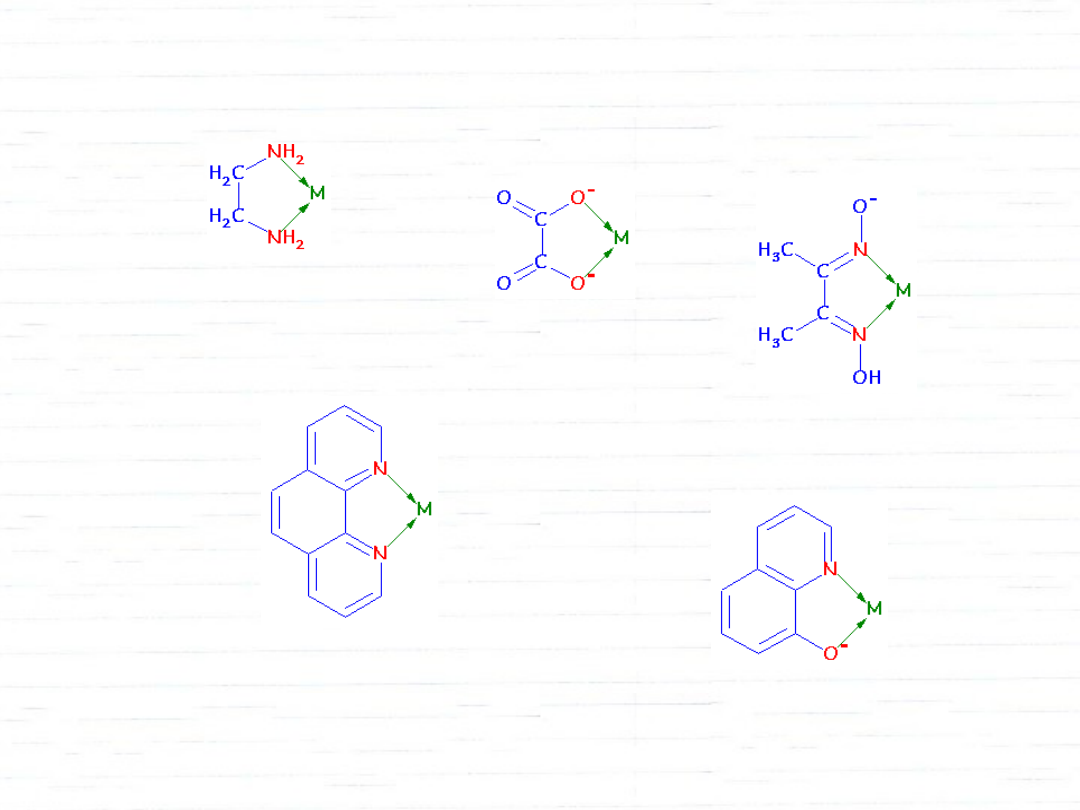
ligandy chelatowe (kleszczowe)
jony szczawianowe (ox):
[Fe(ox)
3
]
3–
dimetyloglioksym (dmg):
[Ni(dmg)
2
]
1,10-fenantrolina (phen):
[Fe(phen)
3
]
2+
8-hydroksychinolina (oxinate):
[Al(oxinate)
3
]
etylenodiamina (en)
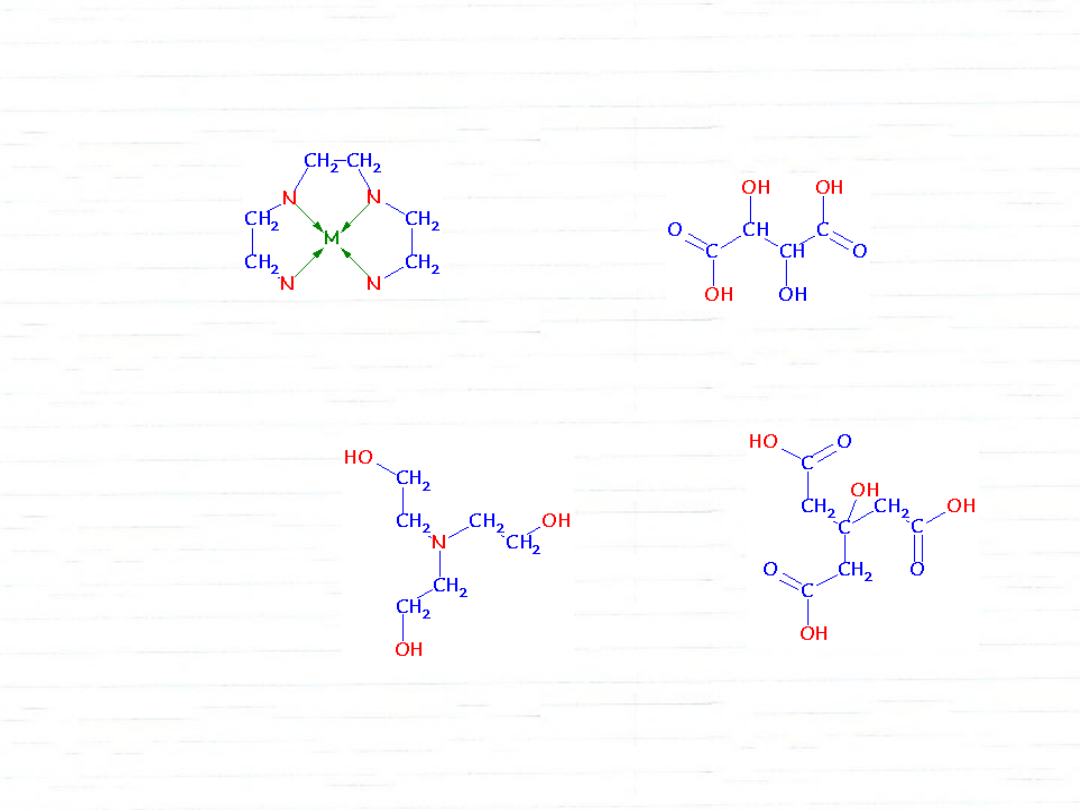
ligandy wielokleszczowe
trietylenotetraamina (trien)
kwas winowy (tartrate)
kwas cytrynowy (citrate)
trietanoloamina (tea)
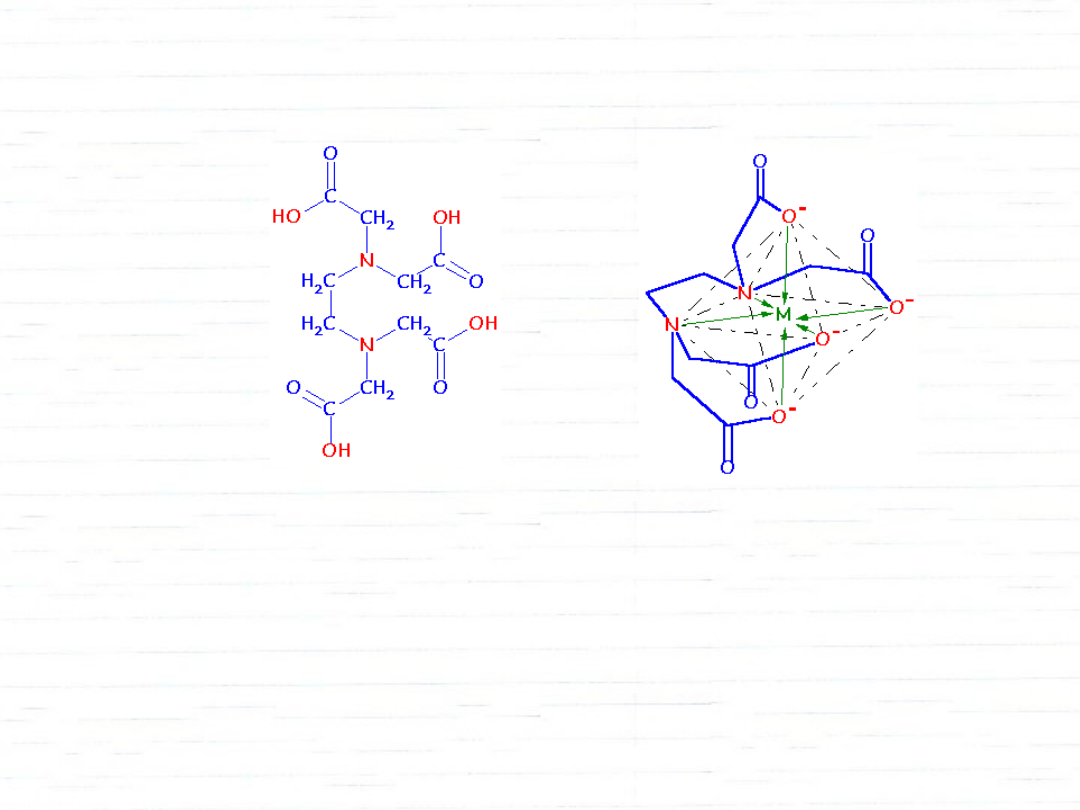
EDTA
kwas etyleno_di_amino_terta_octowy (EDTA)
Trwałość kompleksów chelatowych jest znacznie większa.
EDTA tworzy kompleksy nawet z Mg
2+
lub Ca
2+
.
Służy m.in. do oznaczania stopnia twardości wody.

izomerie związków kompleksowych
izomeria jonowa:
[Co(NH
3
)
5
(SO
4
)]Br
-
[Co(NH
3
)
5
Br]SO
4
izomeria wiązaniowa:
jony pentaamina(nitrito-N)kobaltu(III)
[Co(NH
3
)
5
(
N
O
2
)]
2+
jony pentaamina(nitrito-O)kobaltu(III)
[Co(NH
3
)
5
(
O
NO)]
2+
izomeria hydratacyjna:
[Cr(H
2
O)
6
]Cl
3
-
[Cr(H
2
O)
5
Cl]Cl
2
·H
2
O
-
[Cr(H
2
O)
4
Cl
2
]Cl·2H
2
O
izomerie związków kompleksowych
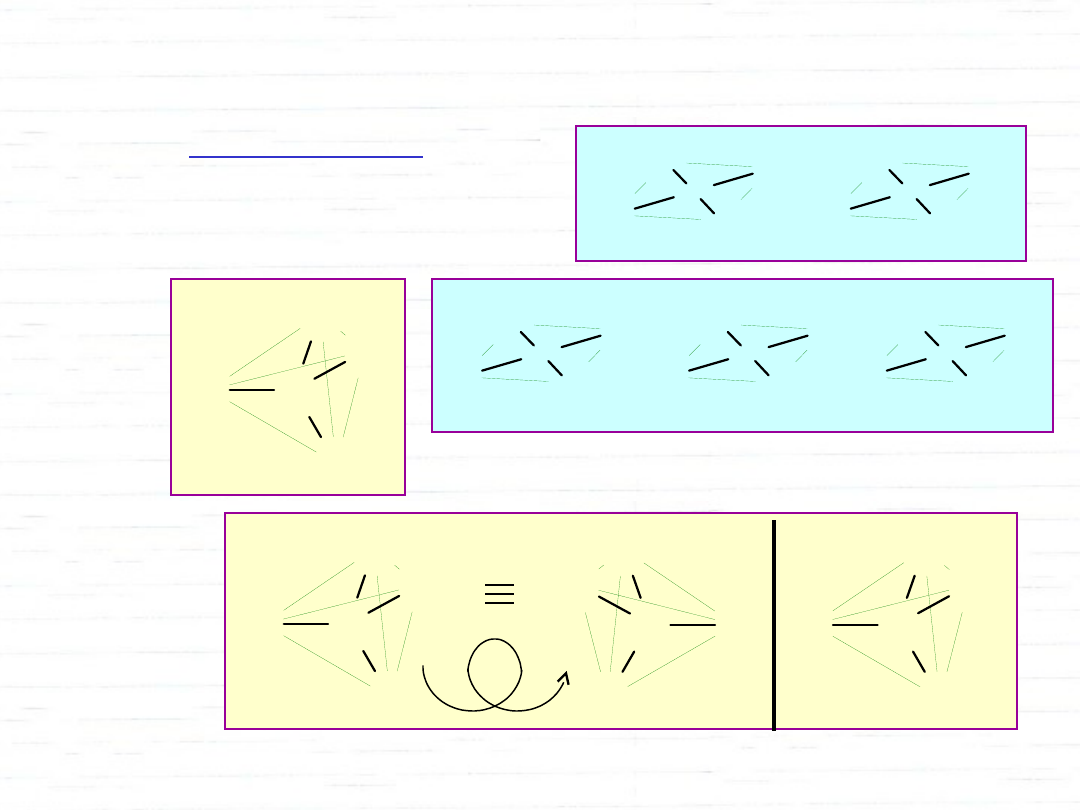
stereoizomeria:
• geometryczna
• optyczna
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
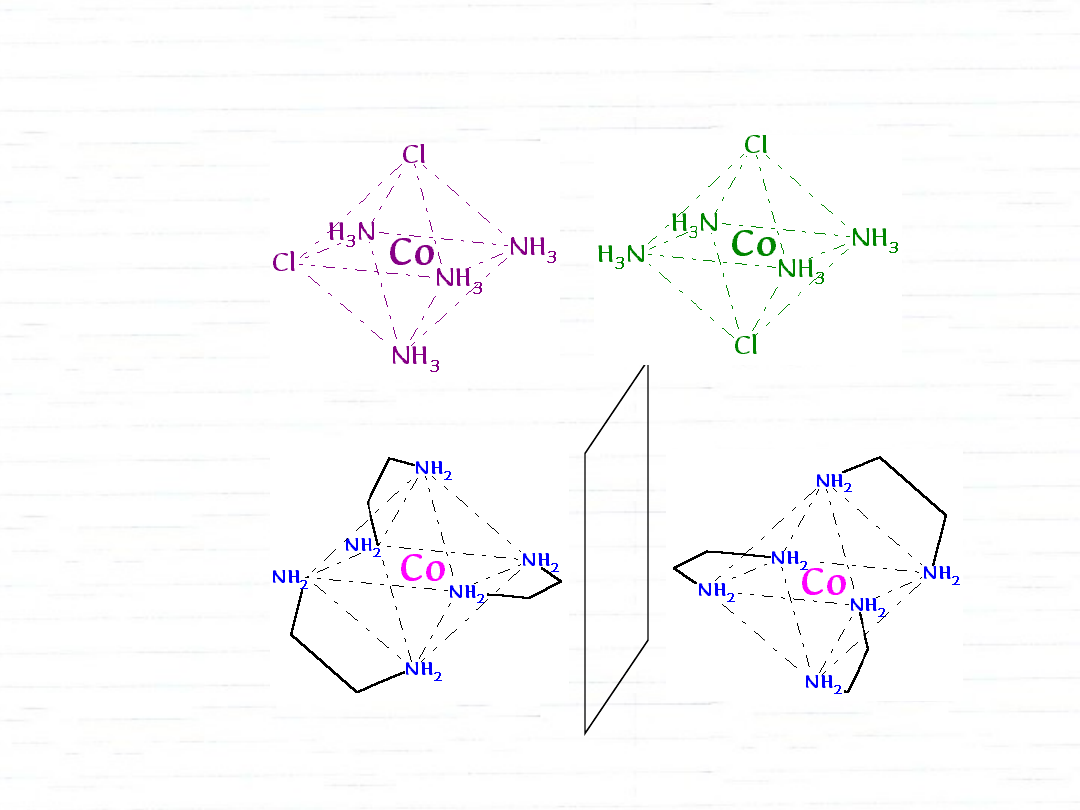
izomerie związków kompleksowych

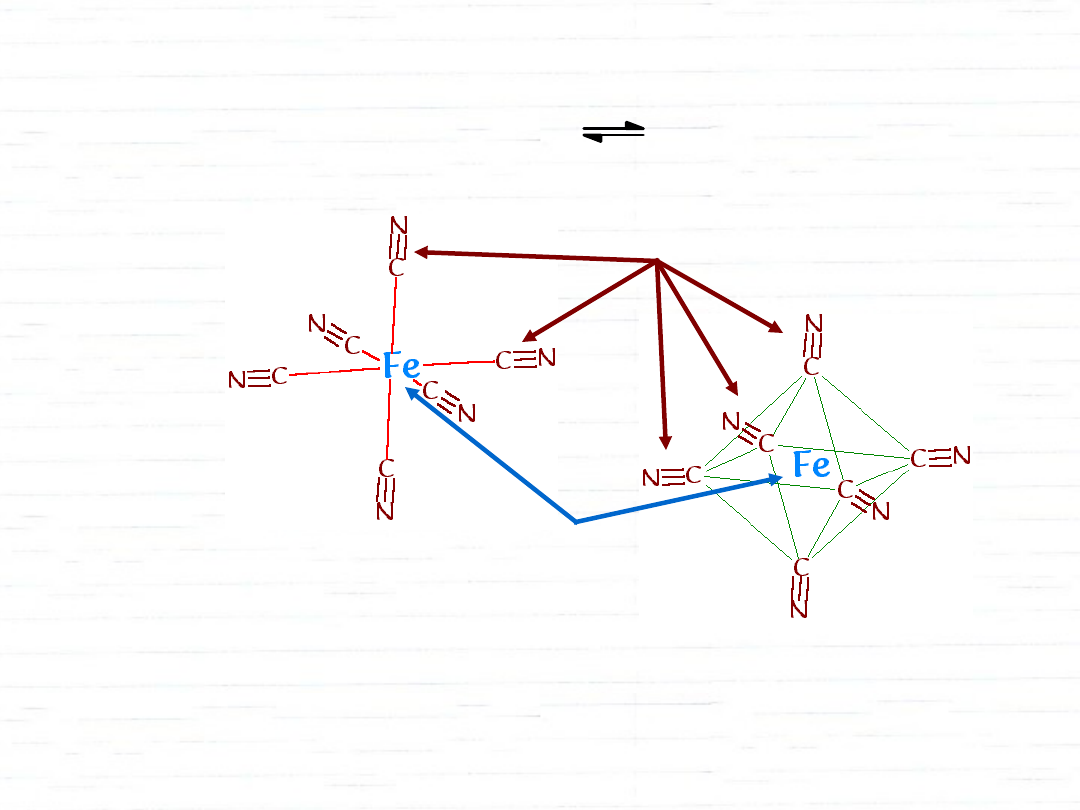
równowaga tworzenia kompleksu
Fe
3+
+ 6 CN
–
[Fe(CN)
6
]
3–
=
________
C
[Fe(CN)
6
]
3–
C
Fe
3+
·C
6
CN
–
[Fe(CN)
6
]
3–
Fe
3+
+ 6 CN
–
K =
________
C
Fe
3+
·C
6
CN
–
C
[Fe(CN)
6
]
3–
stała trwałości kompleksu:
stała dysocjacji kompleksu:
log = –logK = pK

równowagi stopniowe
[Ni(H
2
O)
6
]
2+
[Ni(H
2
O)
5
(NH
3
)]
2+
[Ni(H
2
O)
4
(NH
3
)
2
]
2+
[Ni(H
2
O)
3
(NH
3
)
3
]
2+
[Ni(H
2
O)
2
(NH
3
)
4
]
2+
[Ni(H
2
O)(NH
3
)
5
]
2+
[Ni(NH
3
)
6
]
2+
[Co(H
2
O)
6
]
3+
..
[Co(H
2
O)(NH
3
)
5
]
3+
[Co(NH
3
)
6
]
3+
[Cr(NH
3
)
6
]
3+
[CrCl(NH
3
)
5
]
2+
[CrCl
2
(NH
3
)
4
]
+
[CrCl
3
(NH
3
)
3
]
[CrCl
4
(NH
3
)
2
]
–

wpływ trwałości kompleksów na rozpuszczalność
AgCl
/s/
Ag
+
+ Cl
–
pK
so
= 9,96 C
Ag
+
= 1,05×10
–5
M
AgBr
/s/
Ag
+
+ Br
–
AgI
/s/
Ag
+
+ I
–
Ag
2
S
/s/
2Ag
+
+ S
2–
pK
so
= 12,4 C
Ag
+
= 6,31×10
–7
M
pK
so
= 16,0 C
Ag
+
= 1,00×10
–8
M
pK
so
= 49,5 C
Ag
+
= 3,98×10
–17
M
Ag
+
+ 2NH
3
[Ag(NH
3
)
2
]
+
Ag
+
+ 2S
2
O
3
2–
[Ag(S
2
O
3
)
2
]
3–
Ag
+
+ 2CN
–
[Ag(CN)
2
]
–
log = 7,6 C
Ag
+
= 3,9×10
–8
M
log = 12,8 C
Ag
+
= 2,5×10
–13
M
log = 21,4 C
Ag
+
= 6,2×10
–22
M
zakładając początkowo C
Ag
+
= 0,01M i C
L
=
0,1 M
AgCl rozpuszcza się już w (NH
4
)
2
CO
3 /aq/
(małe stężenie NH
3
)
AgBr rozpuszcza się w NH
3 /aq/
AgI nie rozpuszcza się w NH
3 /aq/
, ale rozpuszcza w Na
2
S
2
O
3
/aq/
Ag
2
S nie rozpuszcza się w Na
2
S
2
O
3/aq/
, ale rozpuszcza w
KCN
/aq/
równowagi w roztworach - podsumowanie
AgNO
3
+
CH
3
COONH
4
H
2
O, Ag
+
,
NH
4
+
, NO
3
–
,
CH
3
COO
–
H
3
O
+
+
OH
–
CH
3
COOAg
/s/
NH
3
+ H
3
O
+
OH
–
+
CH
3
COOH
H
3
O
+
OH
–
NH
3
CH
3
COOH
[Ag(NH
3
)
2
]
+
CH
3
COOAg
/s/
AgOH
/s/
[Ag(NH
3
)
2
]
+
AgOH
/s/
?
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
Wyszukiwarka
Podobne podstrony:
KOMPLEKSY POLAKOW wykl 29 03 2012
pytania nowe komplet
zwiazki kompleksowe 2
W19 kompleksonometria, wska«niki i krzywe miareczkowania kompleks i
Bliskowschodni kompleks bezpieczeństwa Przyczyny destabilizacji w regionie
Kompleksowa ocena geriatryczna
Komplementarnosc
Kompleksowa rozgrzewka z pilkam Nieznany
Kompleksowa rozgrzewka z pilkam Nieznany (2)
ModulIII cz3 kompleksy i osady Nieznany
Metody kompleksowego zarządzania jakością karty kontrolne
dok po wypadku komplet, polec pow
transport zywnosci, Transport Polsl Katowice, 5 semestr, TPD, Komplet
Procedury check in i check out oraz kompleksowa obsługa, powtórki do egzaminów
Laborki 5 zadania kompleksy
Techniki Negocjacji i Mediacji kompletny materiał z wykładów
Sprawozdanie 6 związki kompleksowe
więcej podobnych podstron