
Zastosowania analityczne reakcji
kompleksowania
Wiele metod analitycznych wykorzystuje
tworzenie się kompleksów:
grawimetria (analiza wagowa) - np. kompleks
Ni
+2
z dwumetyloglioksymem
metody objętościowe - głównie zastosowanie
EDTA jako titranta
spektrofotometria - np. kompleksy metali z
dwutiokarbaminianami
związki kompleksowe stosuje się często jako
wskaźniki lub do maskowania substancji
przeszkadzających w analizie.

Teorie tworzenia kompleksów
Teoria wiązań walencyjnych
: rozkład par
elektronowych i tworzenie orbitali
shybrydyzowanych. Wyjaśnia geometrię
kompleksów.
Teoria pola krystalicznego
: zmiany poziomów
energetycznych metalu centralnego. Wyjaśnia
własności spektroskopowe i barwność
kompleksów.
Teoria pola ligandów
: rozważa tworzenie wiązań
kowalencyjnych i jonowych w kompleksach.

Ligandy i jony (atomy) centralne
Ligandy można je podzielić na podstawie liczby
wolnych par elektronowych (w więc liczby
tworzonych wiązań koordynacyjnych:
monodentatne
: jedna para elektronowa (np.
NH
3
). Cząsteczka wody też jest ligandem
monodentatnym, chociaż posiada dwie wolne pary
elektronowe. Po prostu jedna z nich zawsze
skierowana jest w złą stronę.
bidentatne
: dwie pary elektronowe (np.
etylenodwuamina, 8-hydroksychinolina)
multidentatne
:
większa
liczba
par
elektronowych; wykorzystywanych jest tyle, ile
potrzeba (np. EDTA)

Ligandy i jony (atomy) centralne
Metal (atom, jon) centralny także charakteryzuje
liczba wiązań, jakie może utworzyć. Wiąże się to
z geometrią cząsteczki kompleksu.
liniowy - 2 ligandy
tetraedryczny lub płaskokwadratowy - 4
ligandy
oktaedryczny - 6 ligandów
Określenie
stechiometrii
związku
koordynacyjnego wymaga więc znajomości
zarówno
cząsteczki
liganda,
jak
liczby
koordynacji metalu.

EDTA
Kwas
etylenodiaminoczterooctowy,
najpowszechniej stosowany komplekson.
Tworzy kompleksy w stosunku 1:1 z niemal
wszystkimi metalami (z wyjątkiem grupy
1A). Kompleksy te są trwałe i dobrze
rozpuszczalne w wodzie. Posiadają wysokie
stałe trwałości.
EDTA jest ponadto substancją podstawową.
Stosuje się go najczęściej w postaci soli
dwusodowej
(lepiej rozpuszczalnej od
samego kwasu).
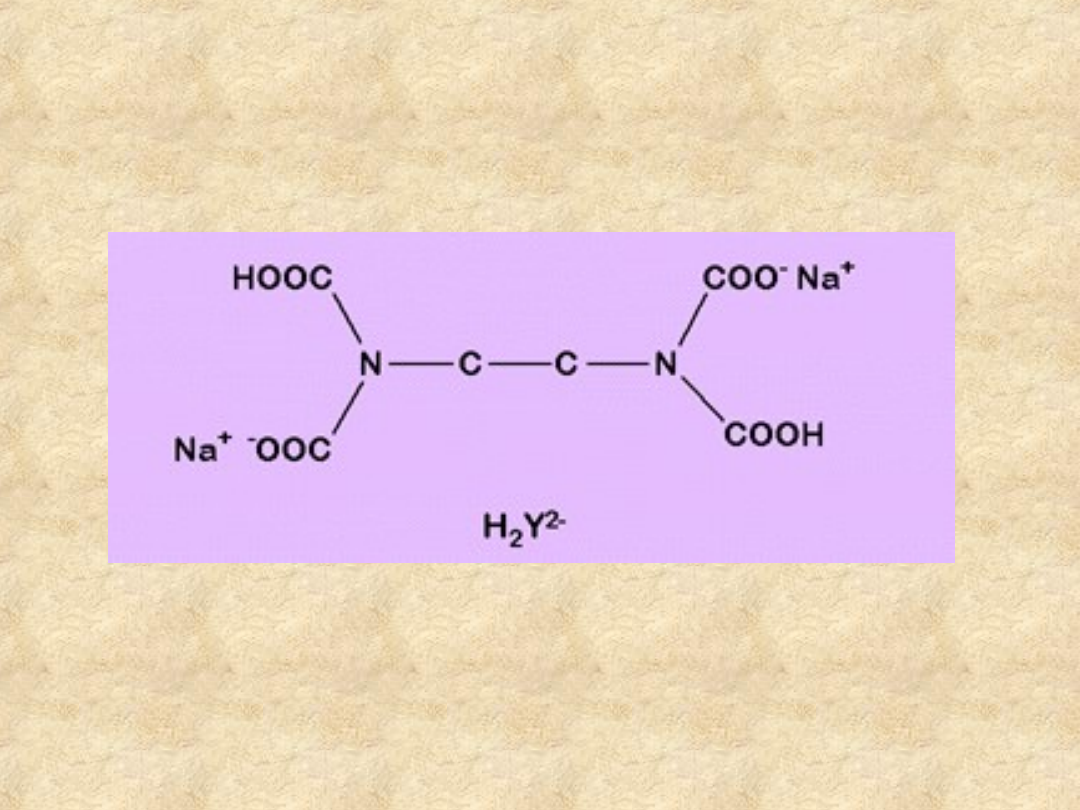
EDTA

EDTA
Cząsteczka EDTA zawiera 6 grup
donorowych. Niezależnie od liczby
koordynacji
metalu
centralnego,
EDTA dostosuje się do jego wymagań.
Mg
2+
+ H
2
Y
2-
MgY
2-
+ 2H
+
Fe
3+
+ H
2
Y
2-
FeY
-
+ 2H
+
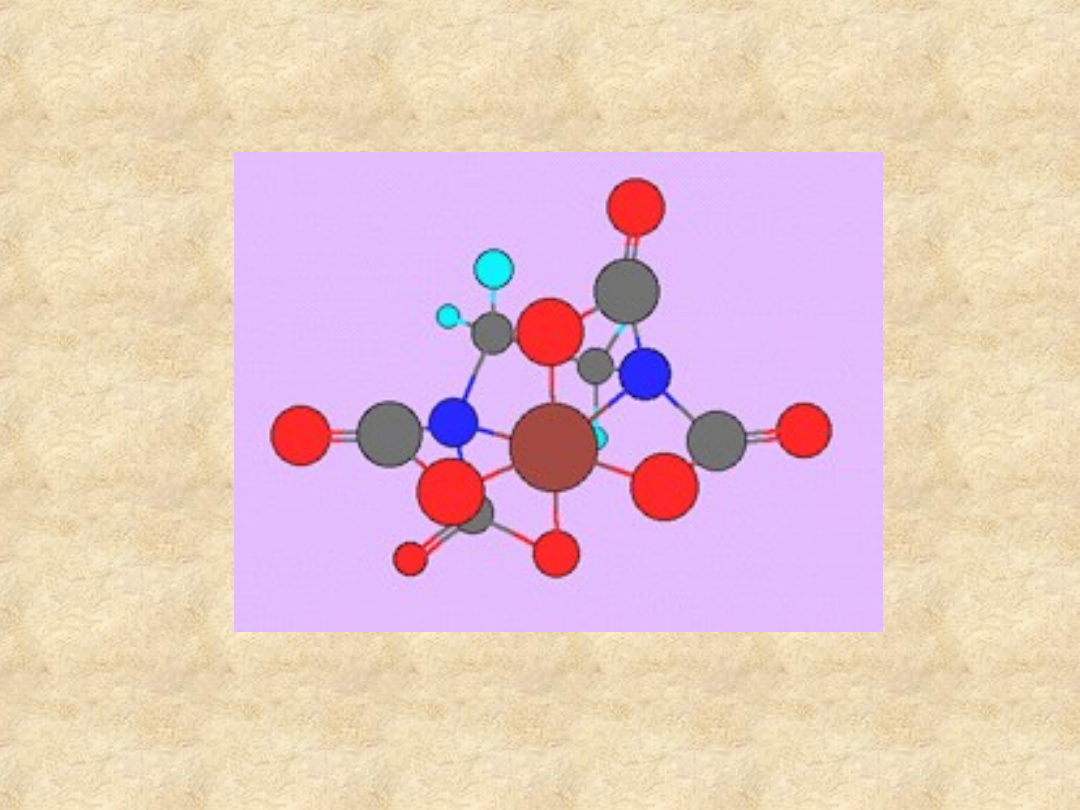
EDTA
kompleks FeEDTA

EDTA - wpływ pH
Trwałość kompleksów z EDTA zależy od pH:
Mg
2+
+ H
2
Y
2-
MgY
2-
+ 2H
+
Skoro ligandem jest jon Y
4+
, wszystko co nań wpływa
ma także wpływ na proces miareczkowania.
Najważniejsze jest pH.
Ten proces komplikuje fakt, że:
grupy aminowe mogą być protonowane
równowagi nie są rozdzielone (przy pewnych
pH mogą obok siebie istnieć, w podobnych
ilościach, więcej niż dwie różne formy).
4
4
K
3
K
2
2
K
3
K
4
K
5
'
K
2
6
Y
HY
Y
H
Y
H
Y
H
Y
H
Y
H
3
2
1
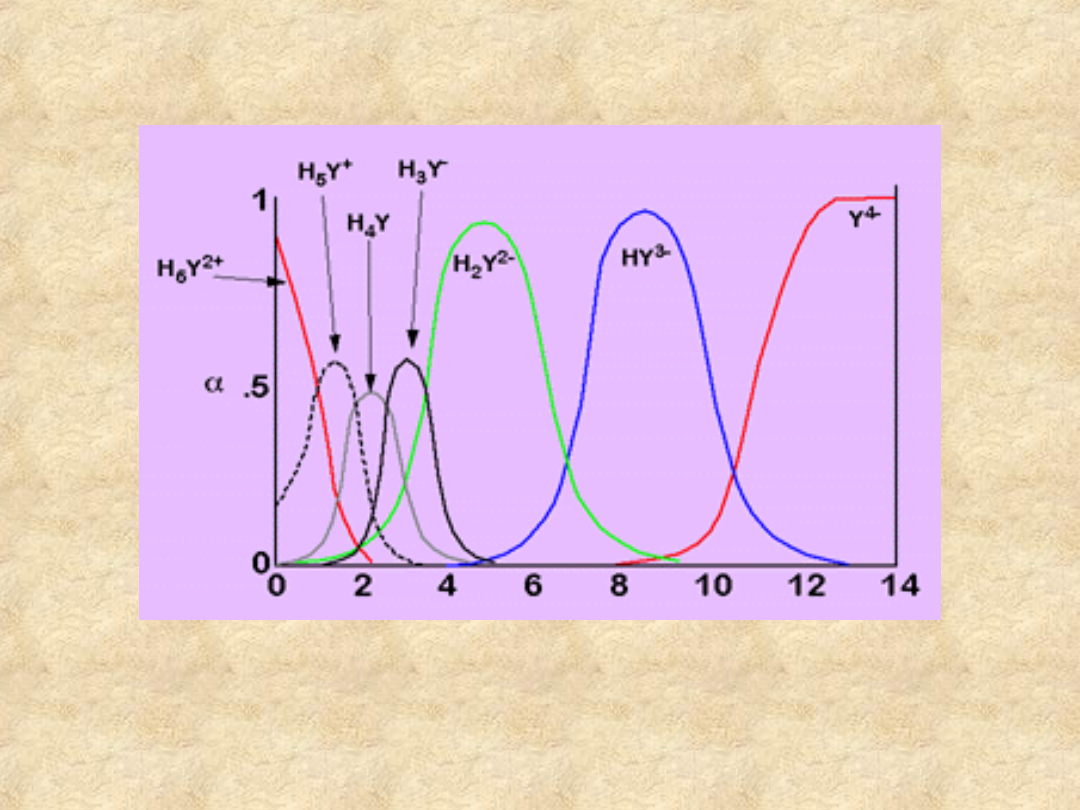
EDTA - wpływ pH
W normalnych warunkach formy H
6
Y
2+
i H
5
Y
+
nie
występują w ilościach konkurencyjnych.

EDTA - wpływ pH
Wpływ jonów H
+
można policzyć stosując
Y
:
Równowagi EDTA można wyrazić poprzez
stałe tworzenia serii reakcji następczych.
Można wówczas wyprowadzić następujący
wzór:
]
'
Y
[
]
Y
[
]
Y
[
]
HY
[
]
Y
H
[
]
Y
H
[
]
Y
H
[
]
Y
[
4
3
2
2
3
4
4
Y
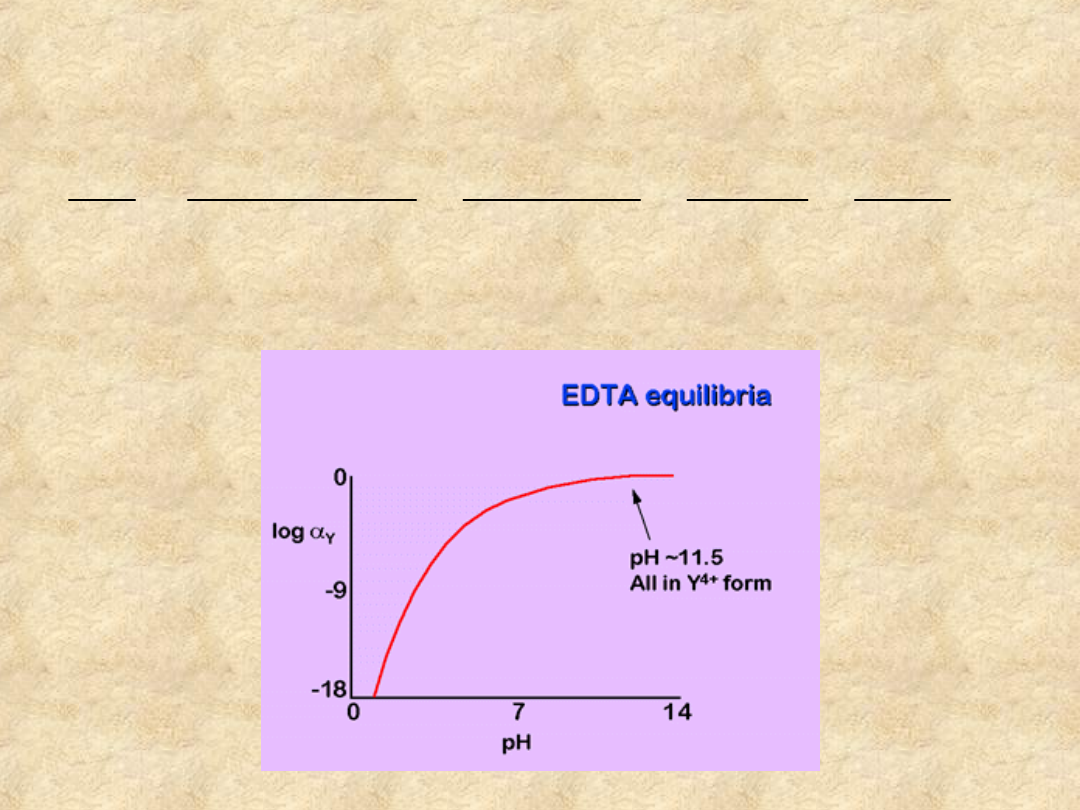
EDTA - wpływ pH
Można więc obliczyć
Y
i wykreślić go w
funkcji pH.
1
K
]
H
[
K
K
]
H
[
K
K
K
]
H
[
K
K
K
K
]
H
[
1
4
4
3
2
4
3
2
3
4
3
2
1
4
Y

EDTA - wpływ pH
Aby uwzględnić wpływ pH, zamiast "zwykłej" stałej
trwałości:
wprowadza się
warunkową stałą trwałości
:
Tak więc, znając pH roztworu, można łatwo uwzględnić
wpływ jonów H
+
na tworzenie kompleksów przez
EDTA.
K
MY
M Y
MY
[
]
[ ][
]
4
4
K
K
MY
MY
Y
'

Stałe tworzenia kompleksów EDTA z
niektórymi metalami
Jon
logK
M
Y
Jon
logK
MY
Jon
logK
M
Y
Fe
3+
25.1
Pb
2+
18.0
La
3+
15.4
Th
4+
23.2
Cd
2+
16.5
Mn
2+
14.0
Cr
3+
23.0
Zn
2+
16.5
Ca
2+
10.7
Bi
3+
22.8
Co
2+
16.3
Mg
2+
8.7
Cu
2+
18.8
Al
3+
16.1
Sr
2+
8.6
Ni
2+
18.6
Ce
3+
16.0
Ba
2+
7.8

Miareczkowania
kompleksonometryczne
Aby otrzymać ostry punkt końcowy,
roztworu zwykle się buforuje.
Zapewnia to właściwą ilość formy Y
4-
oraz
pozwala na występowanie EDTA w
postaci rozpuszczalnej.
Poza tym do ewentualnych obliczeń
stosujemy wtedy tylko jedną wartość
Y
.

Krzywa miareczkowania
kompleksonometrycznego
Jak zwykle przy rozpatrywaniu krzywych
miareczkowania dzielimy je na cztery
obszary:
próbka (0%)
obszar niedomiareczkowania (>0% i
<100%)
punkt równoważnikowy (100%)
obszar przemiareczkowania (>100%)

Krzywa miareczkowania
kompleksonometrycznego
Przykład:
100 ml 0.01 M roztworu Ni
2+
zbuforowano
do pH=10.2. Określ pNi przy 0, 50, 100 i
200% zmiareczkowania. Titrantem jest
0.01 M EDTA.

Krzywa miareczkowania
kompleksonometrycznego
0% zmiareczkowania
Jest to po prostu 0.01 M roztwór Ni
2+
, więc
pNi=2.
50 % zmiareczkowania
Połowa niklu została związana w kompleks,
ponadto objętość roztworu wzrosła o
50%, stąd pNi=2.48

Krzywa miareczkowania
kompleksonometrycznego
100% zmiareczkowania
Jest to 0.005 M roztwór kompleksu [NiY
2-
].
=3.98
.
10
18.
Y
Wyliczamy
Y
=
0.47,
stąd
K’
MY
=1.87
.
10
18
.
Zakładając, że [NiY
2-
]=0.005 M obliczamy:
skąd [Ni
2+
]=5.17
.
10
-11
; pNi=10.3
200% zmiareczkowania
Tutaj [NiY
2-
]=[Y
4-
], więc [Ni
2+
]=5.35
.
10
-19
; pNi=18.27
187 10
0005
18
2 2
.
.
[
]
Ni
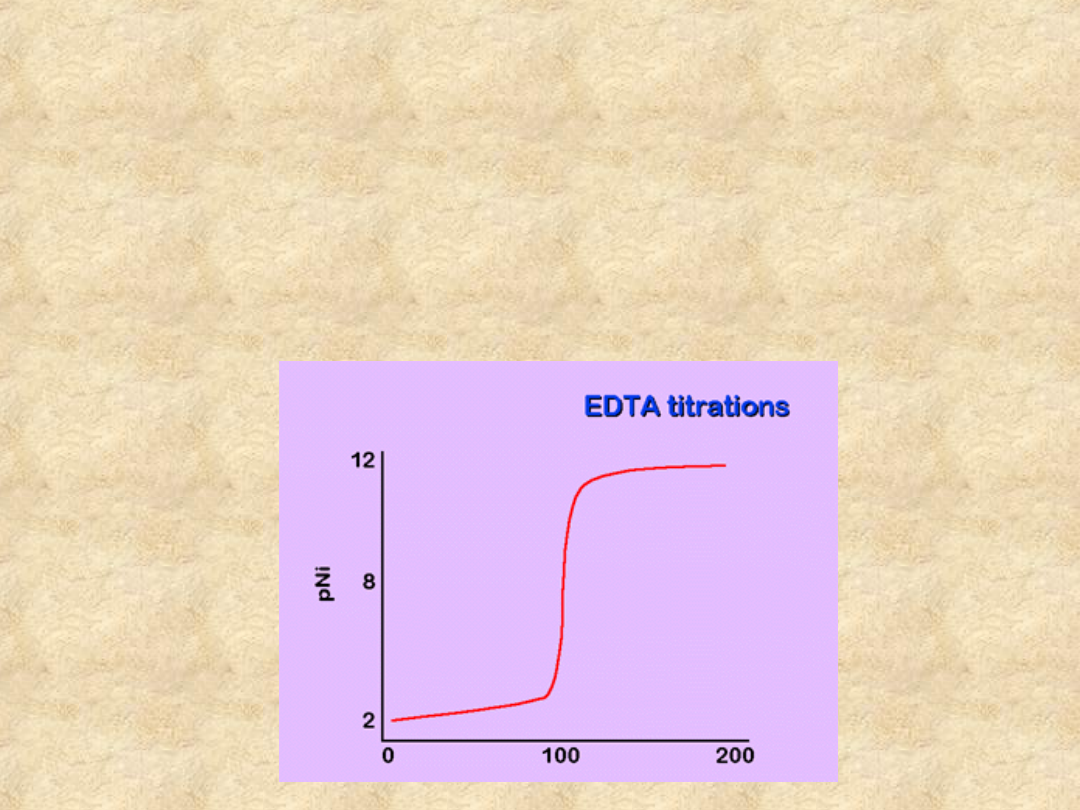
Krzywa miareczkowania
kompleksonometrycznego
W ten sposób można obliczyć krzywą
miareczkowania; w naszym przykładzie
wygląda ona jak następuje:

Krzywa miareczkowania
kompleksonometrycznego
Zauważmy, że kształt krzywej można
oszacować (naszkicować) licząc pMe
tylko w punktach odpowiadających 0
i 200% zmiareczkowania. Do większości
zastosowań to wystarczy.
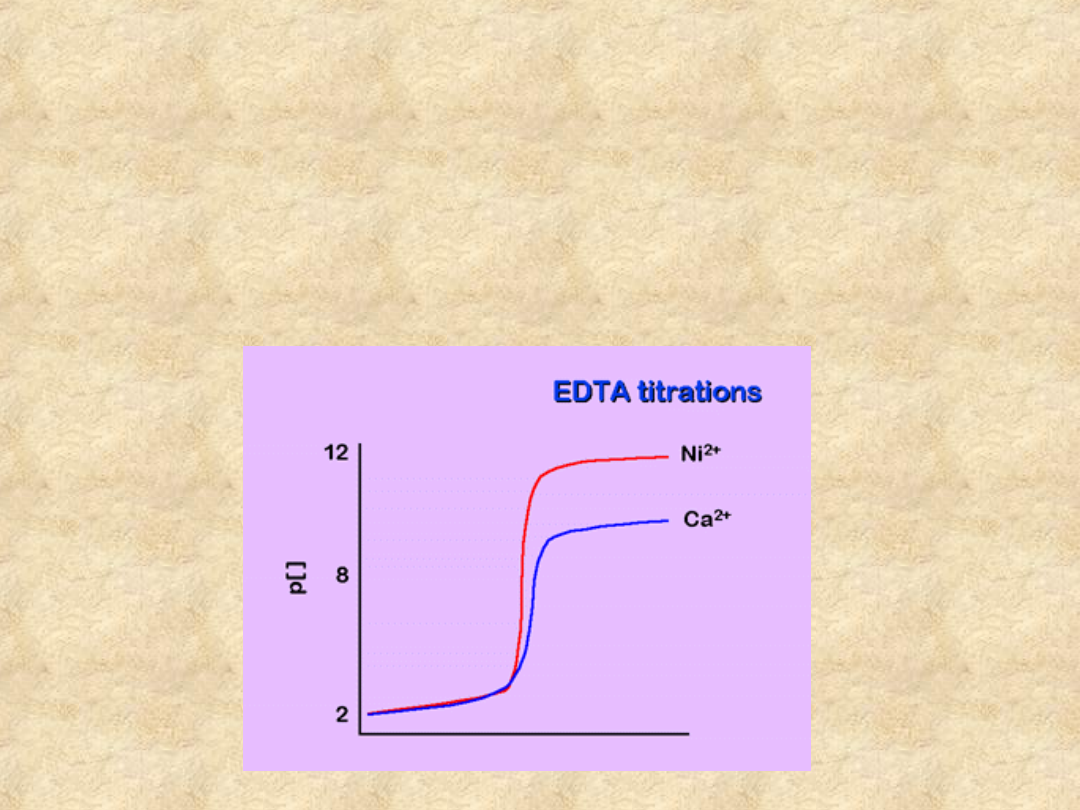
Krzywa miareczkowania
kompleksonometrycznego
Oszacowanie podobnej krzywej dla Ca
2+
(w
tych samych warunkach) i wykreślenie
obu da następujący wynik:

Wskaźniki kompleksometryczne
Powinny one:
współzawodniczyć z EDTA o jon
metalu, ale być słabszym ligandem od
titranta;
wykazywać wyraźną różnicę między
formą wolną i związaną w kompleks.
M-Ind
+ Y M-Y +
Ind
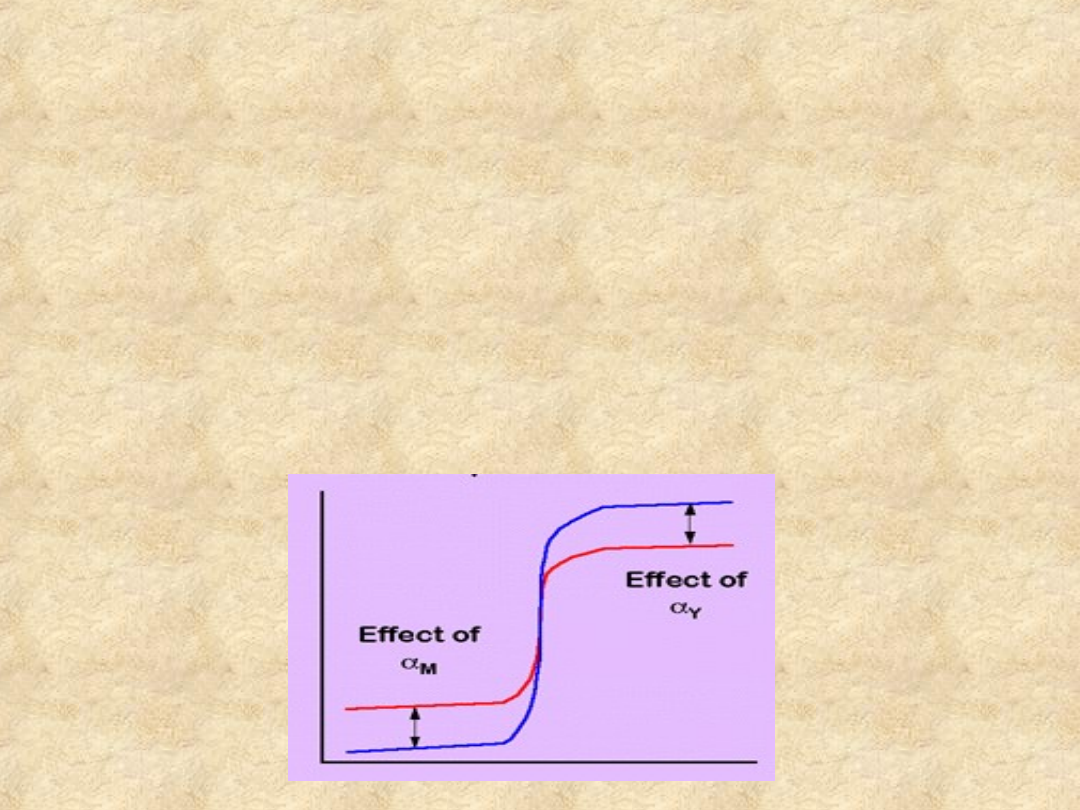
Wskaźniki kompleksometryczne
W obecności wskaźnika reakcja przebiega w ten
sposób, że najpierw titrant kompleksuje metal
niezwiązany, a gdy go zabraknie, wypiera
wskaźnik z wcześniej przezeń utworzonych
kompleksów.
Konkurencja wskaźnika (effect of
Y
) obniża
jednak
efektywny
skok
miareczkowania,
podobnie jak zmniejszenie wyjściowego stężenia
metalu (effect of
M
):
Wskaźniki kompleksometryczne
Kalmagit
Tworzy kolorowe kompleksy z większością metali.
Użyteczny w zakresie pH od 8.1 do 12.4.
Blokowany przez Cu(II), Ni(II), Fe(III), Al(III).
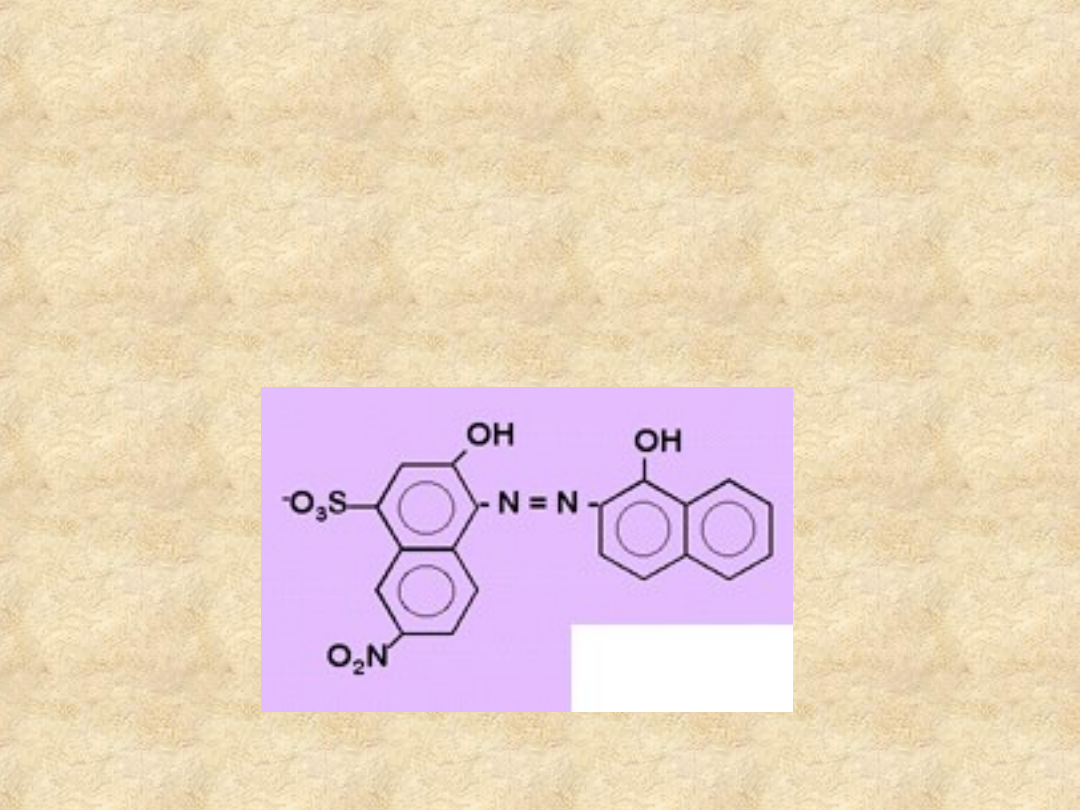
Wskaźniki kompleksometryczne
Czerń eriochromowa T
Podobna do kalmagitu, ale mniej trwała (utlenia
się na powietrzu).
Kompleksy są czerwone, sam wskaźnik jest
niebieski.
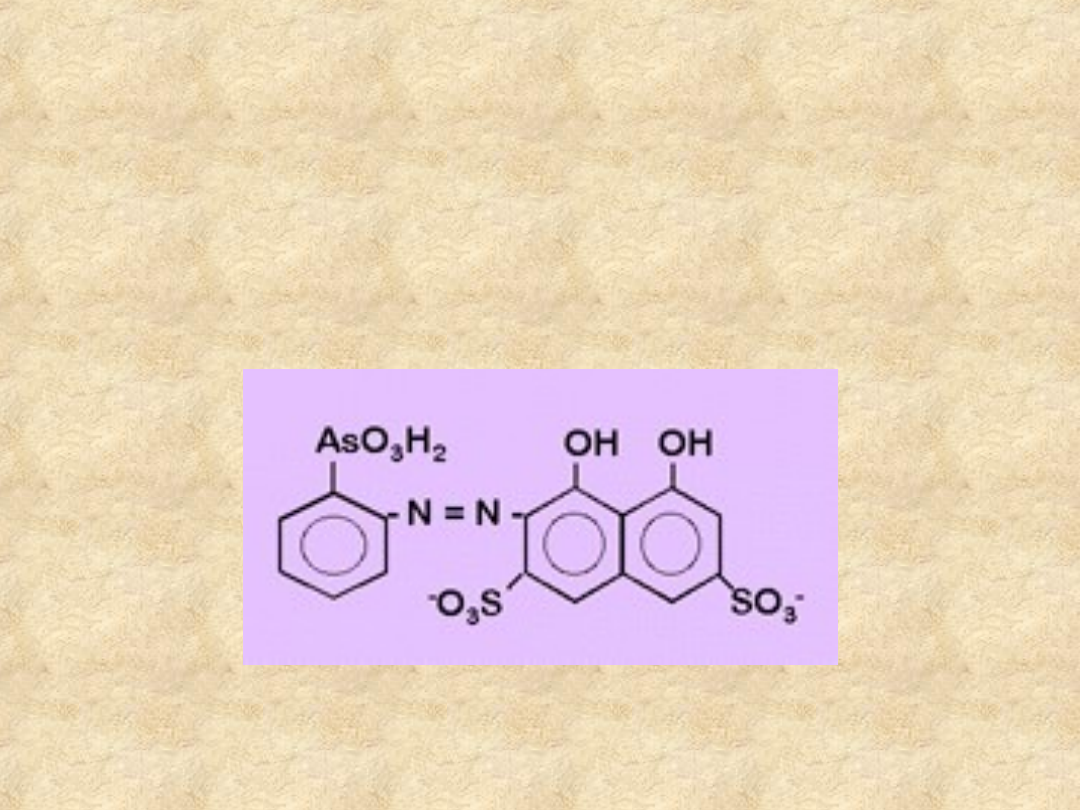
Wskaźniki kompleksometryczne
Arsenazo I
Użyteczny w oznaczaniu Ca(II), Mg(II) i
lantanowców.
Nie jest blokowany przez Cu(II) i Fe(III).
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
Wyszukiwarka
Podobne podstrony:
W17 krzywe miareczkowania redox
w13 alkacymetria, krzywe miareczkowania alkac
W17 krzywe miareczkowania redox
Miareczkowanie kompleksometryczne Cu Ni Ca Mg
zagadnienia kolokwium z kompleksometrii i miareczkow, Farmacja, Analiza leków, Kolokwia
Analiza miareczkowa, kompleksom Nieznany
, chemia analityczna L, miareczkowanie kompleksometryczne zadania
11 miareczkowanie metody kompleksometryczne
, chemia analityczna L, miareczkowanie kompleksometryczne zadania
KOMPLEKSY POLAKOW wykl 29 03 2012
pytania nowe komplet
zwiazki kompleksowe 2
8 kompleksy
Bliskowschodni kompleks bezpieczeństwa Przyczyny destabilizacji w regionie
więcej podobnych podstron