Elementy fizyki statystycznej
Termodynamika
Gęstości stanów
Funkcje rozkładu
Gaz elektronów
Termodynamika
Termodynamika to dział fizyki
zajmujący się energią termiczną
(energią wewnętrzną) układu
Temperatura – podstawowe pojęcie
termodynamiki
Skala Kelvina – bezwzględna skala
temperatury
„odczuwanie temperatury” – zależne
od naszych zmysłów
10
8
10
6
10
4
10
2
10
0
10
-2
10
-9
10
39
T [K]
wszechświat tuż
po powstaniu
najwyższa temp.
uzyskana w lab.
jądro Słońca
powierzchnia Słońca
krzepnięcie wody
wszechświat dziś
wrzenie helu-3
najniższa uzyskana
temperatura
Termodynamiczny opis układu
obiekty traktujemy makroskopowo nie wnikając w naturę cząstek z
których się składa
gaz doskonały: cząsteczki gazu traktujemy jako punkty materialne i
zakładamy, że zderzenia z innymi cząstkami i ściankami naczynia są
sprężyste
podstawowe makroskopowe parametry stanu układu to: ciśnienie p,
objętość V i temperatura T
każda zmiana w układzie termodynamicznym (choćby jednego
parametru) nazywa się procesem termodynamicznym
I zasada termodynamiki:
zmiana energii wewnętrznej układu równa jest sumie ilości ciepła i
pracy wymienionej przez układ z otoczeniem
II zasada termodynamiki:
w procesach odwracalnych zachodzących w układzie entropia
pozostaje stała, a w nieodwracalnych wzrasta

Pierwsza zasada
termodynamiki
Energia wewnętrzna układu U wzrasta, jeżeli
układ pobiera energię w postaci ciepła Q, i
maleje, kiedy wykonuje pracę W
dla nieznacznej przemiany
W
Q
U
−
=
Δ
Przemiana adiabatyczna
Q = 0
⇒ ΔU = -W
W>0 – praca wykonana
przez układ
W<0 – praca wykonana
nad układem
Rozprężanie swobodne
Q = W = 0
⇒ ΔU = 0
dW
dQ
dU
−
=
Przemiany
nieodwracalne
przemiany jednokierunkowe w układzie
zamkniętym nazywamy nieodwracalnymi
o kierunku procesów nieodwracalnych
decyduje zmiana entropii
ΔS układu,
(parametru stanu takiego jak T, p, V)
nie ma zasady zachowania entropii, w
przemianach nieodwracalnych entropia
układu zamkniętego zawsze rośnie
przy nieskończenie małej zmianie stanu układu
∫
=
−
=
Δ
K
P
P
K
T
dQ
S
S
S
T
dQ
dS =
Przemiana odwracalna
Przy odwracalnym izotermicznym rozprężaniu gazu
doskonałego zmiana entropii zależy od całkowitego
ciepła dostarczonego ze zbiornika do gazu
Q>0 – przy rozprężaniu entropia gazu rośnie
przy sprężaniu Q<0 (gaz oddaje ciepło) – entropia
gazu maleje lecz entropia zbiornika rośnie
zmiana entropii układu zamkniętego (gaz + zbiornik)
jest sumą obydwu wartości i jest równa zeru
T
Q
S
gaz
−
=
Δ
T
Q
S
zbior
+
=
Δ
0
=
ΔS
T
Q
dQ
T
S
S
S
K
P
P
K
=
=
−
=
Δ
∫
1
0
>
Δ
gaz
S
Druga zasada termodynamiki
Entropia układu zamkniętego wzrasta w przemianach
nieodwracalnych i nie zmienia się w przemianach
odwracalnych (entropia nigdy nie maleje)
proces nieodwracalny przebiega w kierunku wzrostu
entropii
wzrost entropii – przejście układu do stanu mniejszego
uporządkowania cząsteczek (stanu większego chaosu)
z I i II zasady termodynamiki wynika:
0
≥
ΔS
dW
TdS
dW
dQ
dU
−
≤
−
=
TdS
dQ ≤
⇒
=
T
dQ
dS
ale
dN
pdV
TdS
dU
μ
+
−
=
zmiany liczby cząstek N w układzie
potencjał chemiczny
dW = pdV
Warunki równowagi
termodynamicznej
warunkiem równowagi jest maksimum entropii
lub minimum energii wewnętrznej układu
max
S
S =
V
S
N
U
,
⎟
⎠
⎞
⎜
⎝
⎛
=
∂
∂
μ
Potencjał chemiczny wyraża zmianę energii wewnętrznej układu przy
zmianie liczby jego cząstek o jednostkę w warunkach
stałej entropii i stałej objętości układu
dN
dN
2
1
μ
=
μ
Warunkiem równowagi takiego układu jest równość potencjałów
chemicznych obu układów gazów
Rozpatrzmy układ dwóch gazów o potencjałach chemicznych
μ
1
i
μ
2
w których następuje wymiana
dN
cząstek
Pojęcie gazu doskonałego
gaz składa się z cząsteczek, które możemy traktować jako
punkty materialne o tej samej masie
cząsteczki poruszają się chaotycznie i podlegają zasadą
dynamiki Newtona
całkowita liczba cząstek jest bardzo duża
objętość cząstek gazu jest dużo mniejsza od objętości
naczynia
poza momentem zderzenia cząstki nie oddziaływają ze
sobą żadnymi siłami
zderzenia są sprężyste, a czas ich trwania krótki
Kinetyczna teoria gazów 1
Rozpatrzmy N cząstek gazu w pudełku o objętości V. Jedna cząstka
odbijająca się sprężyście od lewej ścianki naczynia wywiera nań siłę:
t
p
F
x
Δ
Δ
=
1
x
x
x
x
mv
mv
mv
p
2
=
−
−
=
Δ
)
(
Ponieważ czas pomiędzy kolejnymi zderzeniami z ta samą ścianką wynosi:
L
mv
F
v
L
t
x
x
2
1
2
=
⇒
=
Δ
Dla N cząstek całkowita średnia siła wynosi:
2
2
2
x
x
x
v
Nm
pV
V
v
m
N
S
F
p
L
v
m
N
F
=
⇒
=
=
⇒
=
2
2
2
2
2
3
x
z
y
x
v
v
v
v
v
=
+
+
=
k
E
N
v
Nm
pV
3
2
3
2
=
=
x
y
L
v
x
-v
x
bo cząsteczki zderzają się jednakowo ze wszystkimi
ściankami
iloczyn pV jest stały jak długo stała jest E
K
cząsteczek
2
2
2
z
y
x
v
v
v
=
=
3
2
2
v
v
x
=
⇒
Kinetyczna teoria gazów 2
k
E
N
v
Nm
pV
3
2
3
2
=
=
NkT
pV
kT
E
k
=
⇒
=
2
3
równanie stanu
gazu doskonałego
nRT
pV
nR
Nk
=
⇒
=
k – stała Boltzmana
n – liczba moli
N – liczba cząsteczek
R – stała gazowa
trzy stopnie swobody – trzy współrzędne x,y,z
Zasada ekwipatrycji energii – równomierny podział energii na wszystkie stopnie
swobody cząsteczek (½kT na cząsteczkę)
mierząc temperaturę gazu wyznaczmy jednocześnie śr. energię kinetyczną ruchu
postępowego jego cząsteczek
Kinetyczna teoria gazów wiąże właściwości
makroskopowe gazu (np. ciśnienie i temp.) z
właściwościami mikroskopowymi cząsteczek
gazu (np. ich prędkością)
przemiany: izotermiczna,
izochoryczna
, izobaryczna, adiabatyczna
T=const.
V=const.
p=const. Q=0
Statystyczny opis układu
makroskopowe właściwości gazów można opisać
odwołując się do zjawisk mikroskopowych
stan każdej cząstki opisujemy przez (x,y,z,p
x
,p
y
,p
z
)
szukamy prawdopodobieństwa zajścia danego
zdarzenia
osobliwością statystycznych prawidłowości jest ich
probabilistyczny charakter
rozkład cząstek w zależności od ich energii opisuje
statystyczna funkcja rozkładu
ze znajomości funkcji rozkładu wyznaczmy
wartości średnie energii, pędu, prędkości cząstek
Mikro- i makro-stany
Konfiguracja
W
liczba mikrostanów
Entropia
(10
-23
J/K)
n
1
n
2
I
6
0
6!/(6!· 0!)=1
0
II
5
1
6!/(5!· 1!)=6
2,47
III
4
2
6!/(4!· 2!)=15
3,74
IV
3
3
6!/(3!· 3!)=20
4,13
V
2
4
6!/(2!· 4!)=15
3,74
Rozważmy układ złożony z N = 6 identycznych (ale ponumerowanych)
cząstek w dwóch stanach (np. połówkach zbiornika)
mikrostan: stan zawierający określone cząstki w komórkach przestrzeni fazowej;
makrostan: stan zawierający określoną liczbę cząstek w komórkach przestrzeni fazowej
Stan III
7 makrostanów i 64 mikrostany
wielokrotność konfiguracji -
)
!
!
/(
!
2
1
n
n
N
W
⋅
=
W
k
S
ln
=
wzór Boltzmanna
Konfiguracja IV jest
najbardziej prawdopodobna
P
IV
=20/64=31,3%; ale
P
I
=1/64=1,6% ??
Jeśli w zbiorniku będzie 100
cząstek to W(50,50)=10
29
i
W(100,0)=1, tym bardziej
dla mola cząsteczek N=10
24
Przestrzeń fazowa
przestrzeń fazowa jest to 6N wymiarowa przestrzeń o osiach
współrzędnych x,y,z,p
x
,p
y
,p
z
każdy punkt przestrzeni fazowej jednoznacznie określa
mikrostan cząstki, tzn. podaje jej położenie i pęd
sekwencja mikrostanów, które przyjmował układ w czasie
tworzy pewną krzywą zwaną trajektorią fazową
dla ruchu jednowymiarowego
stan cząstki określa x, p
x
badania trajektorii fazowej
pozwalają znaleźć jego
podstawowe własności
dynamiczne
x
p
x
t
1
t
2
Układy zwyrodniałe i
niezwyrodniałe
Na N jednakowych cząstek przypada G różnych stanów
N/G << 1 , to cząstki spotykają się rzadko, właściwości
kwantowe nie ujawniają się - układ jest niezwyrodniały
gdy liczba stanów jest tego samego rzędu co cząstek N/G >1,
to układ nazywamy zwyrodniałym
obiekty klasyczne tworzą tylko układy niezwyrodniałe
obiekty kwantowe zazwyczaj tworzą układy zwyrodniałe,
choć w pewnych warunkach mogą być niezwyrodniałe np.
półprzewodniki
rozróżniamy dwa rodzaje cząstek kwantowych:
fermiony - o spinie połówkowym podlegają zakazowi Pauliego, dążą
do „samotności”
bozony - o spinie całkowitym dążą do „łączenia się”, nieograniczenie
mogą zapełniać ten sam stan
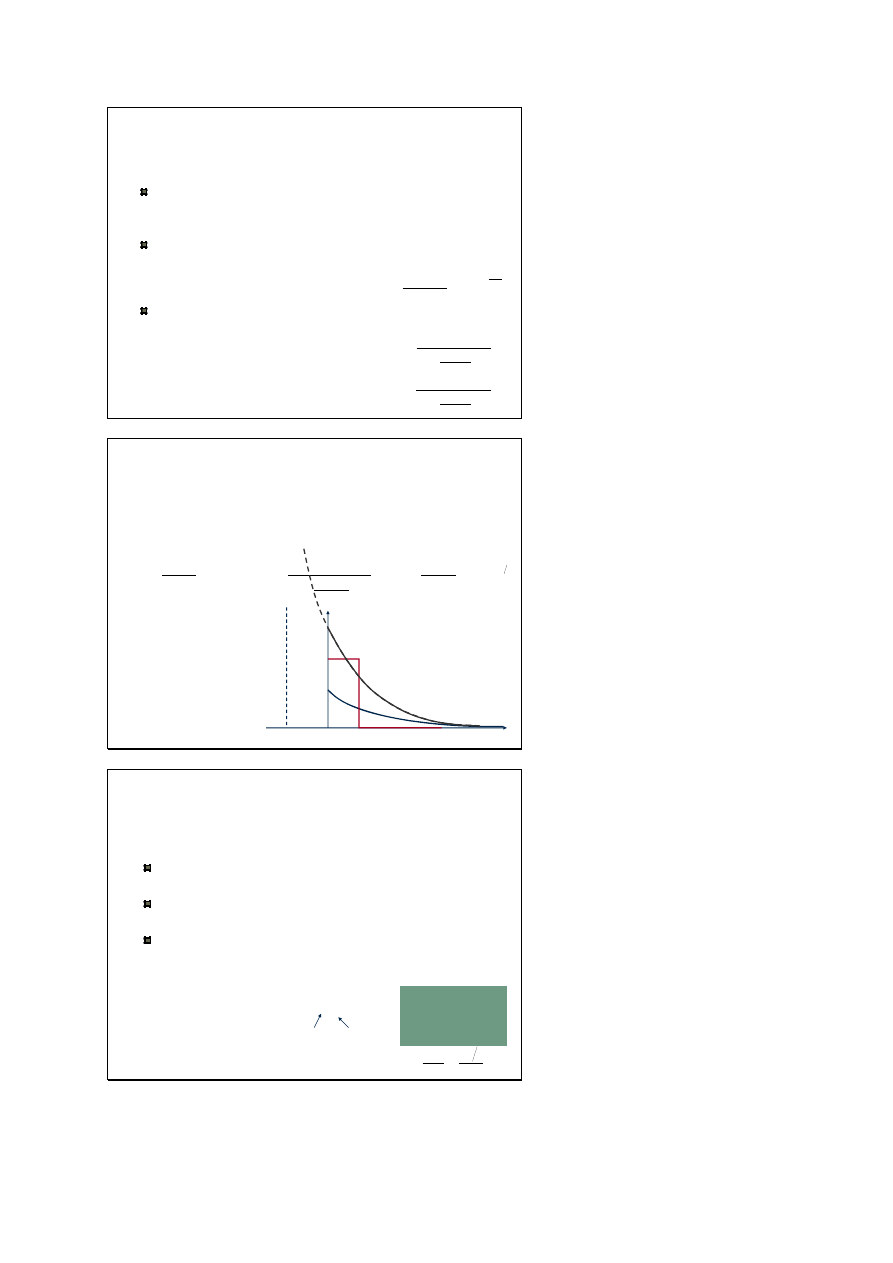
Statystyczna funkcja rozkładu
statystyczna funkcja rozkładu dla cząstek o temperaturze T i
potencjale chemicznym
μ określa średnią ilość cząstek
przypadającą na jeden stan układu o energii E
dla gazu niezwyrodniałego stosuje się statystyką klasyczną
(rozkład Maxwella-Boltzmanna)
fizyka statystyczna, która bada właściwości układów
zwyrodniałych, nazywa się statystyką kwantową
statystyka Bosego-Einsteina
statystyka Fermiego-Diraca
( )
(
)
kT
E
MB
Ne
kT
E
E
f
−
=
⎥⎦
⎤
⎢⎣
⎡
μ
−
−
= exp
( )
(
)
1
1
+
⎥⎦
⎤
⎢⎣
⎡
μ
−
=
kT
E
E
f
FD
exp
( )
(
)
1
1
−
⎥⎦
⎤
⎢⎣
⎡
μ
−
=
kT
E
E
f
BE
exp
Statystyki
W dostatecznie dużych temperaturach funkcje rozkładu Fermiego-
Diraca i Bosego-Einsteina przechodzą w klasyczną funkcję Maxwella-
Boltzmanna, układy zwyrodniałe przechodzą w niezwyrodaniałe
FD
(
)
1
>>
⎥⎦
⎤
⎢⎣
⎡
μ
−
kT
E
exp
Dla
( )
(
)
(
)
kT
E
Ne
kT
E
kT
E
E
f
−
=
⎥⎦
⎤
⎢⎣
⎡
μ
−
−
=
±
⎥⎦
⎤
⎢⎣
⎡
μ
−
=
exp
exp
1
1
E
μ
f(E)
MB
-
μ
BE
Dla rozkładu Bosego-Einsteina
potencjał chemiczny jest
zawsze ujemny
0
1
Im większa energia tym
mniejsze prawdopodobieństwo
obsadzenia danego stanu
Gaz elektronów swobodnych
elektrony swobodne w metalu spełniają warunki gazu
doskonałego
elektrony są fermionami (s=1/2) więc stosujemy statystykę
Fermiego-Diraca
przestrzeń fazowa obiektów kwantowo-mechanicznych
jest skwantowana, a elementarna komórka fazowa zgodnie
z zasada nieoznaczoności Heisenberga ma objętość
3
h
d
d
dp
dp
dxdydzdp
d
p
V
z
y
x
=
Γ
Γ
=
=
Γ
przestrzeń koordynacyjna i pędu
w komórce tej
mogą znajdować
się dwa elektrony o
różnych spinach
Jeśli elektron porusza się swobodnie w objętości V
to jego pęd jest określony z dokładnością do
V
h
d
d
d
V
p
2
3
=
Γ
Γ
=
Γ
V
d
V
=
Γ

G(E
0
)
całkowita
liczba stanów
o energii E
0
Funkcja gęstości stanów
V
h
d
p
2
3
=
Γ
( )
dp
h
V
p
dp
p
g
3
2
8
π
=
Funkcję
g(p)
nazywamy gęstości stanów w przestrzeni pędów – liczba komórek
elementarnych (liczba stanów) w objętości
V
w jednostkowym przedziale pędów
m
p
E
2
2
=
mE
p
2
2
=
dE
E
m
dp
2
2
1
=
( )
( )
dE
E
h
m
V
dE
E
g
2
1
3
2
3
2
4
π
=
( )
( )
2
1
3
2
3
2
4
/
E
h
m
V
E
g
π
=
Obliczmy liczbę elementarnych komórek
fazowych o pędach z przedziału p, p + dp
Przechodząc do przestrzeni energii:
gęstość stanów w
przestrzeni energii:
p
p+dp
dp
p
x
p
y
p
z
V
h
dp
p
d
dp
p
p
3
2
2
8
4
π
π
=
Γ
=
objętość sfery
objętość stanu
g(E)
0
E
E
0
Kryterium zwyrodnienia
N/G << 1
Obliczmy liczbę stanów cząstek gazu doskonałego
(elektronów) o energii E = (3/2)kT
( )
( )
2
3
3
2
3
0
3
2
2
4
E
h
m
V
dE
E
g
E
G
E
π
=
=
∫
)
(
( )
( )
2
3
2
1
3
2
3
2
3
2
4
kT
h
m
V
E
G
⎟
⎠
⎞
⎜
⎝
⎛
π
=
)
(
( )
( )
1
2
2
1
2
3
2
4
2
3
2
2
3
2
1
2
3
3
<<
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
π
=
⎟
⎠
⎞
⎜
⎝
⎛
π
=
mkT
h
V
N
kT
m
V
h
N
G
N
Azot w warunkach normalnych:
n
=10
25
m
–3
,
m
=10
–26
kg, to N/G=10
-6
<<1
Dla elektronów o koncentracji
n=N/V=
10
28
m
-3
i
m
=10
-30
kg powyższy
warunek jest spełniony dla temperatury przekraczającej 10 000 C
W takich temperaturach metale nie mogą istnieć w stanie stałym, więc
gaz elektronowy w metalach jest zawsze zwyrodniały – opisywany jest
statystyką Fermiego-Diraca
Całkowita funkcja rozkładu
Całkowita funkcja rozkładu N
μ,T
(E) jest to funkcja określająca ilość
cząstek obsadzających stany o energii E w całym układzie o
temperaturze T i potencjale chemicznym
μ
( )
)
(
)
(
,
,
E
f
E
g
E
N
T
T
μ
μ
⋅
=
Całkowita ilość cząstek w całym układzie określa się wzorem:
( )
dE
E
f
E
g
dE
E
N
N
T
T
o
∫
∫
∞
μ
∞
μ
⋅
=
=
0
0
)
(
)
(
,
,
Znajomość całkowitej funkcji rozkładu pozwala nam określić średnią
wartość energii lub prędkości cząsteczek – uśrednianie statystyczne
czastek
sumę
energii
suma
dE
E
N
dE
E
N
E
E
=
⋅
=
∫
∫
∞
∞
0
0
)
(
)
(
0
0
N
dv
v
N
v
v
∫
∞
⋅
=
)
(
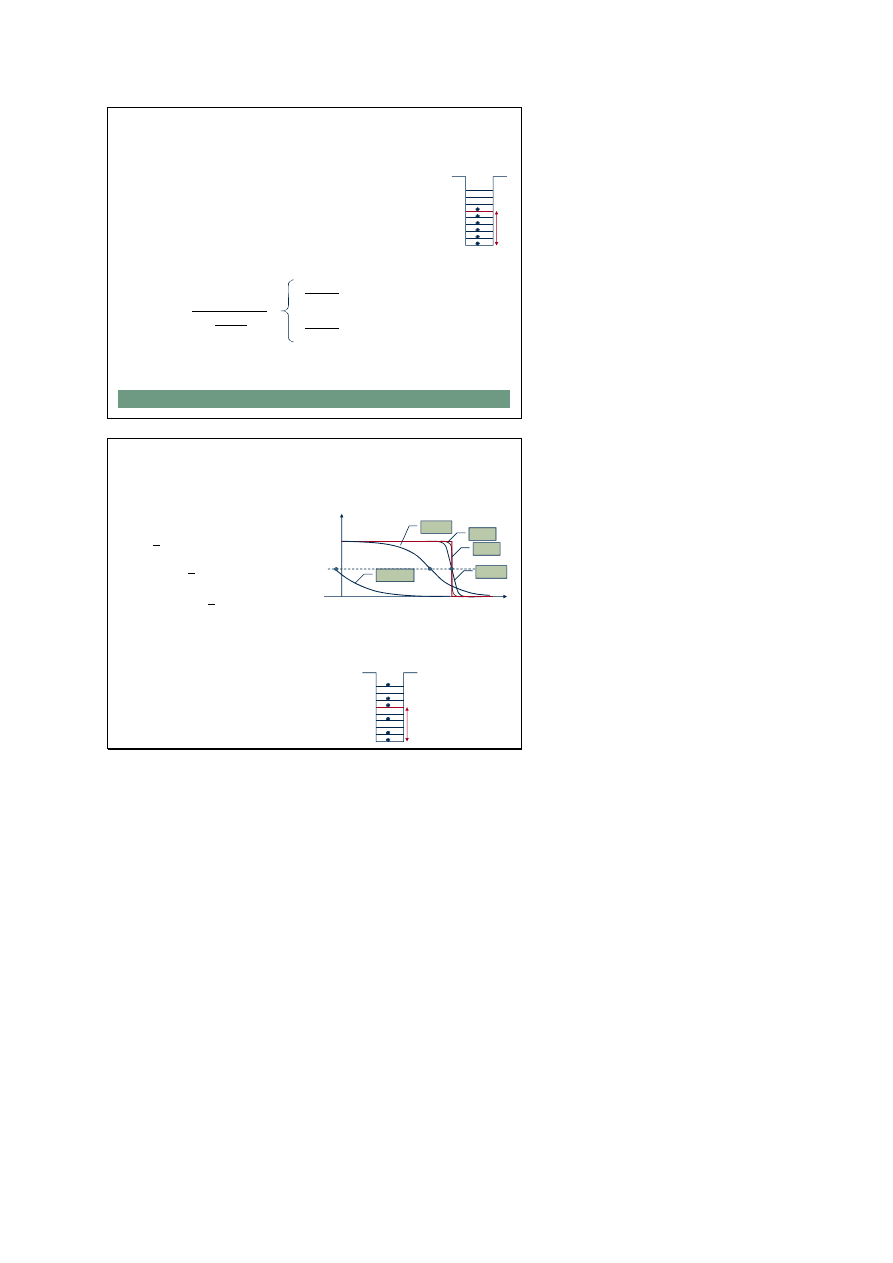
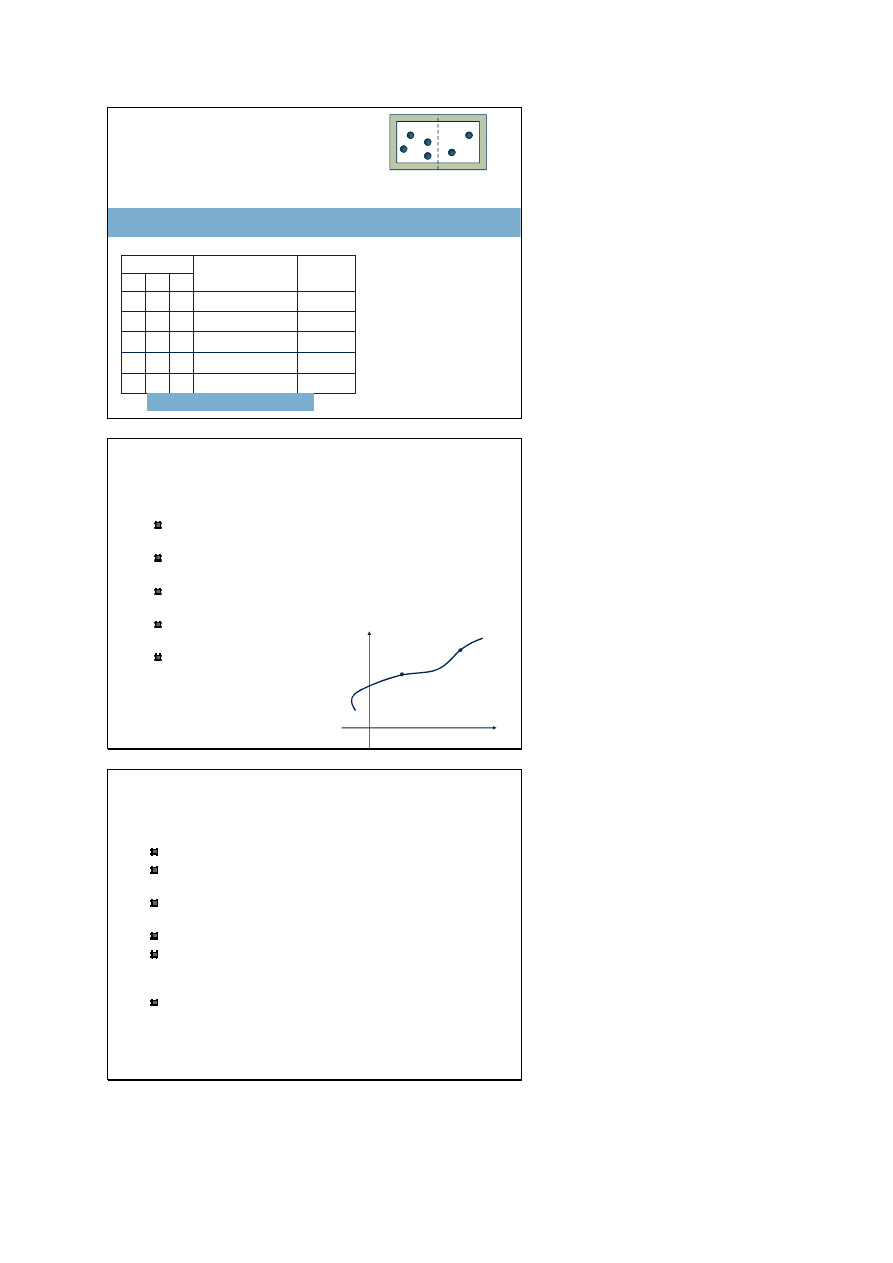
Gaz elektronowy w T = 0 K
Dla elektronów swobodny metal jest swego rodzaju jamą
potencjału. Zgodnie z zasadą Pauliego w temperaturze 0 K
elektrony zajmują kolejno wszystkie stany od najniższego do
ostatniego obsadzonego, który nazywamy poziomem Fermiego,
a odpowiadającą mu energię – energią Fermiego (E
F
)
Analizując funkcję rozkładu Fermiego-Diraca w T = 0 K otrzymujemy:
( )
(
)
=
+
⎥⎦
⎤
⎢⎣
⎡
⋅
μ
−
=
1
0
1
k
E
E
f
FD
exp
1
1
1
=
+
∞
−
e
0
1
1
=
+
∞
+
e
gdy E <
μ
gdy E >
μ
ten sam rezultat przy założeniu
μ = E
F
(obie wielkości są liczone
względem dna jamy potencjału). Dla E = E
F
f(E) = 1/2
Poziom Fermiego jest poziomem o prawdopodobieństwie obsadzenia = 1/2
E
F
Położenie E
F
w funkcji T
( )
1
2
1
<
< E
f
( )
2
1
=
E
f
( )
2
1
0
<
< E
f
dla E < E
F
dla E = E
F
dla E > E
F
Ze wzrostem temperatury poziom Fermiego nieznacznie się
obniża a funkcja rozkładu staje się coraz bardziej wygładzona,
część elektronów przechodzi na wyższe poziomy energetyczne
E
F
Jak pamiętamy dla bardzo
wysokich temperatur rozkład
FD przechodzi w rozkład MB
f(E)
E
E
0
F
T=0
300
1000
2000
10 000
1
½
0
Wyszukiwarka
Podobne podstrony:
b06 fizyka statystyczna a OMNTZ Nieznany (2)
b09 fizyka statystyczna d EV4PL Nieznany
b08 fizyka statystyczna c MKGN4 Nieznany (2)
a09 fizyka statystyczna (12 21) Nieznany
a08 fizyka statystyczna (01 10) Nieznany
a08 fizyka statystyczna (01 11) Nieznany
a09 fizyka statystyczna (12 25) Nieznany
CERN FIZYKA CZASTEK ELEMENTARNY Nieznany
chemia lato 12 07 08 id 112433 Nieznany
Fizyka 1 id 175686 Nieznany
zestaw 7 ZZP, SEMESTR I, MECHANIKA I FIZYKA STATYSTYCZNA, zadania
Arot 2010 07 2010 id 69283 Nieznany
BADANIE STATYSTYCZNEGO CHARAKTE Nieznany
Fizyka 5 id 175251 Nieznany
07 B podsumowanie indukcja[002] Nieznany (2)
2013 06 07 10 04id 28349 Nieznany (2)
więcej podobnych podstron