1
ZWIĄZKI ORGANICZNE ZAWIERAJĄCE W STRUKTURZE ATOMY TLENU
8
O
1s
2
2s
2
2p
4
okres 2; grupa VI
w związkach jest dwuwiążący, z dwoma niewiążącymi parami elektronów
O
drugi w skali elektroujemności Paulinga – 3.5 (za fluorem)
z węglem tworzy wiązania kowalencyjne, spolaryzowane
C O
C
OH
GRUPA KARBONYLOWA
GRUPA HYDROKSYLOWA
ALKOHOLE
R – OH
H
O
H
R
O
H
H / R = alkil
H / R = alkil
ETERY
R – O – R’
FENOLE
Ar – OH
H
O
H
H / Ar = aryl
H
O
Ar
H / Ar = aryl
H / Ar = aryl
Ar
O
Ar
R
O
Ar
R
O
R'
C
OH
C
OH
sp
3
sp
2
NOMENKLATURA
nazwa najdłuższego łańcucha zawierającego grupę hydroksylową staje się
rdzeniem, do którego dodaje się końcówkę
-ol
CH
3
OH
metan
ol
CH
3
CHCH
2
CHCH
2
OH
CH
3
CH
3
2,4-dimetylo-
1
-pentan
ol
5 4 3 2 1
lokant atomu węgla połączonego
z grupą hydroksylową – jak najniższy
CH
3
CHCH
2
CHCH
3
OH
4-fenylo-
2
-pentan
ol
5 4 3 2 1
CHCH
2
CHCH
3
OH
H
2
C
5 4 3 2 1
4-penten
-2
-
ol
ALKOHOLE
CH
2
OH
alkohol benzylowy
H
3
C
C
H
3
C
OH
H
3
C
2-metylo-
2
-propan
ol
alkohol tert-butylowy
1°
2°
3°

2
NOMENKLATURA
ALKOHOLE
gdy w związku jest więcej grup hydroksylowych przed końcówką
–ol
dodaje się
łaciński liczebnik mówiący o ilości grup hydroksylowych, np.
–diol, -triol,
itd.
OH
H
H
OH
HO
CH
2
CH
2
OH
HO
CH
2
CH
2
CHCH
3
OH
OH
HO
HO
CH
2
CHCH
2
OH
OH
HO
HO
OH
OH
1,2
-etano
diol
1,3
-butano
diol
1,2,3
-propano
triol
glikol etylenowy
gliceryna
trans-
1,3
-cykloheksano
diol
cis-
1,3
-cyklopentano
diol
1,2,4,5
-cykloheksano
tetraol
NOMENKLATURA
FENOLE
zwykle nazywane jako pochodne związku macierzystego
OH
FEN
OL
OH
Cl
o
-
chloro
fenol
OH
Br
Br
Br
2,4,6-tri
bromo
fenol
OH
O
2
N
p
-
nitro
fenol
OH
H
3
C
OH
CH
3
OH
CH
3
p
-
krez
ol
m
-
krez
ol
o
-
krez
ol
WŁAŚCIWOŚCI FIZYCZNE
ALKOHOLE
wiązania C –
O
i
H
–
O
są kowalencyjne i spolaryzowane
C
O
H
sp
3
α
kąt walencyjny C
OH
α ≈ 106 - 110°
cząsteczka posiada wypadkowy moment dipolowy
µ = 1.5 D
cząsteczki alkoholi oddziałują ze sobą wiązaniami wodorowymi
R
O
H
H
O
R
R
O
H
H
O
R
WIĄZANIA WODOROWE

3
WŁAŚCIWOŚCI FIZYCZNE
ALKOHOLE
R
O
H
H
O
R
R
O
H
H
O
R
WIĄZANIA WODOROWE
20 –- 40 kJ/mol
:
wysokie temperatury wrzenia
dobra rozpuszczalność w wodzie – charakter hydrofilowy
M
cz
46
CH
3
OCH
3
t
w
–24.9°C
CH
3
CH
2
OH
t
w
+78.3°C
H
O
R
H
O
H
H
O
H
H
O
R
WŁAŚCIWOŚCI FIZYCZNE
ALKOHOLE
CH
3
CH
2
OH
∝
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
OH
0.05 g/100ml H
2
O
CH
3
CH
2
CH
2
CH
2
OH
8.3 g/100ml H
2
O
WŁAŚCIWOŚCI
HYDROFOBOWE
WŁAŚCIWOŚCI
HYDROFILOWE
OTRZYMYWANIE
ALKOHOLE
1.
OTRZYMYWANIE ALKOHOLI Z ALKENÓW
ADDYCJA BOROWODORU DO ALKENU – HYDROBOROWANIE ALKENÓW
R
H
BH
2
+
δ
−
δ
R
H
BH
2
R
H
B
H
2
O
2
/ OH
-
R
H
OH
alkohol niżej rzędowy
OKSYRTĘCIOWANIE ALKENÓW
R
+
H
2
O
+ Hg(CH
3
COO
-
)
2
R
HO
Hg(CH
3
COO)
THF
R
HO
H
NaBH
4
OH
-
alkohol wyżej rzędowy
tzw.
ANTYMARKOWNIKOW

4
OTRZYMYWANIE
ALKOHOLE
1.
OTRZYMYWANIE ALKOHOLI Z ALKENÓW
PRZYKŁADY
CH
3
C
CH
3
CH
3
CH CH
2
3,3-dimetylo-1-buten
1.
Hg(AcO)
2
/ THF – H
2
O
2.
NaBH
4
, OH
-
1.
(BH
3
)
2
2.
H
2
O
2
, OH
-
CH
3
C
CH
3
CH
3
CH
2
CH
2
OH
3,3-dimetylo-1-butan
ol
CH
3
C
CH
3
CH
3
CH
CH
3
OH
3,3-dimetylo-2-butan
ol
OTRZYMYWANIE
ALKOHOLE
1.
OTRZYMYWANIE ALKOHOLI Z ALKENÓW
PRZYKŁADY
metylocykloheksen
1.
Hg(AcO)
2
/ THF – H
2
O
2.
NaBH
4
, OH
-
1.
(BH
3
)
2
2.
H
2
O
2
, OH
-
trans-2
-metylocykloheksan
ol
1-metylocykloheksan
ol
H
3
C
HO
CH
3
OH
OTRZYMYWANIE
ALKOHOLE
2.
OTRZYMYWANIE ALKOHOLI Z HALOGENOALKANÓW –
hydroliza halogenków alkilowych
R – I
R – Br
R – Cl
+ H
2
O + HO
-
S
N
R – OH +
I
-
Br
-
Cl
-
5
OTRZYMYWANIE
ALKOHOLE
3.
OTRZYMYWANIE ALKOHOLI ZE ZWIĄZKÓW KARBONYLOWYCH
redukcja ketonów
R
C
R'
O
reakcja przyłączania związków metaloorganicznych do grupy karbonylowej
[H]:
H
2
, Ni
NaBH
4
[H]
R
CH
R'
OH
CH
3
I
Mg,
eter
CH
3
MgI
R
C
R'
O
R
C
O
-
Mg
+
R'
CH
3
δ+
δ−
R
C
O
H
R'
CH
3
HCl/H
2
O
WŁAŚCIWOŚCI CHEMICZNE
ALKOHOLE
C
O
H
+δ
+δ
−δ
ZASADA / NUKLEOFIL
C
O H
H
A
C
O H
H
+ A
silny kwas
protonowany alkohol
kation oksoniowy
C
O H
H
C O H
S
N
2
C O
H
C
+
H
2
O
nukleofil
protonowany eter
kation oksoniowy
protonowany alkohol
–OH
2
+
dobra grupa
odchodząca
WŁAŚCIWOŚCI CHEMICZNE
ALKOHOLE
1.
WŁAŚCIWOŚCI KWASOWO – ZASADOWE ALKOHOLI
ALKOHOL – słaby kwas
RO – H RO
-
+ H
+
K
a
10
-15
– 10
-16
WODA – K
a
10
-14
ALKOHOL słabszy kwas niż
WODA
2
RO –
H
+ K (Na) 2
RO
-
Na
+
+ H
2
RO
-
Na
+
+
H
2
O
RO –
H
+ NaOH
ALKOHOL silniejszy kwas niż
AMONIAK
RO –
H
+ NaNH
2
RO
-
Na
+
+
NH
3
6
WŁAŚCIWOŚCI CHEMICZNE
ALKOHOLE
1.
WŁAŚCIWOŚCI KWASOWO – ZASADOWE ALKOHOLI
RCH
2
OH R
2
CHOH R
3
COH
1°
2°
3°
KWASOWOŚĆ
RCH
2
O R
2
CHO R
3
CO
ZASADOWOŚĆ
WŁAŚCIWOŚCI CHEMICZNE
ALKOHOLE
1.
WŁAŚCIWOŚCI KWASOWO – ZASADOWE ALKOHOLI
REAKCJE ALKOHOLI Z KWASAMI
NIEORGANICZNYMI, np. H
2
SO
4
H
CH
3
(CH
2
)
3
CH
2
OH
CH
3
(CH
2
)
3
CH
2
O H
H
CH
3
CH
2
CH
2
CH=CH
2
+
O H
H
H
CH
2
CH
3
(CH
2
)
3
O H
E
∆
S
N
CH
2
CH
3
(CH
2
)
3
O
H
CH
2
(CH)
3
CH
3
CH
2
CH
3
(CH
2
)
3
O
CH
2
(CH)
3
CH
3
H
+
-
WŁAŚCIWOŚCI CHEMICZNE
ALKOHOLE
1.
WŁAŚCIWOŚCI KWASOWO – ZASADOWE ALKOHOLI
REAKCJE ALKOHOLI Z KWASAMI
ORGANICZNYMI, np. CH
3
CO
2
H
CH
3
CO
2
H +
CH
3
OH
H
+
+
CH
3
C
O
OCH
3
+ H
2
O
ESTER
K
=
[ESTER] [H
2
O]
[ROH] [RCO
2
H]
K
7
WŁAŚCIWOŚCI CHEMICZNE
ALKOHOLE
1.
WŁAŚCIWOŚCI KWASOWO – ZASADOWE ALKOHOLI
REAKCJE ALKOHOLI Z KWASAMI
HALOGENOWODORAMI, np. HCl, HBr
R – CH
2
–
X
+ H
2
O
R – CH
2
– OH +
HX
R – CH
2
– OH
2
+
X
X: I, Br, Cl
PRZYKŁADY
+
H
2
O
C
CH
3
H
3
C
CH
3
O H
+ HCl
C
CH
3
H
3
C
CH
3
Cl
25°C
94%
chlorek
tert
-butylu
∆
95%
bromek
pentylu
(CH
3
)
2
CHCH
2
OH
+
HBr
(CH
3
)
2
CHCH
2
Br
+
H
2
O
WŁAŚCIWOŚCI CHEMICZNE
ALKOHOLE
2.
REAKCJE ALKOHOLI Z HALOGENKAMI FOSFORU I SIARKI
3 R – OH +
PBr
3
3 R –
Br
+ H
3
PO
3
R – OH +
PCl
5
R –
Cl
+ POCl
3
3 R – OH +
SOCl
2
R –
Cl
+ SO
2
+ HCl
dla alkoholi 1° i 2°
PRZYKŁADY
CH
2
OH
SOCl
2
CH
2
Cl
+ SO
2
+ H
Cl
91%
chlorek
benzylu
-10°C, 4h
60%
bromek
izobutylu
+
H
3
PO
3
(CH
3
)
2
CHCH
2
Br
+
PBr
5
(CH
3
)
2
CHCH
2
OH
WŁAŚCIWOŚCI CHEMICZNE
ALKOHOLE
3.
REAKCJE UTLENIANIA ALKOHOLI
dla alkoholi 2°
dla alkoholi 1°
[O] :
Cu, 300°C
CrO
3
KMnO
4
, H
2
O,
∆
R
CH
H
OH
CrO
3
HCl Pyr
R
C
H
O
PCC
R
C
H
O
R
C
OH
O
[O]
[O]
R
CH
R
OH
R
C
R
O
[O]

8
WYSTĘPOWANIE
FENOLE
OH
OH
R
gdzie
R = (CH
2
)
14
CH
3
(CH
2
)
7
CH=CH(CH
2
)
5
CH
3
(CH
2
)
7
CH=CHCH
2
CH=CH(CH
2
)
2
CH
3
Urusiole – substancje parząca izolowane z toksyn bluszczu
aminokwas tyrozyna
HO
CH
2
CHCOO
2
-
NH
3
+
CH
3
OH
H
H
H
HO
OH
Y
O
HO
OH
O
CONH
2
OH
CH
3
Z
OH
H
N(CH
3
)
2
gdzie
Y = Cl, Z = H aureomycyna
Y = H, Z = OH terramycyna
żeński hormon płciowy – estradiol
antybiotyki z rodziny tetracyklin
OTRZYMYWANIE
FENOLE
2.
IZOLOWANIE FENOLI ZE SMOŁY POGAZOWEJ
– podczas suchej destylacji węgla
OH
OCH
3
EUGENOL
goździki
OH
OCH
3
IZOEUGENOL
gałka
muszkatołowa
OH
H
3
C
TYMOL
mięta, tymianek
1.
IZOLOWANIE FENOLI ZE ŹRÓDEŁ NATURALNYCH
OH
CH
3
OH
CH
3
OH
H
3
C
OH
fenol
o-, m-, p-
krezol
OTRZYMYWANIE
FENOLE
3.
HYDROLIZA HALOGENKÓW AROMATYCZNYCH DO FENOLI
X
10% NaOH
350°C, 200 atm
O
-
Na
+
H
2
O /CO
2
OH
-NaHCO
3
X: Br lub Cl
dla podstawionych halogenków arylowych – reakcja niejednoznaczna
X
CH
3
1. NaOH,
∆
2. CO
2
, H
2
O
OH
CH
3
CH
3
OH
+
o-
oraz
m-
krezol
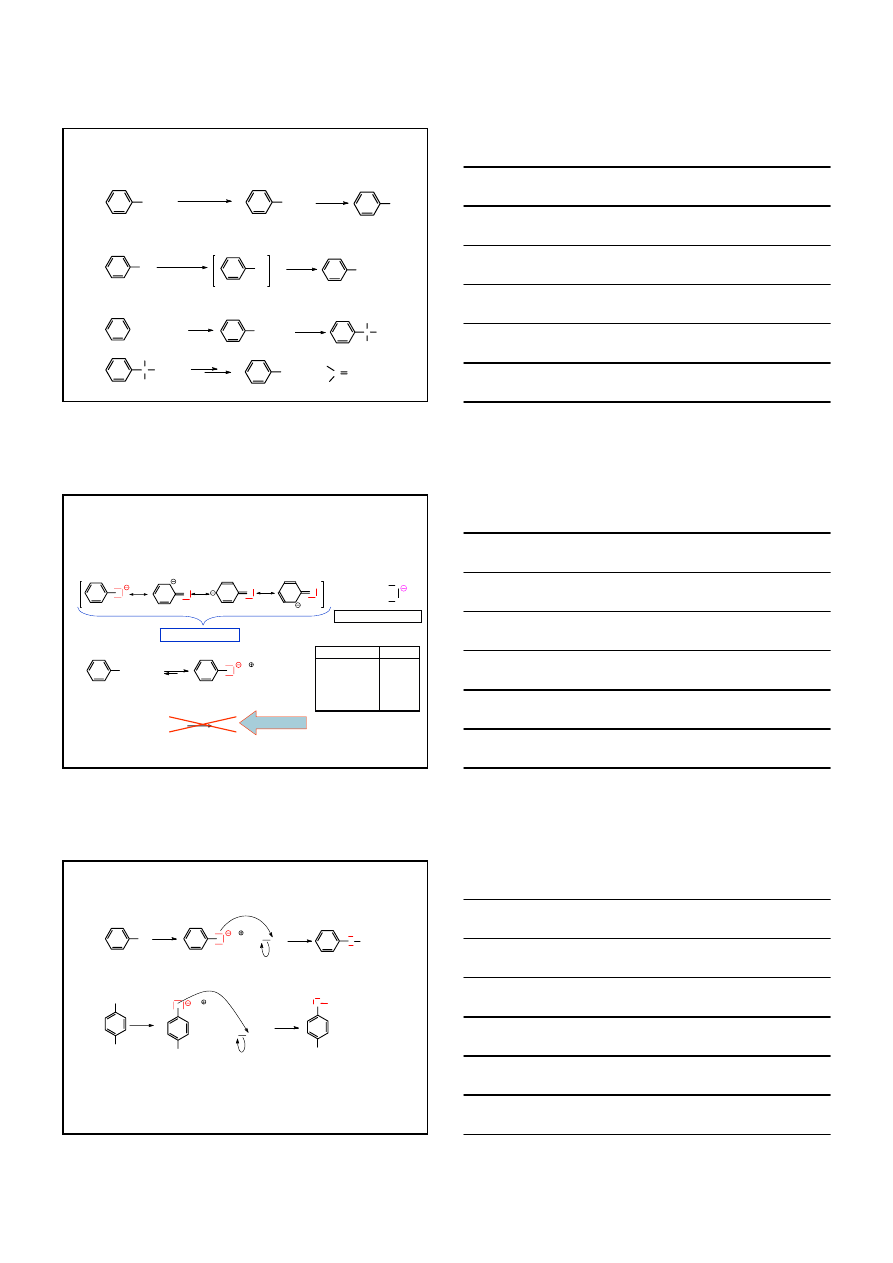
9
OTRZYMYWANIE
FENOLE
4.
STAPIANIE SOLI ARENOSULFONOWYCH Z ALKALIAMI
-NaHCO
3
OH
H
2
O /CO
2
O
-
Na
+
staly NaOH
300°C
SO
3
-
Na
+
5.
OTRZYMYWANIE FENOLI POPRZEZ SOLE DIAZONIOWE
OH
H
2
O,
∆
N
2
+
NaNO
2
/ HCl
0°C
NH
2
Cl
-
N
2
+
6.
OTRZYMYWANIE FENOLU METODĄ KUMENOWĄ
C
CH
3
CH
3
OOH
O
2
powietrze
CH(CH
3
)
2
H
3
PO
4
S
E
+
CH
3
CH=CH
2
KUMEN
C
CH
3
CH
3
OOH
+
H
2
SO
4
80°C
OH
H
3
C
C
H
3
C
O
ACETON
FENOL
WŁAŚCIWOŚCI CHEMICZNE
FENOLE
1.
WŁAŚCIWOŚCI KWASOWO – ZASADOWE FENOLI
FENOLE – silniejsze kwasy od alkoholi i wody
O
O
O
O
JON FENOLANOWY
R – O
JON ALKOHOLANOWY
+
OH
NaOH
O
Na
+ H
2
O
ALE
BRAK REAKCJI
R – OH + NaOH
pKa
FENOL
9.89
WODA
15.74
CH
3
CH
2
OH
15.9
(CH
3
)
3
COH
18.0
WŁAŚCIWOŚCI CHEMICZNE
FENOLE
2.
REAKCJE ALKILOWANIA FENOLI
OH
O
Na
+ NaI
NaOH
CH
3
I
O
CH
3
ANIZOL
(metoksybenzen)
S
N
S
N
p-
etoksytoluen
+ NaI
OH
CH
3
Na
NaOH
CH
2
CH
3
I
O
CH
2
CH
3
CH
3
O
CH
3
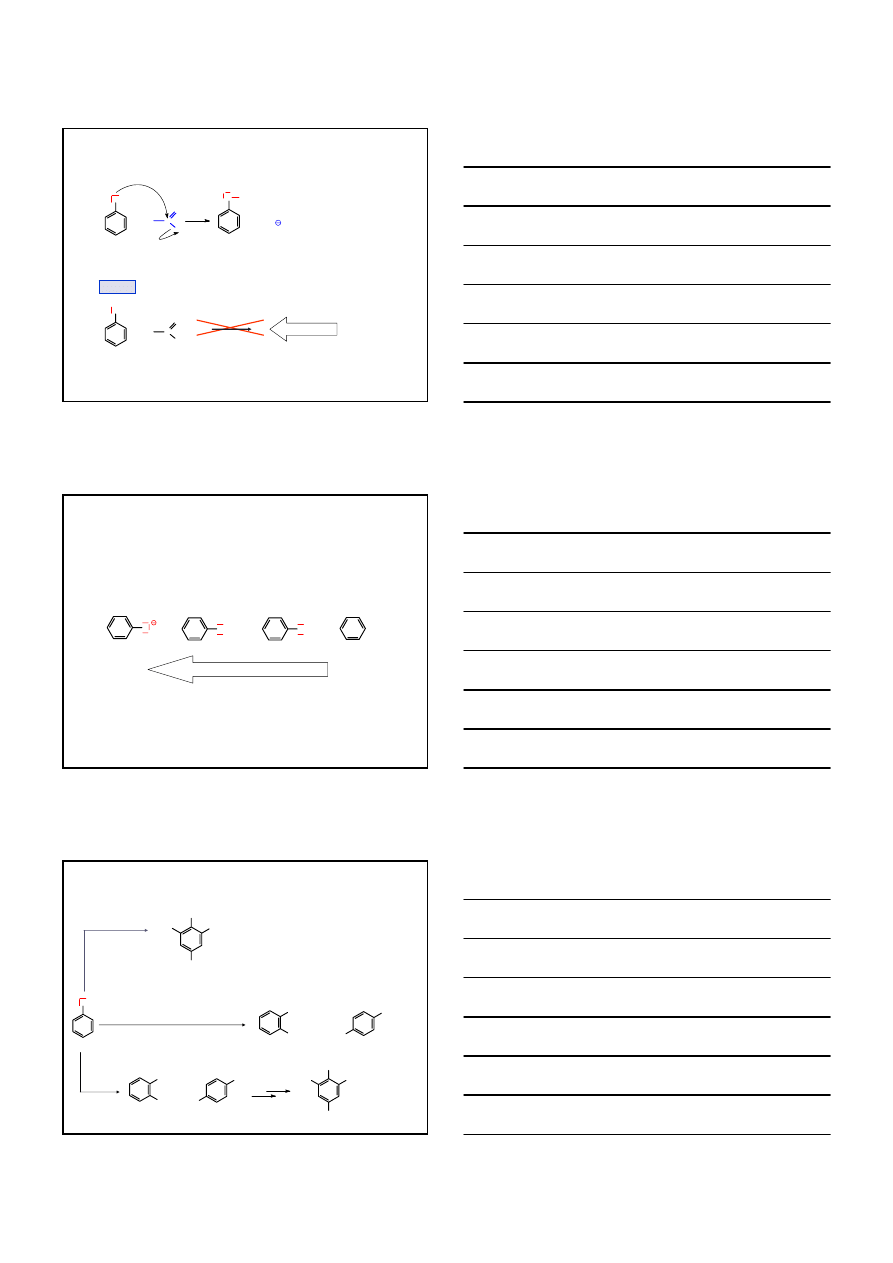
10
WŁAŚCIWOŚCI CHEMICZNE
FENOLE
3.
REAKCJE ACYLOWANIA FENOLI
OH
R
C
O
CI
O
COCH
3
+
Cl
octan
fenylu
UWAGA
OH
R
C
O
OH
+
BRAK REAKCJI
WŁAŚCIWOŚCI CHEMICZNE
FENOLE
4.
REAKCJE S
Earom
FENOLI
HO –
PODSTAWNIK
I RODZAJU
kieruje następny podstawnik w pozycje o- i p-
aktywuje na reakcje S
Earom
OH
OR
O
REAKTYWNOŚĆ W REAKCJI S
Earom
WŁAŚCIWOŚCI CHEMICZNE
FENOLE
4.
REAKCJE S
Earom
FENOLI
OH
+
OH
NO
2
OH
O
2
N
OH
O
2
N
NO
2
NO
2
20% HNO
3
0 – 5°C
kwas pikrynowy
OH
Br
Br
Br
Br
2
/H
2
O
96% H
2
SO
4
temp. pokoj.
+
OH
SO
3
H
SO
3
H
HO
2,4,6-tribromo
fenol
kwas o- i p-
hydroksybenzeno
-
sulfonowy
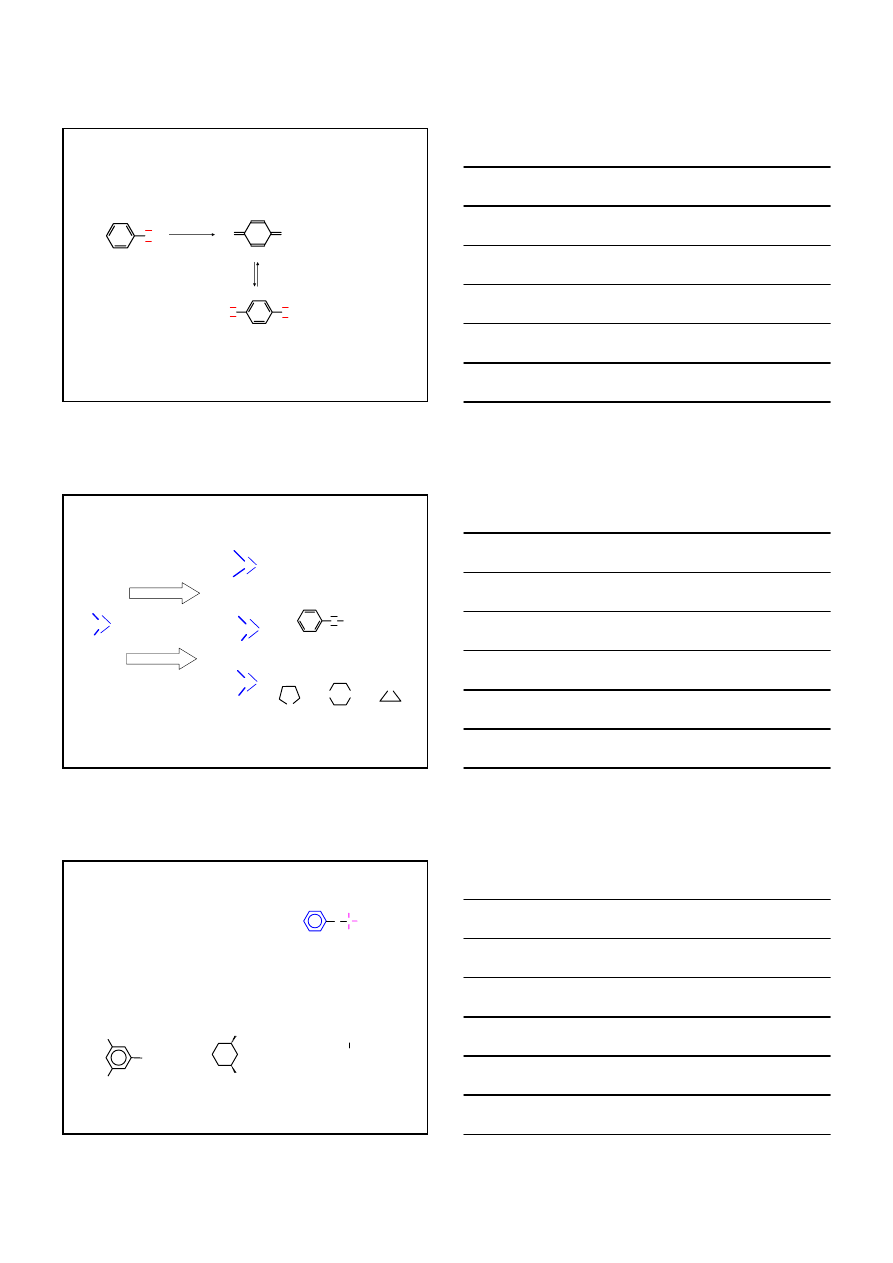
11
WŁAŚCIWOŚCI CHEMICZNE
FENOLE
5.
REAKCJE UTLENIANIA FENOLI
Mn
VI
lub Cr
VI
OH
O
O
+ 2 H
+
+ 2e
-
- 2e
-
OH
HO
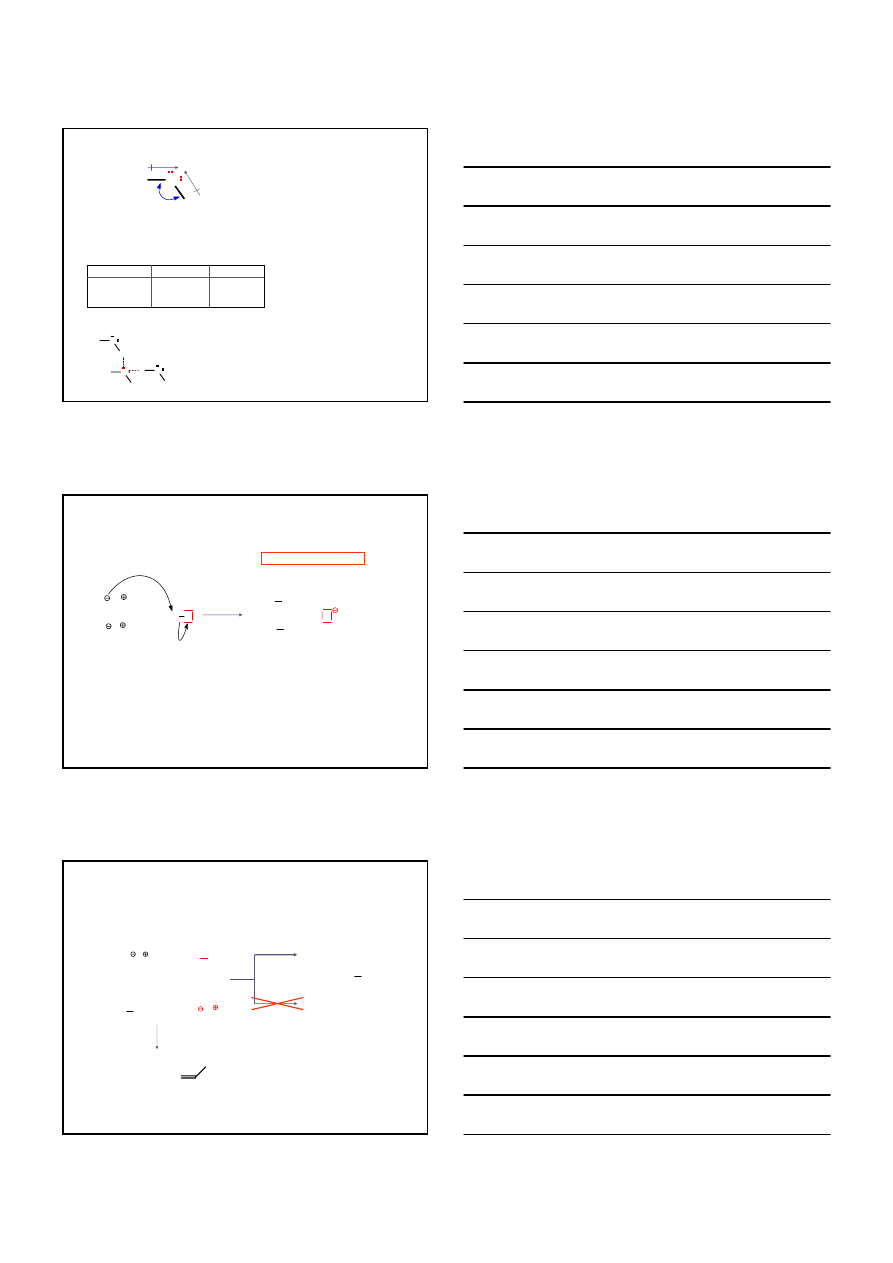
H / R = alkil
ETERY
H
O
H
H / Ar = aryl
Ar
O
Ar
R
O
Ar
R
O
R'
SYMETRYCZNE, np. CH
3
–O–CH
3
NIESYMETRYCZNE, np.
O CH
2
CH
3
CYKLICZNE, np.
O
O
O
O
TETRAHYDROFURAN
1,4-DIOKSAN
OKSIRAN
NOMENKLATURA
ETERY
nazwy tworzy się zazwyczaj przez podanie po słowie ‘
eter
’ nazw dwóch grup w
formie przymiotnikowej wg kolejności alfabetycznej
CH
3
–
O
–
CH
2
CH
3
ETER
ETYLOWO
METYLOWY
CH
3
CH
2
–
O
–
CH
2
CH
3
ETER DI
ETYLOWY
O
C
CH
3
CH
3
CH
3
ETER
tert-
BUTYLOWO
FENYLOWY
IUPAC – jeżeli jedna z grup nie ma prostej nazwy, to należy związek traktować jako
pochodną
alkoksylową
METOKSY
ETAN
ETOKSY
ETAN
tert-
BUTOKSY
BENZEN
OCH
3
CH
3
O
CH
3
O
OH
OCH
2
CH
3
CH
3
CHCH
2
CH
2
CH
3
OCH
2
CH
3
1,3,5-TRI
METOKSY
BENZEN
trans-3-
ETOKSY
CYKLOHEKSANOL
2-
ETOKSY
PENTAN
12
WŁAŚCIWOŚCI FIZYCZNE
ETERY
wiązania C –
O
są kowalencyjne i spolaryzowane
α
kąt walencyjny C
O
R
α ≈ 110°
cząsteczka posiada wypadkowy moment dipolowy
µ = 1.2D;
jest słabo polarna
R
O
R
temp. wrzenia eterów są zbliżone do temp. wrzenia alkanów o tej samej masie cząsteczkowej
M
cz
t
w
1-butanol
74
118°C
eter dietylowy
74
35°C
pentan
76
36°C
cząsteczki eterów o małych podstawnikach są solwatowane przez cząsteczki wody; ale już
eter dietylowy jest nierozpuszczalny w wodzie;
wyjątek:
etery cykliczne
R
O
R
H
O
H
H
O
H
ETERY SĄ NIEREAKTYWNE CHEMICZNIE
OTRZYMYWANIE
ETERY
1.
SYNTEZA WILLIAMSONA OTRZYMYWANIA ETERÓW
RO Na
lub
ArO Na
+
R' X
RO
R'
lub
ArO
R'
+
X
X: Cl, Br, I
R’: CH
3
> 1° > 2°
METODA UNIWERSALNA
(CH
3
)
2
CHO Na
CH
3
CH
2
Br
+
(CH
3
)
2
CH Br
CH
3
CH
2
O Na
+
OTRZYMYWANIE
ETERY
1.
SYNTEZA WILLIAMSONA OTRZYMYWANIA ETERÓW
1°
2°
S
N
(CH
3
)
2
CHO
CH
2
CH
3
E
CH
3
CH
2
OH
+
+
Na
Br
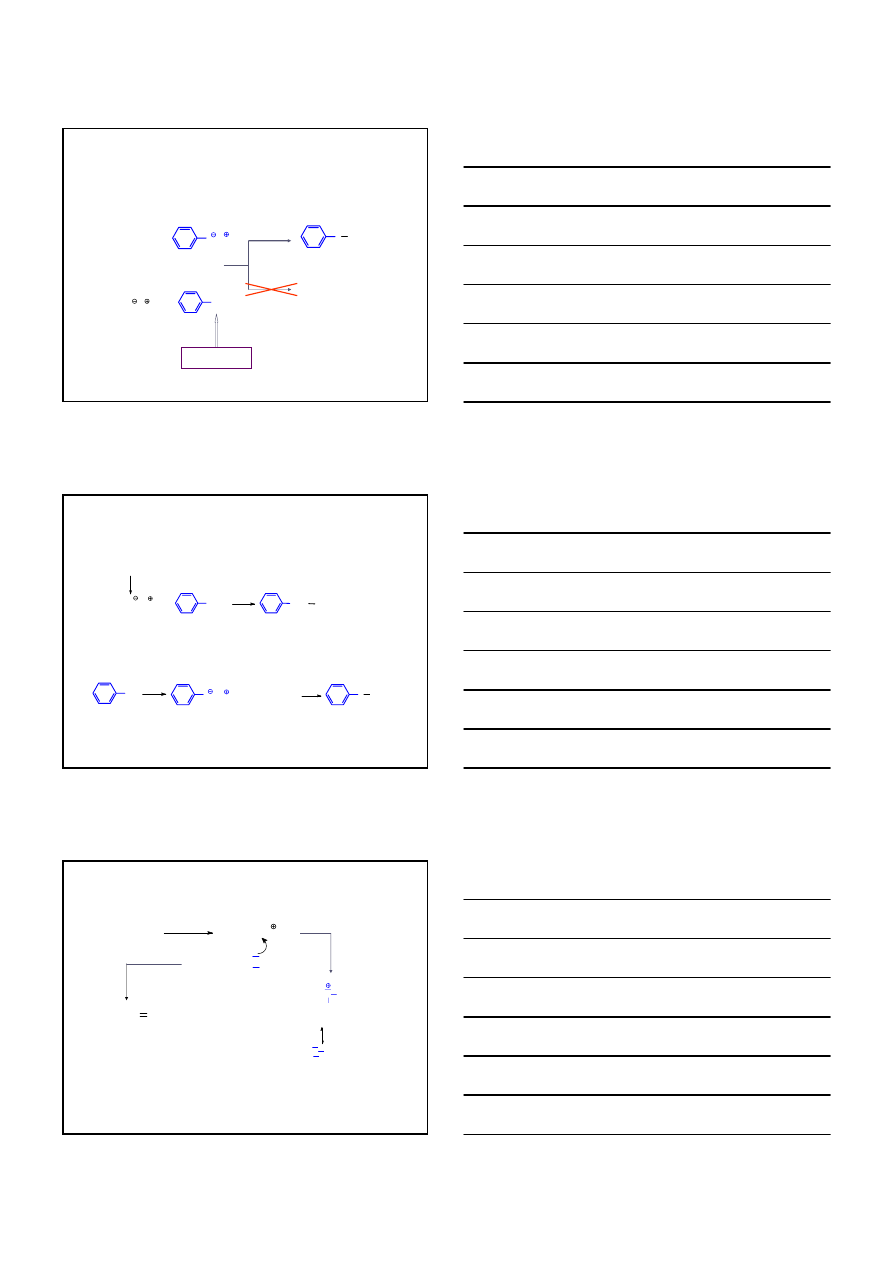
13
OTRZYMYWANIE
ETERY
1.
SYNTEZA WILLIAMSONA OTRZYMYWANIA ETERÓW
S
N
+
O Na
CH
3
CH
2
CH
2
Br
CH
3
CH
2
CH
2
O Na
Br
+
O
CH
2
CH
2
CH
3
+
Na
Br
„NIERUCHLIWY”
CHLOROWIEC
OTRZYMYWANIE
ETERY
1.
SYNTEZA WILLIAMSONA OTRZYMYWANIA ETERÓW
PRZYKŁADY
CH
3
CH
2
OH + NaH
CH
2
Br
+
CH
3
CH
2
O Na
CH
2
O CH
2
CH
3
+
Na
Br
ETER
BENZYLOWO
ETYLOWY
+
O Na
(CH
3
)
2
CHCH
2
Br
OH
NaOH
O
CH
2
CH(CH
3
)
2
+
Na
Br
ETER
FENYLOWO
IZOBUTYLOWY
OTRZYMYWANIE
ETERY
2.
OTRZYMYWANIE
ETERÓW SYMETRYCZNYCH
PRZEZ ODWODNIENIE ALKOHOLI
CH
3
(CH
2
)
2
CH
2
OH
rozc. H
2
SO
4
t < 130°C
CH
3
(CH
2
)
2
CH
2
OH
2
CH
3
(CH
2
)
2
CH
2
OH
CH
3
CH
2
CH CH
2
CH
3
(CH
2
)
2
CH
2
O
CH
2
(CH
2
)
2
CH
3
H
+ H
2
O
CH
3
(CH
2
)
2
CH
2
O
CH
2
(CH
2
)
2
CH
3
+ H
2
O
E
t >130°C
S
N
t <130°C

14
WŁAŚCIWOŚCI CHEMICZNE
ETERY
1.
REAKCJE ACYDOLIZY ETERÓW, tzw. rozszczepianie eterów pod działaniem kwasów
MOCNE KWASY:
HBr
lub
HI
– ANIONY BARDZO DOBRE NUKLEOFILE
R O R'
+
HX
∆
R O R'
H
+
X
R
X
+ R' OH
∆
∆
HX
R'
X
+ H
2
O
R O Ar
+
HX
R
X
+ Ar OH
∆
Ar O Ar +
HX
∆
WŁAŚCIWOŚCI CHEMICZNE
ETERY
2.
REAKCJE AUTOOKSYDACJI ETERÓW
dotyczy eterów z H
α
C
H
O
R
O
2
C
OO
H
O
R
ROH +
C
O
O
n
α
EPOKSYDY – OTRZYMYWANIE
ETERY CYKLICZNE
1.
REAKCJA KATALITYCZNEGO UTLENIANIA ETENU TLENEM
(z powietrza)
H
2
C CH
2
O
2
, Ag
250°C
H
2
C
CH
2
O
2.
REAKCJA WEWNĄTRZCZĄSTECZKOWEJ S
N
HALOGENOHYDRYN
(wobec stężonych zasad)
N
S
H
2
C
CH
CH
3
Cl
OH
H
2
C
CH
O
CH
3
Cl
2
/H
2
O
H
2
C
CH
CH
3
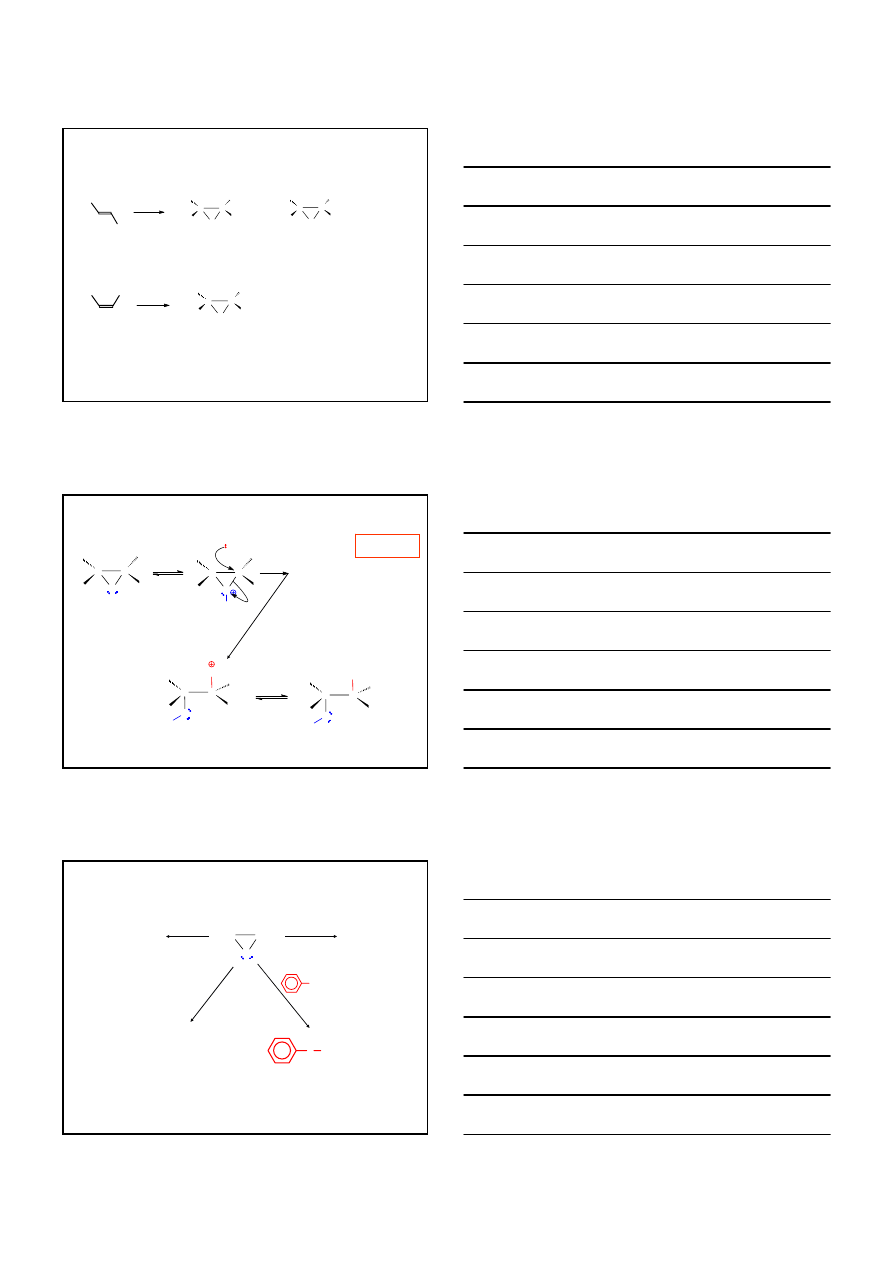
15
EPOKSYDY – OTRZYMYWANIE
3.
REAKCJA UTLENIANIA ALKENÓW NADKWASAMI
+
CH
3
CO
3
H
CCl
4
C
C
O
CH
3
H
H
3
C
H
C
C
O
H
CH
3
H
H
3
C
E
trans-
EPOKSYBUTAN
tlenek trans-2-butenu
CH
3
CO
3
H
CCl
4
C
C
O
H
CH
3
H
3
C
H
Z
cis-
EPOKSYBUTAN
tlenek cis-2-butenu
EPOKSYDY – REAKCJE OTWIERANIA PIERŚCIENIA
1.
REAKCJE OTWIERANIA PIERŚCIENIA KATALIZOWANE KWASAMI
+
H
+
C
C
O
C
C
O
H
C
C
O
H
NuH
-
H
+
C
C
O
H
Nu
ADDYCJA
anti-
NuH
EPOKSYDY – REAKCJE OTWIERANIA PIERŚCIENIA
1.
REAKCJE OTWIERANIA PIERŚCIENIA KATALIZOWANE KWASAMI
H
2
C
CH
2
O
HBr
Br–
CH
2
CH
2
–
O
H
2-
bromo
etanol
HO–
CH
2
CH
2
–
O
H
1,2-etano
diol
H
+
/H
2
O
C
2
H
5
OH/H
+
CH
3
CH
2
O–
CH
2
CH
2
–
O
H
2-
etoksy
etanol
OH/H
+
2-
fenoksy
etanol
O
CH
2
CH
2
O
H

16
EPOKSYDY – REAKCJE OTWIERANIA PIERŚCIENIA
2.
REAKCJE OTWIERANIA PIERŚCIENIA KATALIZOWANE ZASADAMI
C
C
O
OH
H
2
O
C
C
O
H
OH
C
C
O
OH
+
OH
EPOKSYDY – REAKCJE OTWIERANIA PIERŚCIENIA
PORÓWNANIE
OH
+
H
2
C
CH
2
O
H
H
2
C
CH
2
O
O
+
HO
-
H
+
O
CH
2
CH
2
O
H
EPOKSYDY – REAKCJE OTWIERANIA PIERŚCIENIA
EPOKSYD NIESYMETRYCZNY
C
CH
2
O
H
3
C
H
3
C
H
+
/EtOH
EtO
-
/EtOH
C
CH
2
O
H
3
C
H
3
C
H
EtOH
-
H
+
C
CH
2
O
H
O
H
3
C
H
3
C
Et
H
C
CH
2
O
H
O
H
3
C
H
3
C
Et
C
CH
2
O
H
3
C
H
3
C
H
O
Et
C
CH
2
O
H
3
C
H
3
C
O
Et
EtOH
+
EtO
-
2-ETOKSY
-2-METYLO-
1
-PROPANOL
1-ETOKSY
-2-METYLO-
2
-PROPANOL

17
JAKO ROZPUSZCZALNIKI
ETERY
ZWIĄZKI MAGNEZOORGANICZNE – tzw. ZWIĄZKI GRIGNARDA
R –
X
+ Mg
RMg
X
ROZPUSZCZALNIK
OTRZYMYWANIE ZWIĄZKÓW GRIGNARDA
ROZPUSZCZALNIK
CH
3
CH
2
–O–CH
2
CH
3
tw 36
°C
THF
tw 54
°C
R
allil, benzyl
alkil
aryl
winyl
X
I
Br
Cl
RE
A
K
TYWNO
ŚĆ
RE
A
K
TYWNO
ŚĆ
STRUKTURA ZWIĄZKÓW GRIGNARDA
X
Mg
X
R
2
Mg
O
Et
Et
O
Et
Et
RMg
X
R–CH
2
––
MgX
−δ
+δ
WIĄZANIE KOWALENCYJNE SPOLARYZOWANE
REAKCJE ZWIĄZKÓW GRIGNARDA
1.
‘RUCHLIWY’ WODÓR
RCH
2
–MgX +
H
– OH RCH
2
–
H
+ MgX(OH)
RCH
2
–MgX +
H
– OR RCH
2
–
H
+ MgX(OR)
RCH
2
–MgX +
H
– NH
2
RCH
2
–
H
+ MgX(NH
2
)
RCH
2
–MgX +
RCH
2
–
H
+ MgX(RCOO)
O
C
O
H
R
RCH
2
–MgX +
H
– C
≡CH RCH
2
–
H
+ H – C
≡C
-
MgX
+

18
REAKCJE ZWIĄZKÓW GRIGNARDA
2.
PIERWIASTKI
RCH
2
–MgX +
O
2
RCH
2
–
OO
– MgX
RCH
2
–
O
H + MgCl
2
HCl/H
2
O
RCH
2
–MgX +
S
8
RCH
2
–
S
– MgX
RCH
2
–
S
H + MgCl
2
HCl/H
2
O
RCH
2
–MgX +
I
2
RCH
2
–
I
+ MgX
2
3.
EPOKSYDY
HCl/H
2
O
+
MgCl
2
H
2
C CH
2
O
RCH
2
MgX
H
2
C
CH
2
CH
2
R
O
O
H
CH
2
R
CH
2
H
2
C
MgX
REAKCJE ZWIĄZKÓW GRIGNARDA
4.
ZWIĄZKI KARBONYLOWE
+δ
−δ
+δ
−δ
C
O
+
RMgX
C
O
R
MgX
H
3
O
+
/H
2
O
C
O
R
H
PRZYKŁADY
H
C
H
O
+
CH
3
MgCl
H
C
H
O
CH
3
MgCl
H
C
H
O
CH
3
H
+
MgCl
2
HCl
H
C
H
3
C
O
+
CH
3
CH
2
MgCl
H
C
H
3
C
O
CH
2
CH
3
MgCl
H
C
H
3
C
O
CH
2
CH
3
H
+
MgCl
2
HCl
H
3
C
C
H
3
C
O
+
CH
3
CH
2
MgCl
H
3
C
C
H
3
C
O
CH
2
CH
3
MgCl
H
3
C
C
H
3
C
O
CH
2
CH
3
H
+
MgCl
2
HCl
REAKCJE ZWIĄZKÓW GRIGNARDA
4.
ZWIĄZKI KARBONYLOWE – PODSUMOWANIE
METANAL
H
2
C=O
+
R’MgX
R’
CH
2
– OH
ALKOHOL 1°
ALDEHYDY
+
R’MgX
H
C
R
O
H
C
R
O
R'
H
ALKOHOL 2°
KETONY
+
R’MgX
R"
C
R
O
R"
C
R
O
R'
H
ALKOHOL 3°
O=C=O
+
RMgX
OH
O
R
C
KWAS KARBOKSYLOWY
DWUTLENEK WĘGLA

19
REAKCJE ZWIĄZKÓW GRIGNARDA
5.
POCHODNE KWASOWE
Z
O
R
C
+
CH
3
MgCl
H
3
C
C
R
O
CH
3
MgCl
H
3
C
C
R
O
CH
3
H
+
MgCl
2
HCl
gdzie:
Z = –Cl, –OR’
ETERY KORONOWE
[x]korona-y
gdzie
x - liczba atomów tworzących pierścień
y – liczba atomów tlenu w pierścieniu
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
[
18
]korona-
6
dibenzo[
18
]korona-
6
[
12
]korona-
4
[
15
]korona-
5
tt. 39-40
°C
tt. 164
°C
tt. 16
°C
ciecz
ETERY KORONOWE
K
+
O
O
O
O
O
O
MnO
4
-
średnica niszy
0.26-0.32 nm
średnica jonu Na
+
0.19 nm
średnica jonu K
+
0.266 nm
średnica jonu Cs
+
0.334 nm
jon K
+
jest kompleksowany

20
ETERY KORONOWE
O
O
O
O
O
O
O
O
O
O
O
O
NONAKTYNA – selektywnie kompleksuje jony K
+
– selektywny transport
jonów potasu przez membrany komórkowe
Wyszukiwarka
Podobne podstrony:
Chemia organiczna podstawy wykład1
Chemia organiczna podstawy wykład5
Chemia organiczna podstawy wykład6
Chemia organiczna podstawy wykład9
Chemia organiczna podstawy wykład4
Chemia organiczna podstawy wykład8
Chemia organiczna podstawy wykład11
Chemia organiczna podstawy wykład12
Chemia organiczna podstawy wykład3
Chemia organiczna podstawy wykład10
Chemia organiczna podstawy wykład11
więcej podobnych podstron