I Wstęp teoretyczny:
1.Reakcje redoks:
Jest to typ reakcji polegający na wymianie elektronu między czynnikiem redukującym (reduktorem), oddającym elektron i czynnikiem utleniającym (utleniaczem), pobierającym elektron. Cały ten proces zachodzi w myśl równania:
Reduktor utleniacz + elektron
Przykładem może być ogniwo złożone z blaszek platynowych i roztworów jonów Fe3+ i I- , będących w dwóch naczyniach połączonych mostkiem elektrolitycznym, zapewniającym przepływ elektronów z jednego naczynia do drugiego. Następnie, gdy zamkniemy obwód roztwór jodków najpierw żółknie, następnie brązowieje.
W naczyniu z jonami jodkowymi przebiegła reakcja:
![]()
Zgodnie ze schematem:
Reduktor 1 utleniacz 1 + ne
W naczyniu tym zaszła reakcja utleniania i polega ona na oddaniu elektronów. Sam jod jest w tym przypadku reduktorem.
W naczyniu z jonami żelaza zaszła reakcja:
![]()
Zgodnie ze schematem:
Utleniacz 2 + ne reduktor 2
W tej części układu zaszła reakcja redukcji (przejście jonów żelazowych w żelazawe), polegająca na pobraniu elektronów. Żelazo jest zatem utleniaczem.
W całym układzie przebiegła reakcja:
![]()
Żadna z tych reakcji nie może istnieć osobno. Oba roztwory nie ulegają zmianom tak długo, dopóki są izolowane, dopiero po kontakcie tych dwóch częsci układu może zajść reakcja zgodna ze schematem:
utleniacz 2 + reduktor 1 + ne reduktor 2 + utleniacz 1 + ne, czyli:
utleniacz 2 + reduktor 1 reduktor 2 + utleniacz 1
2. Stopień utlenienia:
Stopniem utlenienia pierwiastka nazywamy, wchodzącego w skład określonej substancji nazywamy liczbę dodatnich lub ujemnych ładunków elementarnych, które przypisalibyśmy atomom tego pierwiastka, gdyby cząsteczki tej substancji miały budowę jonową. Ze stopniem utlenienia są związane pewne reguły:
Suma stopni utlenienia wszystkich atomów wchodzących w skład cząsteczki obojętnej wynosi zero, natomiast wchodzących w skład jonu jest równa wartościowości jonu.
Pierwiastki w stanie wolnym mają przypisany stopień utlenienia 0.
Fluor we wszystkich swych połączeniach występuje na -1 stopniu utlenienia.
Tlen w większości swych połączeń występuje na -2 stopniu utlenienia. Wyjątek stanowią nadtlenki np. MgO2, gdzie jest na -1 stopniu utlenienia. W ponadtlenkach tlen występuje na -1/2 stopniu utlenienia np. w Na2O. W OF2 tlen z kolei występuje na +2 stopniu utlenienia.
Wodór przyjmuje w swych związkach +1 stopień utlenienia. Wyjątek stanowią wodorki litowców i berylowców, gdzie stopień utlenienia wodoru jest równy -1.
Stopień utlenienia podaje się jako liczbę arabską ze znakiem + lub - umieszczoną za nazwą lub symbolem pierwiastka. Czasem też oznaczenia stopnia utlenienia umieszcza się nad symbolami chemicznymi.
3. Potencjał redoks:
Potencjał redoks jest wielkością charakteryzującą dany układ pod względem jego właściwości redoks. Można go obliczyć ze wzoru Nernsta:
![]()
E0 - potencjał normalny (standardowy)
R - stała gazowa - 8,314 J/K*mol
T - temperatura bezwzględna wyrażona w Kelvinach (K)
N - liczba elektronów biorąca udział w reakcji
F - stała Faradaya - 96 490 C/mol
autl, ared - aktywności utleniacza i sprzężonego z nim reduktora
Gdy autl = ared, wtedy E = E0, a układ osiąga potencjał normalny.
Współzależność aktywności i stężenia jest wyrażona wzorem: a=fc. Gdy przyjmiemy, że futl = fred wtedy otrzymamy wyrażenie na wartość potencjału układu redoks:
![]()
4. Szereg napięciowy metali:
Szereg napięciowy metali prezentuje nam ułożone wartości potencjałów metali i wodoru (najczęściej od najmniejszego do największego).
Wodór, którego potencjał przyjęto umownie za zerowy dzieli metale na dwie grupy: metale szlachetne (i półszlachetne) oraz metale nieszlachetne. Te pierwsze mają potencjał wyższy od potencjały wodoru i nie są w stanie wyprzeć wodoru z kwasu, w związku z czym sa nierozpuszczalne w kwasach nieutleniających. Można je jedynie rozpuścić działając na nie silnymi utleniaczami. Z kolei metale leżące przed wodorem mają potencjał niższy od wodoru i są w stanie wyprzeć wodór z kwasu i one rozpuszczają się w kwasach beztlenowych.
5. Szereg potencjałów normalnych układów redoks:
Zestawienie to zaczyna się od silnych reduktorów, a kończy na silnych utleniaczach. Należy tu zwrócić szczególną uwagę na dwa układy redoks, bezpośrednio odnoszące się do wody. W praktyce odpowiadaja one działaniu wody jako utleniacza i reduktora. Można je zapisać w nastepujący sposób:
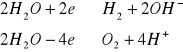
Znajomość normalnych potencjałów elektrod metalicznych, gazowych i redoksowych umożliwia obliczenie siły elektromotorycznej ogniwa, złożonego z dwóch półogniw.
6. Moc utleniacza i reduktora:
Najsilniejsze działanie utleniające wykazują jony metali o najwyższych potencjałach normalnych: Au+, Au3+, Pt2+itd.
Najsilniejszymi środkami redukującymi są metale położone na początku szeregu napięciowego, wykazujące najbardziej ujemne potencjały normalne: Li, Rb, K, Cs, Ba itd.
Ważniejsze utleniacze: nadmanganian potasu, nadsiarczan amonowy, dwuchromian i chromian potasowy lub sodowy, nadtlenek wodoru, podchloryn sodowy, bram, jod, chloramina T, nadjodan potasowy.
Ważniejsze reduktory: sole chromowe (Cr2+), żelazawe (Fe2+), cynawe (Sn2+), tytanawe (Ti3+), siarczyny, azotyny, nadtlenek wodoru, hydroksyloamina, hydrazyna, kwas askorbinowy, kwas szczawiowy i kwas mrówkowy.
Wyszukiwarka
Podobne podstrony:
teoria do redoksów 2a, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie or
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
teoria do redoksów 2, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie org
Redoksy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
sciaga na egzmin, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki
sprawko z osadów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organic
6!!!!!!!!!, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
sprawko cw1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
sprawozdanie z cw 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
Badanie substancji błonotwórczych, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.che
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
ćw.5 Ania, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
więcej podobnych podstron