I Wstęp teoretyczny:
1. Amfotery redoks:
Związki, które w zależności od tego czy reagują z silnym utleniaczem, czy z silnym reduktorem są albo reduktorami, albo w drugim przypadku utleniaczami nazywamy amfoterami redoks. Sa to najczęściej jony lub cząsteczki zawierające pierwiastki na pośrednim stopniu utlenienia. Mogą być one zredukowane do niższego stopnia lub utlenione do wyższego. Np.: Mn(II) - Mn(IV) - Mn(VI) - Mn(VII). Z tego szeregu amfoterami redoks są: Mn(IV) i Mn(VI), bowiem występują na posrednim stopniu utlenienia, mogą zatem obniżyć swój stopień utlenienia lub podwyższyć go.
2. Woda utleniona jako utleniacz oraz reduktor w reakcjach redoks:
Jest to typowy amfoter redoks, stosowany częściej jako utleniacz. Jest wygodny w stosowaniu, bowiem nie powoduje wprowadzenia żadnego dodatkowego jonu do badanego roztworu. Nadmiar nadtlenku wodoru rozkłada się łatwo przez wygotowanie , wydziela się przy tym tlen:![]()
. 30 % roztwór ![]()
zwany jest perhydrolem i w tej postaci nadtlenek wodoru jest przechowywany. Przy dłuższym przechowywaniu zachodzi rozkład tej substancji.
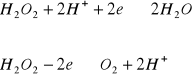
W reakcjach z reduktorami nadtlenek wodoru reaguje według pierwszego równania, np. z jonami jodkowymi:
![]()
(H2O2 jako utleniacz)
W reakcjach z utleniaczami nadtlenek wodoru działa jak reduktor np.:
![]()
(H2O2 jako reduktor)
3. Wpływ środowiska na reakcje redoks:
wzór ogólny tej reakcji:
utleniacz 1 + m1H+ + n1e reduktor 1 + m1/2 H2O
Potencjał tego układu można obliczyc ze wzoru Nernsta:
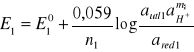
![]()
przyjmując, że log aH+ = -pH, można napisać, że:
![]()
Gdy reakcja redoks przebiega z udziałem protonu, wówczas zmniejszenie pH, czyli zwiększenie kwasowości środowiska, zwiększa potencjał utleniający układu.
wzór ogólny tej reakcji:
reduktor 2 + m2OH- - n2e utleniacz 2 + m2/2 H2O
Potencjał tego układu można obliczyc ze wzoru Nernsta:
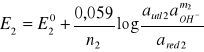
![]()
przyjmując, że log aOH- = -pOH=pH-14, można napisać, że:
![]()
i ostatecznie:
![]()
Z ostatecznego wzoru wynika, że w przypadku reakcji redoks, w których biora udział jony OH-, potencjał redoks układu wzrasta w miarę wzrostu pH . Układ ten jest silniejszym utleniaczem w środowiskach bardziej alkalicznych.
Kwasowość środowiska wpływa też na reakcje redoks przebiegające z jonami hydratowanymi. W układzie jonów wanadu pięcio- i czterowartościowego potencjał wynosi:
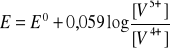
Oba jony są w srodowisku wodnym uwodnione. Reakcja ![]()
, zatem w środowisku wodnym jest prawie niemożliwa i wytwarza się nowa równowaga redoks. Potencjał tej reakcji zalezy już od nowego potencjału normalnego:
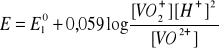
po zmianie [H+] przez pH, otrzymuje sięwyrażenie:
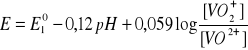
Znając wartości ![]()
oraz stężenia ![]()
i![]()
można określić krzywą zależności E od pH, która wskazuje, jak bardzo zmienia się potencjał redoks tego układu w zależności od pH.
Przykład takiej krzywej:
Reakcja dysmutacji chloru w układzie chlor-woda zależna jest od pH.
4. Reakcja dysproporcjonowania:
Reakcja dysproporcjonowania (zwane tez reakcją dysmutacji) jest to reakcja polegająca na występowaniu jednego pierwiastka w roli utleniacza i reduktora jednocześnie w jednej reakcji. Np. reakcja:
![]()
(utleniacz)
(reduktor)
Wyszukiwarka
Podobne podstrony:
teoria do redoksów 1a, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie or
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
teoria do redoksów 2, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie org
Redoksy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
sciaga na egzmin, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki
sprawko z osadów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organic
6!!!!!!!!!, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
sprawko cw1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
sprawozdanie z cw 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
Badanie substancji błonotwórczych, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.che
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
ćw.5 Ania, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
więcej podobnych podstron