Redoksy
Reakcja redoks jest to reakcja przebiegająca z wymianą elektronu. W reakcji tej bierze udział utleniacz oraz reduktor. Utleniacz przyjmuje elektron od reduktora co powoduje zmniejszenie się stopnia utlenienia (redukcja), natomiast reduktor oddaje elektron zwiększając swój stopień utlenienia (utlenianie). Ogólne równanie reakcji redoks można zapisać następująco:
![]()
Aby kreślić zdolność redukującą lub utleniającą pierwiastka wprowadzono pojęcie potencjału redoks, który można obliczyć ze wzoru Nersta.
![]()
n-ilość elektronów biorąca udział w reakcji
a=fc ![]()
ponieważ ![]()
= ![]()
wzór przyjmuje postać ![]()
ponieważ nie można obliczyć zerowego potencjału zatem przyjęto umownie za potencjał zerowy potencjał elektrody wodorowej.
Elektroda wodorowa jest to płytka platynowa pokryta czernią platynową omywana jonami wodorowymi o aktywności a=1 oraz pod ciśnieniem 1 atm. W układzie tym ustala się równowaga:
![]()
potencjał układu wynosi: 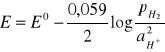
ponieważ ![]()
=![]()
=1 wzór przyjmuje postać ![]()
=0.
Obliczenie potencjałów różnych pierwiastków pozwoliło na ich uporządkowanie pod względem wartości potencjału redoks. Uporządkowanie to jest przedstawione w szeregu napięciowym metali, który jest wyraźnie podzielony na 2 grupy. Pierwszą grupe stanowią metale nie szlachetne o potencjale mniejszym niż potencjał elektrody wodorowej. Charakteryzują się one tym, że wypierają wodór z kwasu więc rozpuszczają się w nim np. Zn. Drugą grupę stanowią metale szlachetne o potencjale wyższym od potencjału elektrody wodorowej. Metale te nie wypierają wodoru z kwasu, więc nie rozpuszczają się w kwasach. Metale te można jednak rozpuścić w kwasach silnie utleniających jak np. kwas azotowy (V).
Na reakcje reoks duży wpływa ma również środowisko w jakim ta reakcja zachodzi. W środowisku silnie kwaśnym oraz zasadowym zwiększa się potencjał utleniający układu, natomiast natomiast w środowisku obojętnym zwiększa się potencjał redukujący. Ponieważ pH ma duży wpływ na przebieg reakcji stworzone formalne potencjał redoks, w którym uwzględniono wpływ pH. Przykładem reakcji, w której pH ma wpływ jest reakcja wanadu z jodem ![]()
w środowisku kwasowym reakcja ta przebiega w prawo wanad (V) utleni jodki redukując się do wanadu (IV) natomiast natomiast środowisku obojętnym lub lekko alkaicznym jod utleni wanad (IV) do wanadu(V).
Wyszukiwarka
Podobne podstrony:
teoria do redoksów 2, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie org
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
teoria do redoksów 2a, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie or
teoria do redoksów 1a, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie or
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
sciaga na egzmin, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki
sprawko z osadów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organic
6!!!!!!!!!, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
sprawko cw1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
sprawozdanie z cw 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
Badanie substancji błonotwórczych, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.che
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
ćw.5 Ania, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
więcej podobnych podstron