nr cwicz. 3 |
data
|
Krzysztof Pittner |
Wydzial Technologii chemicznej |
Semestr II |
grupa IPC |
|
przygotowanie |
wykonanie |
ocena ostatecz. |
||
Roztwory buforowe
Roztwory buforowe są to mieszaniny słabych kwasów i soli tych kwasów z silnymi zasadami lub słabych zasad i soli tych zasad z silnymi kwasami. Cechą charakterystyczna roztworów buforowych jest to, że dodanie do nich nawet stężonych kwasów lub zasad nie znacznie zmienia pH. Dlatego też używamy ich gdy zależy nam na utrzymaniu stałego pH.
O pH roztworu buforowego decyduje rodzaj substancji użytej do jego sporządzenia np. pH buforu octanowego o stężeniu 0,1M ![]()
i 0,1M ![]()
wynosi 4,5 i wyraża się wzorem: ![]()
gdzie ![]()
to stężenie soli a ![]()
to stężenie kwasu lub zasady.
Roztwory buforowe charakteryzują się również wielkością zwaną pojemnością buforową.
Pojemność buforowa wyraża się wzorem ![]()
![]()
gdzie ![]()
to ilość substancji dodanej do roztworu (w molach) a ![]()
to zmiana pH ,która nastąpiła po dodaniu związku.
Gdy w roztworze buforowym pH zawiera się w granicach ok. 3- 11 a stężenie> 0,1M to wzór na pojemność przyjmuje postać 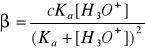
.
Pojemność buforowa przyjmuje największą wartość gdy pKa=pH i wzór ma wówczas postać:
![]()
Obliczenia i wyniki pomiarów
Bufor octanowy |
Sól |
||
Ilośc dodanej zasady [ml] |
pH |
Ilośc dodanej zasady [ml] |
pH |
0 |
4,78 |
0 |
6,94 |
1 |
4,87 |
0,2 |
10,19 |
2 |
4,97 |
0,4 |
10,56 |
3 |
5,06 |
0,6 |
10,84 |
4 |
5,17 |
0,8 |
10,92 |
5 |
5,33 |
1 |
11,02 |
6 |
5,49 |
1,2 |
11,11 |
7 |
5,79 |
1,4 |
11,18 |
8 |
6,55 |
1,6 |
11,23 |
9 |
10,38 |
1,8 |
11,27 |
10 |
11,01 |
2 |
11,32 |
11 |
11,26 |
2,2 |
11,35 |
12 |
11,41 |
2,4 |
11,39 |
13 |
11,5 |
3 |
11,48 |
14 |
11,57 |
4 |
11,57 |
15 |
11,64 |
5 |
11,66 |
16 |
11,69 |
6 |
11,71 |
17 |
11,73 |
7 |
11,76 |
18 |
11,77 |
8 |
11,81 |
19 |
11,79 |
10 |
11,87 |
20 |
11,81 |
12 |
11,92 |
21 |
11,84 |
14 |
11,95 |
22 |
11,86 |
25 |
12,02 |
23 |
11,88 |
|
|
24 |
11,9 |
|
|
25 |
11,93 |
|
|
26 |
11,94 |
|
|
Aby pH buforu zmieniło się o 1 należy dodać 7 ml 0,1M NaOH, z żeby zmienić pH soli NaCl o 1 należy dodać 0,02 ml 0,1M NaOH
2. Obliczyć w jakim stosunku należy zmieszać składniki buforu octanowego w celu otrzymania mieszaniny buforowej o pH = 4,45
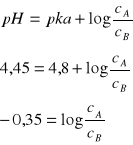
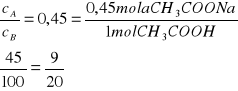
Składniki bufora należy zmieszać w stosunku ![]()
Tablica 2.3
Stężenie I składnika buforu [mol/dm3] |
0,02 |
0,04 |
0,06 |
0,08 |
Stężenie II składnika buforu [mol/dm3] |
0,08 |
0,06 |
0,04 |
0,02 |
pH buforu |
4,19 |
4,09 |
4,9 |
5,4 |
pH teoretyczne |
4,2 |
4,62 |
4,98 |
5,4 |
Składnik I-![]()
składnik II-![]()
obliczenia dla 5ml składnika I
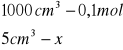
x=0,0005
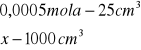
x=0,02![]()
obliczenia dla 10 ml składnika I
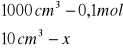
x=0,001
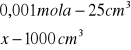
x=0,04![]()
obliczenia dla 15 ml składnika I
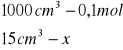
x=0,0015
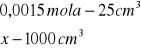
x=0,06![]()
Do obliczenia pH teoretycznego używam wzoru: ![]()
gdzie pka=4,8.
1. ![]()
w analogiczny sposób można wyliczyć pH w pozostałych przypadkach. Wyniki zostały zamieszczone w tabeli powyżej.
Obliczyć pojemność buforową badanego roztworu
Z zamieszczonego powyżej wykresu możemy obliczyć, że do zmiany pH 25![]()
buforu octanowego potrzeba 7 ml 0,1 molowego NaOH. Korzystając z definicji pojemności buforowej jako ilości dodanej zasady lub kwas (w molach) wywołującej zmiane pH 1 ![]()
buforu o 1 możemy obliczyć pojemność buforową.
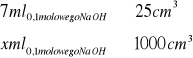
![]()
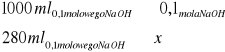
![]()
Aby zmienić pH 1 litra buforu octanowego o 1 należy dodać do roztworu 0,028 mola NaOH
wnioski: W toku pierwszej części zadania widać ze pH roztworów buforowych podczas dodawania 0,1M NaOH faktycznie zmienia się w nie wielkim stopniu w przeciwieństwie do soli NaCl, której pH zmienia się bardzo gwałtownie, jest to zgodne z założeniami teorytycznymi. W wyniku obliczeń dokonanych w zadaniu 2 możemy zobaczyć w jaki sposób po przez mieszanie składników bufora w odpowiednich proporcjach możemy ustalać żądane przez nas pH roztworu.
obliczenia dla 15 ml składnika I
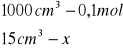
x=0,0015
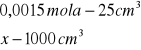
x=0,06![]()
Obliczenia dla 20 ml składnika I
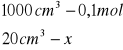
x=0,002
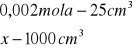
x=0,08![]()
Wyszukiwarka
Podobne podstrony:
sprawozdanie cwiczenia 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie
ćw 1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
ćw.5 Ania, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
sprawozdanie zad.12, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
cw 8 plina, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
sprawozdaniw zad.13, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
sciaga na egzmin, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki
sprawko z osadów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organic
6!!!!!!!!!, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
sprawko cw1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Badanie substancji błonotwórczych, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.che
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
więcej podobnych podstron