Nr ćwicz. 1 |
Data 12.04.2006 |
Radosław Plackowski |
Technologia chemiczna Kier. inżynieria proc. Chem. |
Semestr II |
Dr inż. Bogdan Wyrwas |
przygotowanie: |
wykonanie: |
ocena: |
|
Skala pH
Wstęp teoretyczny:
1) Teoria Arrheniusa:
Głosi, że kwas to substancja odszczepiająca w roztworze wodnym jony wodorowe, natomiast zasada to substancja odczepiająca w roztworze wodnym jony wodorotlenowe. Według tej teorii w wyniku zobojętnienia kwasu zasadą i odwrotnie powstaje sól i woda.Reakcje zobojetniania zgodnie z ta teoria rozpatruje się tylko w środowisku wodnym.Teoria ta zawodzi, gdy trzeba wyjaśniać pojęcia i reakcje kwasów i zasad w innych rozpuszczalnikach.
2) Teoria Broensteda - Lowry`ego:
Jest to teoria protonowa ogłoszona niezaleznie przez dwóch chemików Broesteda i Lowry`ego w 1923 roku. Teoria ta definiuje kwasy definiuje kwasy jako donory protonu, a zasady jako akceptory protonu. Teoria Lewisa jest bardziej ogólna niż teoria Lewisa.
3) Teoria Usanowicza:
Stanowi ona uogólnienie głoszonych wcześniej teorii. Traktuje ona kwasy jako substancje tworzące z zasadami sole, odszczepiające kationy lub przyłączające elektrony. Zasadami według tej teorii są substancje zobojętniające kwasy, odszczepiające aniony lub oddające elektrony.
4)Rola rozpuszczalnika:
Rozpuszczalniki możemy podzielić na:
Aprotonowe (niezdolne do reakcji z protonem)
Protolityczne (zdolne do przyłączania lub oddawania protonu i do reakcji autoprotolizy). Dzielą się na:
Rozpuszczalniki protonoakceptorowe (protonofilowe), którre łatwo przyłączają protony, są to zatem rozpuszcalniki zasadowe. W ich środowisku są szczególnie dobrze zdysocjowane kwasy.
Rozpuszczalniki protonodorowe (protonogenne) - łatwo oddają protony, są to więc rozpuszczalniki kwasowe. W ich środowisku zasady są dobrze zdysocjowane.
Rozpuszczalniki amfoteryczne (amfiprotyczne) - zależnie od warunkoów mogą przyłączać lub oddawać protony, a więc zachowywać się jak kwas lub zasada.
Kwas 1 + zasada 2 ![]()
zasada 1 + kwas 2
HCl + H2O ![]()
Cl- + H3O+ (1)
HSO4- + H2O ![]()
SO42- + H3O+ (2)
H2O + NH3 ![]()
OH- + NH4+ (3)
H2O +Al(H2O)5OH+![]()
OH- + Al.(H2O)63+ (4)
5)pH i iloczyn jonowy wody:
PH jako pierwszy wprowadził Soerensen i określił jako ujemny logarytm stężenia jonów wodorowych:
pH= - log[H3O+]
Wykładnik aktywności jonów wodorowych:
PaH = -log aH3O+
6)Wartości pH kwasów i zasad:
Kwasy pH od 0 ≈ 7
Zasady pH od 7 ≈ 14
Roztwory obojętne - pH = 7
7) Wskaźniki pH:
Wskaźniki pH tworzą grupę związków, organicznych, zo charakterze słabych kwasów lub słabych zasad, które reagując z wodą tworzą sprzężone układy kwas - zasada, przy czym oba człony są inaczej zabarwione. Wskaźniki możemy podzielic na jednobarwne, dwubarwne, mieszane, uniwersalne itd...
Ważniejsze wskaźniki:
Wskaźnik |
Zakres pH zmiany barwy |
Zabarwienie w roztworze |
|
|
|
kwaśnym |
aalicznym |
Błękit tymolowy |
1,2 - 2,8 |
czerwone |
żółte |
Oranż metylowy |
3,1 - 4,4 |
czerwone |
żółte |
Czerwień metylowa |
4,2 - 6,3 |
czerwone |
żółte |
Czerwień bromofenolowa |
5,2 - 6,8 |
żółte |
czerwone |
Czerwień fenolowa |
6,4 - 8,0 |
żółte |
czerwone |
Fenoloftaleina |
8,3 - 10,0 |
bezbarwne |
czerwone |
Tmoloftaleina |
9,3 - 10,5 |
bezbarwne |
niebieskie |
II) Opracowanie wyników:
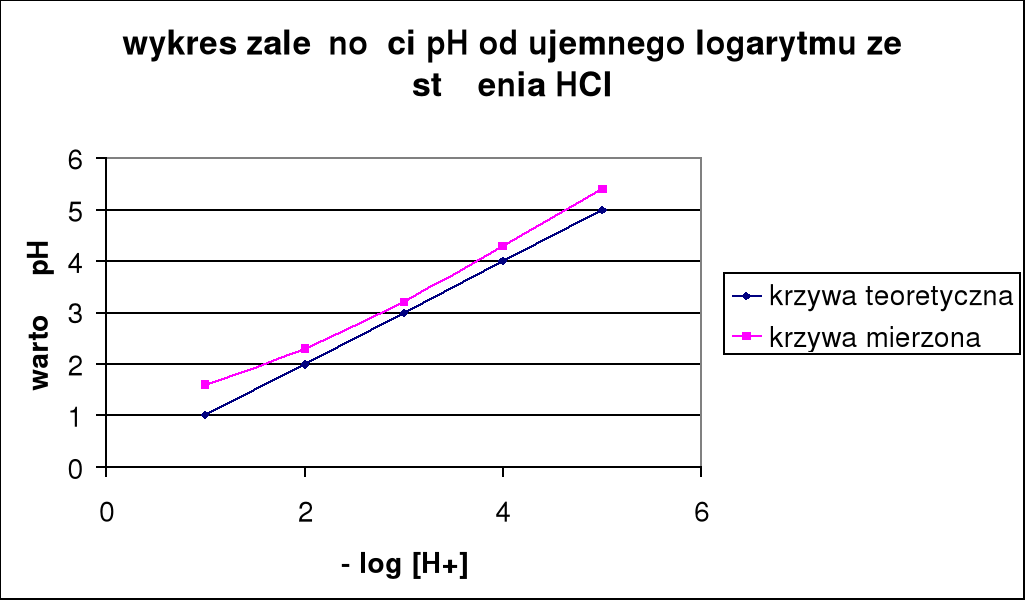
Cm HCl: |
0,1 |
0,01 |
0,001 |
0,0001 |
0,00001 |
pH: |
1,6 |
2,3 |
3,2 |
4,3 |
5,4 |
pH teoretyczne: |
1 |
2 |
3 |
4 |
5 |
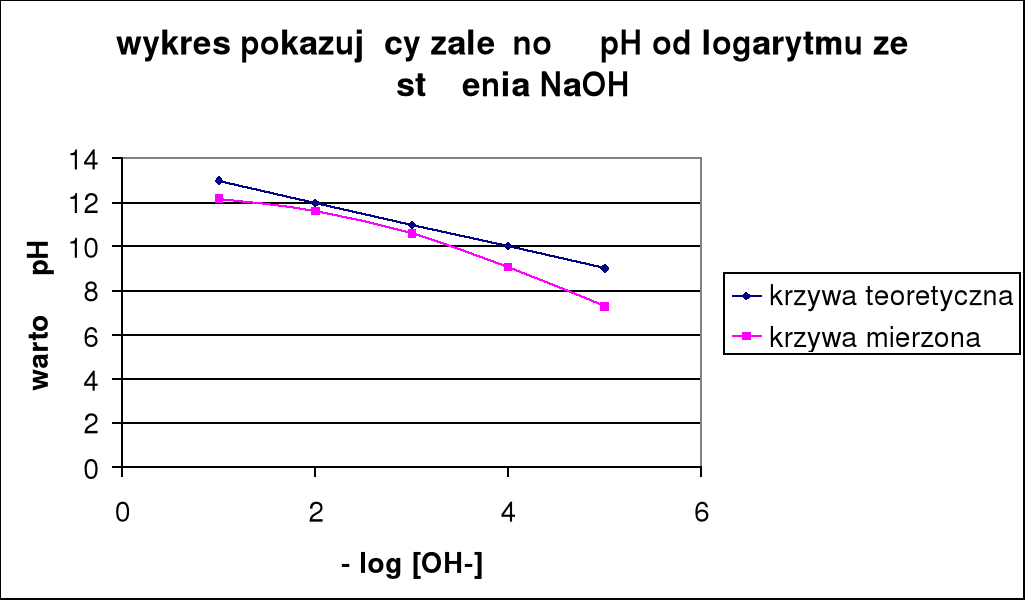
Cm NaOH: |
0,1 |
0,01 |
0,001 |
0,0001 |
0,00001 |
pH: |
12,2 |
11,6 |
10,6 |
9,06 |
7,3 |
pH teoretyczne: |
13 |
12 |
11 |
10 |
9 |
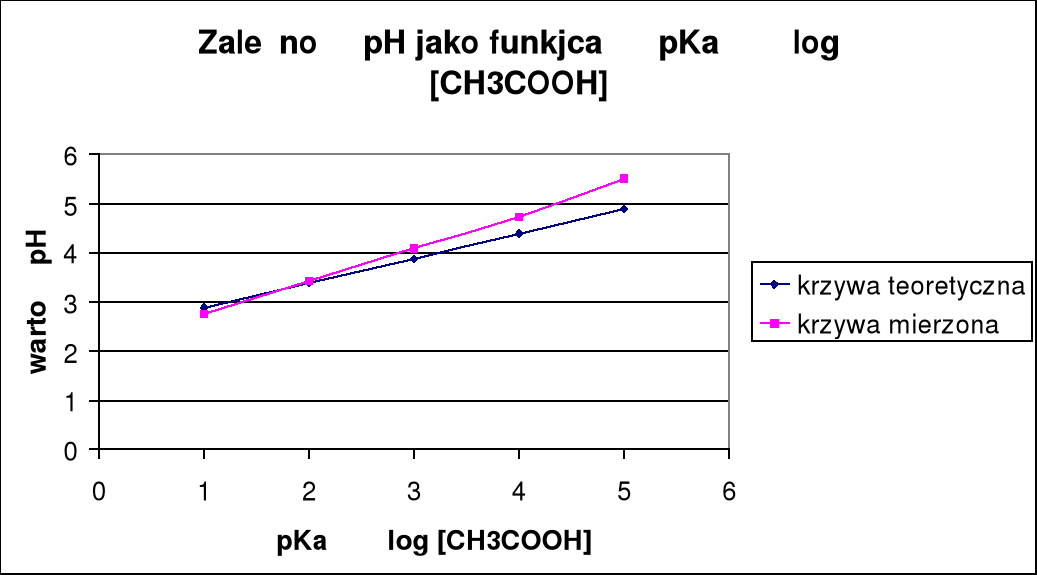
Cm CH3COOH: |
0,1 |
0,01 |
0,001 |
0,0001 |
0,00001 |
pH |
2,75 |
3,42 |
4,08 |
4,73 |
5,5 |
pH teoretyczne: |
2,88 |
3,38 |
3,88 |
4,38 |
4,88 |
Nazwa wskaźnika |
Barwa w roztworze |
Barwa w roztworze |
Przedział pH zmiany |
Błękit bromotymolowy |
żółty |
niebieski |
8,3 - 10,0 |
Oranż metylowy |
czerwony |
żółty |
3,3 - 5,1 |
Fenoloftaleina |
bezbarwna |
malinowa |
8,4 - 10,3 |
Czerwień metylowa |
Czerwony |
żółty |
9,0 - 9,5 |
III) Analiza pomiarów:
pH teoretyczne dla HCl:
Cm = 0,1 M
pH = - log [H+]
pH = -log(10-1)
pH = 1
Cm = 0,01 M
pH = - log [H+]
pH = -log(10-2)
pH = 2
Cm = 0,001 M
pH = - log [H+]
pH = -log(10-3)
pH = 3
Cm = 0,0001 M
pH = - log [H+]
pH = -log(10-4)
pH = 4
Cm = 0,0001 M
pH = - log [H+]
pH = -log(10-5)
pH = 5
pH teoretyczne dla NaOH:
Cm = 0,1 M
pH = 14 + log[OH-]
pH = 14 + log{10-1)
pH = 14 - 1
pH = 13
Cm = 0,01 M
pH = 14 + log[OH-]
pH = 14 + log{10-2)
pH = 14 - 2
pH = 12
Cm = 0,001 M
pH = 14 + log[OH-]
pH = 14 + log{10-3)
pH = 14 - 3
pH = 11
Cm = 0,0001 M
pH = 14 + log[OH-]
pH = 14 + log{10-4)
pH = 14 - 4
pH = 10
Cm = 0,00001 M
pH = 14 + log[OH-]
pH = 14 + log{10-5)
pH = 14 - 5
pH = 9
pH teoretyczne dla CH3COOH:
Cm = 0,1 M
pH = ½ pKa - ½ log [CH3COOH] pKa = 4,75
pH = 2,375 + ½ log(10-1) = 2,375 + 0,5
pH = 2,875 ≈ 2,88
Cm = 0,01 M
pH = ½ pKa - ½ log [CH3COOH] pKa = 4,75
pH = 2,375 + ½ log(10-2) = 2,375 + 1
pH = 3,375 ≈ 3,38
Cm = 0,001 M
pH = ½ pKa - ½ log [CH3COOH] pKa = 4,75
pH = 2,375 + ½ log(10-3) = 2,375 + 1,5
pH = 3,875 ≈ 3,88
Cm = 0,0001 M
pH = ½ pKa - ½ log [CH3COOH] pKa = 4,75
pH = 2,375 + ½ log(10-4) = 2,375 + 2
pH = 4,375 ≈ 4,38
Cm = 0,00001 M
pH = ½ pKa - ½ log [CH3COOH] pKa = 4,75
pH = 2,375 + ½ log(10-5) = 2,375 + 2,5
pH = 4,875 ≈ 4,88
mieszanina kwasów o różnej mocy zachowuje się jak kwas wieloprotonowy, ponieważ taki kwas dysocjuje etapami odrywając po jednym kationie wodorowym dając kolejny kwas o innej mocy.
H2SO4 + H2O -> H3O+ + HSO4-
kwas
HSO4- + H2O -> H3O+ + SO4-
kwas
Wykresy:
IV Wnioski:
pH kwasu wzrasta w miarę rozcięczania.
pH zasady maleje w miarę rozcięczania.
Dzięki znajomości jak zmieniają barwę wskaźniki w różnych środowiskach można określić jakie to środowisko (kwasowe czy zasadowe).
PH teoretyczne różni się od pH zmierzonego w praktyce, co dokładnie widać na wykresach.
Z 3 pierwszych wykresów można zauważyć ze pomiary były prowadzone poprawnie, ponieważ wyniki otrzymane nie odbiegają zbytnio od pomiarów.
Wyszukiwarka
Podobne podstrony:
Cw1 Skala pH, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
SKALA PH, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
Hydroliza soli i pH roztworów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
sciaga na egzmin, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki
sprawko z osadów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organic
6!!!!!!!!!, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
sprawko cw1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
sprawozdanie z cw 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Badanie substancji błonotwórczych, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.che
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
ćw.5 Ania, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
więcej podobnych podstron