
Monika Lasota,
Paweł Tokarz
Właściwości lantanowców
Rozdział lantanowców
Właściwy proces przemysłowego rozdzielania lantanowców rozpoczyna się już po
wyrugowaniu ich związków za pomocą gorącego, stężonego kwasu siarkowego(VI) lub
wodorotlenku sodu. Z bogatego w ich rudy piasku monacytowego selektywnie oddziela się tlenek
tytanu(IV), krzemionkę i krzemiany pierwiastków bloku d.
Pierwszym wydzielanym z mieszaniny lantanowcem jest cer. Wykorzystuje się tu specyficzną
łatwość ceru do osiągania +4. stopnia utlenienia. W tej postaci cer daje się strącać poprzez łatwą
hydrolizę zasadowego azotanu(V) lub siarczanu(VI) albo ekstrakcję.
W dalszych procesach rozdziału wykorzystuje się następujące metody:
−
frakcjonowaną krystalizację,
−
frakcjonowane wytrącanie,
−
chromatografię jonowymienną,
−
ekstrakcję.
Pierwsza z metod wykorzystuje nieznaczne różnice w rozpuszczalności pewnych soli
lantanowców, np. azotanów lantanowcowo-amonowych, podwójnych azotanów lantanowcowo-
manganowych(II) itp. Przebieg procesu jest następujący:
1. Roztwór wodny mieszaniny lantanowców (L
0
) odparowuje się do wydzielenia około połowy
zawartych w niej lantanowców – uzyskuje się roztwór L
1
bogatszy w lepiej rozpuszczalne
sole oraz mieszaninę kryształów K
1
wzbogaconą w sole o mniejszej rozpuszczalności,
2. Kryształy K
1
rozpuszcza się w wodzie, a następnie roztwór częściowo odparowuje do
wydzielenia ok. połowy zawartych w nim lantanowców w postaci kryształów K
2
, które
oddziela się od pozostałego roztworu L’
2
),
3. Jednocześnie roztwór L
1
zatęża się otrzymując w podobny sposób kryształy K’
2
i roztwór
L
2
,
4. Roztwór L’
2
i kryształy K’
2
łączy się,
5. Otrzymuje się frakcje: K
2
, L’
2
K’
2
oraz L
2
o kolejno rosnącej zawartości lepiej
rozpuszczalnych soli lantanowców,
6. Przeprowadzając powyższą procedurę wielokrotnie uzyskuje się coraz lepiej rozdzielone
roztwory poszczególnych lantanowców.
1

Analogiczną metodą jest frakcjonowane wytrącanie. Z pierwotnego roztworu strąca się ok.
połowy zawartych w nim lantanowców, najczęściej w postaci wodorotlenków. Dalsza procedura
obejmuje kolejne strącania i roztwarzania wodorotlenków w kwasach w myśl podobnego jak w
pierwszej metodzie schematu.
Trzecią metodę rozdzielania stanowi chromatografia jonowymienna. Polega ona na
przepuszczaniu roztworu soli lantanowców przez kolumnę preparatywną wypełnioną syntetyczną
żywicą jonowymienną. Żywica w kolumnie jest sprotonowana (HR). W trakcie przepuszczania
roztworu zawierającego kationy Ln
3+
następuje ich zatrzymywanie na jonicie i odszczepianie
kationów wodorowych wg schematu:
Ln
3+
+ 3HR LnR
3
+ 3H
+
Z jonitem najsilniej oddziałują najlżejsze lantanowce: La, Ce, Pr i w tej kolejności osadzają się
na jonicie. Po zaadsorbowaniu wszystkich kationów kolumnę przemywa się roztworem chlorku
sodu,. Jony sodowe wypierają jony lantanowców w myśl równania:
LnR
3
+ 3Na
+
Ln
3+
+ 3NaR
Kolejność wymywania jest dokładnie odwrotna do kolejności osadzania. W ten sposób
zbierając kolejne frakcje otrzymuje się dobrze rozdzielone lantanowce.
Metoda ta daje się jeszcze bardziej usprawnić poprzez zastosowanie do wymywania
odczynników kompleksujących (sole kwasu cytrynowego, EDTA i inne). Obecnie metody te
pozwalają otrzymywać lantanowce o czystości przekraczającej 99,99%.
Nieco mniejszej czystości lantanowce otrzymuje się poprzez ekstrakcję cieczami
niemieszającymi się z wodą. Po raz pierwszy metodę tą zastosowano do oddzielania ceru po jego
utlenieniu do +4 stopnia utlenienia. Jako ekstrahentu użyto roztworu fosforanu tri-n-butylu. Przy
zastosowaniu innych pochodnych organicznych kwasu fosforowego daje się selektywnie
skompleksować i wyekstrahować naftą również inne pierwiastki wewnątrzprzejściowe. Metody
ekstrakcji opierają się na różnej zdolności poszczególnych lantanowców do przechodzenia z +3 na
+4 lub +2 stopień utlenienia.
Właściwości magnetyczne i spektroskopowe
Widma elektronowe lantanowców
Kompleksy lantanowców odznaczają się pięknymi i subtelnymi barwami, przy czym kolory
związków jonów znajdujących się po przeciwległych stronach szeregu są zbliżone. Jony
prazeodymu i tulu mają barwę jasnozieloną, podczas gdy europu i terbu – bladoróżową.
Widma elektronowe lantanowców przynajmniej w dwu kwestiach różnią się od typowych widm
pierwiastków przejściowych. Po pierwsze zakres energii przejść elektronowych odpowiada nie
tylko promieniowaniu UV-Vis, ale sięga nawet do podczerwieni. Po drugie w odróżnieniu od
większości widm tylko w nieznacznym stopniu na położenie pasm absorpcji ma rozpuszczalnik, czy
nawet odczynnik kompleksujący.
Za paletę kolorów odpowiadają pasma absorpcji wywodzące się z trzech rodzajów przejść
elektronowych:
−
przejścia ligand - orbital f metalu
−
przejścia nf - (n+1)d
−
przejścia f-f
2
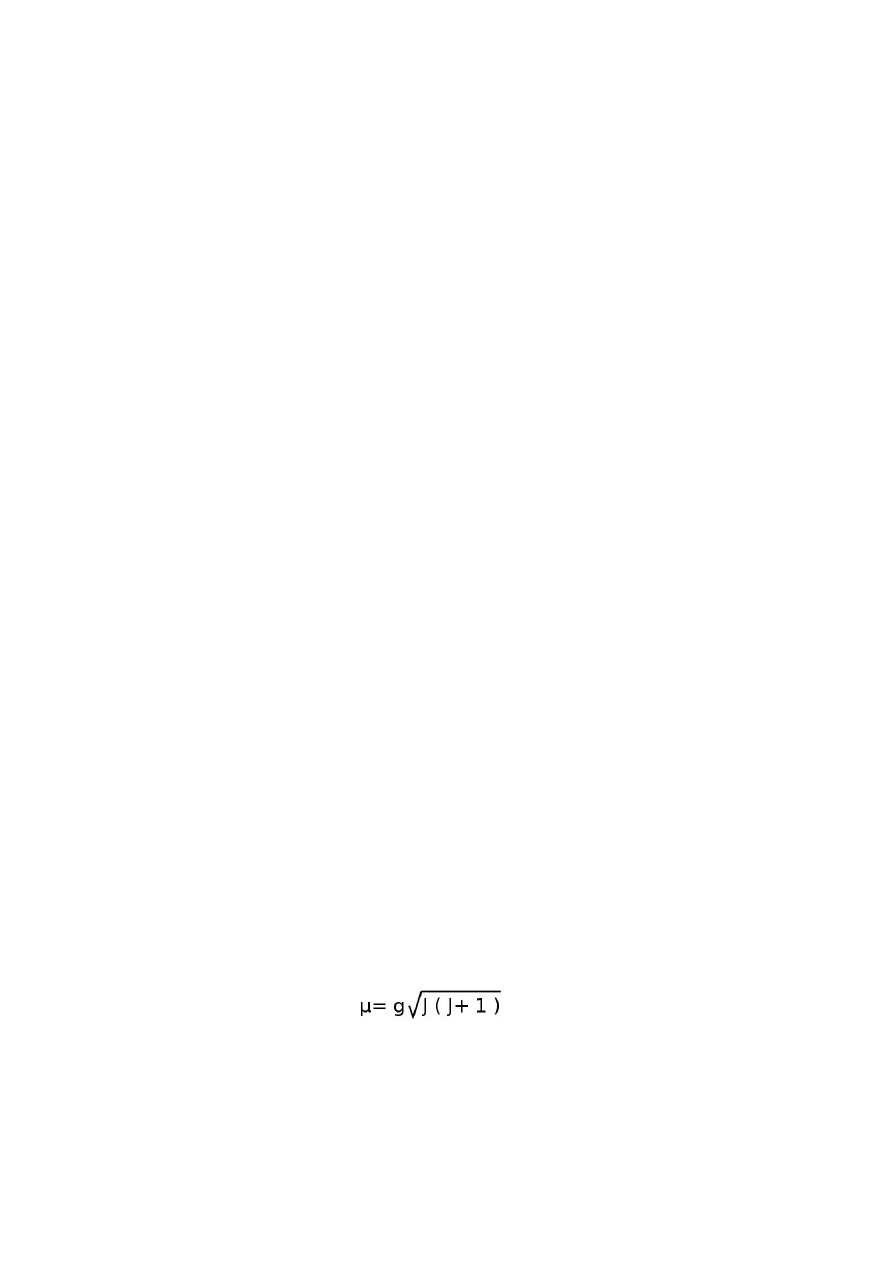
Przejścia f-f
Ostatni rodzaj przejść, f-f daje co prawda najsłabsze pasma absorpcji aczkolwiek poświęcono
im najwięcej publikacji. Przejścia te są zabronione przez reguły wyboru aczkolwiek w
rzeczywistości występują dość często. Podstawowym problemem w badaniach pasm jest fakt, iż
znajdują się one w zakresie podczerwieni nakładając się tym samym na liczne pasma oscylacyjne. Z
drugiej strony pomocnym wydaje się fakt, że otoczenie wywiera bardzo nieznaczny wpływ na
położenie tychże pasm z uwagi na umiejscowienie orbitali f w głębi atomu, a także na bardzo
nieznaczny wpływ słabego pola krystalicznego. Pasma absorpcji tego rodzaju są dosyć wąskie i w
połowie wysokości wynoszą ok. 50 cm
-1
.
Wśród licznych przejść f-f szczególne miejsce zajmują tzw. przejścia hiperczułe. Intensywność
przejść hiperczułych może się wahać w zakresie nawet trzech rzędów wielkości, w zależności od
przyłączonych ligandów. Istnienie przejść hiperczułych tłumaczy się wzajemnym oddziaływaniem
dwóch dipoli. Jednym z nich jest drgający dipol elektryczny fali świetlnej, zaś różnie tłumaczy się
pochodzenie drugiego dipola. Może on wynikać albo z indukowanej polaryzacji cząsteczki,
niecentrosymetrycznej deformacji pola ligandów lub niecentrosymetrycznych drgań kompleksu.
Fluorescencja (luminescencja)
Związki lantanowców wykazują zjawisko luminescencji – świecenia pod wpływem
promieniowania UV. Źródłem fluorescencji są przejścia f-f. Najbardziej trwałe stany wzbudzone
zdolne do emisji luminescencyjnej są tworzone przez lantanowce ze środka szeregu, a średnie czasy
ich życia są ok. 1000 razy większe niż dla skrajnych lantanowców. Jednocześnie lantanowce
położone w centrum osiągają wyższe energie wzbudzenia, mimo iż ich poziomy energetyczne są
rozłożone gęściej.
Istotną rolę dla zjawiska luminescencji pełni rozpuszczalnik. Zamiast bowiem bezpośredniego
wypromieniowania światła może dojść do przekazania energii stanu wzbudzonego nadtonowi
drgania rozciągającego grupy O-H z jednoczesną emisją nadwyżki energii. W przypadku
zastosowania jako rozpuszczalnika ciężkiej wody, czas życia stanów wzbudzonych wzrasta o rząd
wielkości.
Do zastosowań praktycznych o wiele istotniejszą jest luminescencja w stanie stałym (do
wytwarzania luminoforów np. w kineskopach, świetlówkach). Emisja z lantanowca (np. Gd(III))
następuje za pośrednictwem substancji zwanej emiterem np. Eu(III).
Właściwości magnetyczne
Właściwości magnetyczne atomu lantanowca w stanie podstawowym zależą od sumy
orbitalnych i spinowych momentów magnetycznych (J = L+S) oraz wpływu warunków
zewnętrznych np. pola krystalicznego. W przypadku lantanowców pole krystaliczne w istotny
sposób nie zmienia magnetyzmu atomu, dlatego do opisu teoretycznego wystarczy posługiwanie się
wartością J. Związki lantanowców wykazują paramagnetyzm, a wartość momentu dipolowego
opisuje równanie:
w którym g jest stałą opisywaną równaniem:
3

S to suma momentów spinowych, zaś J to suma momentów całkowitych wszystkich elektronów.
Porównanie z pierwiastkami bloku d
Pierwiastki bloku f określa się mianem wewnątrzprzejsciowych w odróżnieniu od
zewnątrzprzejściowych pierwiastków bloku d. Wynika to z faktu iż orbitale f znajdują się bliżej
jądra atomowego niż orbitale d. Rodzi to szereg rozbieżności między właściwościami
fizykochemicznymi lantanowców a pierwiastków zewnątrzprzejściowych:
−
niezależność położenia pasm absorpcji w widmach elektronowych od rozpuszczalnika i czynników
kompleksujących,
−
kontrakcja lantanowcowa,
−
duże podobieństwo fizykochemiczne poszczególnych lantanowców (w porównaniu z dużą
różnorodnością pierwiastków bloku d),
−
wodorotlenki lantanowców na trzecim stopniu utlenienia są dość silnie zasadowe, a ich sole
praktycznie nie ulegają hydrolizie
4
Wyszukiwarka
Podobne podstrony:
Lantanowce
Lantanowcex
lantanowce
Lantanowce(2)
lantanowce spr2012
lantanowce, chemia nieorganiczna, laboratorium, Chemia nieorganiczna
Lantanowce, chemia
11 lantanowce
11 Lantanowce
11 lantanowce, uran, reaktor
Lantanu (III) tlenek
Pytania na kolokwium lantanowce
Charakterystyka lantanowców i aktynowców
Lantanu (III) azotan 6 hydrat
REAKCJE ZWI¥ZKÓW LANTANUPOPRAWIONE
Związki chemiczne lantanowców i aktynowców
Lantanowce
11 lantanowce, uran, reaktor
więcej podobnych podstron