
1
ZWIĄZKI CHEMICZNE
LANTANOWCÓW I
AKTYNOWCÓW

2
Piasek monacytowy
Przeróbka
rud
lantanowców
uzależniona
jest
od
chemicznego składu rudy i może mieć różny przebieg.
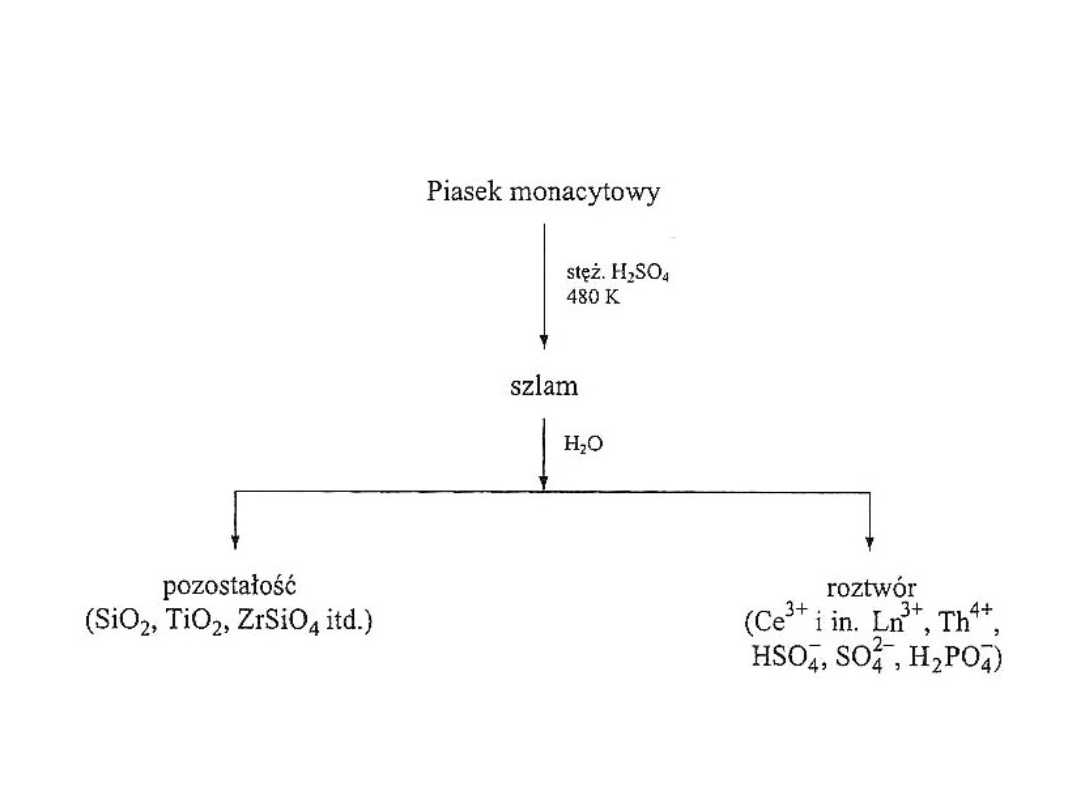
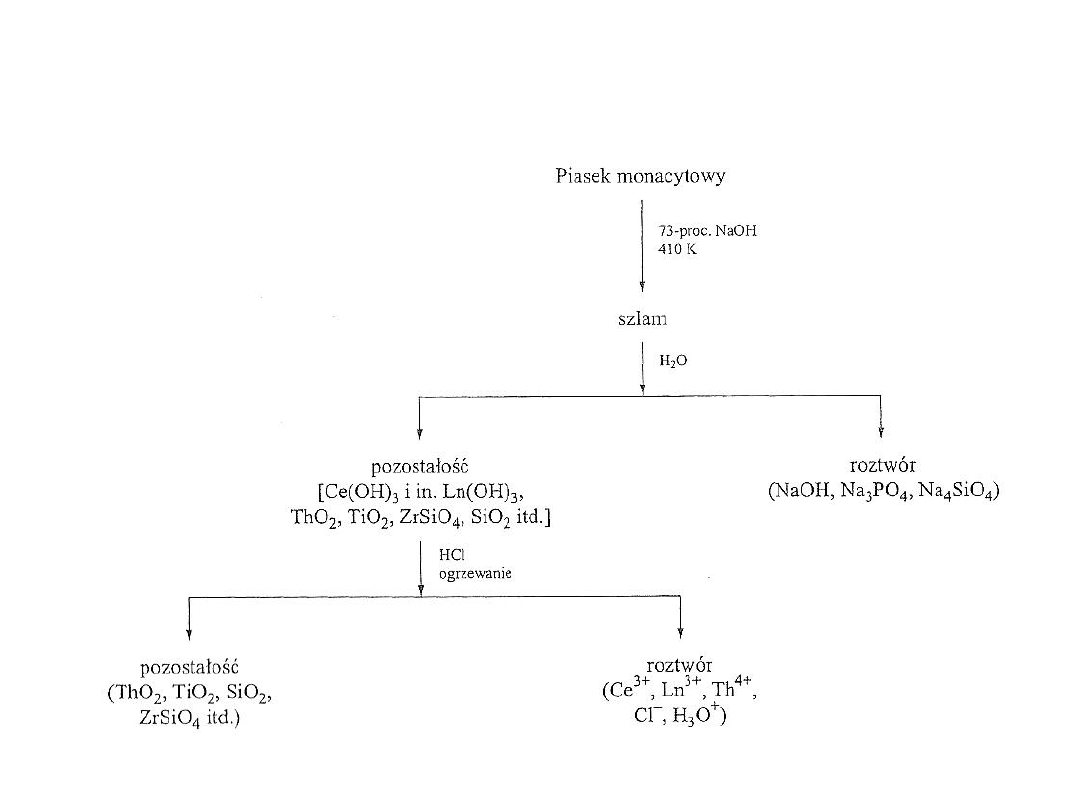
Najczęściej stosowana rudą jest piasek monacytowy. Jego
wstępna przeróbka ma na celu oddzielenie zanieczyszczeń:
krzemionki, związków tytanu i cyrkonu.
Rys 1. Monacyt
3
Rys 2. Schemat przeróbki piasku monacytowego- sposób I
Piasek monacytowy
4
Rys 2. Schemat przeróbki piasku monacytowego- sposób II
Piasek monacytowy

5
Najtrudniejszym
etapem
w
otrzymywaniu
poszczególnych pierwiastków jest separacja- rozdział
lantanowców.
Po
wstępnej
przeróbce
piasku
monacytowego z otrzymanych roztworów pozyskuje
się lantanowce.
krystalizacja frakcjonowana
Rozdział związków lantanowców
Najczęściej stosowane metody to:
strącanie frakcjonowane
ekstrakcja
chromatografia
jonowymienna

6
Krystalizacja frakcjonowana
W metodzie tej wykorzystuje się niewielkie różnice w rozpuszczalności
niektórych soli lantanowców, np.:
• Ln(NO
3
)
3
·2NH
4
NO
3
·4H
2
O, czyli podwójne azotany lantanowco-amonowe
• 2Ln(NO
3
)
3
·3Mn(NO
3
)
2
·24H
2
O
(podwójne
azotany
lantanowco-
manganawe)
Polega ona na kolejnym wykonywaniu odpowiednich czynności:
wielokrotne powtarzanie krystalizacji i rozpuszczania.
W metodzie tej jaki i w strącaniu frakcjonowanym wydziela się fazy stałe
z roztworu
Dzięki temu otrzymuje się preparaty o coraz większej czystości.
Metodę można opisać za pomocą współczynnika rozdzielenia:
Im α większe od 1, tym rozdzielenie jest bardziej efektywne
7
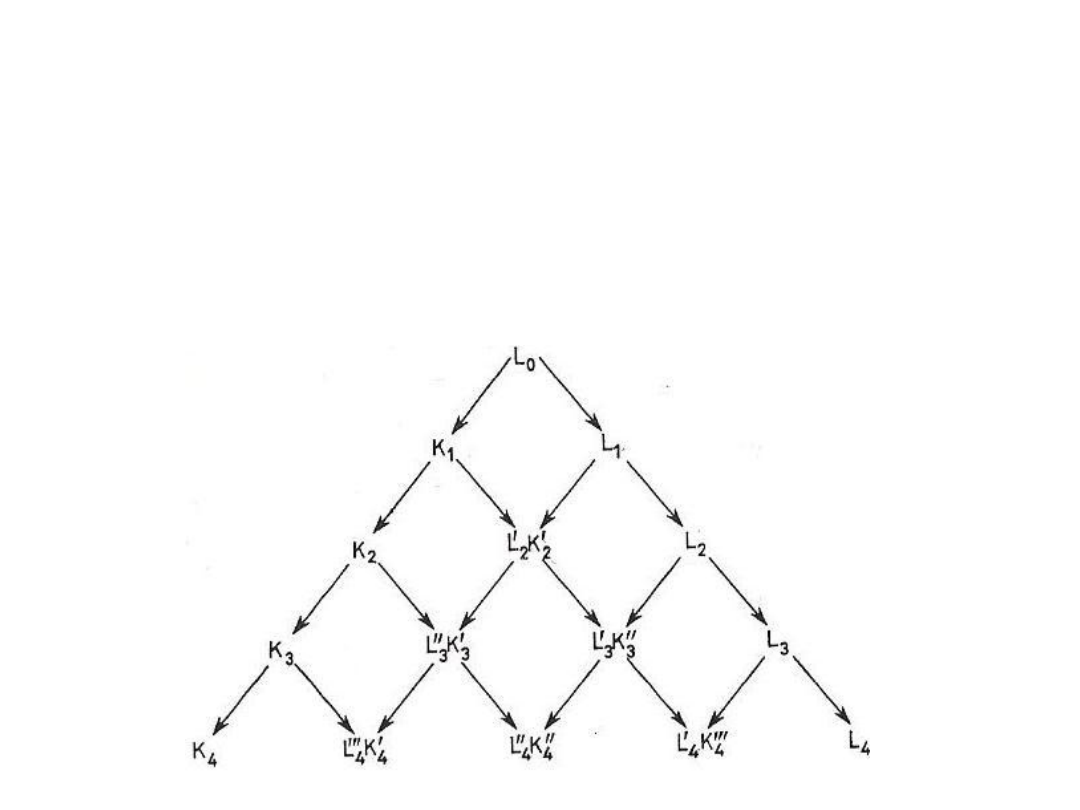
Krystalizację przeprowadza się z roztworów wodnych,
odparowując wyjściowy roztwór (Lo) aż do wydzielenia w postaci
kryształów około 50% zawartych w nim metali. Po odsączeniu
otrzymuje się krystaliczną masę K
1
(wzbogaconą nieco w
trudniej rozpuszczalne lantanowce) oraz ług pokrystaliczny
L
1
(wzbogacony w łatwiej rozpuszczalne lantanowce).
Rys 2. Schemat krystalizacji frakcjonowanej
Krystalizacja frakcjonowana

8
Strącanie frakcjonowane
Przebiega w podobny sposób jak opisana wcześniej metoda.
Lantanowce wytrąca się najczęściej jako wodorotlenki
Ln(OH)
3
–strącanie zasadowe.
Metoda ta obejmuje wszystkie reakcje powstawania osadów
tlenków i wodorotlenków pod wpływem dodawania lub
tworzenia się w roztworze zasad.
Na efektywność rozdzielania lantanowców metoda strącania
zasadowego ma wpływ:
• różnica w zasadowości wodorotlenków strącanych
• zasadowość odczynnika strącającego

9
Strącanie frakcjonowane
Szybkość strącania osadu zmienia się w czasie ze względu
na zmianę stężenia wywołaną wydzieleniem się fazy stałej
(proces strącania frakcji końcowych wymaga dłuższego
czasu niż frakcji początkowych).
Jako odczynniki strącające stosuje się:
• roztwór wody amoniakalnej
• roztwory wodorotlenków litowców, np. KOH, NaOH
• stałe odczynniki o charakterze zasadowym, np. MgO, Ag
2
O
• zasady organiczne, np. anilina, pirydyna

10
Ekstrakcja
Jest to metoda rozdzielania lantanowców za pomocą cieczy nie
mieszających się z wodą, zdolnych jednak do rozpuszczania soli
Ln
3+
.
W 1949 roku dokonano rozdziału jonów ceru (IV) od kationów
trójwartościowych za pomocą ekstrakcji cieczami organicznymi
zawierającymi rozpuszczony fosforan tri-n-butylu.
W kolejnych latach opracowano metody wykorzystujące ten
odczynnik do rozdziału innych lantanowców.
Jako odczynnik ekstrahujący używa się również wiele innych
pochodnych organicznych kwasu fosforowego.
Tworzą one z lantanowcami związki kompleksowe łatwo
rozpuszczalne w cieczach organicznych, np. nafcie.
11
Ekstrakcja fosforanem tri-n-butylowym (TBP):
Ekstrakcja
Ekstrakcja kwasem 2-etyloheksylofosforowym
(HDEHP):
lantanowce ekstrahują się TBP z wodnego roztworu kwasu
azotowego
najlepsze wyniki uzyskuje się w 12-14 molowym kwasie
azotowym
wydajność ekstrakcji Ln
3+
rośnie wraz ze wzrostem liczby
atomowej pierwiastków i stężenia kwasu
rozdzielenie pierwiastków w otoczeniu terbu (Tb) jest
trudne ze względu na małe wartości współczynników
podziału sąsiednich lantanowców
ekstrahent ten wymienia jony wodorowe na lantanowce,
tworząc sole w fazie organicznej
ekstrakcję prowadzi się zazwyczaj z wodnych roztworów
HCl lub HNO
3
ze względu na dużą lepkość HDEHP musi być stosowany
w formie rozcieńczonej
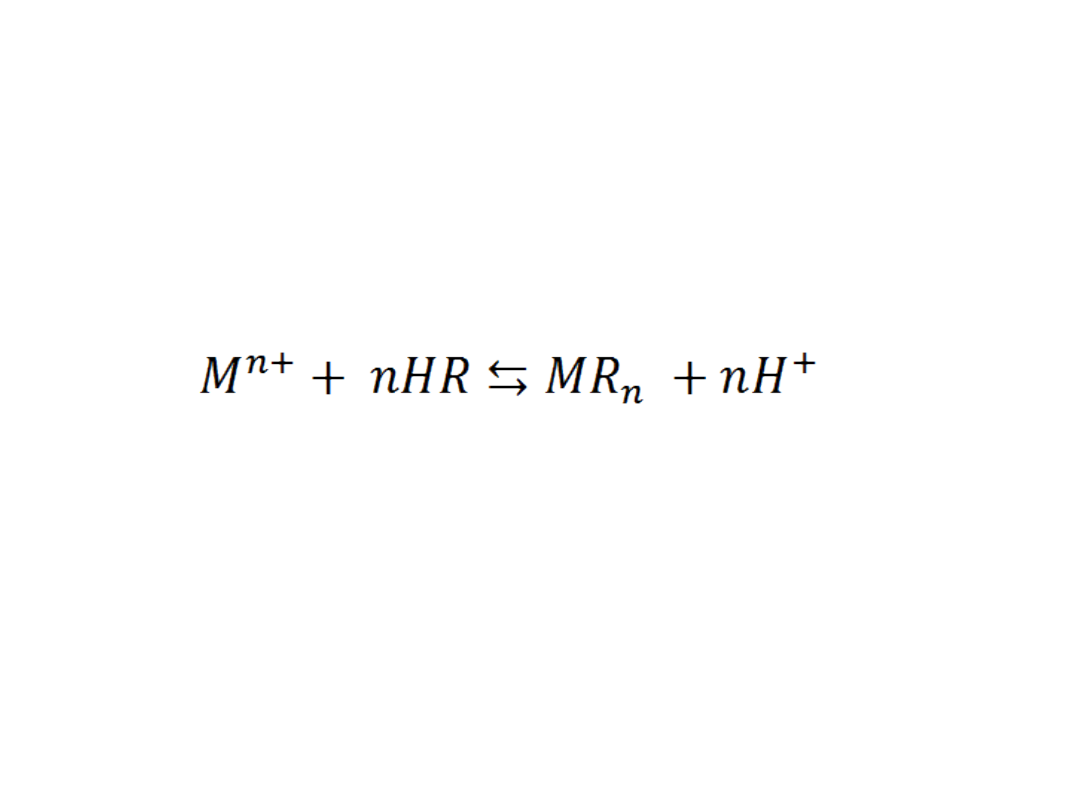
12
Chromatografia jonowymienna
Metoda ta polega na rozdziale lantanowców poprzez
wprowadzenie soli tych pierwiastków do kolumny wypełnionej
kationitem, który stanowi syntetyczna żywica (HR).
Zachodzi wymiana kationów metalicznych na protony:
W pierwszej kolejności adsorbowane są jony najlżejszych
lantanowców: La, Ce, Pr, itd.
W miarę przepływu cieczy przez kolumnę poszczególne
lantanowce osadzają się w określonej kolejności na
sąsiadujących ze sobą warstwach jonitu.
W celu wymycia jonów kolumnę przemywa się chlorkiem sodu.

13
Chromatografia jonowymienna
Wypływający z kolumny roztwór jest najpierw bogatszy w
lantanowce najsłabiej zaabsorbowane, a następnie w
lantanowce coraz silniej absorbowane.
Wymywanie jest znacznie efektywniejsze jeśli stosuje się np.
buforowane roztwory kwasu cytrynowego (substancje
tworzą związki kompleksowe z lantanowcami).
Rozdzielanie nastąpi jeśli stałe trwałości kompleksów różnią
się wystarczająco miedzy sobą.
Obecnie można uzyskać nawet lantanowce o czystości
99,99%(w ilościach kilogramowych).

14
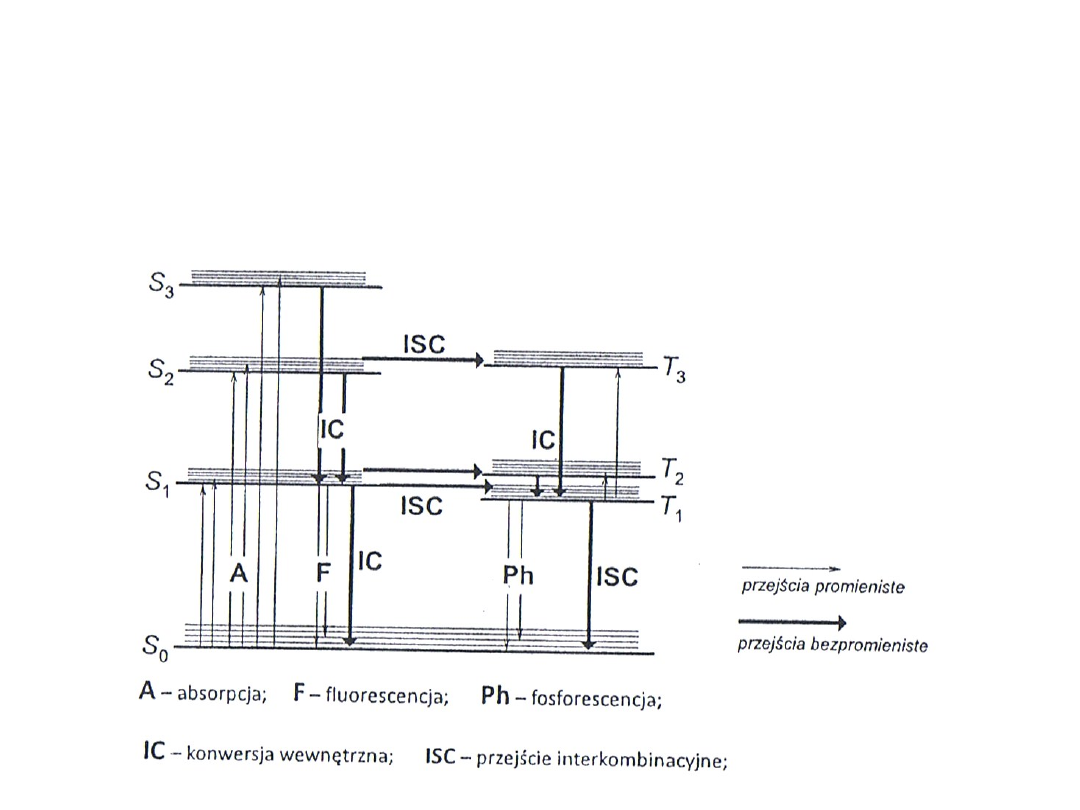
Fluorescencja
Fosforescencja
Luminescencja lantanowców
Fluorescencja
jest jednym z rodzajów luminescencji.
Nazywamy tak emisję światła powstającą przy przejściach
cząsteczek ze wzbudzonych stanów singletowych do stanu
podstawowego. Zjawisko uznaje się za fluorescencję, gdy
po zaniku czynnika pobudzającego następuje szybki zanik
emisji w czasie około 10
−8
s.
Fosforescencja
jest jednym z rodzajów luminescencji. Jest
to zjawisko emisji światła zachodzące przy spinowo
wzbronionym przejściu cząsteczki ze stanu trypletowego
do stanu podstawowego. Czas zaniku emisji jest znacznie
dłuższy niż w fluerescencji.
15
Zmodyfikowany schemat Jabłońskiego
przejść energetycznych w cząsteczce

16
Luminescencja lantanowców
Jony wielu lantanowców fluoryzują pod wpływem
promieniowania
nadfioletowego;
źródłem
tej
fluorescencji są przejścia f→f. Niektóre jony, nie
wykazujące normalnie fluorescencji w temperaturze
pokojowej, fluoryzują po oziębieniu.
Gdy jon znajduje się we wzbudzonym stanie elektronowym,
jego
dezaktywacja
może
nastąpić
w
wyniku
konkurencyjnych
procesów:
radiacyjnego
lub
bezradiacyjnego. Jon jest dobrym emiterem, jeżeli
zdecydowanie przeważa proces radiacyjny.

17
Luminescencja lantanowców
Badając roztwory wodne, stwierdza się, że najbardziej
wydajnymi emiterami są jony lantanowców znajdujących
się w środku szeregu lantanowców.
Ich obserwowane radiacyjne czasy życia są nawet 10
3
razy
dłuższe niż dla lantanowców znajdujących się na obu
końcach szeregu.
Energie stanów wzbudzonych jonów tych lantanowców są
2- lub 3-krotnie większe niż dla lantanowców na końcach
szeregu.
Z wyjątkiem gadolinu (III) jonom środka szeregu
odpowiada więcej stanów wzbudzonych elektronów f,
poziomy energii są więc rozłożone szerzej.

18
Luminescencja lantanowców
W
omawianym
zjawisku
kluczową
rolę
odgrywa
rozpuszczalnik, gdy jako rozpuszczalnik zastosuje się D
2
O
zamiast H
2
O, wszystkie czasy życia wzbudzonych stanów
elektronowych wzrastają o rząd wielkości.
Częstotliwość drgania v(D-H) stanowi tylko około ¾
częstotliwości v(O-H), w przypadku D2O jest konieczny
znacznie wyższy nadton niż w przypadku H
2
O
Przejścia f→f nie są całkowicie odizolowane od otoczenia.
Matrycą, w którą wbudowane są jony lantanowców w
luminoforze, są szkłotwórcze oksoaniony – borany,
krzemiany, gliniany i wolframiany. Wybór substancji jest
istotny gdyż jeden z etapów procesu emisji stanowi
przeniesienie
pochłoniętego
promieniowania
nadfioletowego przez sieć krystaliczną do emitera.
Istotny proces dezaktywacji bezradiacyjnej polega na
przekazaniu energii wzbudzonego stanu elektronowego
nadtonowi drgania rozciągającego v(O – H) cząsteczki
rozpuszczalnika.
19
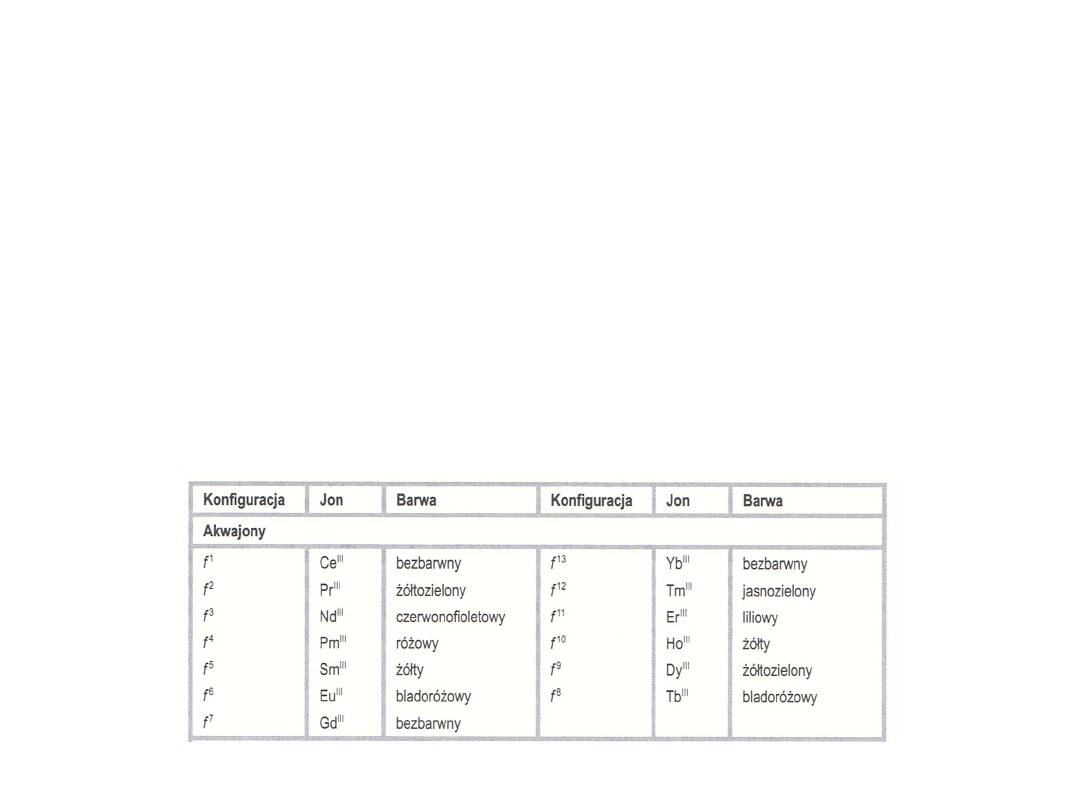
Widma elektronowe
Kompleksy lantanowców odznaczają się pięknymi barwami. W
barwach jonów w roztworze wodnym występuje symetria, jony f
n
i f
14-n
wykazują zbliżone zabarwienie,
Rzeczywiste pasma absorpcyjne, które występują w widmach
lantanowców i są związane z przejściami elektronowymi,
podzielono na trzy grupy: przejścia f→f, nf→(n+1)d,
ligand→orbital f metalu (pasma przeniesienia elektronu)

20
Przejścia elektronów f→f
Przejścia te są całkowicie zlokalizowane w
powłoce f, podobnie jak przejścia d→d, są
formalnie wzbronione. Faktycznie zachodzą i
powodują powstanie wielkiej liczby słabych,
ostrych pasm, występujących w zakresie od
podczerwieni do obszaru widzialnego. Widma
absorpcyjne cząstek w roztworze są ściśle
powiązane z łukowym widmem emisyjnym
odpowiednich jonów.
21
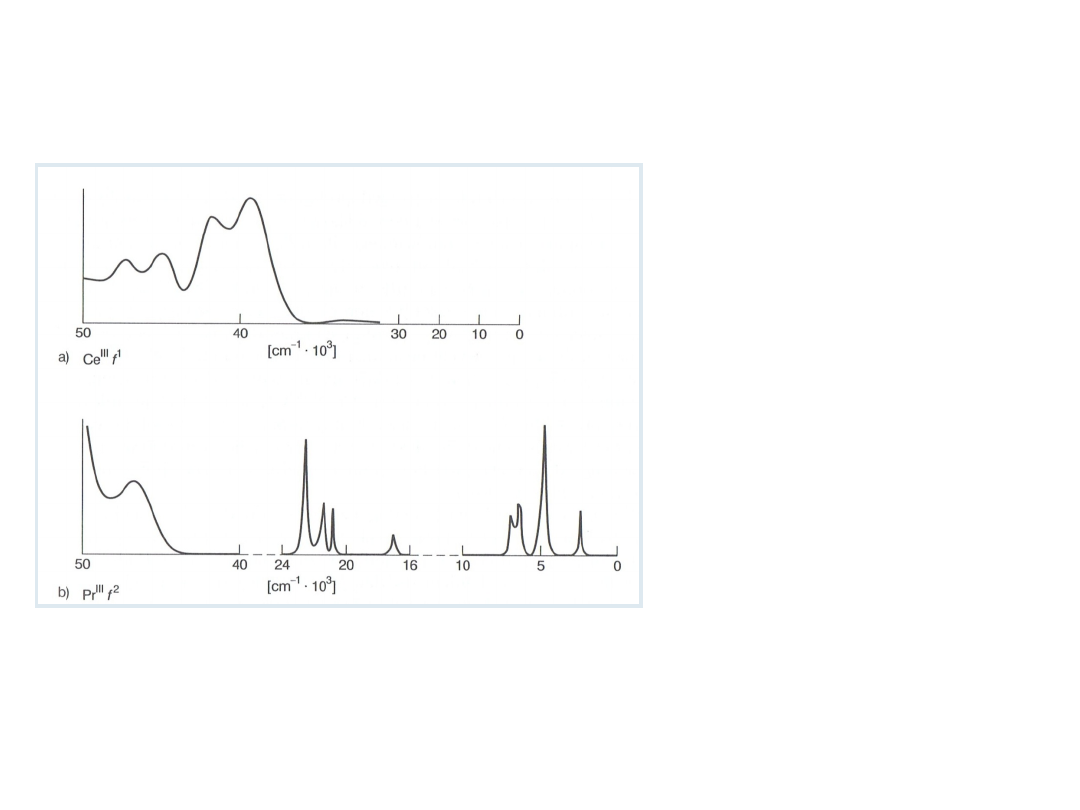
Widmo elektronowe Ce
III
(f
1
) jest zdominowane przez
pasma przeniesienia
ładunku. Można oczekiwać,
że widmo f→f będzie bardzo
proste, odpowiadające
pojedynczemu przejściu
między poziomami
spinowo-orbitalnymi.
Widmo elektronowe
Pr
III
(jon f
2
) jest bardziej
charakterystyczne dla
lantanowców , występują
w nim pasma przeniesienia
ładunku i przejścia f→f
(ostre). Udział odpychania
elektronów f→f powoduje
przesunięcie niektórych
przejść do widzialnego
obszaru widma.

22
Magnetyzm jonów lantanowców
Do obliczenia magnetycznych właściwości jonów
należy:
Zidentyfikować stan podstawowy.
Uwzględnić wszystkie związane z nim
oddziaływania, które, pod względem energetycznym,
przeważają efekt pola magnetycznego.
Skorygowany stan podstawowy poddaje się
zakłóceniu wywołanemu przez pole magnetyczne, co
powoduje rozczepienie tego stanu na szereg
podpoziomów

23
Magnetyzm jonów lantanowców
W jonach lantanowców elektrony f są osłaniane przez
elektrony w bardziej zewnętrznych powłokach i oddziaływanie
ich z polem krystalicznym jest znacznie słabsze.
W rezultacie sprzężenie LS zostaje zachowane a na całkowity
moment magnetyczny jonów lantanowców składa się zarówno
moment spinowy jak i orbitalny.
)
1
(
4
S
S
B
ef
Jony lantanowców z wyjątkiem jonów o konfiguracji f
0
(La
3+
,
Ce
4+
) oraz o konfiguracji f
14
(Yb
2+
, Lu
3+
) wykazują silny
paramagnetyzm.
W jonach metali zewnętrznoprzejściowych na skutek
oddziaływania elektronów d z polem krystalicznym następuje
zerwanie sprzężenia LS i „zamrożenie” momentu orbitalnego,
a obserwowany moment magnetyczny jest momentem tylko
spinowym.
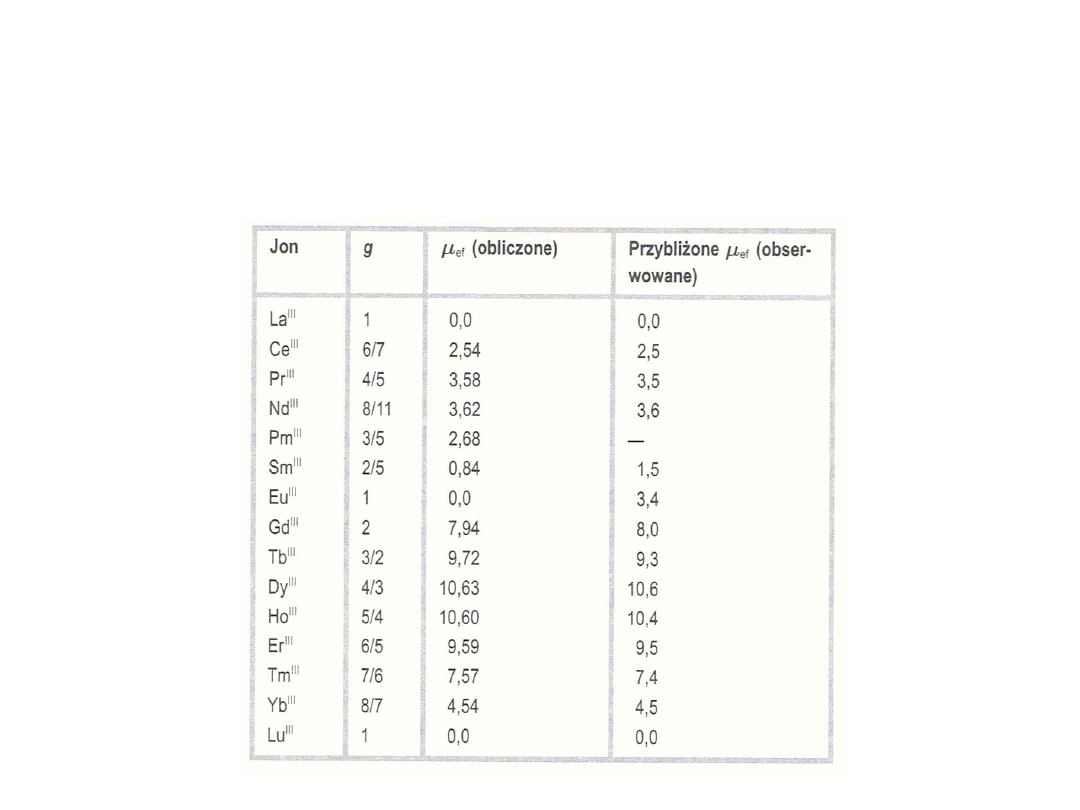
24
Wartości μ
ef
dla jonów lantanowców
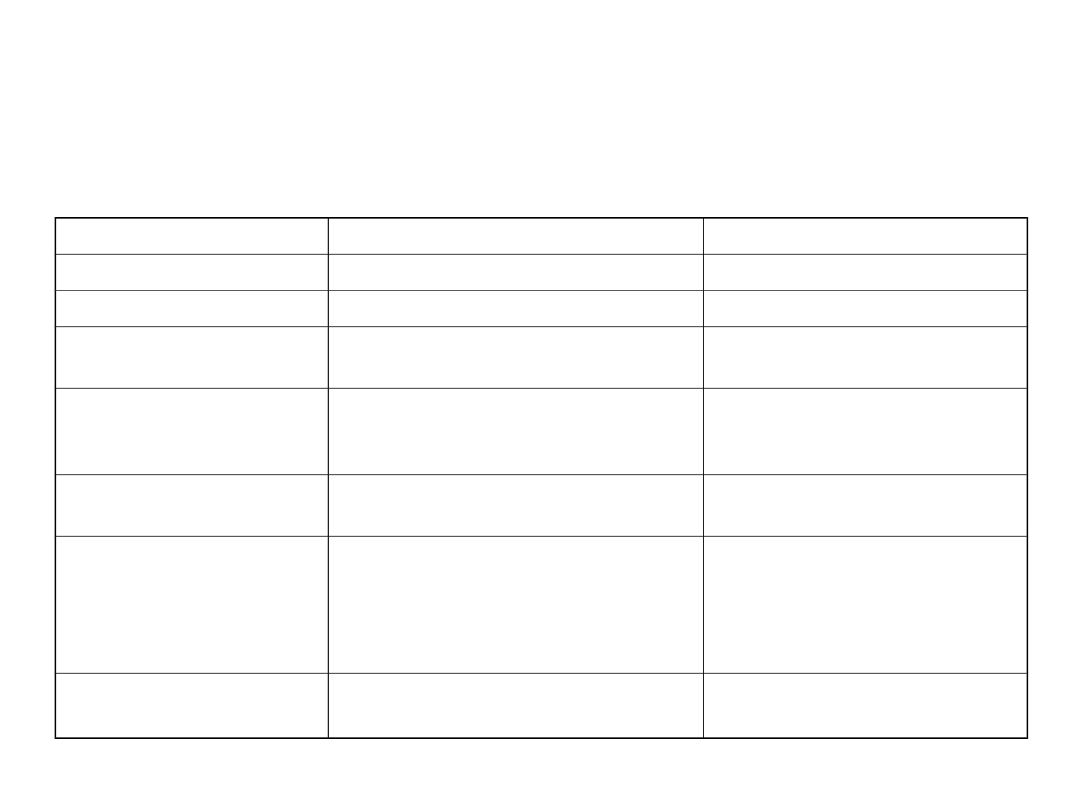
25
Porównanie jonów metali 3d i 4f
jony lantanowców
Jony metali 3d
Orbitale metalu
4f
3d
Promienie jonowe
106-85 pm
75-60 pm
LK
6,7,8,9,10,11,12
znane są również 2,3 i 4
3,4,5,6,7,8
Typowe wielościany
koordynacyjne
pryzmat trygonalny,
antypryzmat kwadratowy,
dodekaedr
płaski kwadrat, tetraedr,
oktaedr
Wiązania
słabe oddziaływania orbitali
metal – ligand
silne oddziaływania orbitali
metal – ligand
Kierunek wiązań
orbitale f bez znaczącego
wpływu sterochemicznego,
geometrie koordynacyjne
określane raczej przez efekty
steryczne ligandów
silna preferencja kierunku
wiązania
Kompleksy w
roztworze
jonowe [Ln(H
2
O)
n
]
3+
bardzo
labilne
często kowalencyjne,
labilne i bierne
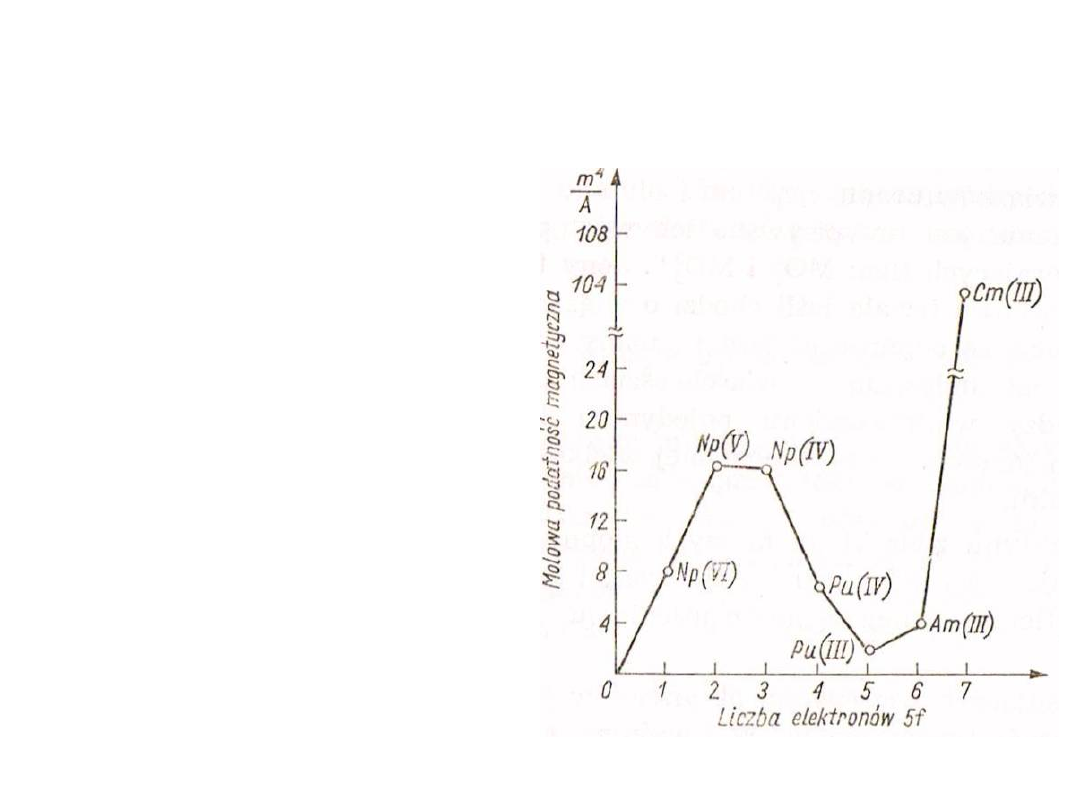
26
Magnetyzm jonów aktynowców
W przypadku aktynowców jak
dotąd nie udało się dokładnie
(ilościowo) wyjaśnić ich
właściwości magnetycznych
wyłącznie na podstawie
obecności niesparowanych
elektronów na podpowłoce 5f
czy 6d. Można jednak zauważyć,
że właściwości paramagnetyczne
jonów aktynowców na różnych
stopniach utlenienia zmieniają
się podobnie do właściwości
jonów lantanowców.
Podobieństwo to wynika z
podobnej konfiguracji
elektronowych i stanowi mniej
lub bardziej niezależne
potwierdzenie istnienia
podpowłok 5f w atomach
aktynowców

27
Widma elektronowe aktynowców
Widma absorpcyjne jonów aktynowców charakteryzują się
wąskimi pasmami w części widzialnej widma, w bliskim
nadfiolecie i bliskiej podczerwieni.
Środowisko chemiczne wpływa słabiej na widma aktynowców
aniżeli na widma pierwiastków d-elektronowych
Pasma absorpcyjne aktynowców przypisuje się przejściom
elektronowym wewnątrz podpowłoki 5f, w której wyższe i
niższe stopnie utlenienia danego jonu mają konfigurację 5f
Pasma są intensywniejsze niż w przypadku jonów
lantanowców – jest to spowodowane mniejszym ekranowaniem
elektronów 5f, co zwiększa ich podatność na działanie pola
ligandów.

28
Widma elektronowe aktynowców
Doświadczalnie wykazano, że widma absorpcyjne
jonów aktynowców stają się coraz bardziej
złożone w miarę przejścia od krańcowych
pierwiastków grupy do środkowych.
W przypadku kiuru 5f
7
, widmo jest ograniczone
tylko do nadfioletu, podobnie również dla
gadolinu 4f
7
Izoelektronowe jony aktynowców mają podobne
pasma absorpcyjne.
29
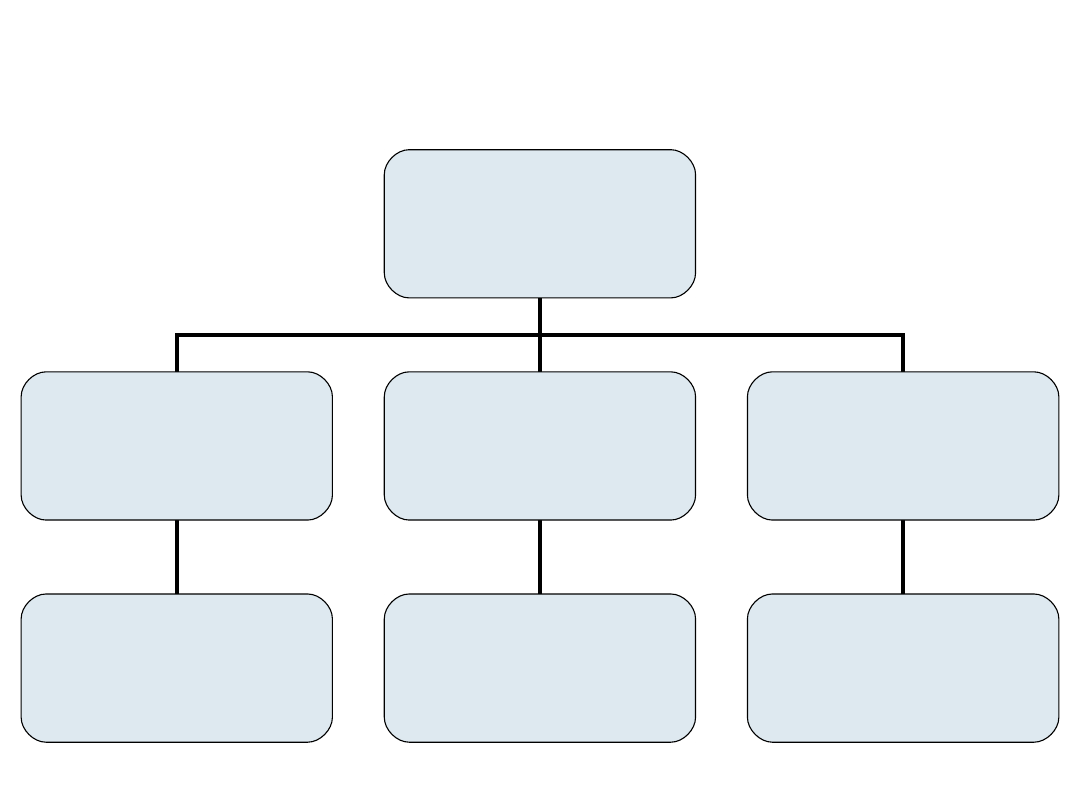
METODY
ROZDZIELANIA
AKTYNOWCÓW
METODY
EKSTRAKCYJNE
METODY
JONOWYMIENNE
METODY
WSPÓŁSTRĄCANIA
30
Metody ekstrakcyjne
EKSTRAHENTY
SOLWATUJĄCE
z obojętną donorową
parą elektronów
TWORZĄCE
KOMPLEKSY
O CHARAKTERZE
KWASOWYM
TWORZĄCE
PARY JONOWE
metal-zasada org.
alkohole, estry,
etery, ketony
kwasy
organofosforowe,
kwasy tłuszczowe
Wysokocząsteczkowe
aminy

31
Ekstrakcja ekstrahentami
solwatującymi
ETER DIETYLOWY
Jeden z pierwszych ekstrahentów używany do rozdzielania
aktynowców
Azotan uranylu
UO
2
(NO
3
)
2
rozpuszcza się dobrze w eterze
dietylowym
Uran (VI) ekstrahuje się z fazy wodnej jako solwat
UO
2
(NO
3
)
2
·2H
2
O·2(C
2
H
5
)2O.
Ekstrakcja z 5M HNO
3
jest procesem fizykochemicznym w
wyniku którego powstaje kompleks
(C
2
H
5
)
2
O·H[UO
2
(NO
3
)
2
]
ekstrahujący się eterem dietylowym.
Dodatek wysalaczy np.
Ca(NO
3
)
2
powoduje zwiększenie
wydajności ekstrakcji

32
KETONY
Metyloizobutyloketon
ekstrahuje azotan
uranylu z roztworu HNO
3
o pH = 0-3, z Al(NO
3
) –
jako wysalacz
Do ekstrakcji proaktynu Pa(V) stosuje się
diizopropyloketon
. Najefektywniejsza jest
ekstrakcja z 1M roztworu HNO
3
zawierającego
~4M azotan amonu.
Pluton 231 ekstrahuje się bardzo dobrze z 6 M
roztworu HCl, w postaci
PuCl
3
·3(C
3
H
7
)
2
CO
.
Ekstrakcja ekstrahentami
solwatującymi

33
ESTRY
Fosforan tri-n-butylowy (TBP) – jako ekstrahent o
dużych wartościach współczynników podziału
Ekstrakcji TBP ulegają solwaty
UO
2
(NO
3
)
2
·2TBP
. Przy dużym stężeniu HNO
3
do
fazy organicznej przechodzi kompleks
H[UO
2
(NO
3
)
3
].
Ze względu na dużą lepkość TBP stosuje się
rozcieńczalniki np.
CHCl
3
, CCl
4
, benzen.
Ekstrakcja ekstrahentami
solwatującymi

34
Ekstrakcja ekstrahentami kwasowymi
tworzącymi komleksy
Ekstrahenty kwasowe:
Kwas butylofosforowy
Kwas dibutylofosforowy
Kwas enantowy
Kwas 2-etyloheksylofosforowy (HDEHP)
Mieszanina techniczna kwasów C
7
-C
9
Tenoizotrifluoroketon (TTA)

35
HDEPH ekstrahuje aktynowce z roztworu kwasu
azotowego.
TTA reaguje z U(VI) tworząc połączenia
chelatowe, które ekstrahuje się przy pH = 3 lub
wyższym.
Reekstrakcję aktynowców z fazy organicznej
przeprowadza się 10M roztworem HNO
3.
Ekstrakcja ekstrahentami kwasowymi
tworzącymi komleksy

36
Ekstrakcja ekstrahentami tworzącymi
pary jonowe
Wysokocząsteczkowe aminy tworzą z U(IV), U(VI), Th(IV)
pary jonowe metal – zasada organiczna typu:
[B
+
]
2
[U(NO
3
)
62-
],
[B
+
]
2
[U(SO
4
)
32-
],
[B
+
]
2
[U
2
O(SO
4
)
22-
],
[([B
+
][NO
3-
])
n
[B
+
][UO
2
(NO
3
)
3-
]
- łatwo ekstrahujące do fazy organicznej.
Do rozdzielania aktynowców stosuje się tri-n-oktyloaminę
(TNOA), triizooktyloaminę (TIOA), trilauryloaminę (TLA)
37
Ekstrakcja ekstrahentami tworzącymi
pary jonowe
An
Oddzielanie
od:
Faza wodna
Ekstrahent Reekstrahen
t
U(VI) /
Pu(VI)
Th,
produktów
rozpadu
uranu i
plutonu
7-4,8M HCl
5% TIOA w
ksylenie
0,1M HCl
Np
Am,
naświetlonego
U
12M HCl
5% TIOA w
ksylenie
woda
U(VI)
aktynowców
3,5M HCl
10% TIOA w
kasylenie
woda
Transpluto-
nowce
lantanowców
11,6M LiCl –
0,2M HCl
11M LiCL –
0,02M HCl
5%TNOA w
ksylenie
0,6M alamina
336 w
dietylobenze
nie
woda
5M HCl
38
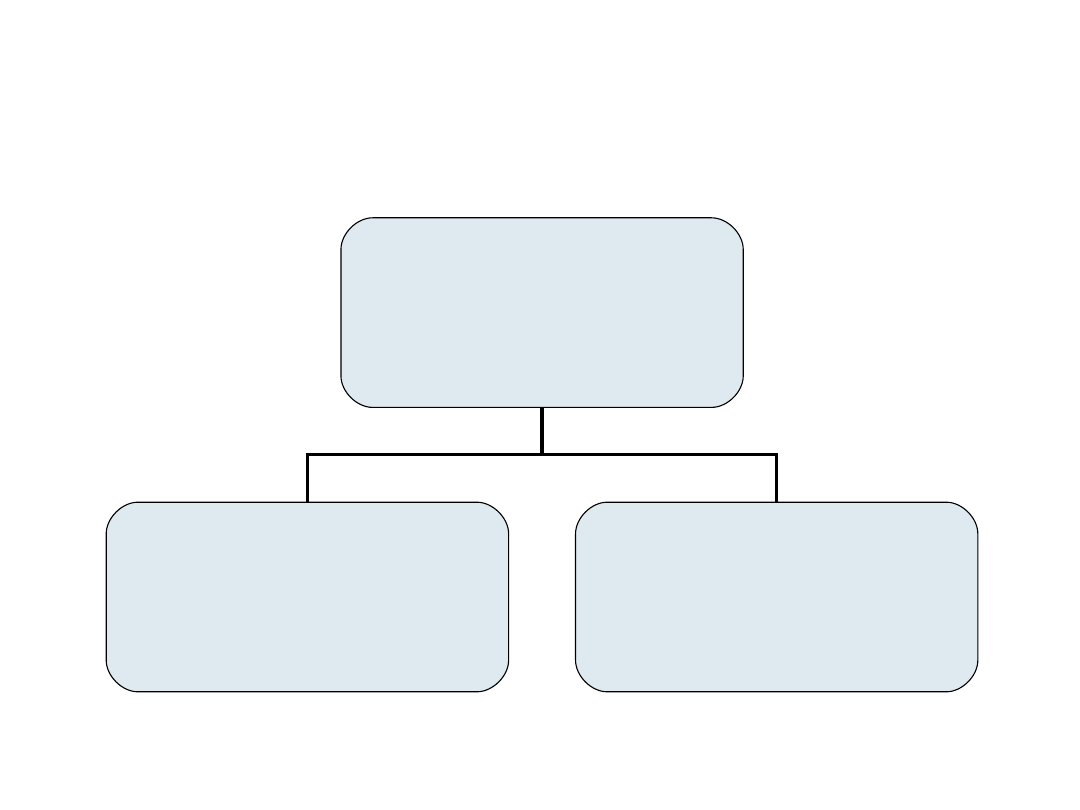
Metody jonowymienne
METODY
JONOWYMIENNE
ROZDZIELANIE
NA KATIONITACH
ROZDZIELANIE
NA ANIONITACH

39
Rozdzielanie aktynowców na
kationitach
Oddzielanie U(IV) od innych aktynowców na
kationitach, stosuje się rzadko.
Najbardziej przydatne do rozdzielania U(IV),
U(VI) i toru są żywice diallilofosfonowe
wykazujące największą selektywność
Aktyn sorbuje się na jonitach z rozcieńczonych
roztw. HCl i HClO
4
,
Wymiana na kationitach jest najczęściej
stosowana do rozdzielania transplutonowców i
oddzielanie ich od lantanowców powstających w
reakcjach jądrowych.

40
Rozdzielanie aktynowców na
anionitach
Często stosowany proces
Opiera się na zdolności jonów do tworzenia
anionów kompleksowych charakteryzujących się
różnym powinowactwem do anonitów.
SORPCJA KOMPLEKSÓW SIARCZANOWYCH
U(VI) tworzy silne kompleksy siarczanowe –
dobrze adsorbujące się na anionice, z roztworu
H
2
SO
4
, znacznie lepiej niż Th(IV) i Pa(V).

41
Rozdzielanie aktynowców na
anionitach
SORPCJA KOMPLEKSÓW CHLORKOWYCH
Uran tworzy silne kompleksy anionowe UO
2
Cl
22-
-
dobrze sorbuje z 4-6M HCl
Tor (IV) dobrze sorbuje się z roztworu HCl
zawierającego wyższe alkohole np. butanol
Pa(V), Np(IV,V,VI), Pu(IV,V,VI) dobrze sorbują się
na anionitach silnie zasadowych, ze stężnonego
roztw. kwasu solnego, podczas gdy aktynowce
(III) nie sorbują

42
Rozdzielanie aktynowców na
anionitach
SORPCJA KOMPLEKSÓW AZOTANOWYCH
Azotanowe kompleksy anionowe uranu (VI) słabo
adsorbują się na silnie zasadowych anionitach –
maksymalna adsorpcja zachodzi z 6-8 M roztworu
HNO
3
Pu(IV) i Np(IV) tworzą z kwasem azotowym
kompleksy anionowe:
[Np(NO
3
)
6
]
2-
, [Pu(NO
3
)
6
]
2-
- dobrze sorbujące z 1M
HNO
3

43
Metody współstrącania
Stosuje się do wydzielania śladowych ilości aktynowców ze
złożonych mieszanin
Otrzymywania koncentratów i zagęszczania śladów
Jako kolektory stosuje się: LaF
3
, Fe(OH)
3
, BaSO
4
,CaC
2
O
4
U(IV) współtrąca się w formie fluorku lub fosforanu, z silnie
kwaśnego roztworu, natomiast U(VI) ze słabo kwaśnego
roztworu w obecności węglanu amonu.
Th(IV) współtrąca się w środowisku kwaśnym z LaF
3
, i BaSO
4
,
a w formie szczawianu z szczawianami metali ziem rzadkich
Neptun i pluton na III i IV stopniu utlenienia współstrącają się
również z LaF
3
Proaktyn (V) współstrąca się ilościowo z fosforanem cyrkonu
lub MnO
2
,
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
Wyszukiwarka
Podobne podstrony:
Związki chemiczne
Związki chemiczne produkty reakcji tlenków z wodą
Zasady nomenklatury związków chemicznych, Chemia
Zanieczyszczeniami gleb i gruntów są wszelkie związki chemiczne i pierwiastki promieniotwórczex
więcej podobnych podstron