
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
STEREOIZOMERIA
2 godz.
1.
Izomery – definicja i klasyfikacja
1.1.
Konstytucyjne - związki różniące się sposobem połączenia atomów w cząsteczce
(tj. różna budowa szkieletu węglowego lub inne rozmieszczenie grup
funkcyjnych); na przykładzie 5-etylo-2,3-dimetyloheptanu i 2,2,4,4,5-
pentametyloheksanu oraz kwasu 3-hydroksybutanowego i kwau 3-hydroksy-2-
metylopropanowego
1.2.
Stereoizomery – związki o identycznym połączeniu atomów w cząsteczce, ale o
różnym ich rozmieszczeniu w przestrzeni
•
Enancjomery – para niekładalnych na siebie stereoizomerów mających się do
siebie jak przedmiot i jego lustrzane odbicie
•
Diastereoizomery – stereoizomery nie będące enancjomerami
2.
Chiralność na przykładzie przedmiotów codziennego użytku
2.1.
Obiekty chiralne - obiekty nienakładalne na swoje odbicie lustrzane: ręka,
nożyczki, samochód, śruba
2.2.
Obiekty achiralne - obiekty nakładalne na swoje odbicie lustrzane; krzesło
3.
Chiralność i enancjomeria w związkach organicznych na przykładzie cis-1,2-
dichlorocyklopentanu (związek achiralny) oraz trans-1,2-dichlorocyklopentan
(związek chiralny)
4.
Elementy symetrii występujące w związkach organicznych
4.1.
Płaszczyzna symetrii w cis-1,2-dimetylocyklopropanie (związek achiralny)
4.2.
środek symetrii w 1,2-dietylo-3,4-dimetylocyklobutanie (związek achiralny)
4.3.
Brak płaszczyzny symetrii i środka symetrii w trans-1,2-dimetylocyklopropanie
(związek chiralny)
5.
Pojęcie asymetrycznego atomu węgla (centrum asymetrii), jako jednego z
czynników powodujących chiralność związków organicznych
•
Asymetryczny atom węgla (C*) - atom węgla w stanie hybrydyzacji sp
3
związany z czterema różnymi podstawnikami (nazywany także centrum
asymetrii).
6.
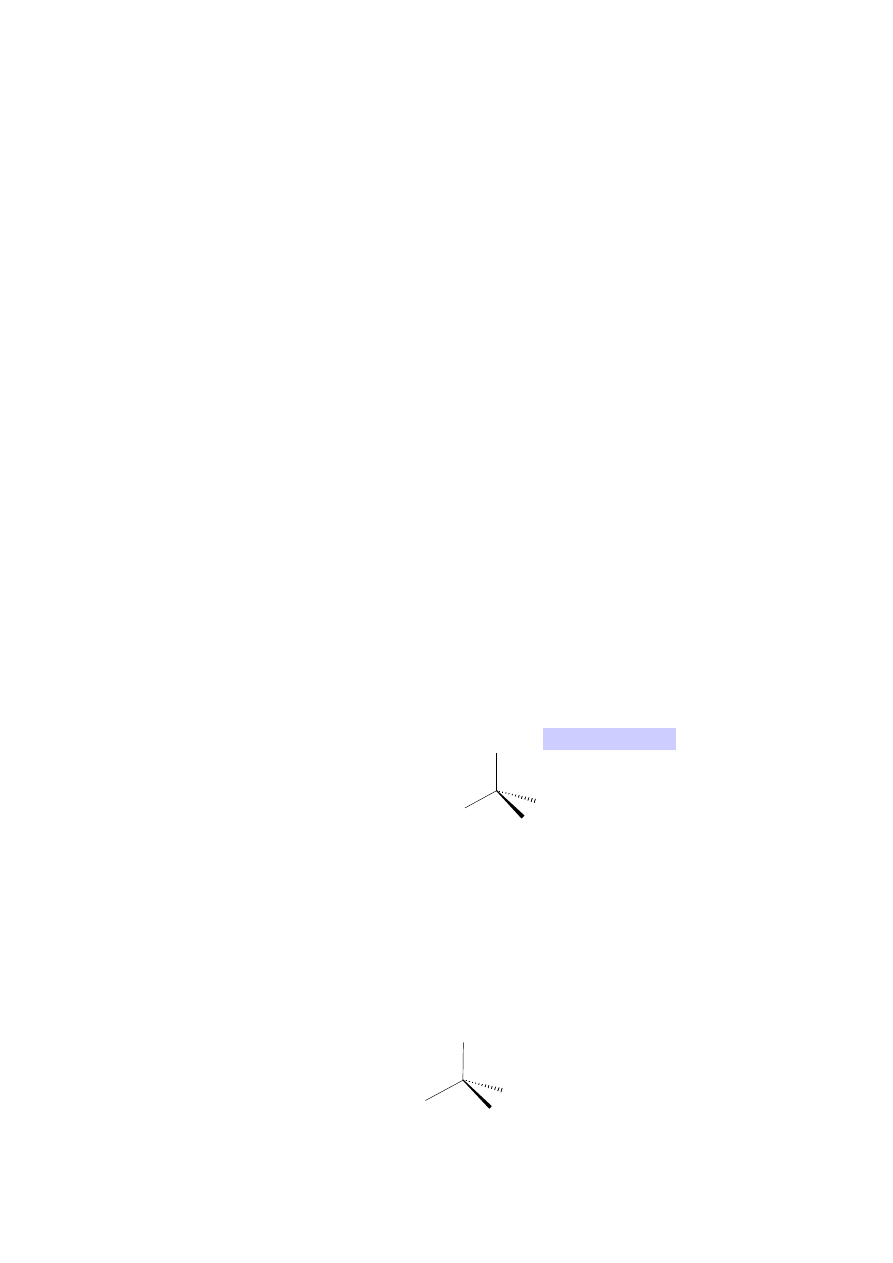
Określanie czy dany związek jest chiralny na przykładzie 2-chlorobutanu; na
modelach i wzorach przestrzennych:
1
CH
3
CH
CH
2
CH
3
Cl
*
CH
3
CH
CH
2
CH
3
Cl
*
A
(związek macierzysty)
B
(odbicie lustrzane)
B
po obrocie o 60
°
wokół wiązania C-Cl
B
po obrocie o 120
°
wokół wiązania C-Cl
2-chlorobutan
A
i
B
nie nakładają się na siebie,
są to enancjomery.
Wniosek – związek posiadający asymetryczny
atom węgla może występować w postaci dwóch
enancjomerów.
Cl
H
5
H
2
C
H
3
C
Cl
H
C
2
H
5
CH
3
Cl
CH
3
2
H
5
C
H
Cl
H
H
3
C
2
H
5
C
Cl
H
5
H
2
C
H
3
C
Cl
H
C
2
H
5
CH
3
Cl
CH
3
2
H
5
C
H
Cl
H
H
3
C
2
H
5
C
60°
60°
Cl
H
H
3
C
Cl
H
H
3
C
5
H
2
C
A
B
5
H
2
C
Cl
H
H
3
C
Cl
H
H
3
C
5
H
2
C
A
B
5
H
2
C
CH
3
F
NH
2
H
1
3
4
2
F > N > C > H
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
7.
Czynność optyczna związków organicznych
7.1.
Zasada działania polarymetru
7.2.
Enancjomer prawoskrętny (+) – skręca płaszczyznę światła spolaryzowanego w
prawo; kierunek obrotu analizatora w celu przywrócenia zaciemnienia pola
widzenia jest zgodny ze wskazówkami zegara
7.3.
Enancjomer lewoskrętny (
−
)
−
skręca płaszczyznę światła spolaryzowanego w
lewo; kierunek obrotu analizatora w celu przywrócenia zaciemnienia pola widzenia
jest przeciwny do ruchu wskazówek zegara
7.4.
Enancjomery skręcają płaszczyznę światła spolaryzowanego o ten sam kąt, ale w
przeciwnych kierunkach
7.5.
Mieszanina racemiczna (lub racemat) – równomolowa mieszanina enancjomerów
nie skręca płaszczyzny światła spolaryzowanego
8.
Przykłady enancjomerów wybranych związków organicznych:
8.1.
(-)-2-Aminopropan-1-ol i (+)-2-aminopropan-1-ol
8.2.
Kwas (-)-mlekowy i kwas (+)-mlekowy
8.3.
Kwas (-)-migdałowy i kwas (+)-migdałowy
9.
Konfiguracja absolutna związków organicznych - opis przestrzennego
rozmieszczenia podstawników wokół centrum asymetrii (informacja niezbędna do
skonstruowania prawidłowej nazwy związku chiralnego)
9.1.
Sposób określania konfiguracji absolutnej opracowany przez Cahna, Ingolga i
Preloga
•
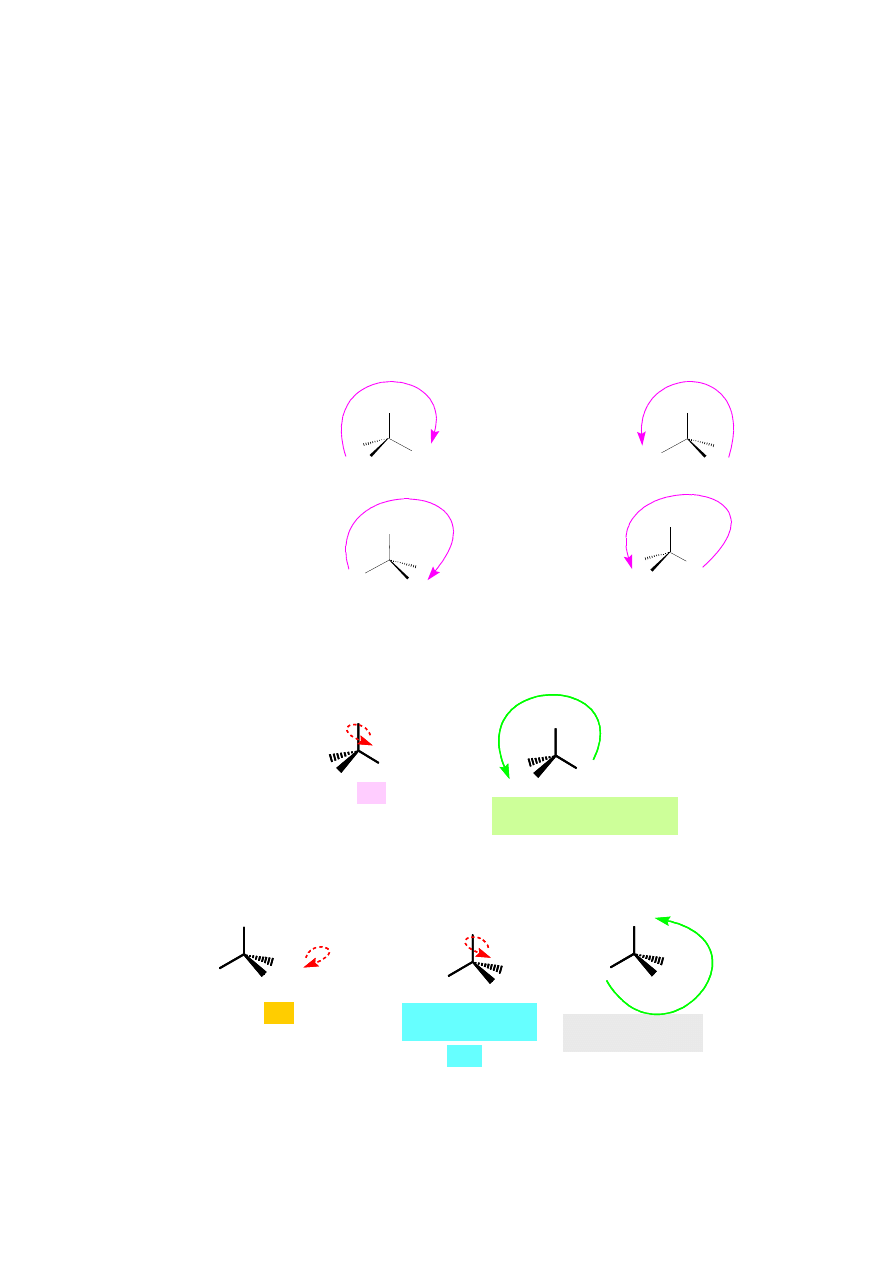
Krok 1: ustalenie kolejności podstawników, postępując zgodnie z regułami
pierwszeństwa
Reguła 1: jeżeli wszystkie cztery atomy połączone z centrum
asymetrii są różne, to pierwszeństwo grup zależy od liczb
atomowych tych atomów, przy czym priorytet ma atom o większej
liczbie atomowej; na przykładzie 1-amino-1-fluoroetanu (F > N > C
> H); jeżeli dwa atomy są izotopami tego samego pierwiastka, to
pierwszeństwo na atom o większej liczbie masowej (T > D > H).
Reguła 2: jeżeli względnego pierwszeństwa dwóch grup nie można
ustalić na podstawie reguły 1, to należy przeprowadzić podobne
porównanie następnych atomów w tych grupach (jeżeli i to nie
przyniesie rozstrzygnięcia, to należy przesunąć się jeszcze dalej od
centrum chiralności); na przykładzie 1-bromo-3-etylo-4-
metylopentanu [-CH(CH
3
)
2
> -CH
2
CH
2
Br > -CH
2
CH
3
> H].
2
CH
2
CH
2
Br
CH
3
CH
2
CH(CH
3
)
2
H
3
2
4
1
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
•
Krok 2: zorientowanie cząsteczki w taki sposób, aby podstawnik o najniższym
pierwszeństwie był jak najbardziej oddalony od obserwatora, a następnie
przesuwanie się według malejącego pierwszeństwa od podstawnika o
najwyższym pierwszeństwie w stronę kolejnych podstawników:
Jeżeli wykonuje się obrót zgodnie z kierunkiem ruchu wskazówek
zegara, to taką konfigurację oznacza się literą R (rectus-prawy); na
przykładzie kwasu (R)-2-aminopropanowego i (R)-1,3-
dibromobutanu;
Jeżeli wykonuje się obrót przeciwnie do ruchu wskazówek zegara,
to taką konfigurację oznacza się literą S (sinister-lewy); na
przykładzie kwasu (S)-2-aminopropanowego i (S)-1,3-
dibromobutanu.
9.2.
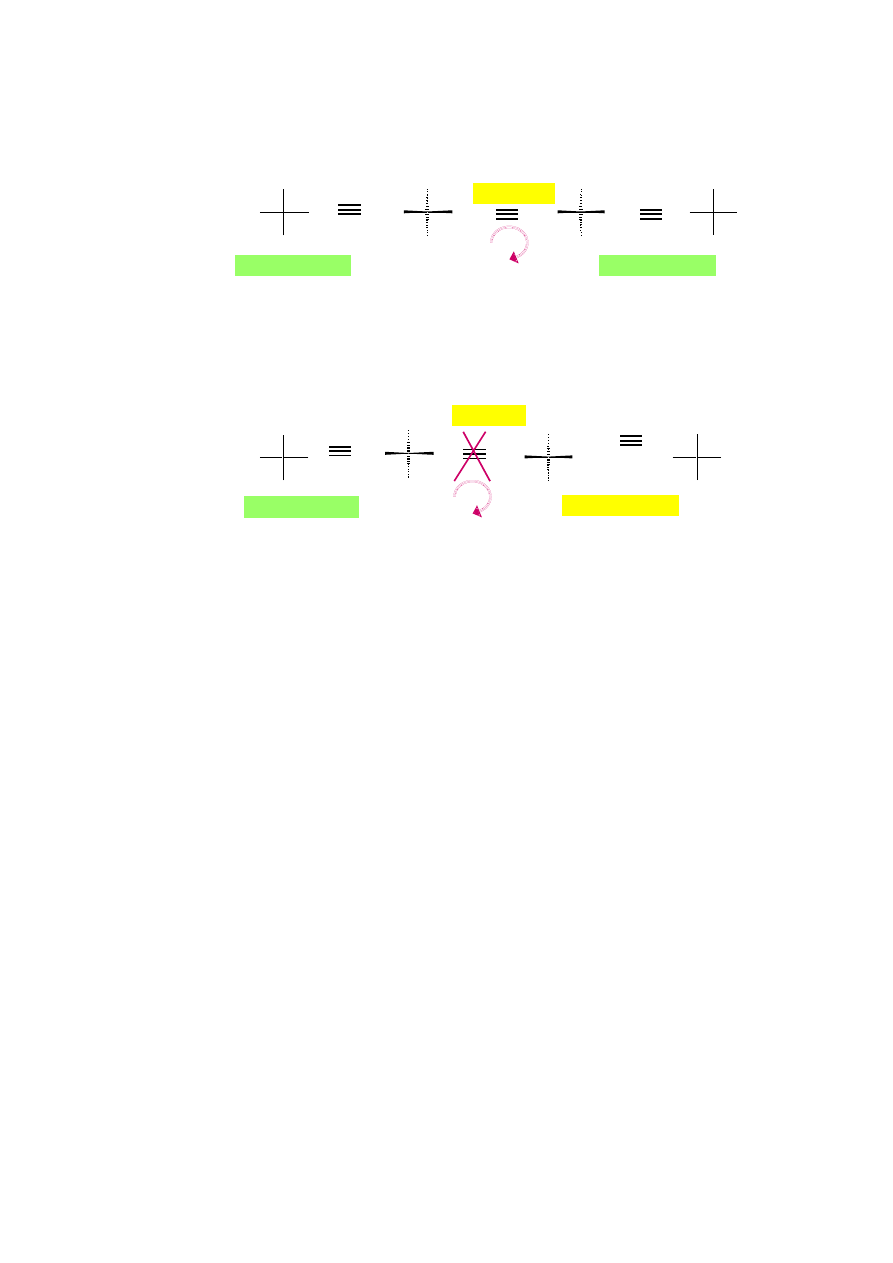
Umiejętność zorientowania cząsteczki w taki sposób, aby podstawnik o najniższym
pierwszeństwie był jak najdalej oddalony od obserwatora; na przykładzie kwasu
(S)-(+)-mlekowego i (S)-(+)-2-aminopropan-1-olu:
9.3.
Prezentacja konfiguracji absolutnej na wzorach rzutowych Fischera na przykładzie
kwasu (R)-mlekowego i zastrzeżenia co do obrotu wzoru Fischera
3
COOH
CH
3
NH
2
H
3
2
4
1
(R)
COOH
CH
3
H
2
N
H
3
2
4
1
(S)
CH
2
CH
2
Br
Br
CH
3
H
1
2
4
3
(R)
CH
2
CH
2
Br
Br
H
3
C
H
1
2
4
3
(S)
(A)
(A) po obrocie wokół wiązania
C-CO
2
H w lewo
kwas (S)-(+)-mlekowy
CO
2
H
H
3
C
H
O H
(S)
CO
2
H
H O
H
3
C
H
2
3
1
60°
1
2
3
4
CO
2
H
H
3
C
H
O H
(S)
CO
2
H
H O
H
3
C
H
2
3
1
60°
1
2
3
4
(A)
(A) po obrocie wokół
wiązania C-N w lewo
(A’) po obrocie wokół
C-CH
3
w prawo
(S)-(+)-2-aminopropan-1-ol
(A’)
H
H
3
C
C H
2
O H
NH
2
C H
3
H O H
2
C
H
N H
2
CH
3
H
2
N
CH
2
O H
H
(S)
1
2
3
4
1
2
3
2
3
1
60°
60°
H
H
3
C
C H
2
O H
NH
2
C H
3
H O H
2
C
H
N H
2
CH
3
H
2
N
CH
2
O H
H
(S)
1
2
3
4
1
2
3
2
3
1
60°
60°
Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
•
Wzór rzutowy Fischera można obracać o 180° lub 360° - konfiguracja
absolutna jest zachowana; na przykładzie obrotu wzoru rzutowego Fischera (S)-
mlekowego:
•
Obrót wzoru rzutowego Fischera o 90° lub 270° powoduje zmianę konfiguracji
absolutnej na przeciwną - uzyskany wzór przedstawia przeciwny enancjomer;
na przykładzie obrotu wzoru rzutowego Fischera kwasu
(R)-mlekowego:
10.
Związki chiralne posiadające dwa asymetryczne atomy węgla
10.1.
2,3-Dibromobutan
•
Przedstawienie stereoizomerów (na wzorach rzutowych Fischera)
•
Wskazanie enancjomerów oraz diastereoizomeru (formy mezo), który posiada
płaszczyznę symetrii i nakłada się na swoje odbicie lustrzane; nie skręca
płaszczyzny światła spolaryzowanego
10.2.
Przykłady związków mezo: cis-cyklopentano-1,2-diol, cis-1,2-dibromocykloheksan
oraz kwas mezo-winowy
4
kwas (R)-mlekowy
kwas (S)-mlekowy
COOH
(S)
CH
3
H
HO
COOH
(S)
CH
3
H
HO
obrót o 90°
OH
(R)
H
COOH
H
3
C
OH
(R)
H
COOH
H
3
C
kwas (S)-mlekowy
COOH
(S)
CH
3
H
HO
COOH
(S)
CH
3
H
HO
COOH
(S)
CH
3
H
OH
COOH
(S)
CH
3
H
OH
obrót o 180°
kwas (S)-mlekowy
Document Outline
- Konspekt wykładu „Chemia Organiczna” dla studentów Wydziału Inżynierii Chemicznej i Procesowej
- STEREOIZOMERIA 2 godz.
Wyszukiwarka
Podobne podstrony:
dyd k2c r id 144871 Nieznany
DYD 2012 id 144884 Nieznany
dyd k3c r id 144875 Nieznany
dyd inz1i id 144858 Nieznany
dyd k2c r id 144871 Nieznany
dyd inz e05 id 144824 Nieznany
dyd inz e02 id 144818 Nieznany
dyd inz e08 id 144830 Nieznany
dyd inz e03 id 144820 Nieznany
dyd szcz tematy id 144878 Nieznany
dyd inz e05 id 144824 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
więcej podobnych podstron