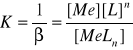Nr ćwicz. 8 I 9 |
Data 26.04.2006 |
Radosław Plackowski |
Technologia chemiczna Kier. inżynieria proc. Chem. |
Semestr II |
Dr inż. Bogdan Wyrwas |
przygotowanie: |
wykonanie: |
ocena: |
|
Reakcje kompleksowania
Wstęp teoretyczny:
Związki kompleksowe to związki zawierające grupę składającą się z atomu lub jonu centralnego E otoczonego pewną liczbą atomów, grup atomów lub jonów L zwanych ligandami:
[E(L)n]z
E - atom lub jon centralny
L - ligand
n - liczba ligandów (liczba koordynacyjna)
z - ładunek kompleksu - jest algebraiczną sumą ładunków atomu lub jonu centralnego i ligandów. Ładunek kompleksu może być dodatni, ujemny lub równy zero.
Liczba koordynacyjna jest równa najczęściej 4 lub 6, rzadko 2, 3, 5 7 lub 8
Ligandy są rozmieszsczone dookoła atomu lub jonu centralnego E w sposób prawidłowy:
W przypadku liczby koordynacyjnej 4 w narożach czworościanu foremnego lub kwadratu.
W przypadku liczby koordynacyjnej 6 w narożach ośmiościanu foremnego.
Związki kompleksowe tworzą najczęściej metale przejściowe (leżące w grupach miedzy 3, a 12 w układzie okresowym). Ich atomy lub jony mają w swojej powłoce walencyjnej wolne orbitale o małej energii, co umożliwia im tworzenie wiązań koordynacyjnych z ligandami, które pełnią rolę donorów par elektronowych.
Nomenklatura związków kompleksowych:
W nazwie kompleksu wymienia się najpierw nazwy ligandów, a następnie nazwę atomu (jonu) centralnego.
Ligandy wymienia się według kolejności: ujemne, obojętne na końcu dodatnie.
Ligandy ujemne mają końcówkę -o:
CN- - cyjano OCN- - cyjaniano
Cl- - chloro F- - fluoro Br- - bromo I- - jodo H- - hydro OH- - hydrokso |
SCN- - tiocyjaniano S2- - tio
|
Ligandy ujemne wymienia się w nazwie związku kompleksowego w kolejności alfabetycznej.
Ligandy obojętne mają różne końcówki:
NH3 - amina
H2O - akwa
CO - karbonyl
NO - nitrozyl
Z kolei grupy weglowodorowe mają końcówkę -yl (metyl, fenyl)
Ligandy obojętne wymienia się w nazwie związku kompleksowego w kolejności: H2O, NH3, a następnie pozostałe w porządku alfabetycznym.
Ligandy dodatnie:
H+ - wodoro
![]()
- hydrazono
Liczbę ligandów określa się przedrostkami: di-, tris-, tetra-, penta- i heksa-. Gdy nazwa ligandu zawiera liczbę, np. etylenodiamina lub w nazwie jest przedrostek tio- (tiosiarczano-), wtedy ujmuje się ją w nawias i umieszcza przed nim przedrostki: bis-, tris -, tetrakis zamiast di-, tri-, tetra-.
Stopień utlenienia atomu centralnego oznacza się cyfra rzymską, w nawiasie bezpośrednio po jego nazwie.
Kompleksowe jony ujemne mają końcówkę -an.
Przykłady:
[Cr(H2O)6]Cl3 - chlorek heksaakwachromu (III)
[Co(NH3)5Cl]2+ - jon chloropentaaminakobaltu (III)
[Ag(S2O3)2]3- - jon bis (tiosiarczano)srebrzanowy (I)
K4Fe(CN)6 - heksacyjanożelazian (II) potasu
[Cr(en)3]Cl3 - chlorek tris(etylenodiamina) chromu (III)
Fe(Co)5 - pentakarbonylożelazo (0)
Podział kompleksów ze względu na ładunek:
kationy:
[Co(NH3)6]3+ - jon heksaaminakobaltu (III)
[Cu(H2O)4]2+ - jon tetraakwamiedzi (II)
aniony:
[Cu(CN)4]3- - jon tetracyjanomiedzianowy (I)
[Zn(OH)4]2- - jon tetrahydroksocynkanowy (II)
obojętne:
Fe(Co)5 - pentakarbonylożelazo (0)
Ni(Co)4 - tetrakarbonylonikiel (0)
Związki kompleksowe proste:
Kompleksy chelatowe:
EDTA (kwas wersenowy):
Trwałość związków kompleksowych:
Barwność ligandów i kompleksów:
Maskowanie:
Ocena reakcji kompleksowania na podstawie zmiany barwy.
Po dodaniu do roztworu tiocyjanianu amonowego następujących kationów, powstały barwy:
Do płytki porcelanowej, w której wgłębieniach umieszczono po jednej kropli 2M roztworu NH4SCN dodać z pipety kapilarnej kolejno kroplę roztworu jonów: Zn++, Cd++, Cu++, Ni++ oraz Co++. Obserwować kolory otrzymanych roztworów.
Stopniowe tworzenie kompleksów.
Do czterech probówek zawierających po 2 - 4 cm3 roztworu, Co++, dodać kolejno: 5, 15, 25 kropli oraz ok. 2 cm3 nasyconego roztworu tiocyjanianu amonowego. Po dokonaniu oceny intensywności barwy, każdy z roztworów rozcieńczyć do równej objętości. Ponownie ocenić intensywność zabarwienia roztworu.
Do probówki zawierającej 1 - 2 kropli roztworu jonów Fe+++ dodać 1 cm3 stężonego HCl oraz 1 - 2 kropli roztworu SCN-. Po zaobserwowaniu barwy kompleksu, dopełnić probówkę wodą i z tak otrzymanego roztworu pobrać do czterech probówek kolejno 1, 2, 3, 15 cm3 i dopełnić probówki wodą do równej objętości. Porównać zabarwienie otrzymanych roztworów.
Do probówki zawierającej 0,5 - 1 cm3 roztworu EDTA oraz 2 - 3 krople roztworu tiocyjanianu, dodawać ostrożnie po kropli roztwór zawierający jony Fe+++ aż do momentu pojawienia się czerwonego zabarwienia (określenie czułości reakcji kompleksowania).
Do wgłębienia płytki porcelanowej dodać po 2 krople nasyconego roztworu tiocyjanianu amonowego. Następnie przygotować z roztworu 0,1 M Fe+++ pięć kolejnych roztworów przez kolejne dziesięciokrotne rozcieńczenie wodą. Do kolejnych wgłębień płytki dodawać przy pomocy kapilary po jednej kropli roztworu Fe+++ o stężeniu 10-1, 10-2, 10-3, 10-4, 10-5, 10-6. Na podstawie obserwacji zabarwienia ocenić czułość roztworu na jony Fe+++.
Do probówki zawierającej ok. 1 cm3 roztworu Cu++ dodać ok. 9 cm3 wody. Przez kolejne rozcieńczenie otrzymanego roztworu w proporcji 1: 10 przygotować serię czterech roztworów Cu++ o malejącym stężeniu. Do każdej z probówek dodać kilka kropli 6 M roztworu NH4OH. Porównać intensywność zabarwienia roztworów.

Uzasadnij buforujące działanie roztworu Hg++ wobec jonów SCN-Przedstawić na wykresie, korzystając z literatury {1}, dlaczego roztwór jest buforowy wobec jonów Fe+++.
Ocenić czułość wskaźników jonów Fe+++ oraz jonów Cu++ przez podanie przybliżonego granicznego stężenia tych jonów.
Liczba koordynacja jest równa najczęściej 4 lub 6 (tak jak to miało miejsce w danych tabelarycznych w punkcie 1.1.1.)
Na intensywność barwy kompleksu wpływa:
stężenia roztworów
rozcieńczanie (zauważalne między innymi podczas oznaczania stężenia jonów żelaza w wodzie)
różna objętość roztworów
Związki kompleksowe tworzą różnego rodzaju bufory (Hg2+/HgSCN+ lub Y4-/FeY-), które zapobiegają zmianie barwy kompleksu, w miarę dodawania małych ilości kationów metali bądź ligandów:
Hg2+ tworzy kompleksy z SCN- tym samym zmniejsza się ilość wolnych SCN- w roztworze
Im więcej Y4- przejdzie w kompleks FeY- tym stężenie Fe3+ wzrasta
Nawet niewielki dodatek NH4SCN uwidacznia jony Fe+++ i Cu++ w roztworze, nawet przy małym stężeniu, co sprawia, że czułość wskaźników tych jonów jest bardzo duża.
Nieznane, przybliżone stężenie jonów żelaza można określić na podstawie intensywności zabarwienia, wzorcowych roztworów o znanym stężeniu żelaza.
Do probówki zawierającej kilka kropel tiocyjanianu amonowego dodać kroplę roztworu Fe+++. Następnie dodać kroplę roztworu fluorku amonowego. Odbarwienie roztworu świadczy o skompleksowaniu jonów Fe+++ przez fluorki. Następnie dodać ostrożnie po kropli roztworu 6 M H2SO4 do momentu ponownego zabarwienia roztworu na czerwono, świadczy o obecności w roztworze tiocyjanowego kompleksu Fe+++.
Roztwór odbarwił się na kolor czerwonawy.
Roztwór odbarwił się na biały kolor.
Roztwór odbarwił się na kolor czerwony.
Do roztworu zawierającego jony Cu++ dodać kilka kropel roztworu 2 M NH4OH. Błękitne zabarwienie roztworu świadczy o obecności amoniakalnego kompleksu miedzi. Następnie ostrożnie dodajemy po kropli rozcieńczonego kwasu obserwując zmianę zabarwienia roztworu.
Trwałość kompleksu.
Na płytkę porcelanową z wgłębieniami wprowadzić po kropli rozcieńczonego roztworu Fe+++ oraz tiocyjanianu amonowego. Następnie tiocyjanianowy kompleks żelaza rozcieńczyć kilkoma kroplami wody i do każdego z wgłębień dodać po kolei wkraplaczem po kropli: a/ 2 m HCl, b/ 2 M H3PO4, c/ 2 M H2C2O4. Odbarwienie kompleksu tiocyjanianowego świadczy o powstaniu trwałego związku zespolonego.
Wykonać doświadczenie na płytce porcelanowej z wgłębieniami nanosząc wkraplaczem po kropli roztworu wg następującego schematu:
Najtrwalsze kompleksy ulegają reakcji maskowania.
Najtrwalsze kompleksy mają wysoką wartość pK.
Jony SCN- maskują niepożądane działanie jonów kobaltu, z kolei jony F- maskują działanie jonów żelaza (III), co jest zgodne z definicją reakcji maskowania, która mówi, że reakcja maskowania polega na wiązaniu w kompleks jonów, które wpływają niekorzystnie na przebieg reakcji chemicznej.
Metale: Cu, Fe, Co, które były w doświadczeniach i które zaliczają się do metali chromoforowych są zdolne do tworzenia w reakcjach chemicznych barwnych kompleksów.
Zmiany barwy np. Odbarwienie kompleksu tiocyjanianowego świadczy o powstaniu trwałego związku zespolonego. (ale nie zawsze).
Reakcja maskowania zachodzi tylko między wybranymi jonami, gdyż nie każy odczynnik maskuje różne metale.
Kompleksy biorąc udział w reakcjach mogą się odbarwiać.
Jeżeli ligand ma jeden atom ligandowy (jest wielofunkcyjny) i zajmuje w sferze koordynacyjnej metalu tylko jedno miejsce koordynacyjne, np.: NH3, CN-, I-, Br-, H2O, SCN-, to powstający kompleks jest prosty.
Cu(NH3)4]2+
wzór strukturalny wzór sumaryczny
Jeżeli ligand zawiera więcej niż jeden atom ligandowy (jest wielofunkcyjny), to zajmuje więcej niż jedno miejsce w sferze koordynacyjnej metalu. Ligandy wielofunkcyjne (zwane też wielokleszczowymi) łącząc się z metalami w komleksy tworzą pierścienie.
Kompleks chelatowy, to kompleks pierścieniowy, w którym metal wchodzi w skład pierścienia. Nazwa „chelatowe” wzięta została z języka greckieho i oznacza kleszcze.
ligand dwukleszczowy (etylenodiamina)
EDTA - kwas etylenodiaminotetraoctowy jest ligandem sześciokleszcowym, który wiąże się z metalem poprzez dwa atomy azotu i cztery atomy tlenu, tworząc pięć pierścieni.
EDTA ma szerokie zastosowanie w chemii analitycznej i w przemyśle.
Jeżeli atom centralny Me tworzy z jednofunkcyjnym liganden L związek kompleksowy: Me + nL MeLn, to stałą równowagi tworzenia kompleksu nazywamy stałą trwałości β. Stała równowagi rozpadu kompleksu (dysocjacji), to stała nietrwałości K.
Stała trwałości β |
Stała nietrwałości K |
|
|
W nawiasach kwadratowych podane sa stężenia w stanie równowagi [mol*dm-3].
Najczęściej w danych tablicowych spotyka się pK:
pK = -log K
Znaczną część raeakcji tworzenia się kompleksów stanowią reakcje barwne. Istanieje ścisła zależność między zabarwieniem substancji i jej strukturą elektronową. Cząsteczka wykazuje absorpcję w części widzialnej lub w nadfiolecie, gdy pod wpływem promieniowania elektrony jej zostaną przeniesione ze stanu podstawowego w stan wzbudzony. Powstanie barwy związane jest z deformacją normalnej normalnej elktronowej struktury cząsteczki lub atomu. W cząsteczkach zawierających ugrupownaia chromoforowe , czyli ugrupowania atomów z wielokrotnymi , nienasyconymi wiązaniami następuje zmiana energii elektronowej pod wpływem naświetlania. Jeżeli w cząsteczce odczynnika organicznego znajduje się grupa chromoforowa , to taki odczynnik ma własne zabarwienie, a przy reakcji z metalem często zmienia się intensywność barwy. Gdy grupy chromoforowe łączą się z jonami metali o właściwościach chromoforowych, wówczas powstaja kompleksy o szczególnie intensywnym zabarwieniu.. Zmiana zabarwienia w kierunku fal dłuższych nazywa się pogłębieniem barwy, przesunięciem lub efektem betachromowym. Przesuwanie się maksimum absorpcji w kierunku od czerwieni do nadfioletu nazywa się z kolei podwyższeniem barwy lub efektem hipsochromowym. Barwne kompleksy z bezbarwnymi ligandami tworza metale o właściwościach chromoforowych, mogące występować na różnych stopniach utlenienia np. Fe, Cu, Ni, Co, Cr, V, Mn, Ce. Obecność w cząsteczce ligandu organicznego obok grup chromoforowych także wpływa na zabarwienie, wzmacniając je lub zmieniając jego odcień.
W celu zwiększenia selektywności reakcji analitycznych często stosuje się reakcje kompleksowania, aby zamaskować jony, które nam przeszkadzają podczas reakcji. Maskowanie jonu przeszkadzającego odbywa się przez przeprowadzenie go w wyniku reakcji kompleksowania z odpowiednim ligandem w kompleks o odpowiedniej trwałości. Związany w tej postaci jon jest niezdolny do reakcji zakłócającej prawidłowy przebieg reakcji wykrywania lub oznaczania innego jonu.
II analiza wyników:
- Fe+++ barwa ciemnoczerwona, przypominająca sztuczą krew
- Ni++ barwa zielonkawa (jasny odcień)
- Cu++ barwa żółtawa
- Co++ barwa fioletowa
Reakcje towarzyszące dodaniu tiocyjanianu amonowego:
![]()
![]()
![]()
![]()
L.p. |
Me+n |
Wzór kompleksu |
Barwa |
pK |
1 |
Fe+++ |
[Fe(SCN)6]3- |
ciemnoczerwona |
2,9 |
2 |
Ni++ |
[Ni(SCN)4]2- |
Zielonkawa |
22 |
3 |
Co++ |
[Co(SCN)6]4- |
Fioletowawa |
19,1 |
4 |
Cu++ |
[Cu(SCN)4]2- |
Zielonkawa |
30,3 |
1 |
Zn++ |
ZN(OH)2 (osad); [Zn(NH3)4]2+ |
osad biały; bezbarwna |
9,5 |
2 |
Cd++ |
Cd(OH)2 (osad); [Cd(NH)3]2+ |
osad białawy; bezbarwna |
7,1 |
3 |
Cu++ |
[Cu(NH3)4]2+ |
ciemnoniebieska |
12,7 |
4 |
Ni++ |
[Ni(NH3)6]2+ |
Granatowo-ciemnoniebieska |
8,7 |
5 |
Co++ |
[Co(NH3)4]2+ |
sbladozielonkawa |
5,1 |
Po dodaniu NH4SCN do poniższych jonów zaobserwowaliśmy nastepujące barwy:
- Zn++ jasnoniebieski
- Cu++ błękitny
- Ni++ jasnoniebieski
- Co++ żółty
- Cd++ bezbarwny
Reakcje, które zaszły podczas dodawania NH4SCN do Zn++, Cd++, Cu++, Ni++ oraz Co++:
![]()
![]()
![]()
![]()
![]()
![]()
1cm3 ![]()
+ 0,5 cm3 NH4SCN - ciemny róż
1cm3 ![]()
+ 1cm3 NH4SCN - ciemniejszy róż niż na początku
1cm3 ![]()
+ 5 cm3 NH4SCN - jasny fiolet
1cm3 ![]()
+ kryształki NH4SCN - niebiesko-granatowy
Barwa zmienia się wraz ze zwiększeniem ilości NH4SCN od ciemnego różu do fioletu.
![]()
Nastąpiła zmianę barwy na czerwony i żółty. Wraz z dodawaniem kolejnych ilości wody roztwór zmienił kolor na pomarańczowy. Wraz ze wzrostem ilości dodanej wody roztwór stawał się coraz ciemniejszy.
Wyjściową barwą roztworu była barwa żółta, która zmieniła się w czerwoną po dodaniu jonów żelaza. Po przemiareczkowaniu roztwór stał się ciemno czerwony.
![]()
![]()
Oznaczanie ilości jonów żelaza w wodzie z sieci wodociągowej:
Porównaliśmy intensywność barwy probówki z wodą z sieci wodociągowej z probówkami, w których stężenie jonów żelaza w roztworze wcześniej oznaczyliśmy. Otrzymaliśmy następującą zawartość jonów Fe+++:
5*10-7 mol*dm3 10-6 stężenie jonów Fe+++ w kranówce
10-7
Obliczenie zawartości jonów żelaza w szklance hebaty (250ml):

X=1,25 * 10-7mol roztworuFe+++
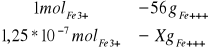
X=7*10-6gFe+++
Wypijając moją ulubioną herbatę wypijam wraz z nią 7*10-6g jonów Fe3+.
Gdy do roztworu rodanku żelaza dodamy jony rtęci, wtedy jony rtęci wyprą żelazo z jej kompleksu, co zaobserwujemy w postaci odbarwienia się roztworu. Ponieważ stała trwałości rodanku rtęci jest większa niż stała trwałości rodanku żelaza, dlatego takowa reakcja ma w ogóle szansę zajść. Jest to reakcja maskowania jonów żelaza:
![]()
Zróżnicowanie barwy od niebieskiej do fioletowej. W tym przypadku na intensywność barwy ma wpływ stężenie Cu++.
III Opracowanie wyników:
Roztworem buforowym jest w tym przypadku Hg++/HgSCN+. Jeżeli do takiego roztworu buforowego dodamy krople roztworu Fe+++, otrzymamy zabarwienie wywołane przez wolne SCN- w roztworze. Jeśli teraz dodamy rozcieńczonego tiocyjanianiu amonu, pHSCN- zmieni się nieznacznie, a więc i zabarwienie pozostanie prawie nie zmienione, co świadczy o własnościach buforujących Hg++ wobec jonów SCN-.
Wykres zmiany pFe3+ w zależności od stężeń Y4- i FeY-.
Na tym wykresie można śledzić zmiany [Fe3+] . Dopiero gdy Y4- zniknie z roztworu na skutek połączenia w kompleks, stężenie jonów Fe3+ wzrasta, co tłumaczy nam to, że roztwór jest buforowy.
Nawet niewielki dodatek NH4SCN uwidacznia jony Fe+++ i Cu++ w roztworze, nawet przy małym stężeniu i wskaźniki są bardzo czułe.
IV Wnioski:
Własności związków kompleksowych
I analiza i opracowanie wyników:
Reakcje zachodzące w podpunkckie:

Otrzymane odbarwienia roztworów:
W ćwiczeniu tym obserwujemy zmianę zabarwienia z bardzo jasno niebieskiego na ciemno niebieski, oraz pojawienie się nierozpuszczonej części jonów Cu++ w postaci niebieskiego osadu. Po dodaniu stężonego kwasu solnego osad się rozpuścił.
Reakcje:
1)Cu++ + 2NH4OH Cu(OH)2↓ + 2NH4+
niebieski osad
2)Cu(OH)2 + 2HCl CuCl2 + 2H2O
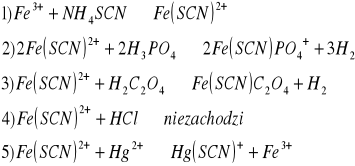
Barwy kompleksów:
1)Czerwony
2)blado-żółty
3)żółtawy
4)barwa się lekko rozjaśniła
5)brak barwy (bezbarwny)
Bi+++ + J- → Fe+++ + C2O42- + J- →
Fe+++ + J- → Bi+++ + C2O42- + J- →
Bi+++ + Fe+++ + C2O42- + J- →
1) Co + ![]()
→ + ![]()
2) Fe+++ + ![]()
→ ![]()
3) Fe+++ + ![]()
+![]()
→ ![]()
4) Co + ![]()
+![]()
→ barwa pozostała taka sama
5) Co + ![]()
+ ![]()
+ Fe+++→ roztwór odbarwił się na lekko czerwonawy
Reakcje maskowania zaszły w punktach:
1), poznieważ jony kobaltu są maskowane przez odczynnik jakim są jony SCN-
3), gdyż jony Fe+++ maskowane są odczynnikiem jonów F-
4), jony kobaltu są maskowane przez jony SCN-
5), Jony kobaltu maskowane są przez jony SCN-,a jony Fe3+ maskowane sa przez jony F-.
II Wnioski:
Mocno czerwony
Mocno czerwony
Średnio czerwony
Średnio czerwony
Bezbarwny (muśnięty)
bezbrawny
Wraz ze zmniejszaniem się stężenia roztworu, jego barwa blednie
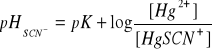
Wyszukiwarka
Podobne podstrony:
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
Cw9 Reakcje kompleksowania II, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
Cw8 Reakcje kompleksowania I, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna
sprawko z kompleksy I, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie or
Cw2 Reakcje w ukladzie kwas-zasada, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
sprawko z kompleksów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie org
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
sciaga na egzmin, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki
sprawko z osadów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organic
6!!!!!!!!!, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
sprawko cw1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
sprawozdanie z cw 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Badanie substancji błonotwórczych, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.che
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
ćw.5 Ania, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
więcej podobnych podstron