nr cwicz. 8 i 9 |
data
|
Krzysztof Pittner |
Wydzial Technologii chemicznej |
Semestr II |
grupa IPC |
|
przygotowanie |
wykonanie |
ocena ostatecz. |
||
Reakcje kompleksowania
Kompleks jest to związek składający się z atomu centralnego który jest najczęściej metalem oraz z ligandu (jony elektro ujemne lub cząsteczki obojętne). Ogólne równanie reakcji tworzenia się kompleksów możemy zapisać jako:
Atom centralny + ligand= kompleks
Np.![]()
Mówiąc o kompleksach należy wspomnieć, że istnieją kompleksy bardziej i mniej trwałe. O trwałości kompleksu decydują własności atomu centralnego oraz ligandów np. kompleksy chelatowe, czyli takie, w których ligandy łączą się z metalem centralnym przez więcej niż jedno wiązanie odznaczają się wysoko trwałością. Trwałość kompleksów wyraża się po przez tzw. stałą trwałości, która jest stałą równowagi reakcji tworzenia się kompleksu i wyraża się wzorem: ![]()
gdzie ![]()
to stężenie kompleks, [L] to stężenie ligandu i [M] to stężenie atomu centralnego.
Bardzo ważną własnością kompleksów jest ich zdolność do przeprowadzania reakcji maskowania. Reakcje te polegają na przeprowadzeniu jonu przeszkadzającego w reakcji w trwały kompleks tak aby stał się nie aktywny. Przykładem takiej reakcji może być próba wydzielenia kadmu z roztworu zawierającego również jony miedzi. W tym celu oba metale możemy przeprowadzić w kompleks cyjankowy. Następnie do roztworu dodajemy siarkowodór który wypiera kadm z jego kompleksu nie naruszając jednocześnie kompleksu miedzi, który jest trwalszy niż kompleks kadmu. W ten sposób wyeliminowaliśmy nie pożądany wpływ jonów miedzi na reakcje, która chcemy przeprowadzić z kadmem. Poniżej przedstawiono reakcja maskowania.
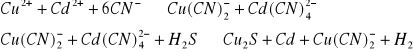
wyróżniamy również reakcje demaskowania, która polega na uwalnianiu wcześniej związanego w kompleks metalu w celu przeprowadzenia z nim dalszej reakcji.
Wykonanie ćwiczenia
Ocena reakcji kompleksowania na podstawie zmiany barwy.
Do płytki porcelanowej, w której wgłębieniach umieszczono po jednej kropli nasyconego roztworu tiocyjanianu amonowego dodać z pipety kapilarnej po jednej kropli roztworu następujących jonów: Fe+++, Ni++, Co++, Cu++. Obserwować kolory otrzymanych roztworów.
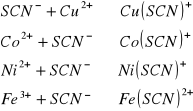
Do płytki porcelanowej, w której wgłębieniach umieszczono po jednej kropli 2M roztworu NH4SCN dodać z pipety kapilarnej kolejno kroplę roztworu jonów: Zn++, Cd++, Cu++, Ni++ oraz Co++. Obserwować kolory otrzymanych roztworów.
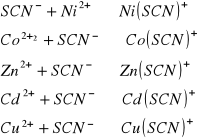
Stopniowe tworzenie kompleksów.
Do czterech probówek zawierających po 2 - 4 cm3 roztworu, Co++, dodać kolejno: 5, 15, 25 kropli oraz ok. 2 cm3 nasyconego roztworu tiocyjanianu amonowego. Po dokonaniu oceny intensywności barwy, każdy z roztworów rozcieńczyć do równej objętości. Ponownie ocenić intensywność zabarwienia roztworu.
Możemy zauważyć, że im wyższe stężenie jonów Co++ tym roztwór ma ciemniejszy kolor. Natomiast po rozcieńczeniu wszystkie próbki miały taki sam Kolor.
Do probówki zawierającej 1 - 2 kropli roztworu jonów Fe+++ dodać 1 cm3 stężonego HCl oraz 1 - 2 kropli roztworu SCN-. Po zaobserwowaniu barwy kompleksu, dopełnić probówkę wodą i z tak otrzymanego roztworu pobrać do czterech probówek kolejno 1, 2, 3, 15 cm3 i dopełnić probówki wodą do równej objętości. Porównać zabarwienie otrzymanych roztworów.
![]()
Zaobserwowaliśmy zmianę barwy na niebieski i żółty. Następnie po dodaniu wody roztwór zmienił kolor na pomarańczowy. Wraz ze wzrostem ilości dodanej wody roztwór stawał się coraz ciemniejszy.
Roztwór buforowy związku kompleksowego.
Do probówki zawierającej 0,5 - 1 cm3 roztworu EDTA oraz 2 - 3 krople roztworu tiocyjanianu, dodawać ostrożnie po kropli roztwór zawierający jony Fe+++ aż do momentu pojawienia się czerwonego zabarwienia (określenie czułości reakcji kompleksowania).
Na początku roztwór miał kolor żółty, który zmienił się w czerwony po dodaniu
jonów żelaza. Po przemiareczkowaniu roztwór stał się ciemno czerwony.
Do wgłębienia płytki porcelanowej dodać po 2 krople nasyconego roztworu tiocyjanianu amonowego. Następnie przygotować z roztworu 0,1 M Fe+++ pięć kolejnych roztworów przez kolejne dziesięciokrotne rozcieńczenie wodą. Do kolejnych wgłębień płytki dodawać przy pomocy kapilary po jednej kropli roztworu Fe+++ o stężeniu 10-1, 10-2, 10-3, 10-4, 10-5, 10-6. Na podstawie obserwacji zabarwienia ocenić czułość roztworu na jony Fe+++.
![]()
Do probówki zawierającej ok. 1 cm3 roztworu Cu++ dodać ok. 9 cm3 wody. Przez kolejne rozcieńczenie otrzymanego roztworu w proporcji 1: 10 przygotować serię czterech roztworów Cu++ o malejącym stężeniu. Do każdej z probówek dodać kilka kropli 6 M roztworu NH4OH. Porównać intensywność zabarwienia roztworów.
Jeżeli do roztworu rodanku żelaza dodamy jony rtęci wówczas jony rtęci wyprą żelazo z jej kompleksu. Efektem tego jest odbarwienie się roztworu. Reakcja ta zachodzi ponieważ stała trwałości rodanku rtęci jest większa niż stała trwałości rodanku żelaza. Jest to reakcja maskowania jonów żelaza. Reakcję tą przedstawia poniższe równanie.
![]()
zjawisko to zostało przedstawione na poniższym wykresie:
Oznaczanie ilości jonów żelaza w wodzie z sieci wodociągowej:
Po porównaniu intensywności zabarwienia probówki zawierającej wodę wodociągową oraz probówki intensywność ze znanym stężeniem jonów w roztworze, otrzymaliśmy następującą zawartość jonów Fe+++:
5*10-7 mol*dm3 -stęzenie jonów żelaza (III) w wodzie wodociągowej
Obliczenie zawartości jonów żelaza w szklance hebaty (250ml):
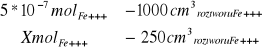
X=1,25 * 10-7mol roztworuFe+++
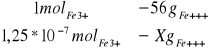
X=7*10-6gFe+++
Wypijając szklankę (250ml) herbatę wypijamy 7*10-6g jonów Fe3+.
wnioski:
Na intensywność barwy kompleksu wpływa: stężenie roztworu, rozcieńczenie oraz objętość roztworu.
Związki kompleksowe tworzą różnego rodzaju bufory (Hg2+/HgSCN+ lub Y4-/FeY-), które zapobiegają zmianie barwy kompleksu, w miarę dodawania małych ilości kationów metali bądź ligandów. Im więcej jonów Y4 przejdzie w kompleks tym stężenie Fe3+ wzrasta. -
Własności związków kompleksowych
Wykonanie ćwiczenia
Kompleksy a kwasowość.
Do probówki zawierającej kilka kropel tiocyjanianu amonowego dodać kroplę roztworu Fe+++. Następnie dodać kroplę roztworu fluorku amonowego. Odbarwienie roztworu świadczy o skompleksowaniu jonów Fe+++ przez fluorki. Następnie dodać ostrożnie po kropli roztworu 6 M H2SO4 do momentu ponownego zabarwienia roztworu na czerwono, świadczy o obecności w roztworze tiocyjanowego kompleksu Fe+++.
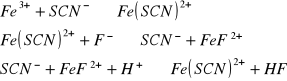
Do roztworu zawierającego jony Cu++ dodać kilka kropel roztworu 2 M NH4OH. Błękitne zabarwienie roztworu świadczy o obecności amoniakalnego kompleksu miedzi. Następnie ostrożnie dodajemy po kropli rozcieńczonego kwasu obserwując zmianę zabarwienia roztworu.
![]()
W pierwszej części doświadczenia kolor zmienił się z lazurowego na ciemno niebieski. Pojawił się również jasno niebieski osad. Po dodaniu stężonego kwasu solnego osad się rozpuścił.
Trwałość kompleksu.
Na płytkę porcelanową z wgłębieniami wprowadzić po kropli rozcieńczonego roztworu Fe+++ oraz tiocyjanianu amonowego. Następnie tiocyjanianowy kompleks żelaza rozcieńczyć kilkoma kroplami wody i do każdego z wgłębień dodać po kolei wkraplaczem po kropli: a/ 2 m HCl, b/ 2 M H3PO4, c/ 2 M H2C2O4. Odbarwienie kompleksu tiocyjanianowego świadczy o powstaniu trwałego związku zespolonego.
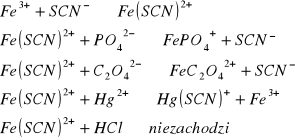
Wykonać doświadczenie na płytce porcelanowej z wgłębieniami nanosząc wkraplaczem po kropli roztworu wg następującego schematu:
![]()
+ ![]()
→ ![]()
roztwór nie zmienił barwy
Fe+++ + ![]()
→ ![]()
roztwór stał się czerwony
Fe+++ + ![]()
+![]()
→ ![]()
roztwór zmienił kolor z czerwonego na biały
![]()
+ ![]()
+![]()
→ ![]()
barwa się nie zmieniła
![]()
+ ![]()
+ ![]()
+ Fe+++→![]()
roztwór odbarwił się na różowo.
L.p |
Me+n |
Wzór kompleksu |
Barwa |
pK |
1. |
Fe+++ |
[Fe(SCN)6]3-
|
czerwona |
2,3 |
2. |
Ni++ |
[Ni(SCN)4]2- |
Jasno zielony |
? |
3. |
Co++ |
[Co(SCN)6]4- |
Jasny fiolet |
3 |
4. |
Cu++ |
[Cu(SCN)4]2-
|
Błękit paryski |
? |
1. |
Zn++ |
[Zn(NH3)4]2+ |
bezbarwny |
2,3 |
2. |
Cd++ |
[Cd(NH)3]2+ |
bezbarwny |
2,6 |
3. |
Cu++ |
[Cu(NH3)4]2+ |
granatowy |
4,1 |
4. |
Ni++ |
[Ni(NH3)6]2+ |
granatowy |
2,8 |
5. |
Co++ |
[Co(NH3)4]2+ |
seledynowa |
2,1 |
Wnioski: Różne kompleksy mają różne barwy co jest pomocne w identyfikacji związków
W doświadczeniu 1.2.1 możemy zaobserwować zmiane zabarwienia wynikającą z rozpadu tiocyjanowego kompleksu żelaza. Jest to spowodowane powstaniem trwalszych kompleksów. Na trwałość kompleksów ma wpływ kwasowość środowiska. Jak widać w tabeli zamieszczonej powyżej naj trwalsz jest amino kompleks miedzi II, którego pK wynosi 4,1. niestety nie udało się ustalić pK dla tiosiarczanu niklu II oraz tiosiarczanu miedzi II.
żółty
Jasny fiolet
Jasna zieleń
Ciemna czerwień
Jasno niebieski
Żółty
Jasny niebieski
Bezbarwny
Błękit paryski
Mocno czerwony
Mocno czerwony
Średnio czerwony
Średnio czerwony
Bezbarwny (muśnięty)
bezbarwny
Roztwór odbarwił się na czerwono
Roztwór odbarwił się na biało
Roztwór odbarwił się na czerwono
Czerwony
Jasno żółty
Jasno żółty
Bezbarwny
Lekko się rozjaśnił
Wyszukiwarka
Podobne podstrony:
sprawko z kompleksy I, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie or
sprawko z osadów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organic
sprawko cw1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Cw8 Reakcje kompleksowania I, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna
sprawko cw2, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
sprawko z redoskow, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organ
Cw9 Reakcje kompleksowania II, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
sprawko cw1 wersja 2, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie org
reakcje kompleksowania 111, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna n
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
sciaga na egzmin, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki
6!!!!!!!!!, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
sprawozdanie z cw 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Badanie substancji błonotwórczych, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.che
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
więcej podobnych podstron