
CHEMIA
Struktura cieczy, ciał
stałych i gazów
dr Marek Jasiorski
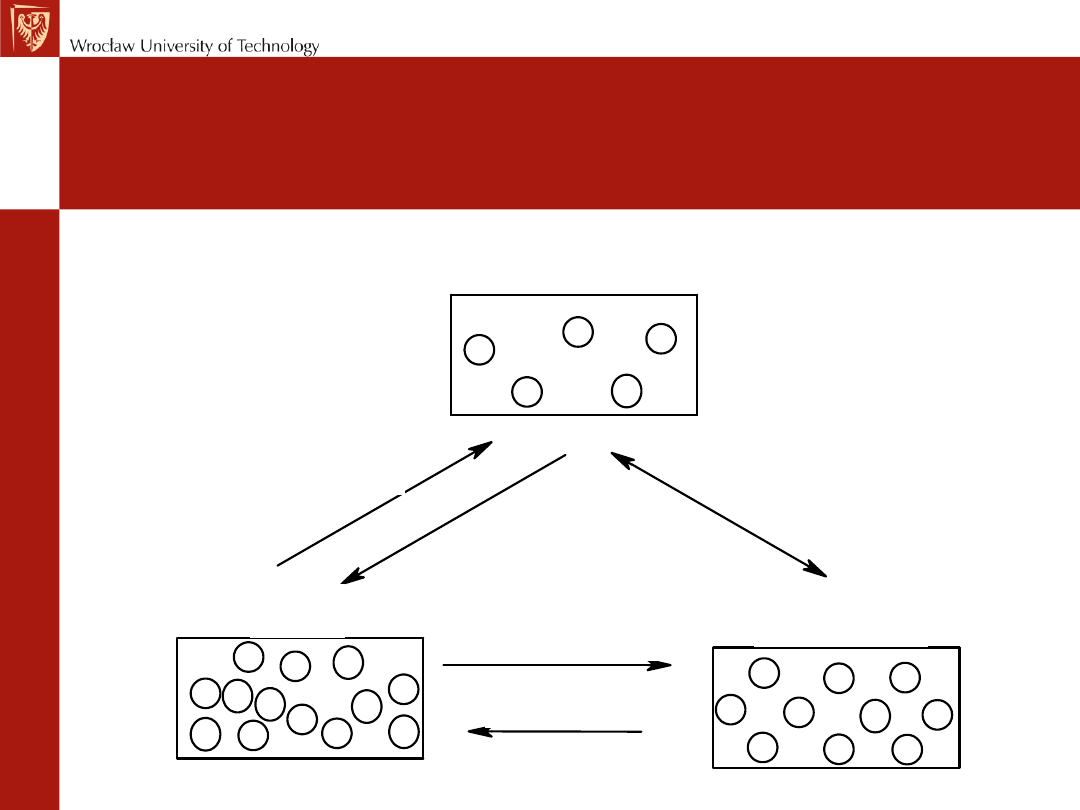
Stany skupienia substancji
krzepnięcie
topnienie
parowanie
skraplanie
sublimacja
gaz
ciecz
ciało stałe
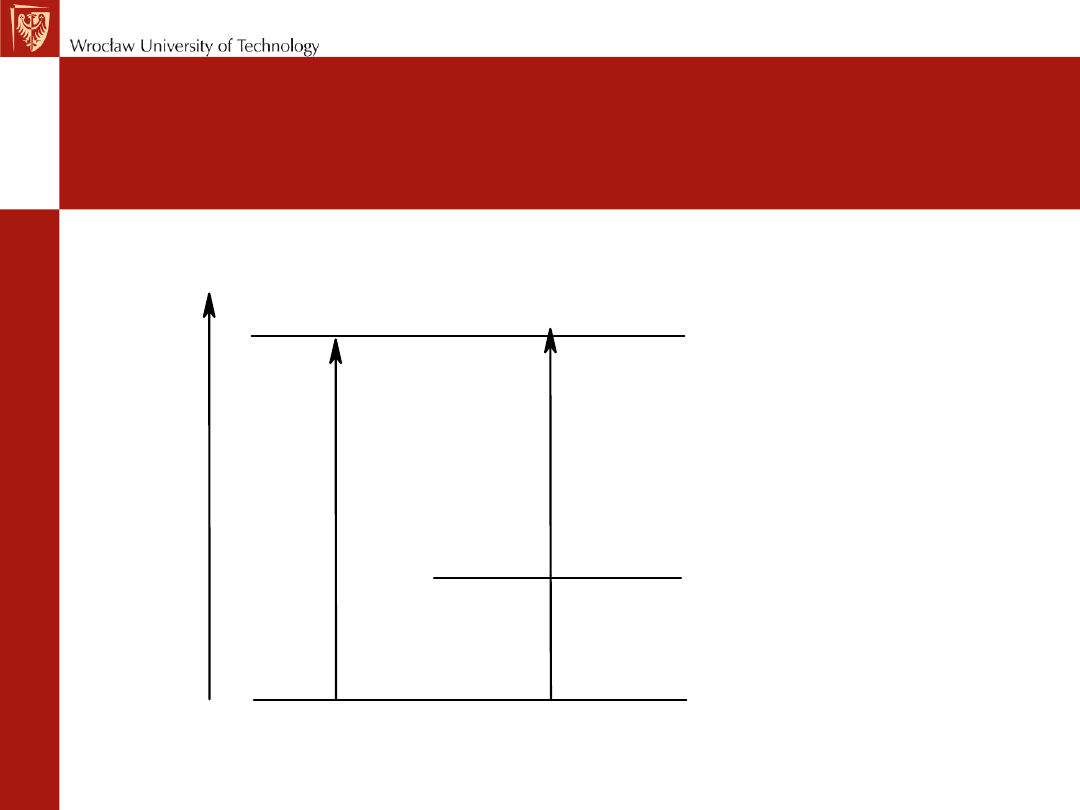
Zmiana energii przy przechodzeniu
substancji ze stanu stałego w ciekły i
gazowy
ciepło
parowania
ciepło
sublimacji
ciepło topnienia
substancja stała
ciecz
gaz
E


Gazy
Gazami nazywamy substancje, które nie mają
określonego kształtu ani objętości, lecz
przyjmują kształt i objętość zbiornika, w
którym się znajdują.
Dążąc do zajęcia jak największej objętości gazy
wywierają ciśnienie na ścianki zbiornika.
Wywierając na gaz ciśnienie można zmienić
jego objętość.
Gaz jest zbiorem cząsteczek lub atomów
będących w ciągłym, chaotycznym ruchu, o
szybkości rosnącej ze wzrostem temperatury.

Przykłady gazów
- gazy jednoatomowe (helowce: hel,
neon, argon, krypton, xenon, radon)
- gazy dwuatomowe (H
2
, O
2
, N
2
, Cl
2
, F
2
)
- gazy nieorganiczne (NH
3
, CO, CO
2
, SO
2
)
- gazy organiczne (metan CH
4
, propan
C
3
H
8
, butan C
4
H
10
)
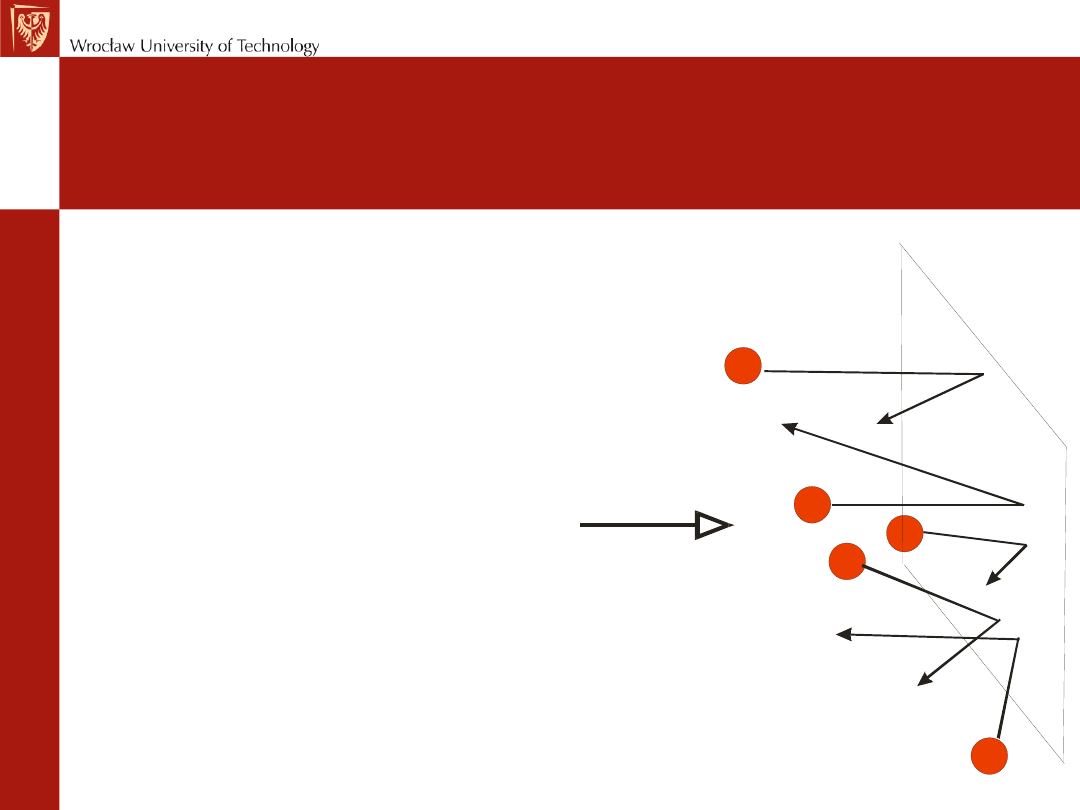
Ciśnienie
Ciśnienie
gazu
jest
wynikiem
uderzeń cząsteczek o stałą
powierzchnię. Jest to siła
uderzeń podzielona przez
pole powierzchni, na którą
działa.
Ciśnienie

Jednostki ciśnienia
1 Pa = 1 kg/(m x s
2
) = 1 N/m
2
1 bar = 10
5
Pa = 100 kPa
1 atm = 1,01325 x 105 Pa = 101,325
kPa
1 atm = 760 Tr

Prawo Avogadra
W jednakowych warunkach temperatury i ciśnienia
dana liczba cząsteczek dowolnego gazu zajmuje
jednakową objętość.
Gaz doskonały
22,41
Argon
22,09
Ditlenek węgla
22,26
Azot
22,40
Tlen
22,40
Wodór
22,43

Równanie stanu gazu
doskonałego
PV = nRT
R = 0,08205781 atm/(K x mol) - stała gazowa
Gaz, który w dowolnych warunkach stosuje się do
tego równania nazywamy gazem doskonałym.
Gazy rzeczywiste (azot, tlen, gazy używane w
laboratoriach) zachowują się jak gazy doskonałe w
przypadku, gdy ciśnienie jest niskie.

Równanie van der Waalsa
an
V
2
2
efekt
odpychania
efekt
przyciągania
(P +
(V - nb) = nRT
)
Stała a uwzględnia efekt przyciągania między cząsteczkami, a stała
b – efekt odpychania
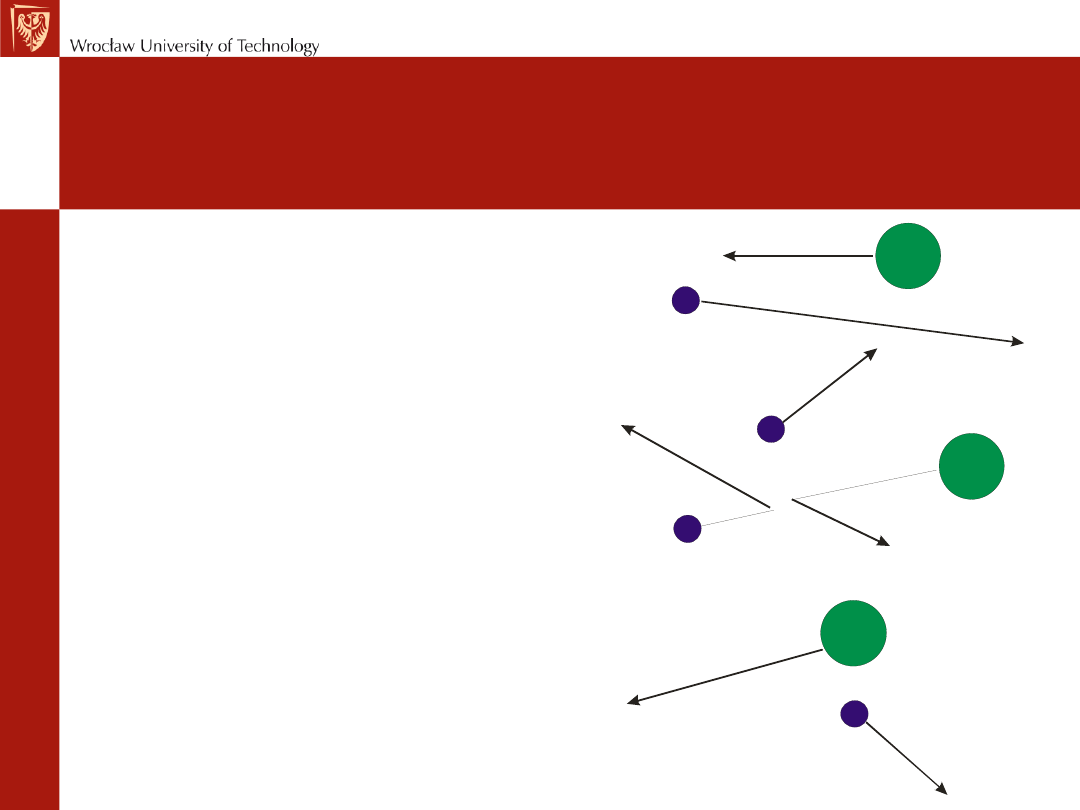
Dyfuzja
Jest to proces rozprzestrzeniania
się cząsteczek w danym ośrodku,
będący konsekwencją
chaotycznych zderzeń cząsteczek
dyfundującej substancji między
sobą i cząsteczkami otaczającego
ją ośrodka.

Ciecze
Ciecze traktuje się jako stan pośredni
pomiędzy gazami i ciałami stałymi.
Ciecze zachowują własną objętość, ale
przyjmują kształt naczynia, w którym
się znajdują. Wykazują znaczną, w
porównaniu z gazami, gęstość i lepkość,
niewielką ściśliwość i rozszerzalność
cieplną.

Lepkość
Lepkość cieczy jest to opór przeciwdziałający
jej płynięciu.
Im większa jest lepkość cieczy, tym wolniejszy
jest jej przepływ. Ciecze zawierające wiązania
wodorowe mają z reguły dużą lepkość.
Lepkość
zwykle
maleje
ze
wzrostem
temperatury.

Napięcie powierzchniowe
Napięcie powierzchniowe cieczy określa
działającą
na
jej
powierzchnię
siłę.
Powierzchnia cieczy jest gładka, ponieważ siły
międzycząsteczkowe wciągają cząsteczki do
wewnątrz.
Napięcie powierzchniowe jest przyczyną
tworzenia przez ciecze kropelek i wykazywania
przez substancje działania kapilarnego.

Ciała stałe
Ciała stałe w przeciwieństwie do gazów
i cieczy, mają określony kształt i
objętość,
charakteryzują
się
sztywnością, a ich gęstość w dużo
mniejszym
stopniu
zależy
od
temperatury i ciśnienia.
Podział ciał stałych:
- ciała krystaliczne
- ciała bezpostaciowe (amorficzne)

Ciała krystaliczne
Ciała krystaliczne (kryształy) – mają w dużym
obszarze uporządkowaną budowę

Ciała bezpostaciowe
Ciała bezpostaciowe nie mają określonego
rozmieszczenia
atomów;
są
to
ciecze
przechłodzone o dużej lepkości lokalnie
uporządkowane (smoła, szkło, tworzywa
sztuczne).
W ciałach bezpostaciowych nie obserwuje się
ostrego przejścia fazowego, wiązania między
atomami mają różną wytrzymałość i pękają w
różnych temperaturach.

Ciekłe kryształy
Ciekłe kryształy są to substancje, które
wykazują płynność lepkich cieczy, lecz
występuje
w
nich
pewne
uporządkowanie cząsteczek, podobnie
jak w krysztale.
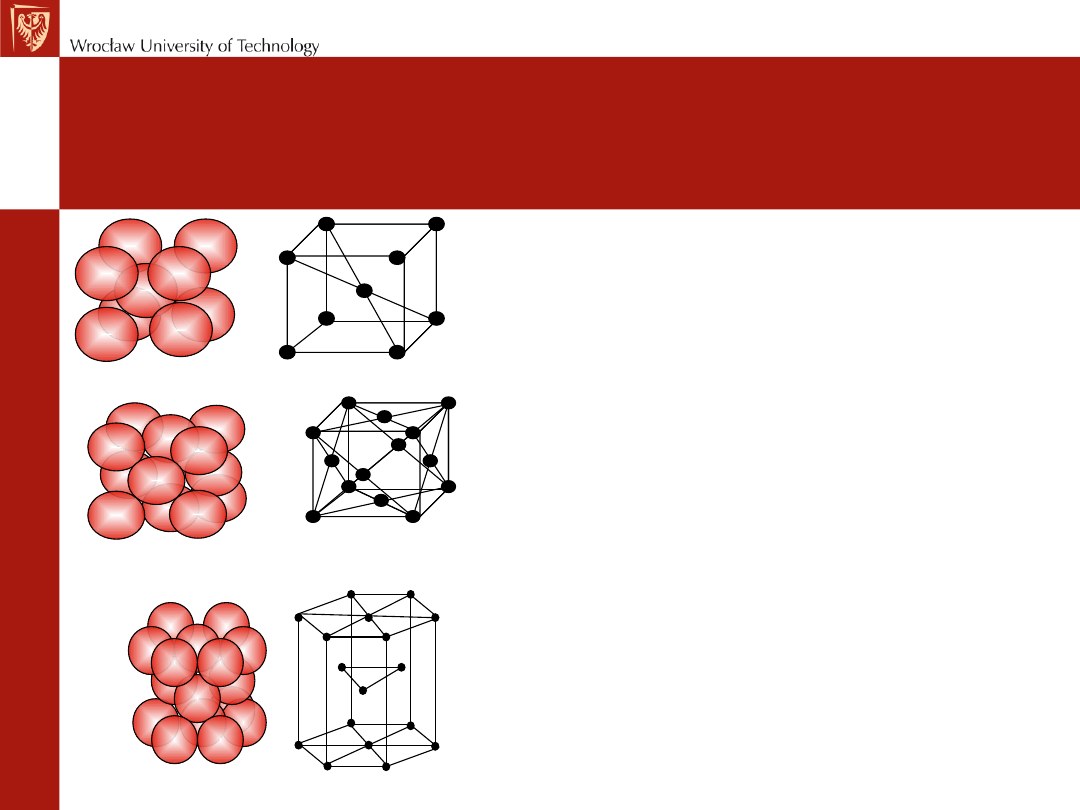
Budowa atomowa metali
Sieć heksagonalna zwarta A3
Sieć regularna płaskocentrowana A1
Sieć regularna przestrzennie centrowana A2

Kryształ metaliczny
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-

Metale - właściwości
Ruchliwość elektronów walencyjnych w
metalach warunkuje ich właściwości:
- połysk
- kowalność
- ciągliwość
- przewodnictwo elektryczne

Opór elektryczny
Opór elektryczny jest miarą zdolności substancji do
przewodzenia elektryczności. Im mniejszy jest opór,
tym lepiej substancja przewodzi elektryczność.
Klasyfikacja substancji oparta na ich oporze i jego
zależności od temperatury:
- izolator
- przewodnik metaliczny
- półprzewodnik
- nadprzewodnik

Temperatura
Opór elektryczny
Nadprzewodnik
Przewodnik
metaliczny
Półprzewodnik

Teoria pasmowa ciał stałych
- Teoria
pasmowa
dotyczy
zasadniczo
2
poziomów
energetycznych
atomów
w
ciele
stałym:
najbardziej
zewnętrznego poziomu obsadzonego elektronem i najbliższego
mu poziomu wzbudzonego
- Poziomy te pod wpływem oddziaływania pól elektrostatycznych
pozostałych atomów ulegają rozszczepieniu na dużą liczbę
blisko położonych poziomów tworzących pasma energetyczne:
walencyjne i przewodnictwa
- W ramach pasma elektrony poruszają się swobodnie dzięki
małym różnicom energii pomiędzy tworzącymi je poziomami
- Na każdym poziomie tworzącym pasmo mogą być 2 elektrony
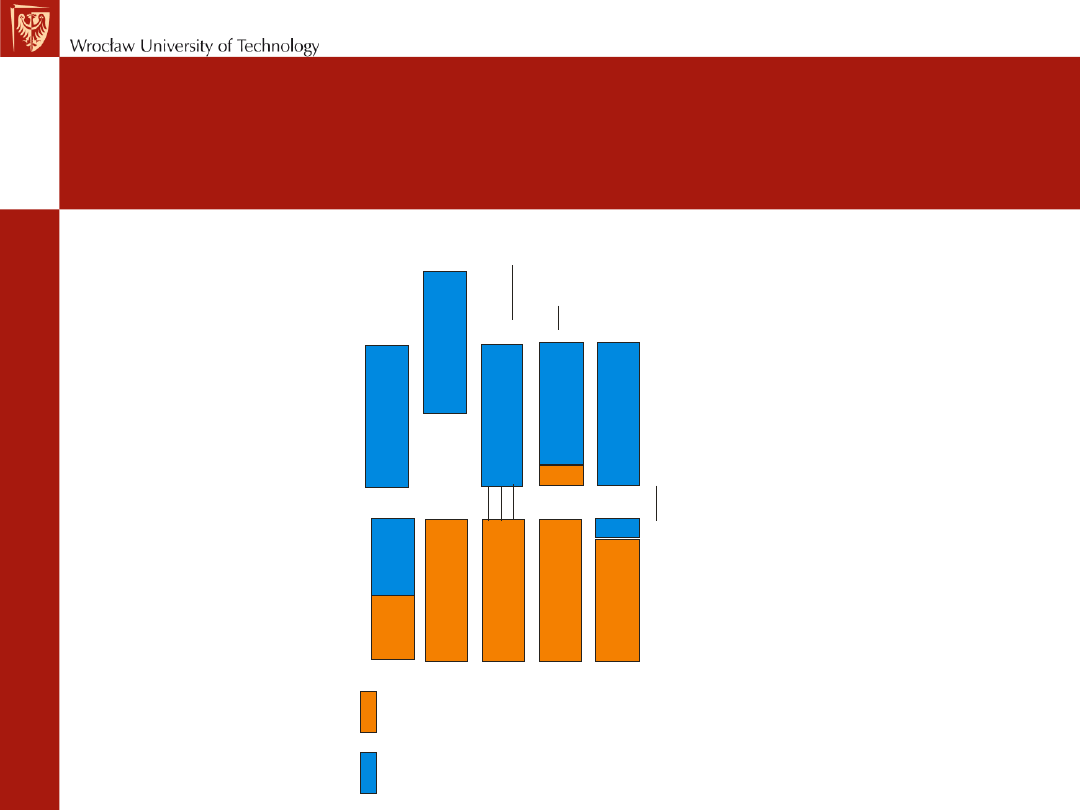
Struktura pasmowa
Pasmo walencyjne
Pasmo przewodnictwa
Pasmo wzbronione
półprzewodnik
półprzewodnik typu n
półprzewodnik typu p
izolator
przewodnik
metaliczny

Półprzewodniki
Półprzewodnik samoistny
– monokryształ
półprzewodnika pozbawionego defektów
sieci krystalicznej i domieszek, czyli nie
zawierający obcych atomów w sieci
krystalicznej
Półprzewodnik typu n
– półprzewodnik, w
którym elektryczność jest przenoszona przez
nadmiar elektronów
Półprzewodnik typu p
– półprzewodnik, w
którym elektryczność jest przenoszona przez
dziury elektronowe
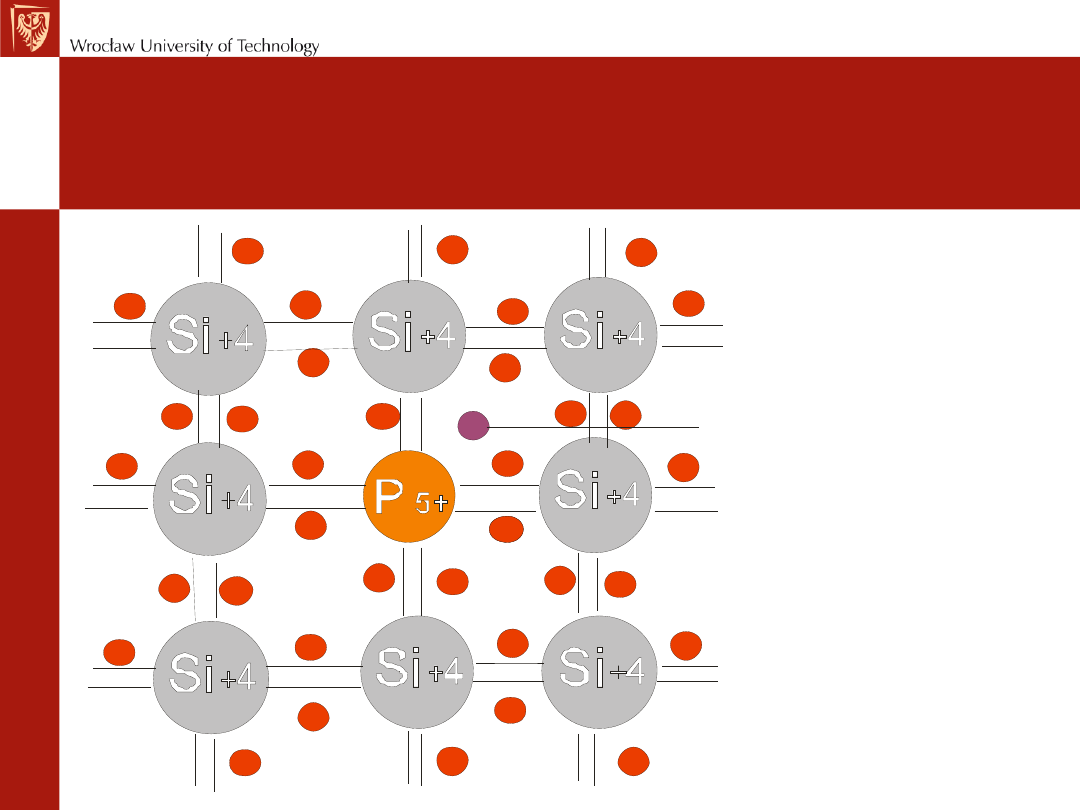
Półprzewodnik typu n
Elektron nadmiarowy
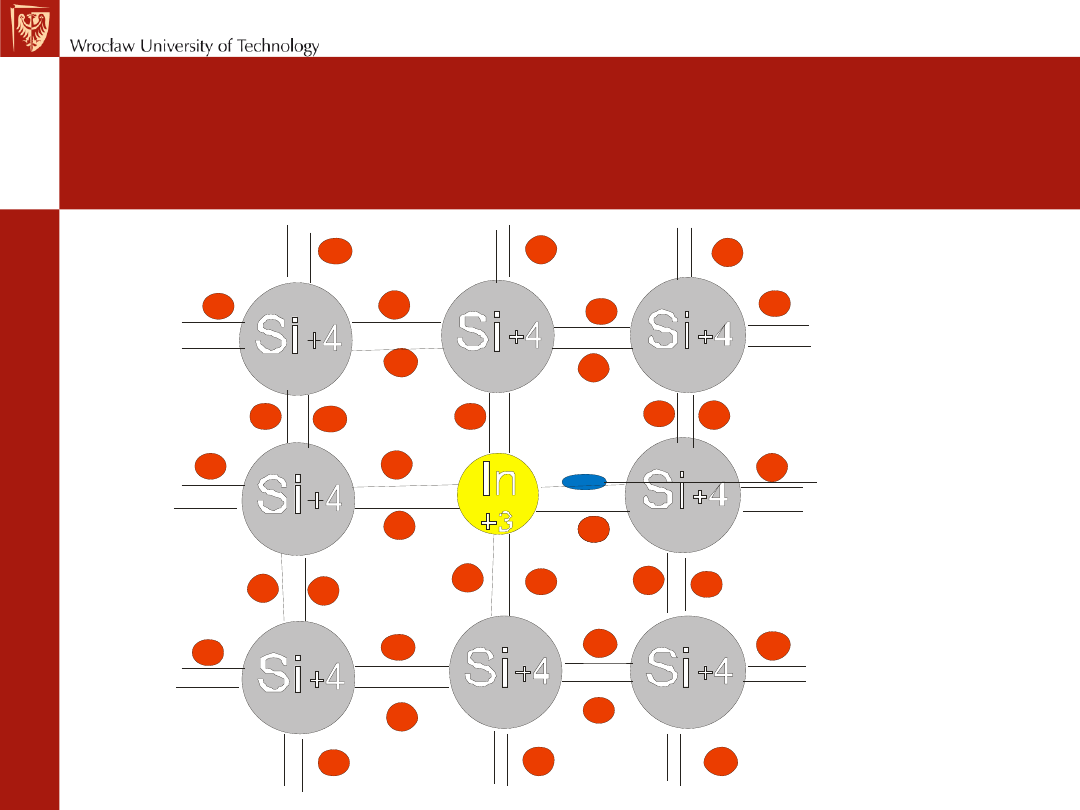
Półprzewodnik typu p
Dziura

Stopy
Stopy są to mieszaniny dwóch lub większej
liczby metali.
Podział stopów:
- Stopy homogeniczne (jednofazowe) – atomy
różnych metali są rozmieszczone równomiernie.
Przykłady: mosiądz, brąz, stopy monetowe.
- Stopy heterogeniczne (wielofazowe) stanowią
mieszaniny obszarów krystalicznych o różnym
składzie. Przykłady: amalgamat, lut cyna-ołów.

Budowa stopów
stop substytucyjny
stop międzywęzłowy

Skład typowych stopów
Mosiądz – do 40% cynku w miedzi
Brąz – metal inny niż cynk lub nikiel w miedzi
Lut – cyna i ołów
Stal – stop żelaza z węglem (mniej niż 2%)
Stal nierdzewna – ponad 12% chromu w żelazie
Amalgamat – stop metalu z rtęcią
Stopy metali wykazują na ogół większą twardość i
mniejszą przewodność elektryczną niż czyste
metale.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
Wyszukiwarka
Podobne podstrony:
Proces pielęgnowania wykład 3 ppt
wyklad 2(1) ppt
Wsparcie jako element procesu pielęgnowania wykład ppt
Wyklad4 ppt
Wyklad 4 ppt
Wyklad 7 ppt
Wyklad9 ppt
Ekonomia Wyklad11 ppt
Wyklad 8 ppt
STRATEGIE ORGANIZATORSKIE WYKŁAD ppt
Wyklad8 ppt
Ekonomia Wyklad4 ppt
więcej podobnych podstron