
ANALIZA
MIARECZKOWA
REDOKSYMETRIA

Redoksymetria (lub redoksometria) - dział
chemii analitycznej, zbiór technik
miareczkowych w których wykorzystuje się
reakcje redoks.
Redoksymetria dzieli się na:
• oksydymetrię - miareczkowanie
mianowanymi roztworami utleniaczy,
• reduktometrię - miareczkowanie
mianowanymi roztworami reduktorów.
Redoksymetria

Oksydymetria i reduktometria dzielą się na kilka
metod w zależności od związku będącego titrantem
Do typowych metod
oksydometrycznych należą:
manganometria - jako utleniacz
stosowany jest KMnO4.
cerometria - jako utleniacz
stosowany jest Ce(SO4)2.
chromianometria - jako
utleniacz stosowany jest K2Cr2O7
lub K2CrO4
bromianometria - jako utleniacz
stosowany jest KBrO3
jodometria – jako utleniacz I2 lub
Na2S2O3
Do typowych metod
reduktometrycznych należą:
tytanometria - jako reduktor
stosuje się związki tytanu(III)
najczęściej TiCl3
ferrometria - jako reduktor
stosowany jest roztwór FeSO4
Redoksymetria

Analiza miareczkowa
Analiza miareczkowa (analiza objętościowa)
polega na oznaczaniu substancji badanej w
roztworze za pomocą dodawania małych porcji
roztworu odczynnika (titranta) o dokładnie
znanym stężeniu (mianie). Obliczenia
zawartości oznaczanej substancji dokonuje się
na podstawie zmierzonej objętości roztworu
miareczkującego w oparciu o równanie reakcji.
Redoksymetria

Podstawowe pojęcia
używane w analizie
miareczkowej:
Redoksymetria

• Miano roztworu - jest to liczba gramów
substancji rozpuszczonej, znajdująca się w
1 ml roztworu lub liczba gramów substancji
oznaczanej reagująca z 1 ml danego roztworu
mianowanego. Jednostka miana to g/ml.
• Roztwór mianowany - roztwór o dokładnie
znanym stężeniu.
• Titrant - roztwór miareczkujący o dokładnie
znanym stężeniu
Redoksymetria

• Punkt równoważnikowy (PR, punkt nasycenia równoważnikowego) –
punkt miareczkowania, w którym została doprowadzona taka ilość
titranta, która jest równoważna chemicznie ilości substancji oznaczanej.
• Punkt końcowy miareczkowania (PK) - punkt, w którym za pomocą
metod instrumentalnych lub zmiany barwy wskaźnika można
zaobserwować punkt równoważnikowy (koniec miareczkowania). Punkt
końcowy powinien pokrywać się z punktem równoważnikowym.
• Błąd miareczkowania - różnica między punktem końcowym a
punktem równoważnikowym. Powinno się tak dobrać wskaźnik lub
metodę instrumentalną, by błąd miareczkowania był nie większy niż
0,05-0,1 %. W przypadku, gdy PK znajduje się za PR, otrzymujemy za
duże wyniki (błąd dodatni), w przeciwnym przypadku wyniki są za małe
(błąd ujemny).
Redoksymetria

• Indykator – wskaźnik.
• Krzywa miareczkowania – graficzny sposób przedstawienia
przebiegu procesu miareczkowania. W układzie współrzędnych na
osi odciętych przedstawia się objętość titr anta (ml) lub %
zmiareczkowania, natomiast na osi rzędnych wartości liczbowe
parametru odpowiadającego stężeniu substancji oznaczanej.
• Procent zmiareczkowania – jest to stosunek ilości substancji
miareczkowanej, która przereagowała z titrantem do całkowitej
początkowej ilości tej substancji, wyrażony w %.
• Skok miareczkowania – gwałtowna zmiana w pobliżu punktu
równoważnikowego, spowodowana dodaniem jednej kropli
roztworu miareczkującego
Redoksymetria

Podczas procesu miareczkowania
powinny zostać spełnione cztery
podstawowe warunki:
• po dodaniu każdej porcji odczynnika reakcja powinna przebiegać
z dużą szybkością;
• reakcja powinna przebiegać stechiometrycznie, zgodnie z
równaniem reakcji;
• poza substancją oznaczaną, żadna inna znajdująca się w
roztworze nie powinna reagować z odczynnikiem
miareczkującym;
• należy dobrać odpowiedni wskaźnik lub metodę instrumentalną,
by koniec miareczkowania był wyraźnie widoczny.
Redoksymetria

Podstawowe naczynia
miarowe stosowane w
analizie miareczkowej:
Redoksymetria

Kolba
Redoksymetria

cylinder
Redoksymetria
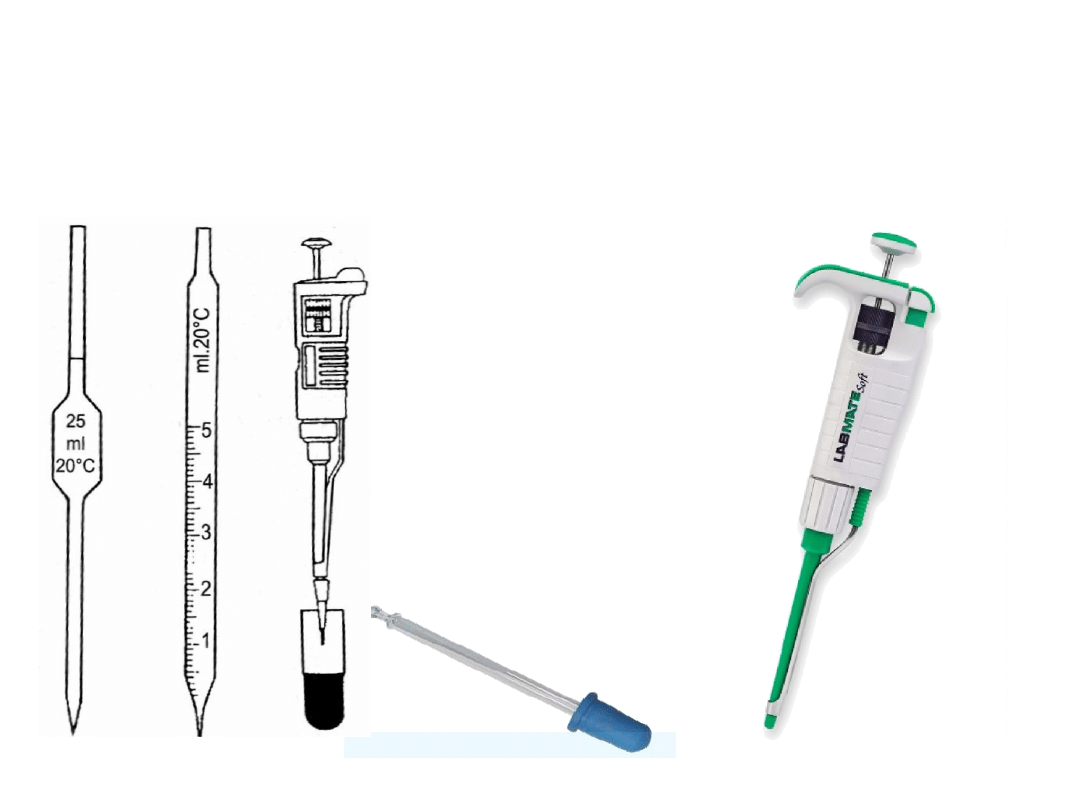
Redoksymetria
pipeta pełna jednomiarowa
pipeta miarowa z podziałką
pipeta automatyczna
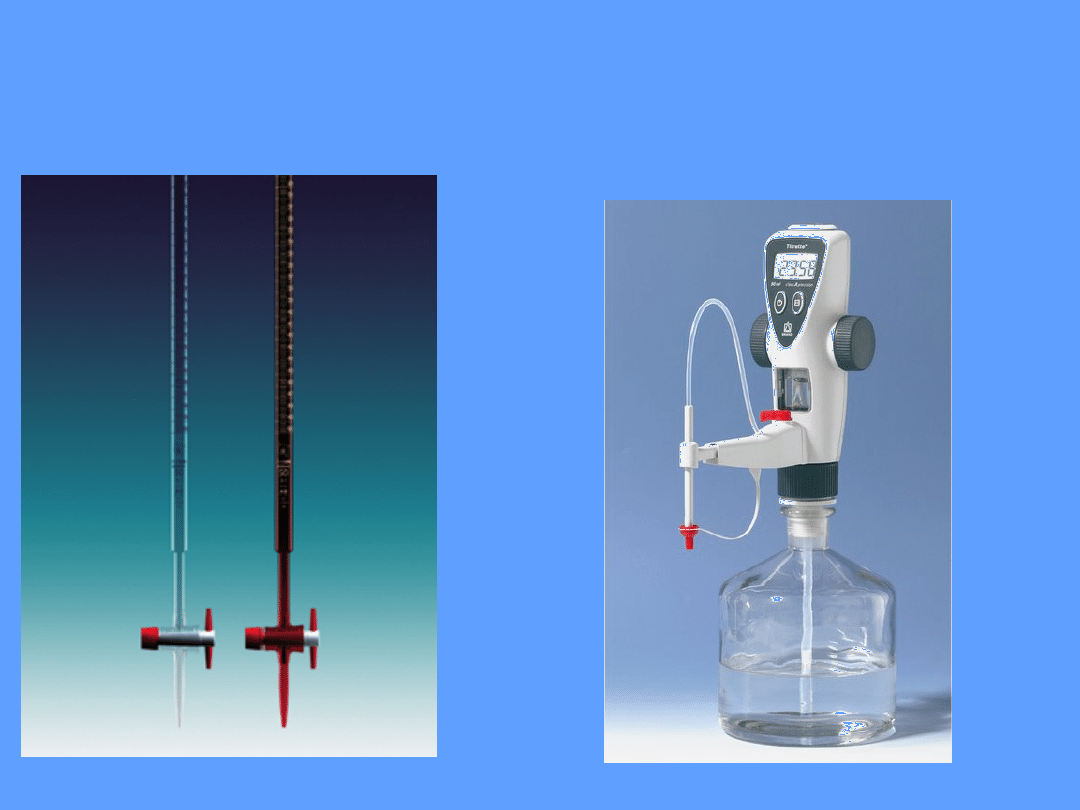
biureta
Redoksymetria

OGÓLNE ZASADY ANALIZY
MIARECZKOWEJ
1.
Wszystkie używane naczynia muszą
być czyste
2.
Naczyń miarowych nie wolno ogrzewać
oraz napełniać roztworami o innej
temperaturze od podanej na naczyniu
3.
Pipety i biurety ( nigdy kolby miarowe )
należy przed użyciem przemyć
roztworem, który ma być odmierzany,
dwukrotnie kilkoma cm3 roztworu
4.
Nie wolno wydmuchiwać płynu z
pipety, lecz opróżnić ją przytykając do
ścianki kolby stożkowej
5.
Po napełnieniu biurety roztworem
należy upewnić się, czy w jej końcówce
nie ma pęcherzyków powietrza, które
w razie potrzeby należy usunąć przez
otwarcie kranu i wypuszczenie cieczy
6. Jeśli do napełniania biurety używa się
lejka, należy go zdjąć przed
ustaleniem poziomu cieczy na „0”
7. Po ustawieniu poziomu „0” na biurecie,
należy podstawić kolbę stożkową z
badanym roztworem pod biuretę i
miareczkować otwierając lewą ręką
kran, a prawą mieszając ciecz w kolbie
ruchem wirowym do zmiany barwy
wskaźnika ( od jednej kropli )
8. Pomiar objętości w biurecie wykonuje
się, odczytując poziom cieczy dla :
- płynów bezbarwnych : menisk dolny
- płynów kolorowych : menisk górny
9. Miareczkowanie powinno się
przeprowadzić co najmniej trzykrotnie,
a poszczególne wyniki nie mogą różnić
się od siebie nie więcej, niż o 0,10 cm3
Redoksymetria

Manganometria
Manganometria jest jednym z działów
oksydymetrii i polega na miareczkowaniu
analizowanej substancji mianowanym roztworem
manganianu(VII) potasu jako utleniacza.
W reakcji z analizowaną substancją jon
manganianowy(VII) MnO4- redukuje się do jonu
Mn2+ w środowisku kwaśnym, zaś w środowisku
słabo kwaśnym do tlenku manganu(IV) MnO2
Redoksymetria

Manganian(VII) potasu
• jest utleniaczem na tyle silnym, że może być
stosowany do różnorodnych oznaczeń,
• w miareczkowaniu nie trzeba stosować wskaźnika,
gdyż posiada on silne fioletowe zabarwienie, które
znika w trakcie tworzenia bezbarwnych jonów
Mn2+; gdy cały reduktor przereaguje z KMnO4 to
pod wpływem jednej kropli nadmiaru tego związku
roztwór zabarwia się na lekko różowo co sygnalizuje
koniec miareczkowania.
Redoksymetria

Jako roztworu miareczkującego używa się
manganianu(VII) potasu o silnie fioletowym
zabarwieniu, który w zależności od środowiska
reakcji (ze zmianą pH zmienia się potencjał
redoks układu) ulega różnym przemianom:
Redoksymetria

• gdy środowisko kwaśne - roztwór ulega odbarwieniu
MnO4¯ + 8 H+ + 5 e → Mn2+ + 4 H2O
• gdy środowisko obojętne lub słabo zasadowe lub
słabo kwasowe - wytrąca się brunatny osad MnO2
MnO4¯ + 2 H2O + 3 e → MnO2 ↓ + 4 OH¯
• Gdy środowisko mocno zasadowe - roztwór
przybiera zieloną barwę
MnO4- + e → MnO42¯
Redoksymetria

Metodą miareczkowania manganometrycznego
można oznaczać żelazo w postaci jonów
dwuwartościowych. Reakcję przeprowadza się w
środowisku kwasu siarkowego(VI).
5 Fe2+ + MnO4¯ + 8 H+ → 5 Fe3+ + Mn2+ +
4 H2O
Redoksymetria

Cerometria
Cerometria - metoda miareczkowania wykorzystująca
mianowane roztwory siarczanu(VI) ceru(IV) (w
środowisku kwaśnym Ce(IV) ulega redukcji do Ce(III),
zmieniając barwę z żółtej na bezbarwną).
W cerometrii oznacza się substancje o własnościach
redukujących [np. Fe(II), Sb(III)] jak i - pośrednio -
odczynniki utleniające. Najczęściej stosowanym
wskaźnikiem w cerometrii jest ferroina (fenantrolina).
Redoksymetria

Bromianometria
Bromianometria (bromometria), metoda
miareczkowania, wykorzystująca mianowane roztwory
bromianu(V) potasu, który w środowisku kwaśnym
ulega redukcji do bromków, reagujących dalej z
bromianem(V) do wydzielenia bromu. Za jej pomocą
oznaczać można zarówno reduktory (np. arsen(III)),
jak i - pośrednio - utleniacze (np. nadtlenki).
Najczęściej stosowanym wskaźnikiem jest oranż
metylowy.
Redoksymetria

Chromianometria
Chromianometria - metoda miareczkowania
wykorzystująca mianowane roztwory dichromianu(VI)
potasu (Cr(VI)), który w środowisku kwaśnym ulega
redukcji do Cr(III).
W chromianometrii prowadzi się bezpośrednie
oznaczenia Fe(II), innych metali, hydrochinonu oraz
oznaczenia pośrednie (np. nadtlenki, chlorany(V)),
wykorzystując do tego celu sól Mohra.
Najczęściej stosowanymi wskaźnikami w
chromianometrii są difenyloamina i kwas
difenyloaminosulfonowy.
Redoksymetria

Jodometria
Jodometria, metoda miareczkowania wykorzystująca mianowane
roztwory jodu (do oznaczania reduktorów) lub tiosiarczanu (do
oznaczania utleniaczy).
Z roztworu utleniaczy, do którego dodaje się znaną ilość jodku
potasu KI, wydzielana jest równoważna ilość jodu,
odmiareczkowywana następnie za pomocą roztworu tiosiarczanu
(2S2O32- + I2 › S4O62- + 2I-).
Za pomocą jodometrii oznaczać można bromiany(V) (sole kwasu
bromowego HBrO3), jodany(VII), dichromiany(VI),
manganiany(VII), nadtlenek wodoru, cer (IV), miedź (II), żelazo (III)
oraz nadtlenki organiczne.
Najczęściej stosowanymi wskaźnikami są skrobia i chloroform,
które pod wpływem jodu zabarwiają się na - odpowiednio -
niebiesko i fioletowo.
Redoksymetria

Podział w zależności od sposobu
prowadzenia oznaczenia
miareczkowego
Redoksymetria

Miareczkowanie
bezpośrednie
Miareczkowanie bezpośrednie:
polega na wykorzystaniu do miareczkowania
tylko 1 roztworu titranta, który
bezpośrednio reaguje z substancją
oznaczaną.
Redoksymetria

Miareczkowanie pośrednie
Miareczkowanie pośrednie: podczas miareczkowania
oznaczana substancja nie reaguje w sposób bezpośredni z
roztworem miareczkującym a np. z inną substancją, którą się
miareczkuje. Metodę ta możemy podzielić na :
• MIARECZKOWANIE ODWROTNE :
wymaga przygotowania 2
roztowów mianowanych.
Najpierw dodajemy w nadmiarze
roztwór substancji reagującej z
substancją oznaczaną, a w
dalszej kolejności nadmiar
miareczkuje się drugim
roztworem mianowanym.
MIARECZKOWANIE PODSTAWIENIOWE
( SUBSTYTUCYJNE ) :
nie miareczkuje się oznaczonego
składnika, ale jego podstawnik, który
może być produktem reakcji
oznaczanego składnika z
odpowiednim odczynnikiem.
Redoksymetri
a

Podział według wyznaczania
punktu końcowego
Redoksymetri
a

Metody wizualne
Metody wizualne:
wyraźnie zauważalna zmiana barwy
roztworu w wyniku zmiany barwy
wskaźnika, utworzenia barwnego
produktu przez nadmiar titrantu,
bądź pojawienia się nadmiaru
barwnego titr anta.
Redoksymetri
a

Metody instrumentalne
Metody instrumentalne :
polegaja na pomiarze zmian
właściwości fizycznych lub
fizykochemicznych roztworu ( np.
miareczkowanie
potencjometryczne,
konduktometryczne,
spektrofotometryczne ).
Redoksymetri
a

DZIĘKUJEMY ZA UWAGĘ !
:)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
Wyszukiwarka
Podobne podstrony:
ANALIZA MIARECZKOWA
Cw1 Analiza miareczkowa
ANALIZA MIARECZKOWA, Farmacja studium 2 letnie, I II semestr, analiza
CHEMIA ANALIZA MIARECZKOWA, PWR, chemia
Analiza Miareczkowa 1
Ćwiczenia z analizy miareczkowej 1
ANALIZA MIARECZKOWA. ALKACYMERIA, Biochemia, Biochemia
Ćwiczenia z analizy miareczkowej
podstawy analizy miareczkowej
ANALIZA MIARECZKOWA
analiza miareczkowa2012
Analiza miareczkowa jest metodą ilościowego oznaczania substancji, Studia, Ogólne, Fiyzka, od romka,
Analiza miareczkowa, kompleksom Nieznany
ANALIZA MIARECZKOWA
sprawozdanie analiza miareczkowa 3
Cw1 Analiza miareczkowa
sprawozdanie analiza miareczkowa 2
więcej podobnych podstron