
Analiza Miareczkowa
Analiza miareczkowa jest metodą ilościowego
oznaczania substancji.
Polega na stopniowym dodawaniu równoważnej
chemicznie ilości roztworu mianowanego do
roztworu oznaczanej substancji.
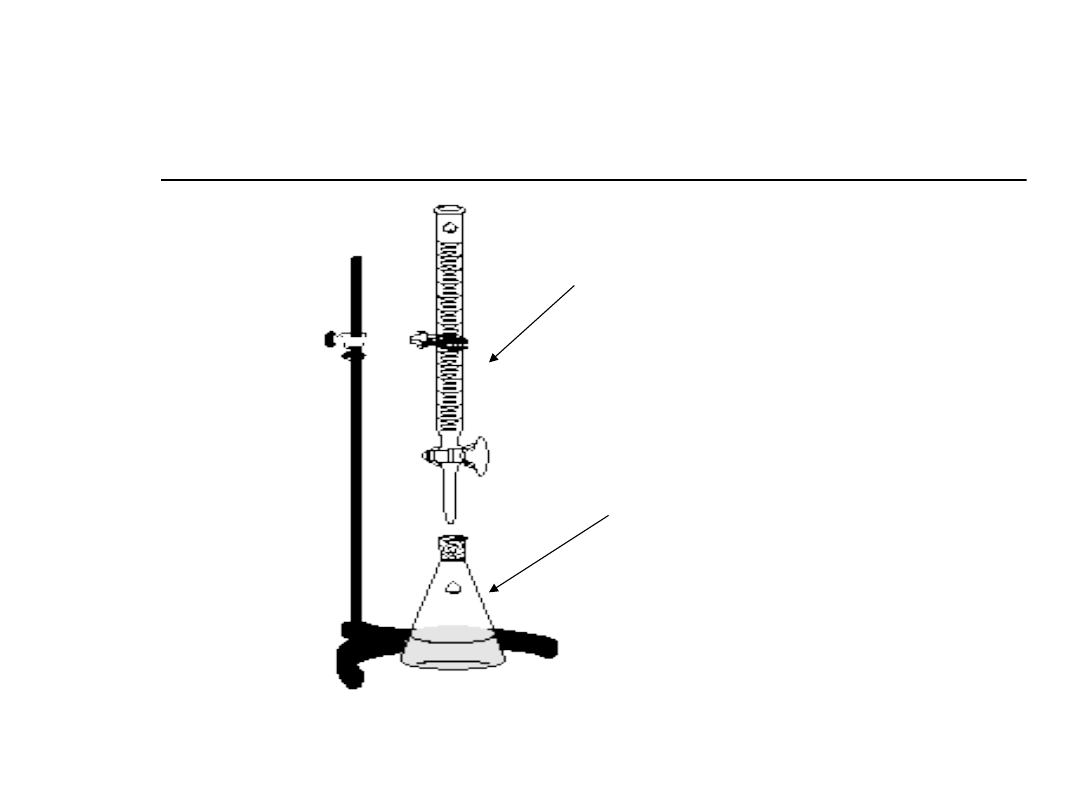
Titrant
(roztwór o ściśle
określonym
stężeniu, mianie)
Roztwór analizowany,
wskaźnik
Zestaw do miareczkowania
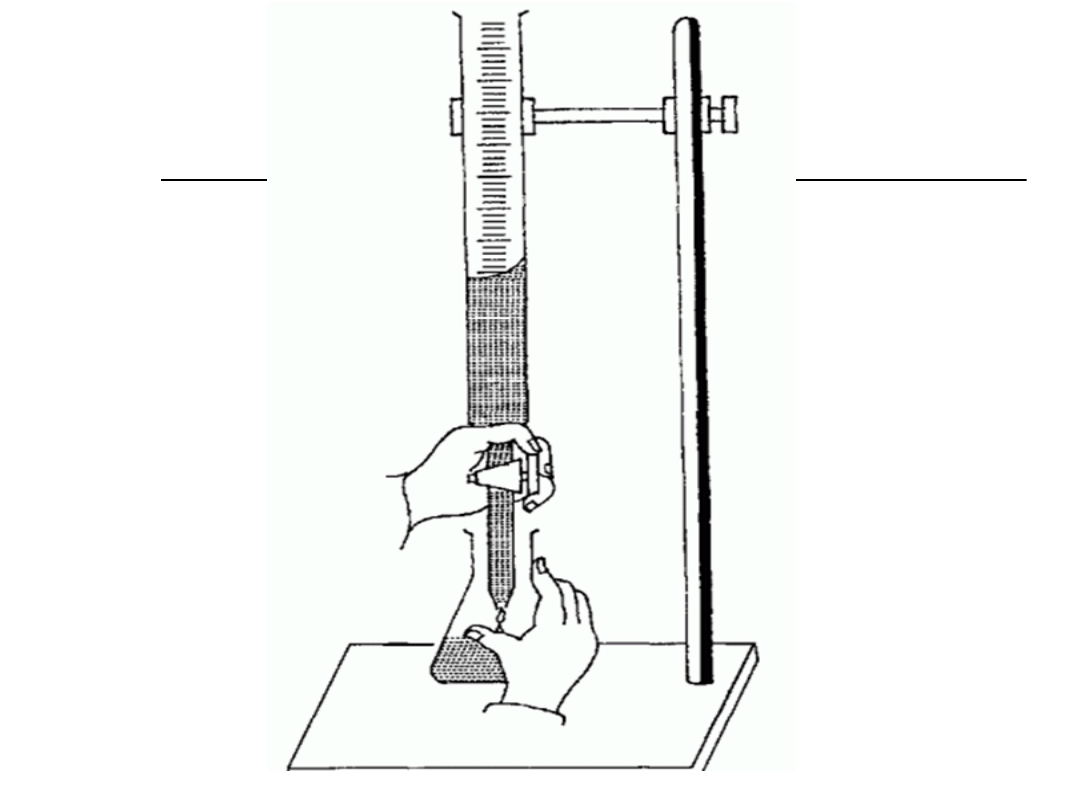
Biurety automatyczne
Zestawy do miareczkowania
(Titratory)

Definicja titranta, miana
roztworu
Roztwór mianowany, zwany titrantem jest to roztwór
odczynnika o znanym dokładnym stężeniu (mol/l)
lub mianie.
Miano to stosunek masy substancji oznaczanej
(miareczkowanej) w gramach do objętości titranta
w mililitrach potrzebnej do zmiareczkowania tej
masy.
T =m/V [g/ml] [mg/ml]

Punkt równoważnikowy
Punkt równoważnikowy (PR) jest to moment, w
którym cały oznaczany związek przereagował
stechiometrycznie z roztworem mianowanym, a
zmierzona w tym punkcie objętość zużytego
titranta umożliwia obliczenie zawartości
oznaczanej substancji.
Rozpoznanie punktu równoważnikowego odbywa się
metodami wizualnymi (wprowadza się tzw.
wskaźnik, który w momencie zakończenia
reakcji zmienia barwę)
metodami instrumentalnymi

Metody wizualne (PK≠PR)
Moment zmiany barwy wskaźnika nazywany
jest punktem końcowym
miareczkowania (PK) i powinien być
równy punktowi równoważnikowemu.
W praktyce jednak można obserwować
między nimi pewną niezgodność.
Różnica pomiędzy punktem
równoważnikowym i punktem końcowym
stanowi tzw. błąd miareczkowania.

Metody instrumentalne
Identyfikację punktu równoważnikowego
przeprowadza się metodami
optycznymi (kolorymetria, turbidymetria,
nefelometria)
instrumentalnymi, np. mierząc zmiany
potencjału elektrody (miareczkowanie po-
tencjometryczne) lub przewodności
roztworu (miareczkowanie
konduktometryczne)

Cechy reakcji wykorzystywanych
w analizie miareczkowej
Reakcja powinna przebiegać bardzo
szybko i nieodwracalnie
Reakcja powinna przebiegać
stechiometrycznie, zgodnie z równaniem
Powinna istnieć możliwość dokładnego
ustalenia punktu równoważnikowego
Związki chemiczne, biorące udział w
reakcji powinny być dostatecznie trwałe
Titrant nie może wchodzić w reakcje z
innymi składnikami roztworu.
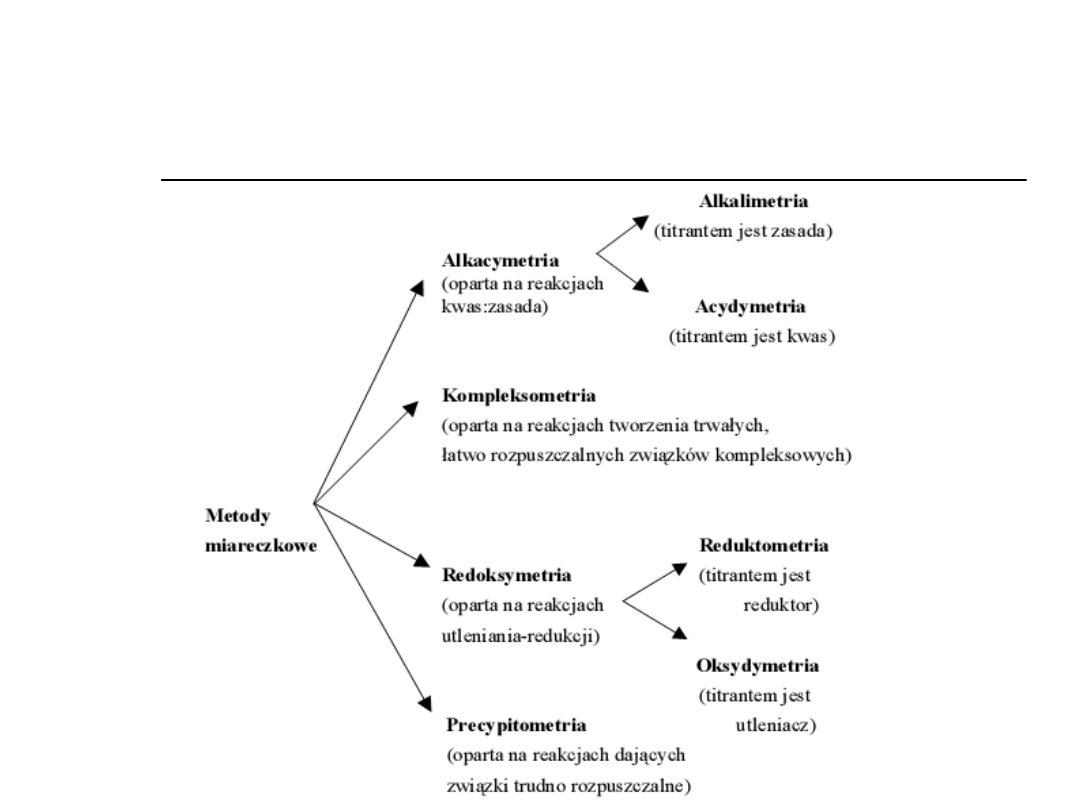
Podział metod miareczkowych
zależnie od rodzaju titranta i typu
reakcji.

Redoksymetria
Jodometria jest metodą miareczkową obejmującą
miareczkowanie:
-oksydymetryczne( roztworem jodu lub KIO
3
oraz
-reduktometryczne (miareczkowanie roztworem Na
2
S
2
O
3
).

Precypitometria
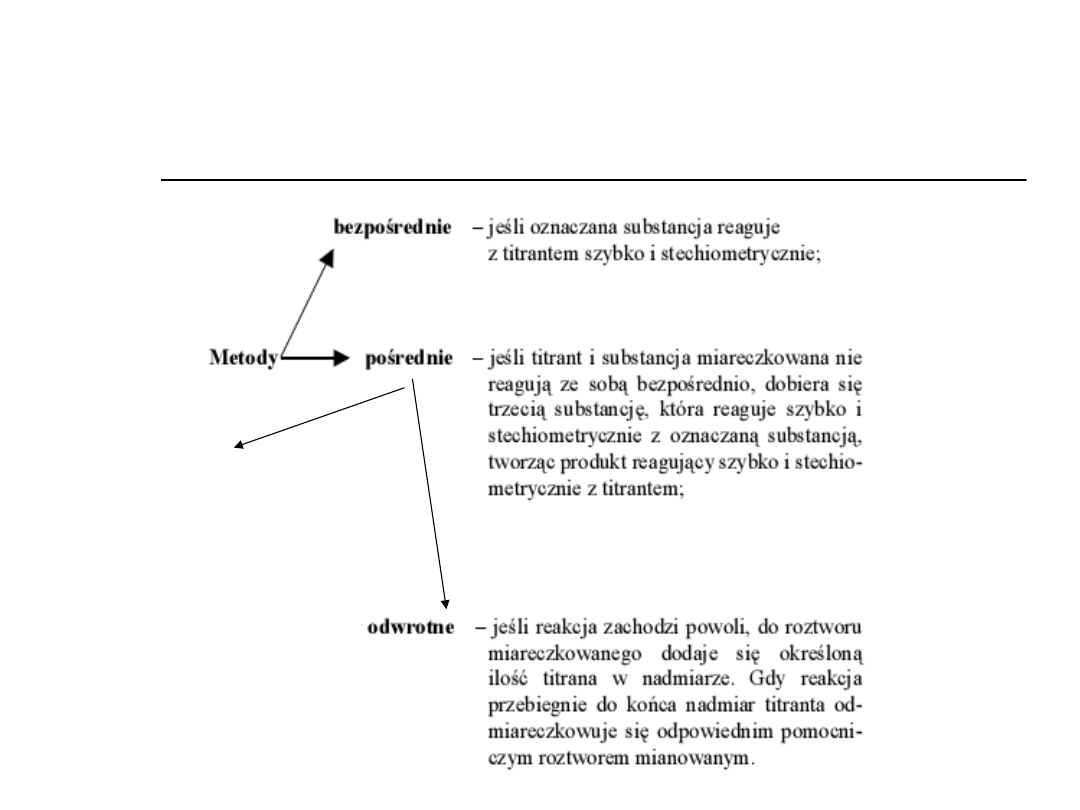
Klasyfikacja metod miareczkowych
według sposobu prowadzenia
miareczkowania
Podstawieniowe
(substytucyjne)-jeśli
miareczkujemy podstawnik jako
produkt reakcji oznaczanej
substancji z odpowiednim
odczynnikiem

Alkacymetria
Alkacymetria obejmuje metody oznaczania stężeń
kwasów, zasad, a także soli mocnych kwasów i
słabych zasad oraz soli mocnych zasad i słabych
kwasów.
Detekcja punktu końcowego odbywa się metodami
instrumentalnymi (np. potencjometrycznie) lub
wizualnymi. Wskaźnikami w alkacymetrii są słabe
kwasy lub zasady organiczne, których formy
zdysocjowane i niezdysocjowane różnią się
zabarwieniem.

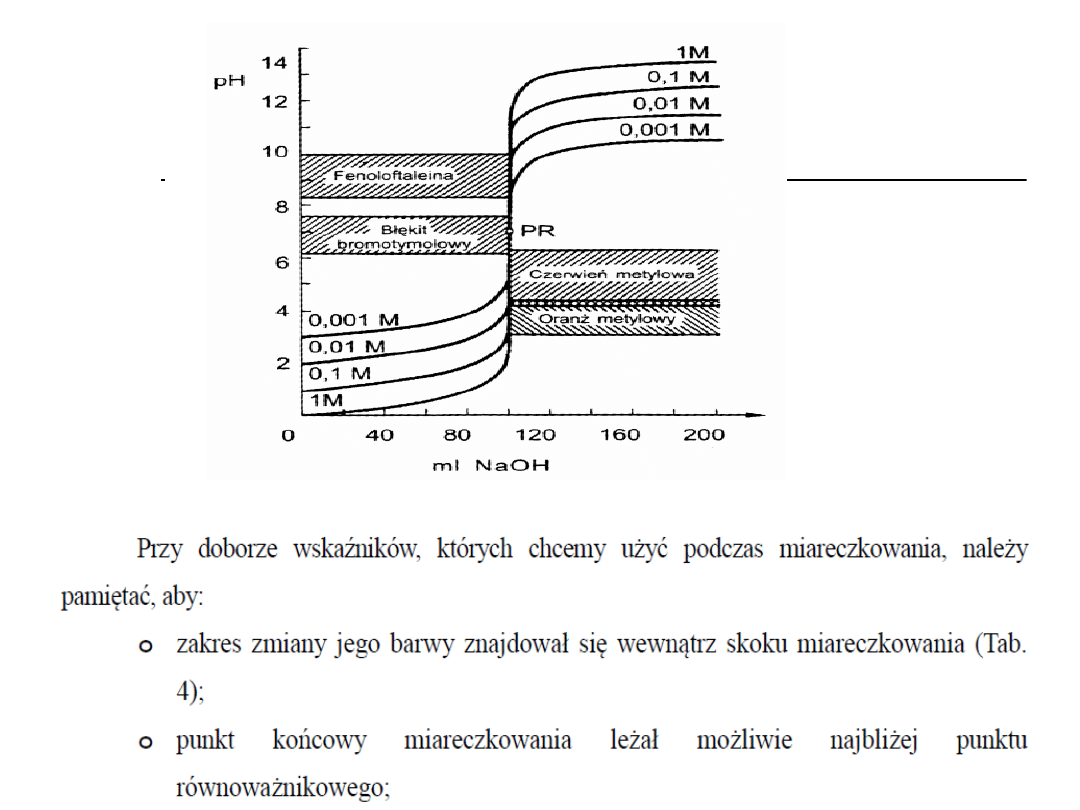
Wskaźniki alkacymetryczne
Jednobarwne (fenoloftaleina,
tymoloftaleina)
Dwubarwne (oranż metylowy,
czerwień metylowa)
Wielobarwne (błękit tymolowy)
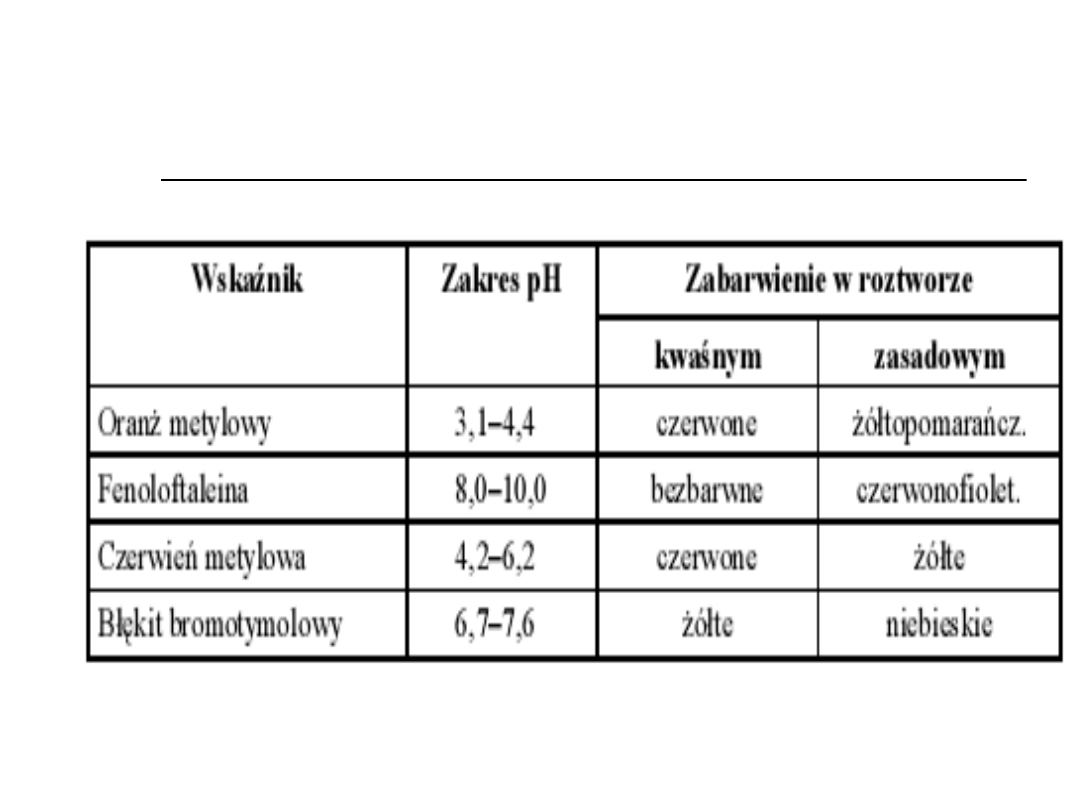
Przykłady wskaźników
stosowanych w alkacymetrii
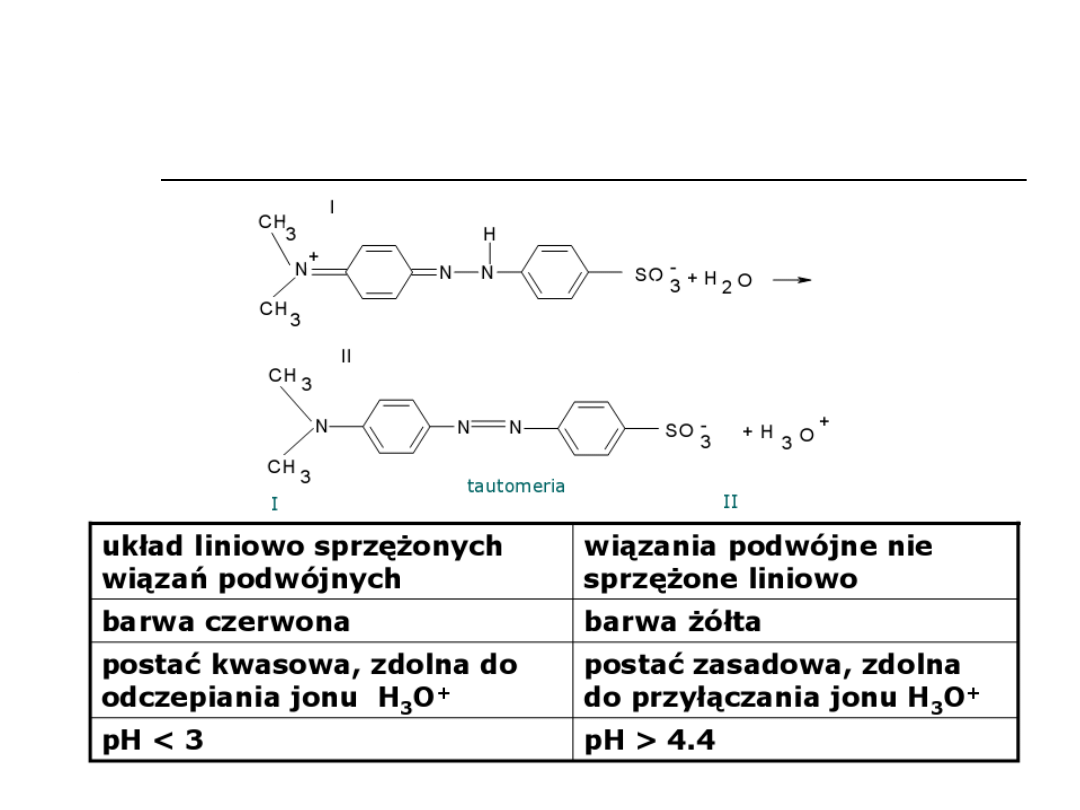
Oranż metylowy (dwubarwny)
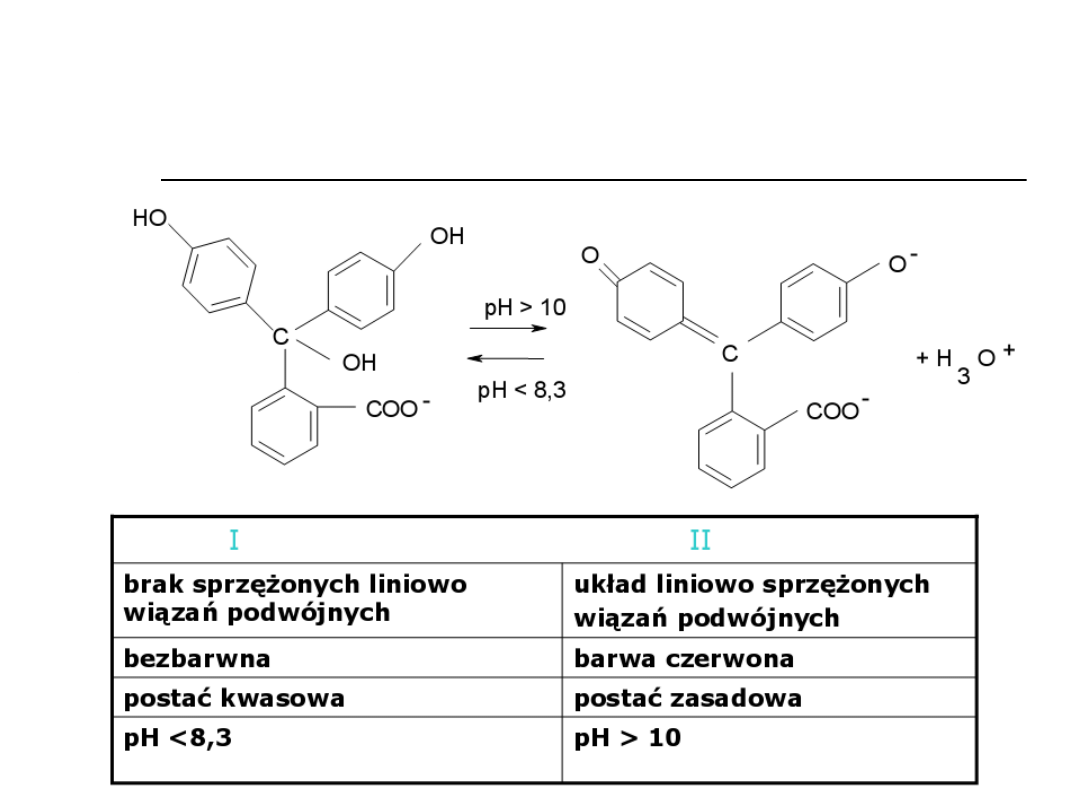
Fenoloftaleina (jednobarwna)
Wskaźniki alkacymetryczne

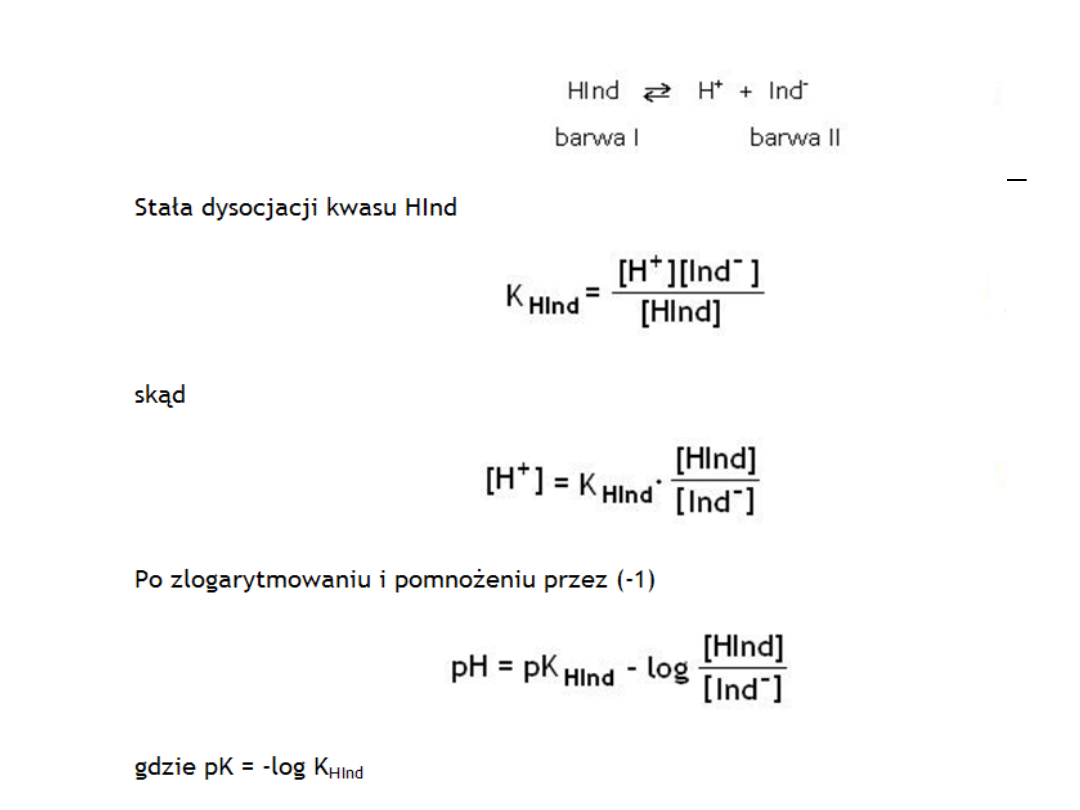
Zakres zmiany barwy wskaźnika
dwubarwnego
pH = pK
HInd
+ log [Ind
-
] / [HInd]
[Ind
-
] / [HInd] =1 to
log [Ind
-
] / [HInd]=0, a pH=pK
a
[Ind
-
] / [HInd] < 0.1 czyli
pH = pK
HInd
+ log 10
-1
pH = pK
HInd
-1
[Ind
-
] / [HInd] > 10
pH = pK
HInd
+ log 10
1
pH = pK
HInd
+1
pH = pK
HInd
±1

Wskaźniki jednobarwne

Roztwory mianowane w
alkacymetrii (HCl, NaOH)
Przygotowanie roztworów mianowanych
Roztwór mianowany przyrządza się rozpuszczając w
wodzie ściśle określoną ilość substancji stanowiącej
titrant, po czym roztwór dopełnia się wodą do
właściwej objętości. Ponieważ większość substancji
chemicznych nie jest doskonale czysta, miano tak
sporządzonego roztworu powinno być nastawione
według tzw. substancji podstawowych
Mianowanie odbywa się metodą miareczkową poprzez
miareczkowanie
1.Odważek substancji wzorcowych
2.Miareczkowanie roztworów wzorcowych
Roztwór mianowany oraz roztwór którego miano
wyznaczamy powinien być zawsze w biurecie‼

Cechy substancji wzorcowych
Ściśle określony wzór chemiczny. Jeśli zawierają
wodę krystalizacyjną to należy ją uwzględnić.
Korzystniejsze są substancje bezwodne.
Są to substancje stałe, o wysokim stopniu
czystości,
trwałe,
Łatwo rozpuszczalne,
niehigroskopijne
reagujące stechiometrycznie z titrantem,
Łatwe do otrzymania, oczyszczania,
przechowywania,
Możliwie dużą masę molową.

Mianowanie kwasu solnego
Weglan sodu (Na
2
CO
3
)
Tetraboran disodu (Na
2
B
4
O
7
)
Szczawian disodu (Na
2
C
2
O
4
)
Wodorowęglan potasu (KHCO
3
)
Tetraboran dipotasu (K
2
B
4
O
7
x 4H
2
O)
Tlenek rtęci (HgO)
HgO +4KI+H2O=K
2
HgI
4
+ 2KOH
KOH+HCl=KCl + H2O
jodometrycznie

Mianowanie NaOH
HCl
Wodoroftalan potasuC
6
H
4
(COOH)
(COOK)
Kwas szczawiowy (COOH)
2
x 2H
2
O
Kwas benzoesowy C
6
H
5
COOH
Wodorojodan potasu KH(JO
3
)
2
Siarczan hydrazyny N
2
H
4
xH
2
SO
4

Trwałość roztworów
mianowanych
NaOH jest nietrwały. Miano zmienia
się pod wpływem:
Rozpuszczania szkła
Pochłaniania CO
2

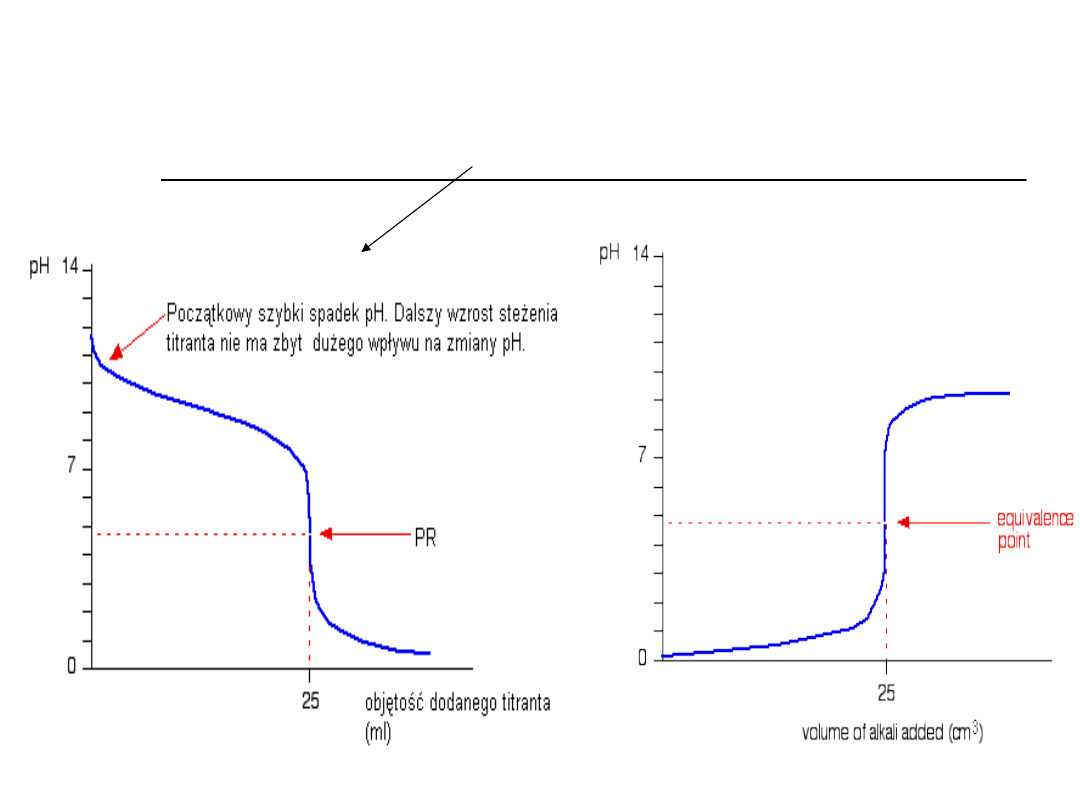
Krzywa miareczkowania
Graficznym przedstawieniem zmian zachodzących
w trakcie miareczkowania jest tzw. krzywa
miareczkowania, odzwierciedlająca zależność
pH roztworu od objętości dodanego titrantu
wyrażonej w mililitrach.
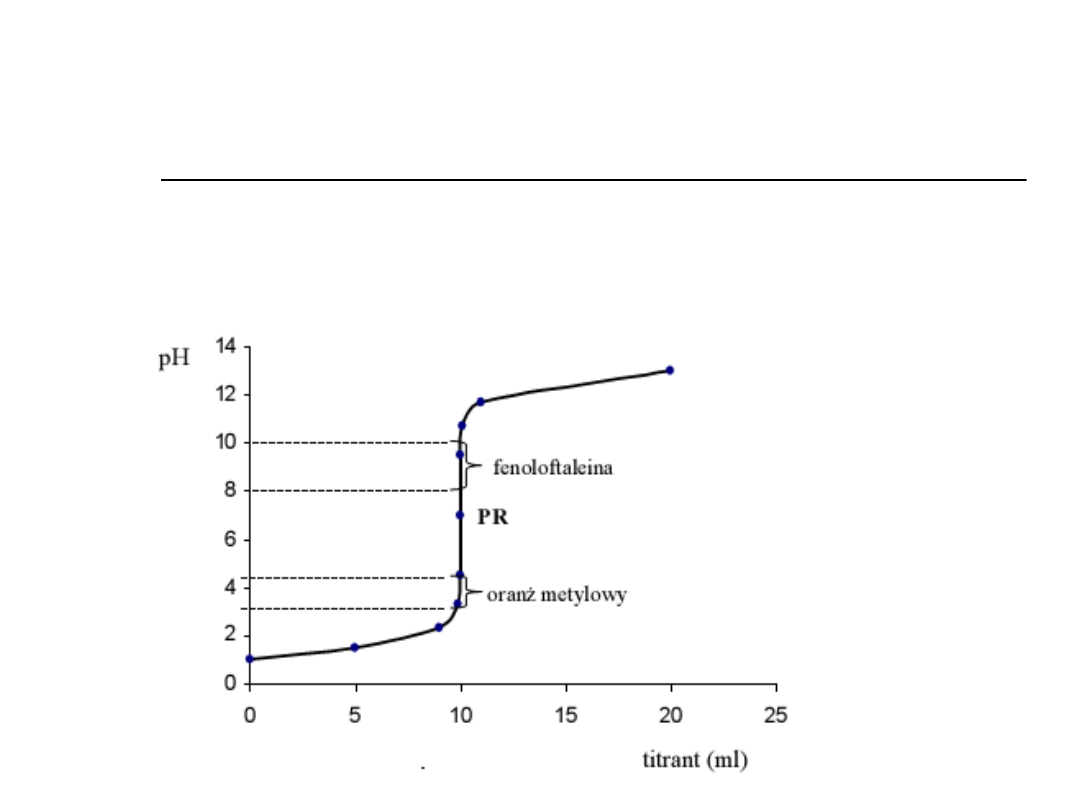
1.Mocny kwas-mocna zasada
np.10 ml roztworu HCl o stężeniu 0,1 mol/l
mianowanym roztworem NaOH o stężeniu 0,1 mol/l.
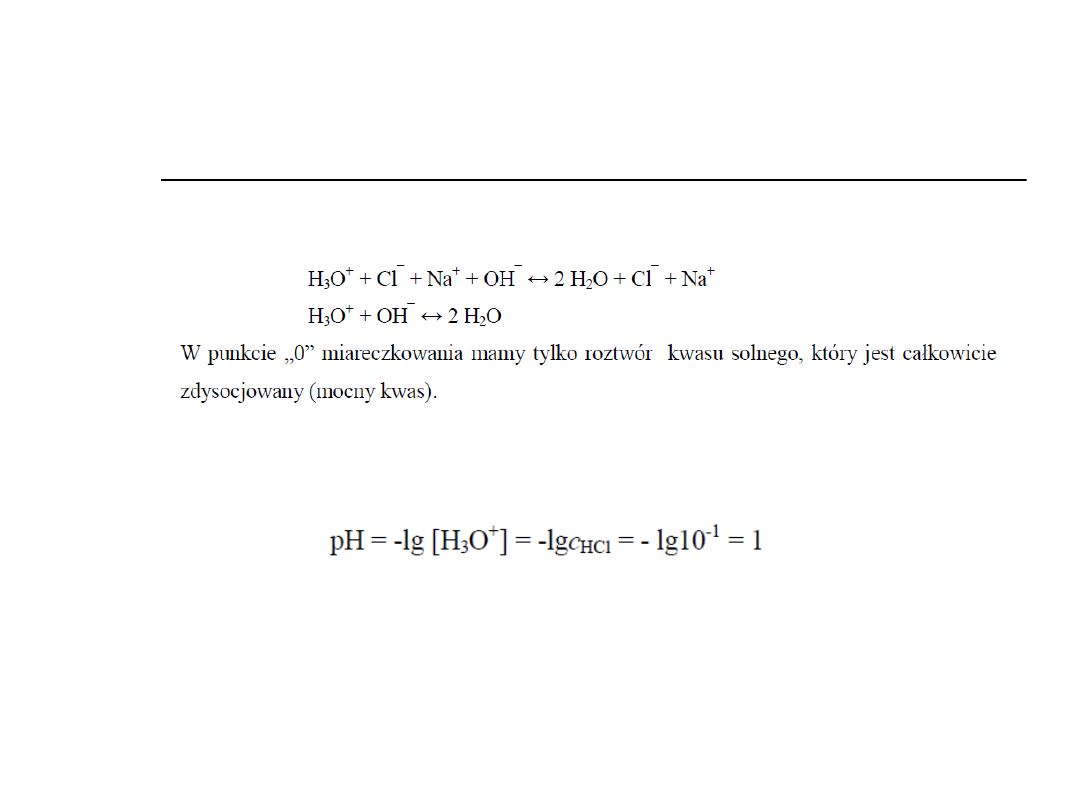
Punkt zero
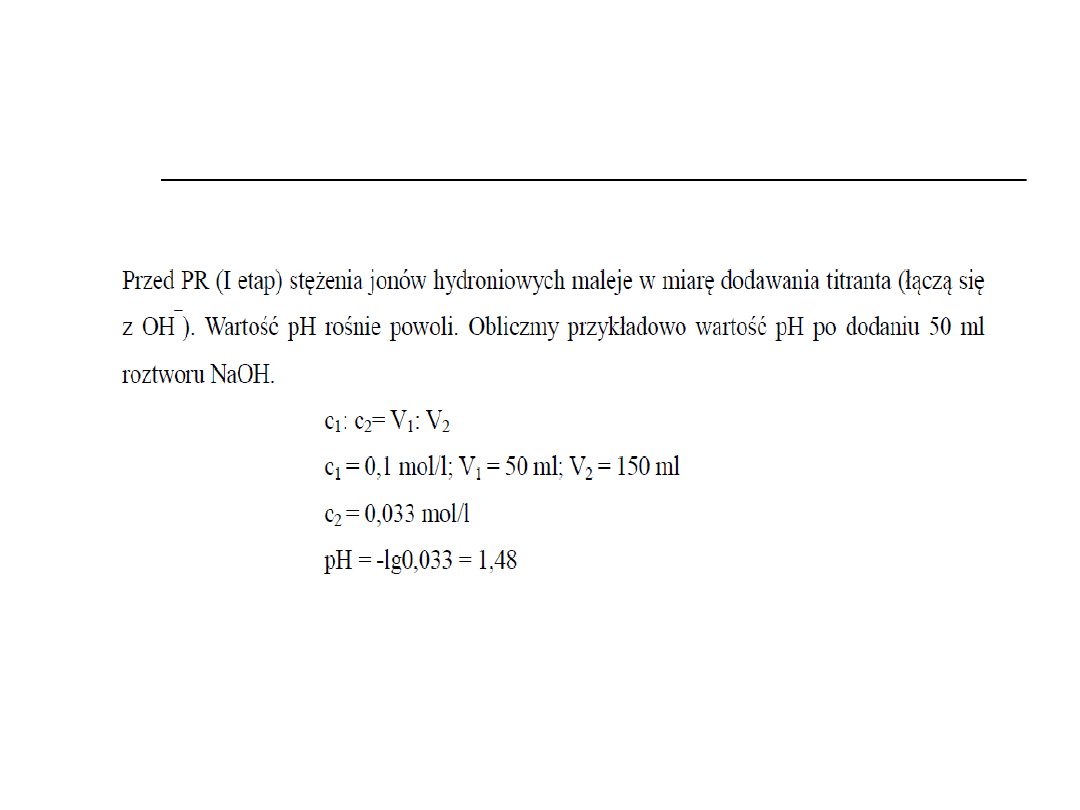
Przed punktem
równoważnikowym
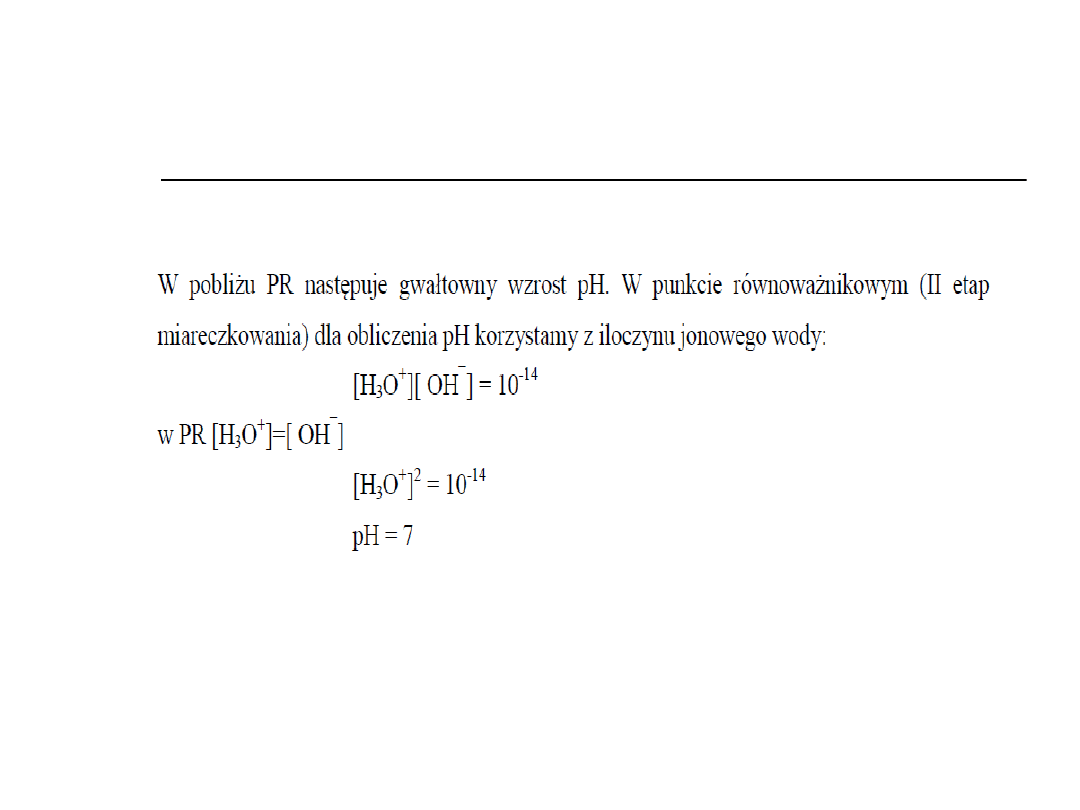
W punkcie równoważnikowym

Po punkcie równoważnikowym
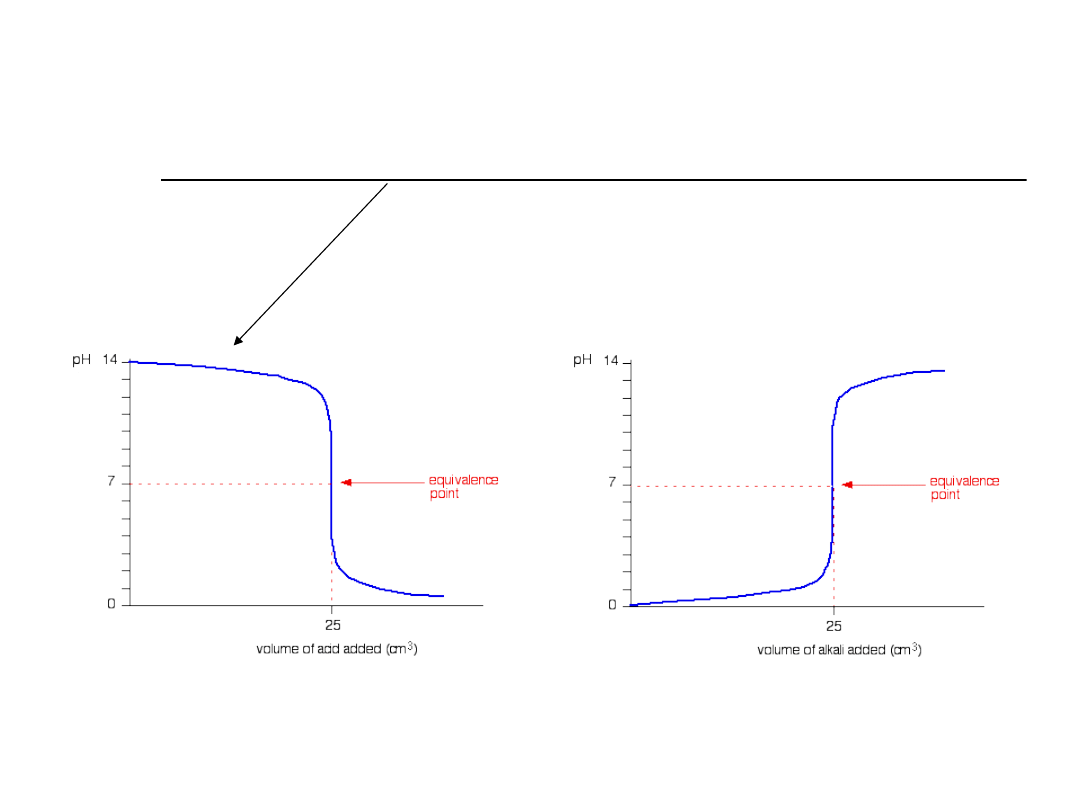
NaOH + HCl → NaCl + H
2
O
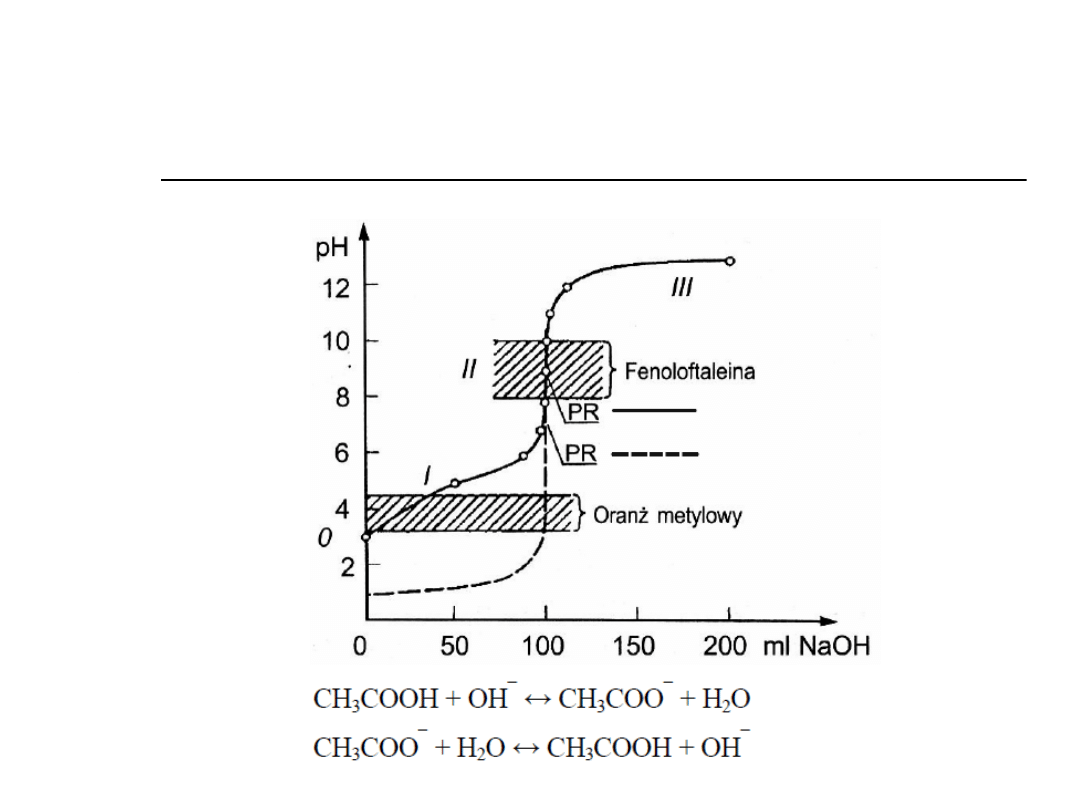
Słaby kwas-mocna zasada
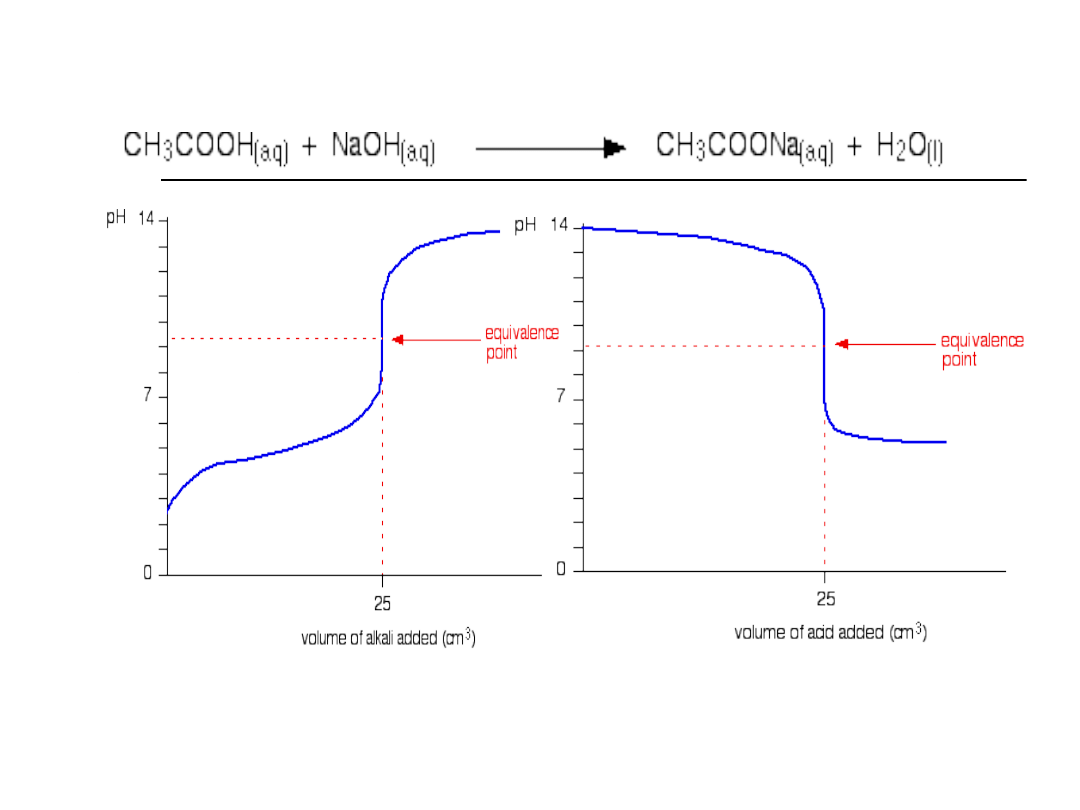
3. Słaby kwas –mocna zasada

Kwas octowy-zasada sodowa
Etap 0
Kwas octowy
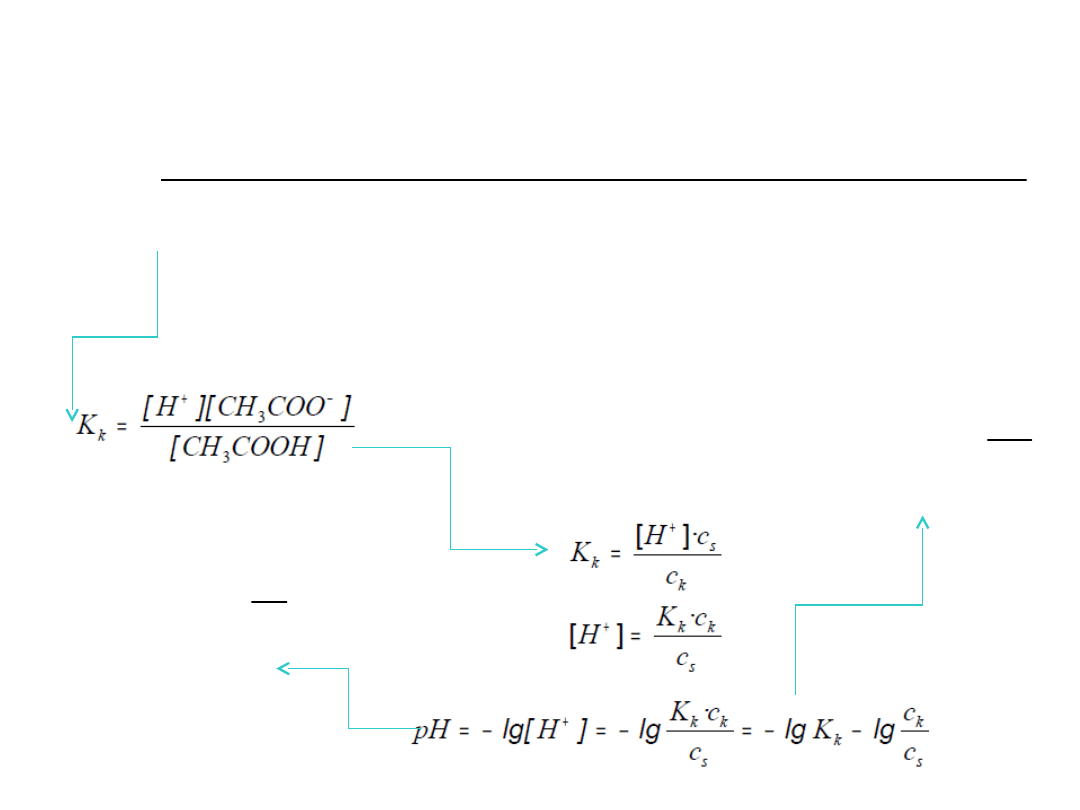
Etap I (bufor octanowy)
H
COO
CH
COOH
CH
3
3
Na
COO
CH
COONa
CH
3
3
s
k
c
c
p
pK
pH
k
s
c
c
pK
pH
log
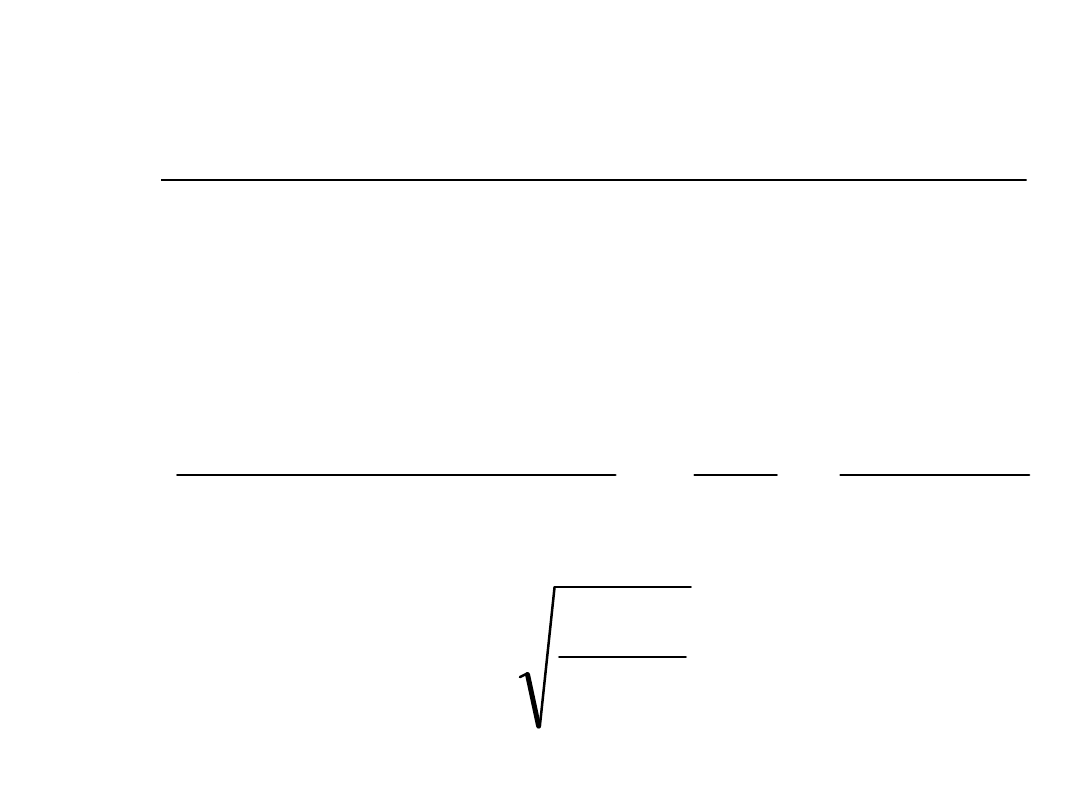
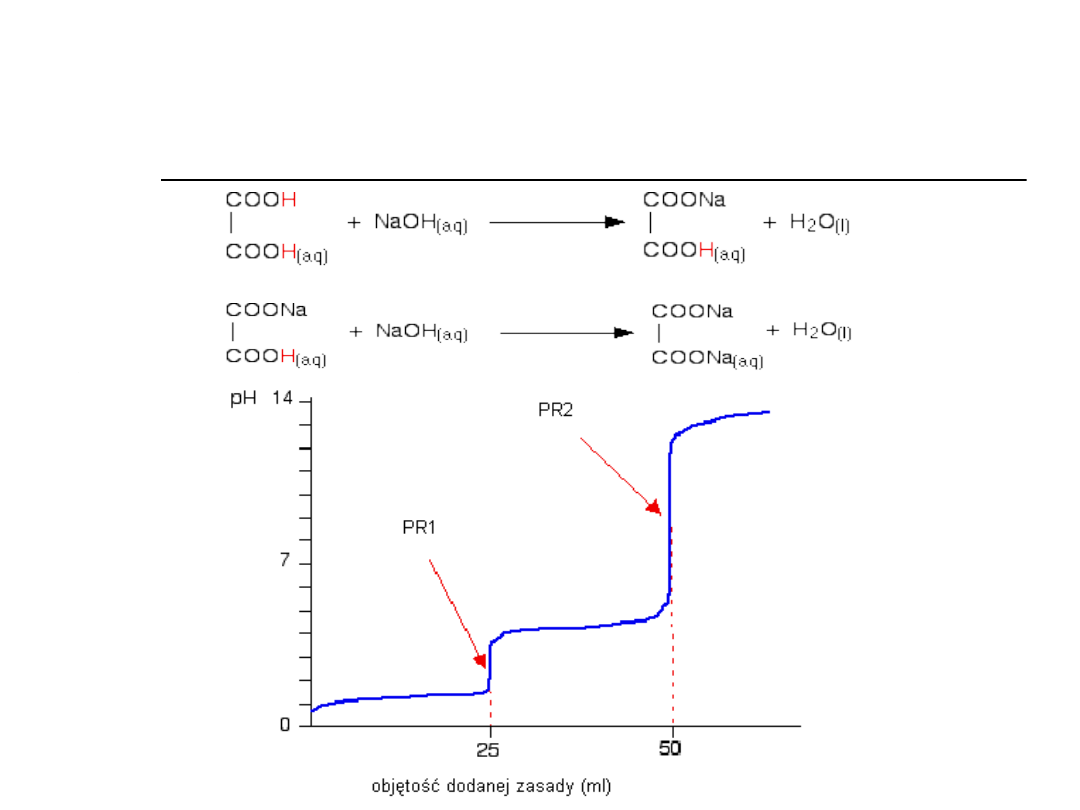
Punkt równoważnikowy (sól
słabego kwasu mocnej zasady)
Na
COO
CH
COONa
CH
3
3
OH
COOH
CH
O
H
COO
CH
3
2
3
]
[
]
][
[
3
3
COO
CH
OH
COOH
CH
K
H
s
k
w
c
OH
K
K
2
]
[
k
w
s
K
K
c
OH
]
[
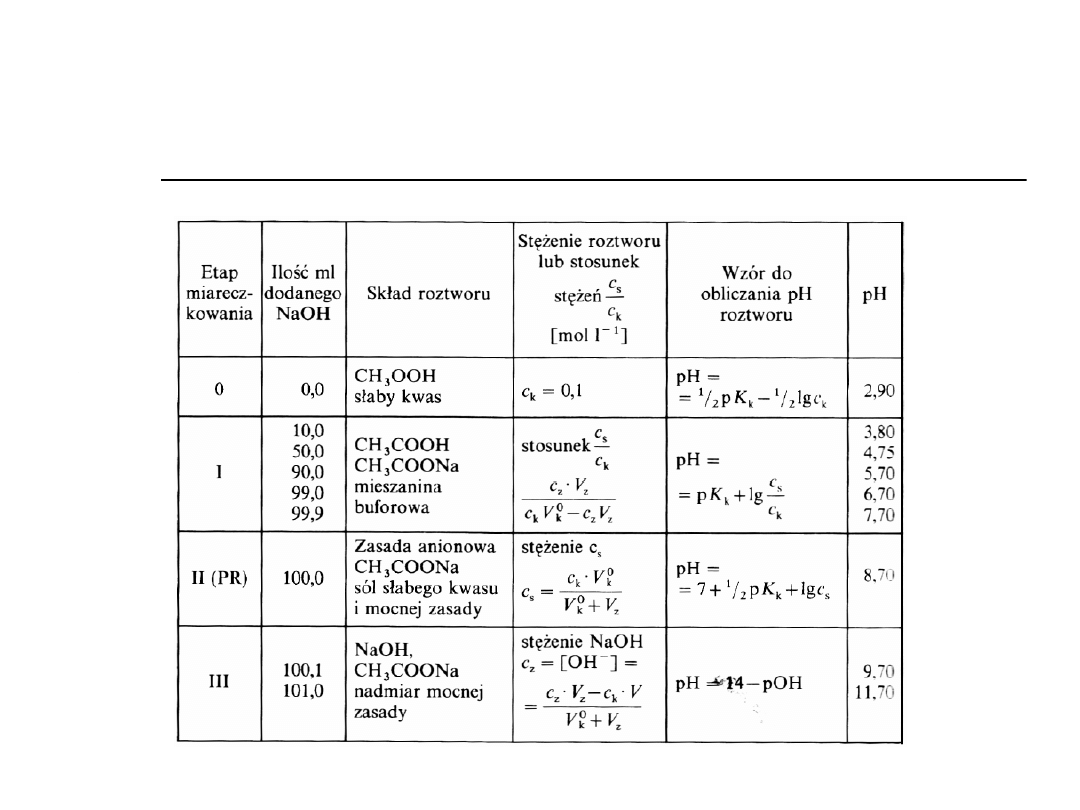
Obliczanie pH na krzywej
miareczkowania
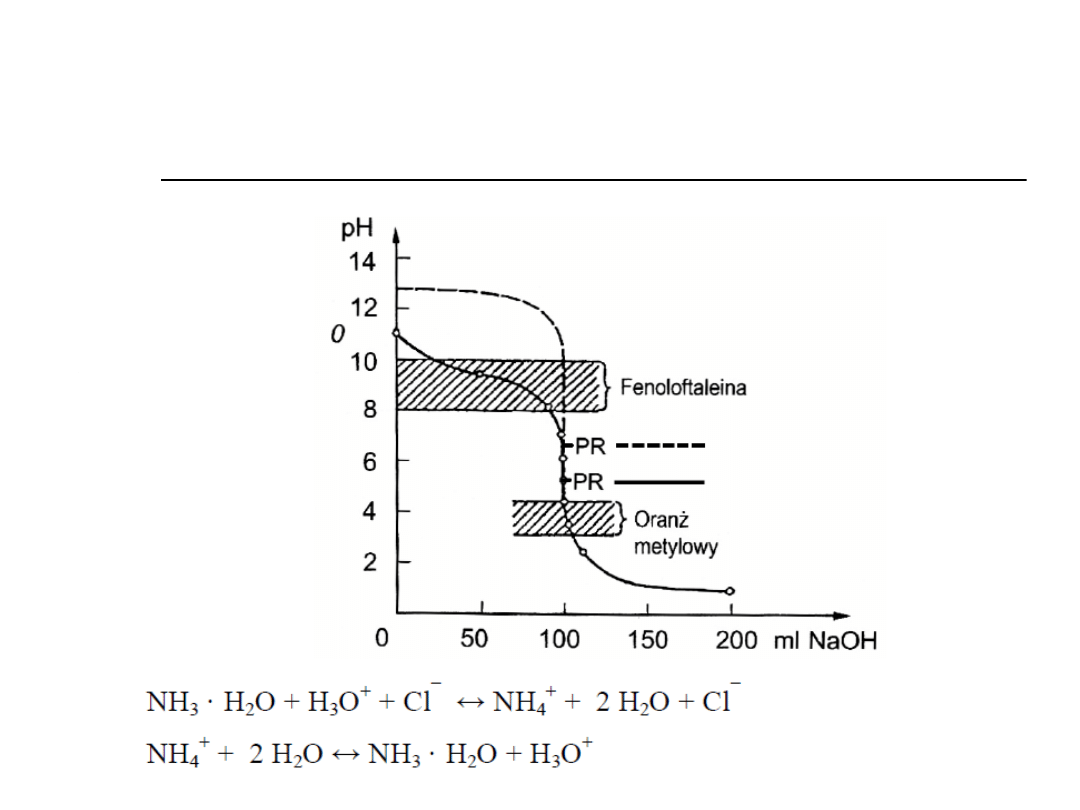
Słaba zasada-mocny kwas
2. Miareczkowanie słabej zasady
mocnym kwasem
NH
3
+ HCl → NH
4
Cl
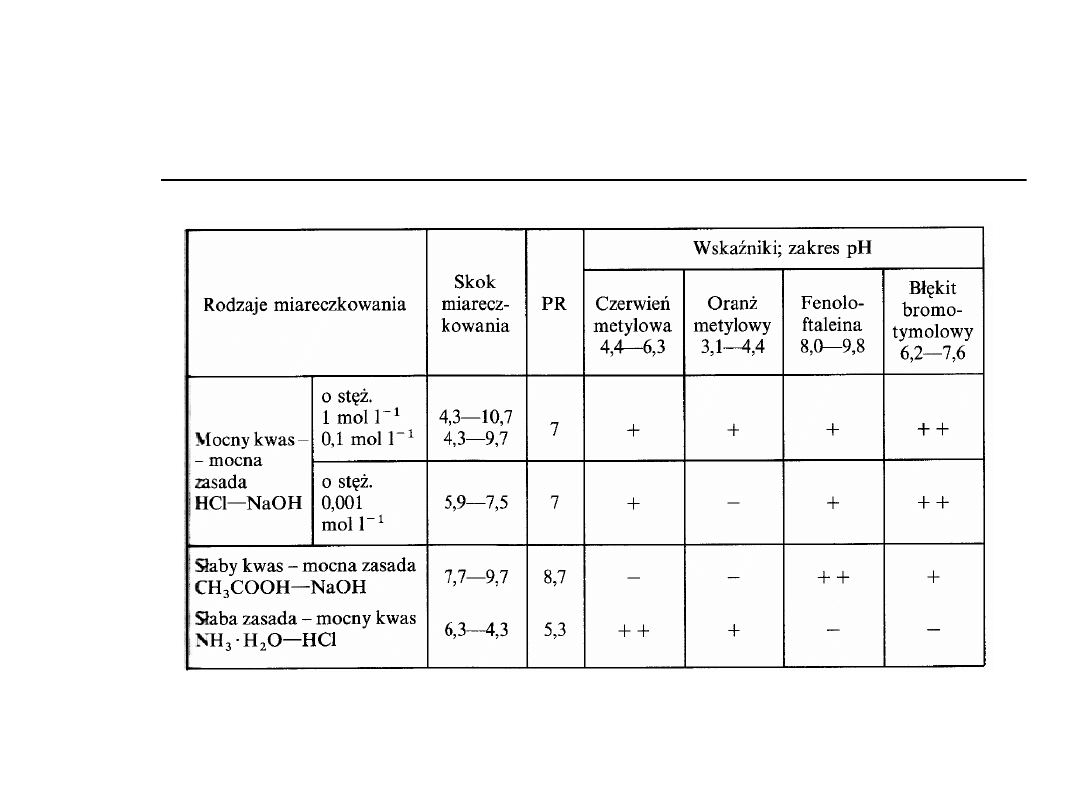
Ogólne zasady doboru
wskaźników
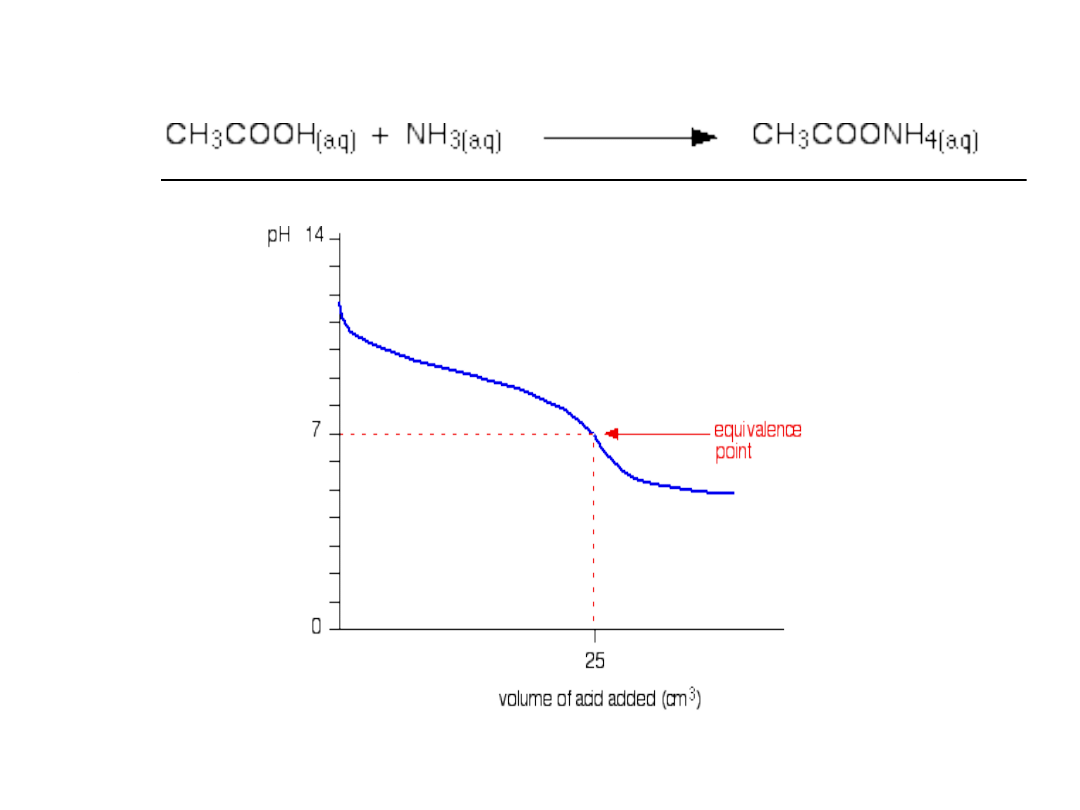
Słaba zasada-słaby kwas
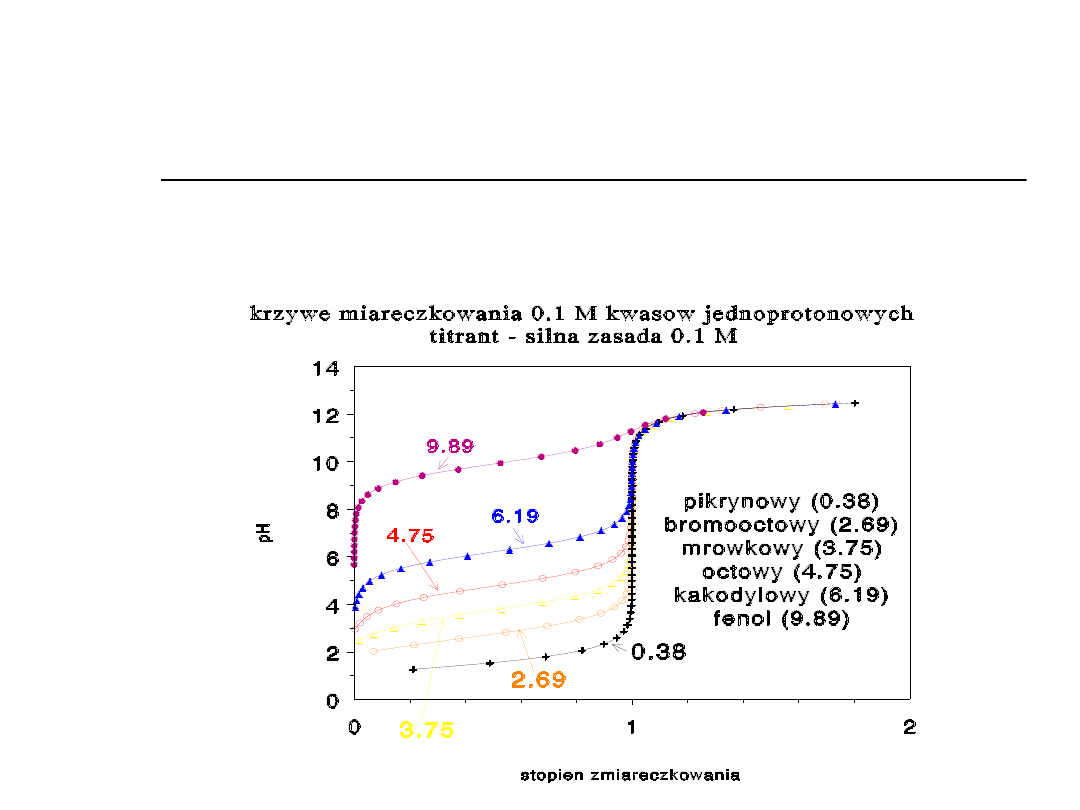
Wielkość skoku
miareczkowania
Stężeń roztworów (im większe stężenia tym większy skok)
Mocy kwasów i zasad K nie mniejsze jak 10
-8
Miareczkowanie zasad
wieloprotonowych
Miareczkowanie wieloprotonowego kwasu
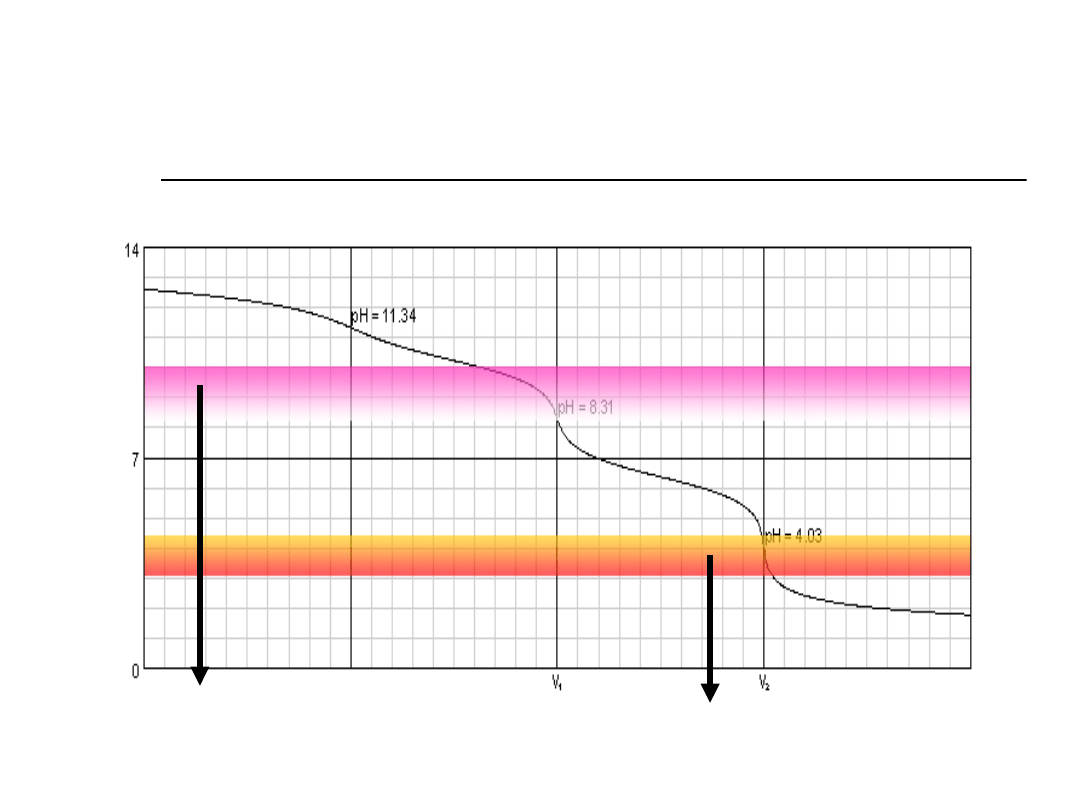
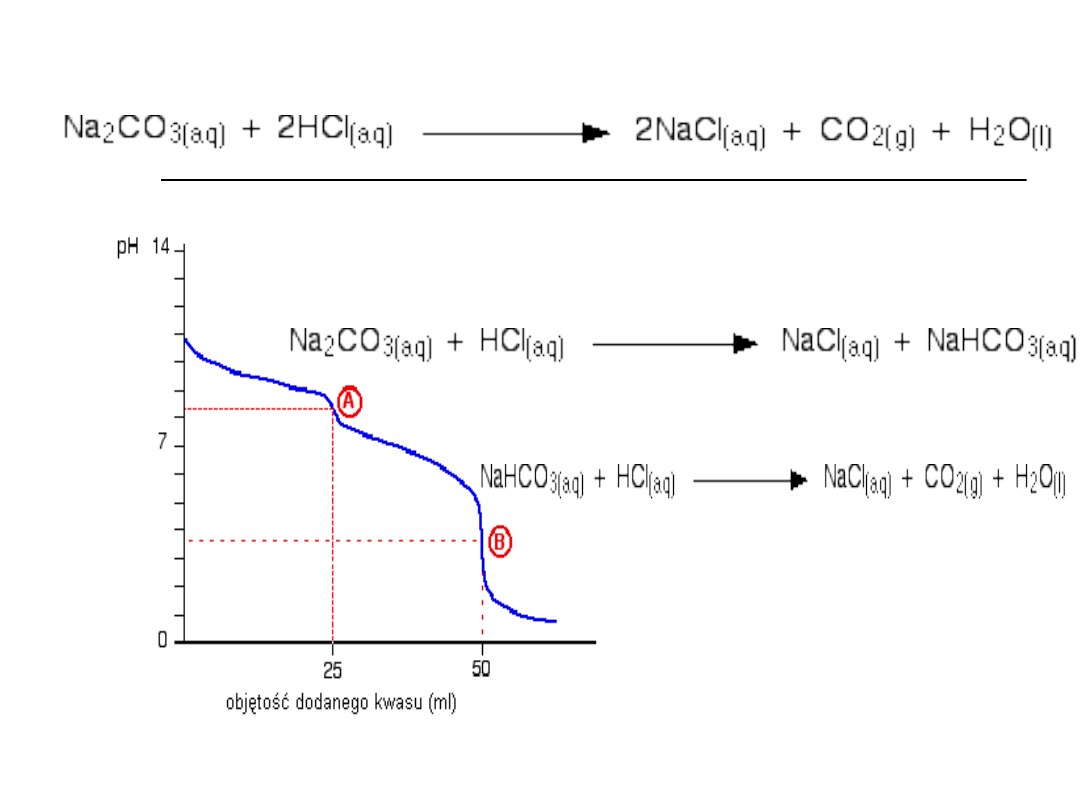
Miareczkowanie NaOH obok
Na
2
CO
3
metodą Wardera.
NaOH + HCl → NaCl + H2O
Na2CO3 + HCl → NaCl + NaHCO3
NaHCO3 + HCl → NaCl + H2O + CO2

Miareczkowanie NaOH obok
Na
2
CO
3
metodą Winklera.
I (fenoloftaleina-do odbarwienia)
BaCl
2
+ CO
3-
→BaCO
3
+ 2 Cl
-
NaOH + HCl→NaCl + H
2
O
II (oranż metylowy-żółta-cebulkowa)
NaOH + HCl→NaCl + H
2
O
Na
2
CO
3
+ HCl→NaCl + CO
2
+ H
2
O
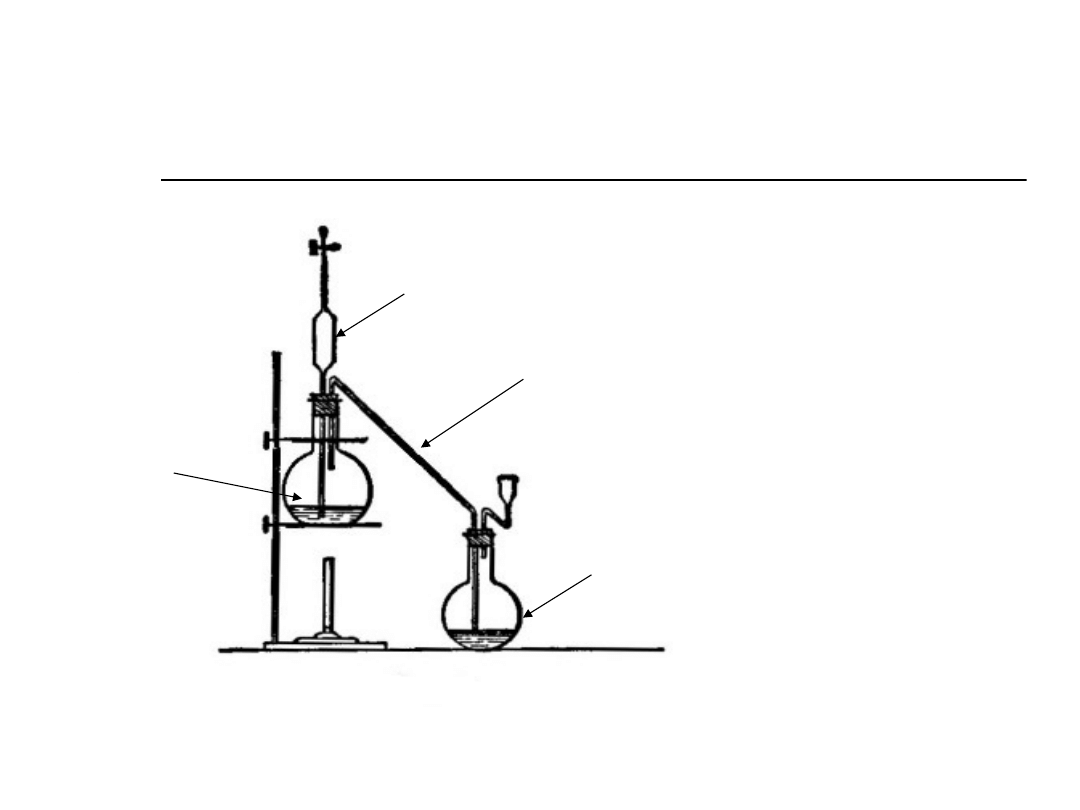
Oznaczanie soli amonowych
metoda destylacyjną
NaOH
NH
4
+
NH
3
HCl
1. NH
4
Cl + NaOH →NH
3
+ NaCl + H
2
O
2. NH
3
+ HCl →NH
4
Cl
3. HCl + NaOH→NaCl + H
2
O
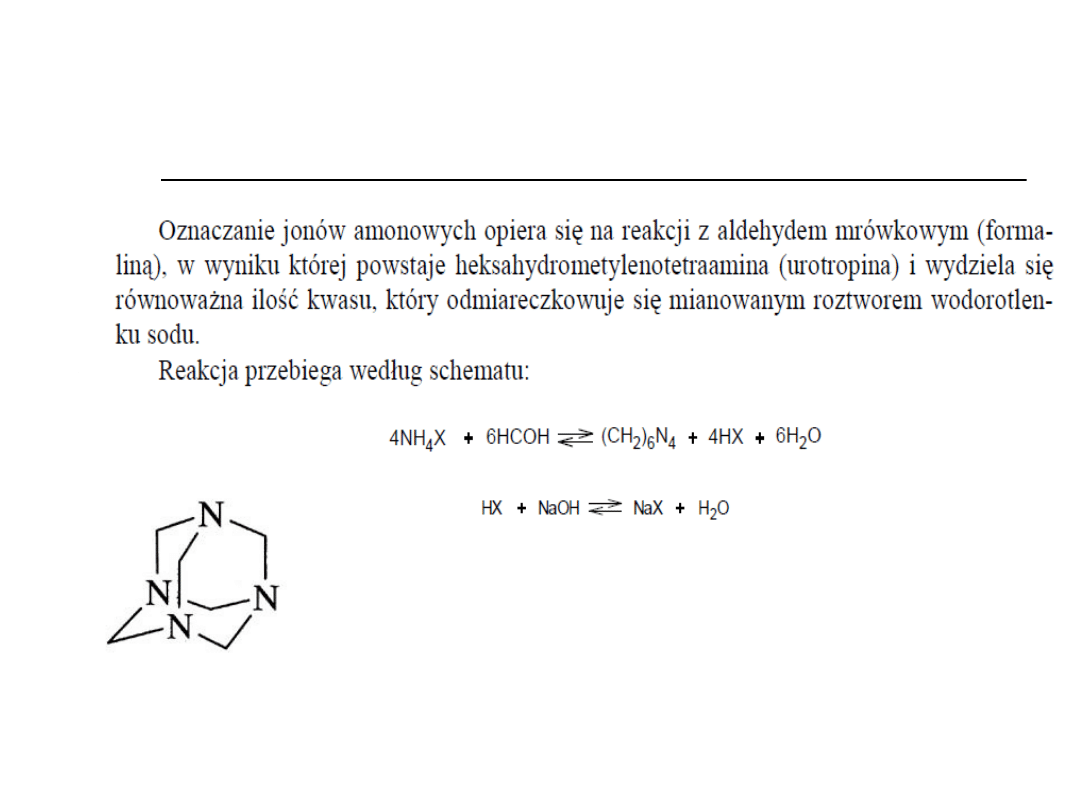
Metoda formalinowa
oznaczania soli amonowych

Oznaczanie twardości węglanowej
wody
Twardość węglanowa (przemijająca) Ze
względu na łatwość usunięcia tego typu twardości
(wystarczy tylko przegotowanie wody), nazywa się
ją twardością przemijającą. Sam kamień
kotłowniczy składający się tylko ze strąconych
węglanów jest łatwy do usunięcia.
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Mg(HCO3)2 → MgCO3 + CO2 + H2O
Oznaczanie poprzez miareczkowanie HCl w
obecności oranżu metylowego.
Podział rozpuszczalników
niewodnych

Rozpuszczalniki aprotolityczne

Rozpuszczalniki protolityczne

Protonofilne (zasadowe,
powinowactwo do protonu)

Miareczkowanie aniliny w
środowisku niewodnym w
obecności fioletu krystalicznego

Zaliczenie alkacymetrii
Teorie kwasów i zasad
Wzory na pH
Krzywe miareczkowania
Nastawianie miana titrantów
Oznaczanie NaOH/Na2CO3 (Wardera, Winklera)
Oznaczanie soli amonowych
Rozpuszczalniki niewodne
Miareczkowanie w środowisku niewodnym
(anilina)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
Wyszukiwarka
Podobne podstrony:
ANALIZA MIARECZKOWA
Cw1 Analiza miareczkowa
ANALIZA MIARECZKOWA, Farmacja studium 2 letnie, I II semestr, analiza
CHEMIA ANALIZA MIARECZKOWA, PWR, chemia
Ćwiczenia z analizy miareczkowej 1
ANALIZA MIARECZKOWA. ALKACYMERIA, Biochemia, Biochemia
Ćwiczenia z analizy miareczkowej
podstawy analizy miareczkowej
ANALIZA MIARECZKOWA
Analiza miareczkowa
analiza miareczkowa2012
Analiza miareczkowa jest metodą ilościowego oznaczania substancji, Studia, Ogólne, Fiyzka, od romka,
Analiza miareczkowa, kompleksom Nieznany
ANALIZA MIARECZKOWA
sprawozdanie analiza miareczkowa 3
Cw1 Analiza miareczkowa
sprawozdanie analiza miareczkowa 2
więcej podobnych podstron