
Materiały pochodzą z Platformy
Edukacyjnej Portalu
www.szkolnictwo.pl
Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą być wykorzystywane przez jego
Użytkowników
wyłącznie
w zakresie własnego użytku osobistego oraz do użytku w szkołach podczas zajęć dydaktycznych. Kopiowanie, wprowadzanie zmian,
przesyłanie,
publiczne
odtwarzanie
i wszelkie wykorzystywanie tych treści do celów komercyjnych jest niedozwolone. Plik można dowolnie modernizować na potrzeby
własne
oraz
do
wykorzystania
w szkołach podczas zajęć dydaktycznych.


Spis treści
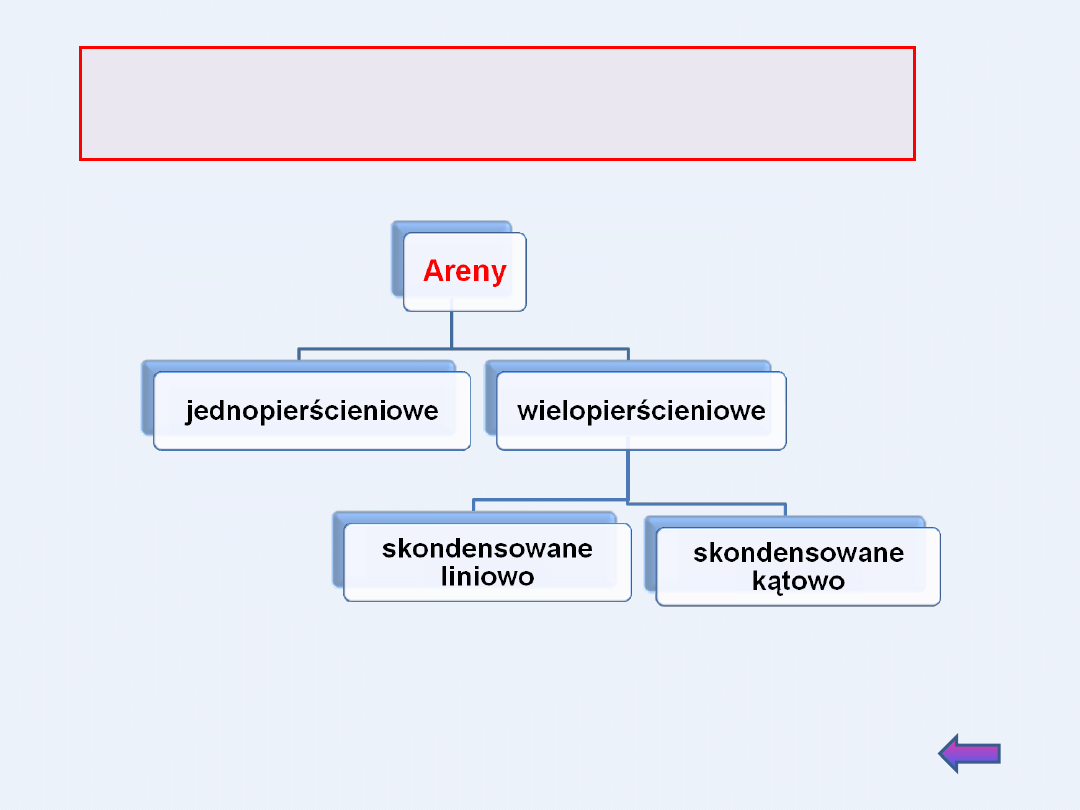
Wielopierścieniowe węglowodory aromatyczne
Nazewnictwo związków aromatycznych
Występowanie i otrzymywanie arenów
Węglowodory aromatyczne (areny)
to płaskie
cykliczne związki węgla i wodoru posiadające 4n+2
zdelokalizowanych elektronów π
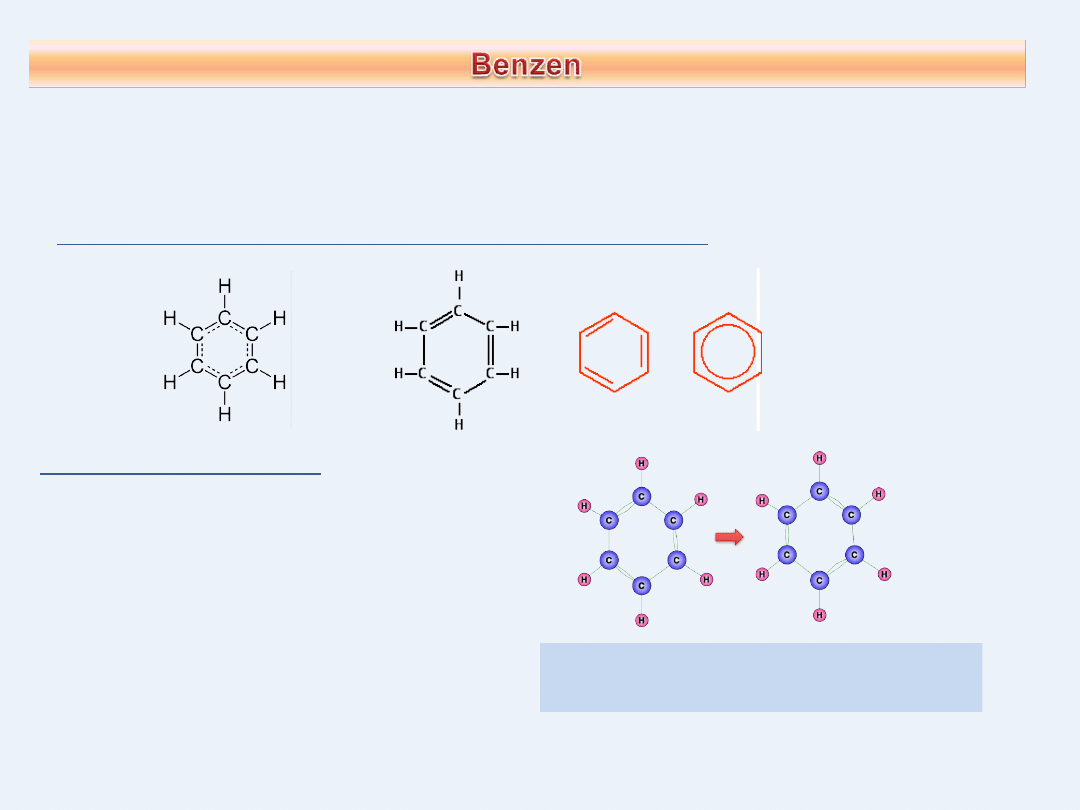
Benzen to jednopierścieniowy związek aromatyczny o
wzorze sumarycznym
C
6
H
6
Sposoby zapisywania wzoru cząsteczki benzenu
Właściwości fizyczne
:
Stan skupienia – ciecz
Barwa
-bezbarwny
Zapach
-
charakterystyczny
Temperatura wrzenia – 80
o
C
Struktury rezonansowe (graniczne)
Kekulego
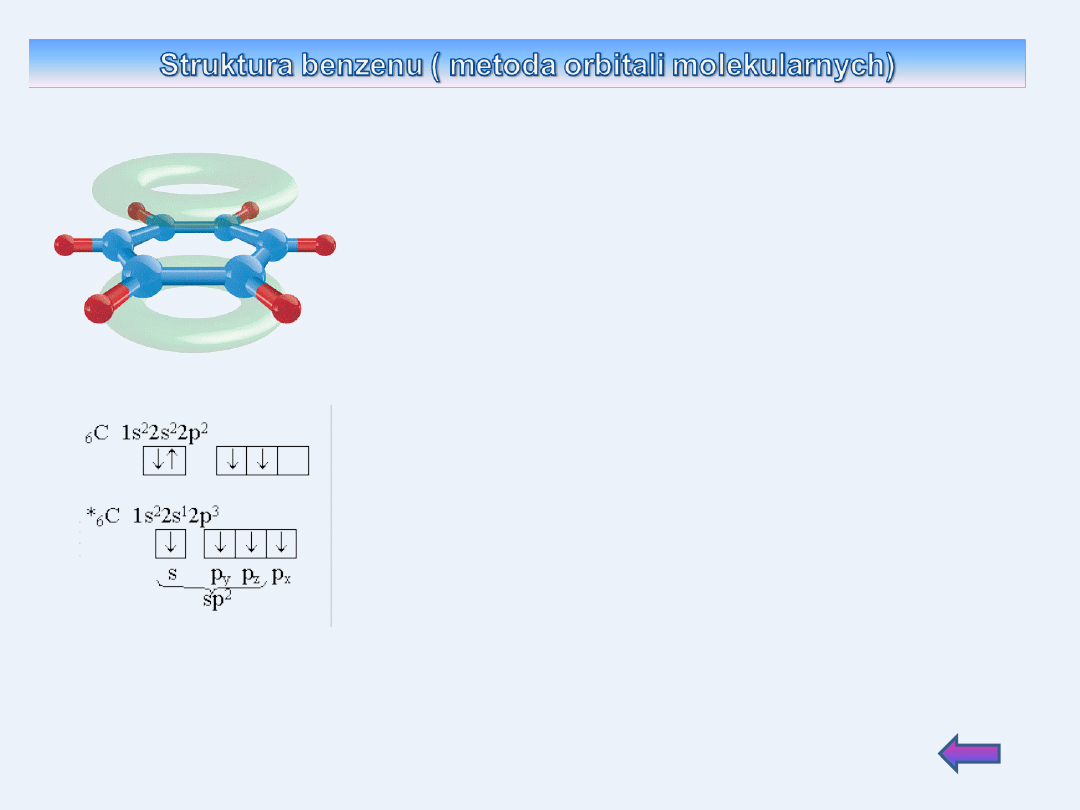
W cząsteczce benzenu sześć atomów węgla
pierścienia posiada hybrydyzację sp
2
i tworzy za
pomocą zhybrydyzowanych orbitali trzy wiązania
atomowe typu sigma
Dwa z nich łączą sąsiednie atomy węgla, trzecie
stanowi wiązanie C-H. .
Wszystkie wiązania pomiędzy atomami węgla są
identycznej długości i stanowią pewną średnią
pomiędzy typowym wiązaniem podwójnym C=C
i pojedynczym C—C.
Przy każdym atomie węgla pozostaje jeden,
niezhybrydyzowany, jednoelektronowy orbital.
Boczne przenikanie się tych orbitali z podobnymi
orbitalami sąsiednimi powoduje powstanie
sześcioelektronowego orbitalu molekularnego, w
którym gęstość elektronowa rozłożona jest
ponad i pod płaszczyzną pierścienia, w której
leżą wszystkie atomy cząsteczki benzenu..
( wiązanie zdelokalizowane).
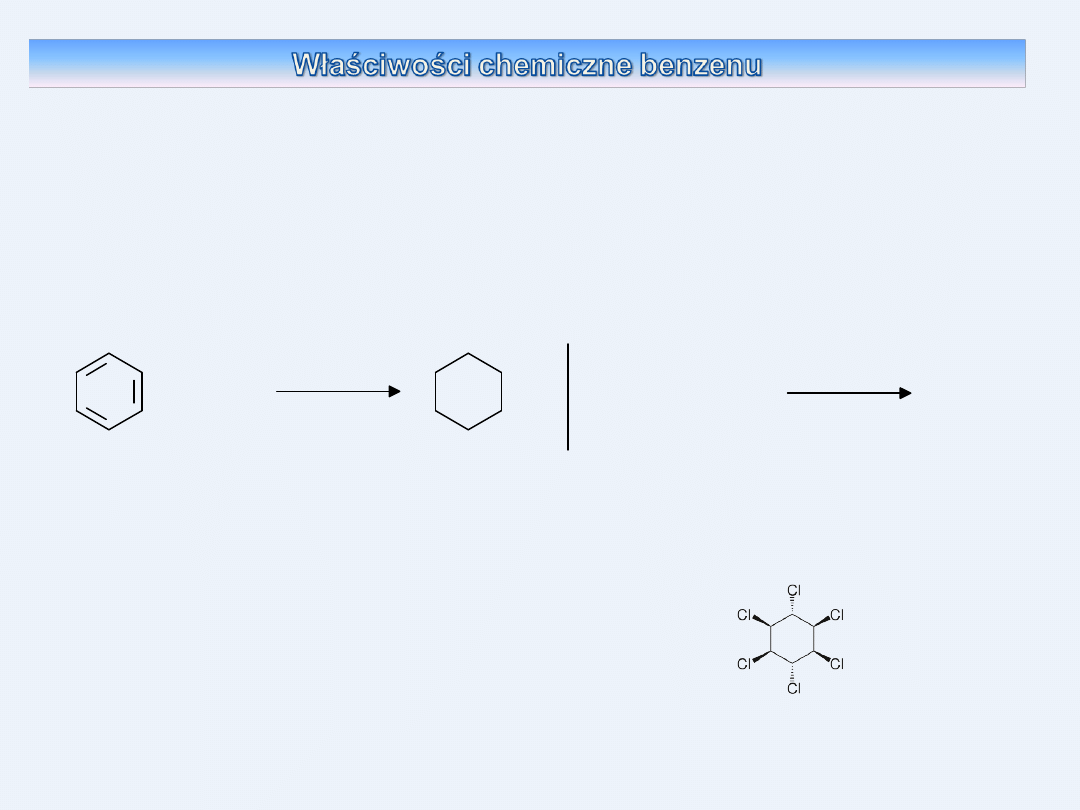
spala się kopcącym płomieniem, pary benzenu tworzą z powietrzem
mieszaninę wybuchową.
w zwykłych warunkach nie reaguje z wodą bromową i roztworem
nadmanganianu potasu
(wykazując podobieństwo do alkanów)
nie reaguje z chlorowodorem
reakcja uwodornienia
(reakcja przyłączenia - podobieństwo do
alkenów)
+
benzen
cykloheksan
C6H6 + 3 H2
C6H12
kat. (Ni)
p. T.
3 H2
kat. (Ni)
p. T.
w wyniku naświetlania mieszaniny benzenu i
chloru
promieniowaniem ultrafioletowym
powstaje nasycony heksachlorocykloheksan.
ma właściwości silnie toksyczne !!!
Stabilność cząsteczek związków aromatycznych jest większa niż
węglowodorów nienasyconych. W reakcji uwodornienia należy
zastosować bardziej drastyczne warunki.
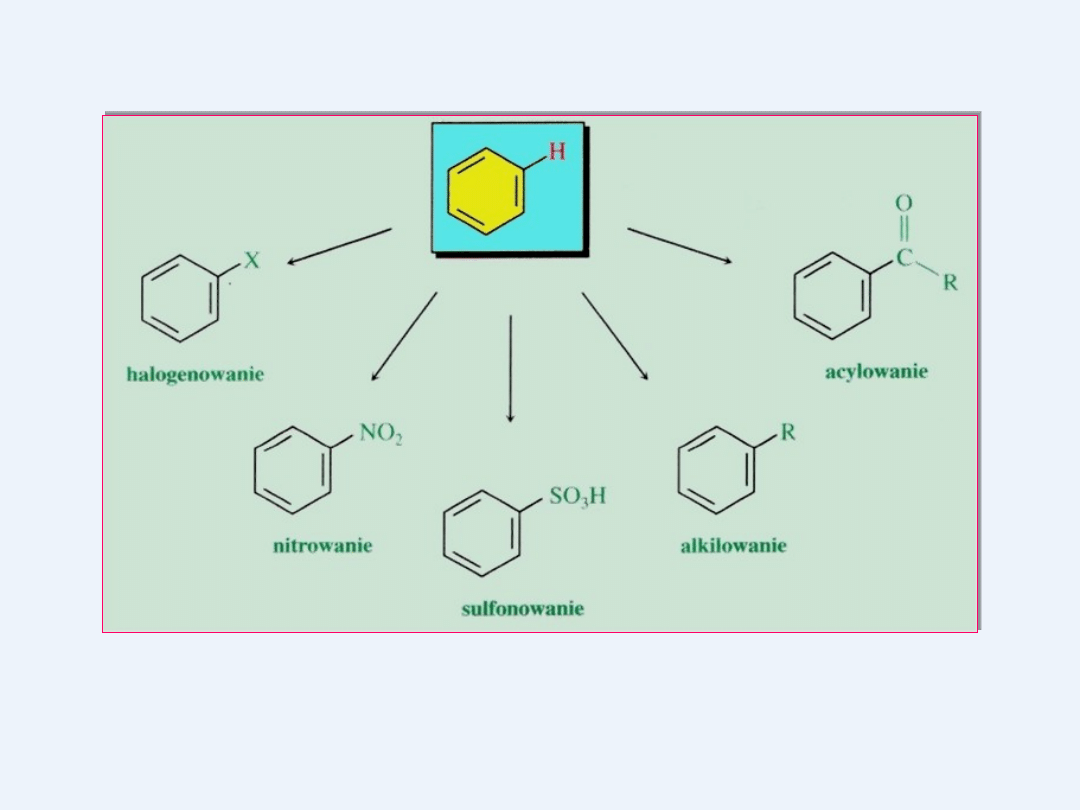
wchodzi w reakcje podstawiania ( substytucja elektrofilowa)
Wszystkie te reakcje przebiegają według jednego mechanizmu
substytucji
elektrofilowej (SE) i polegają na podstawieniu atomu wodoru z
pierścienia
benzenowego innym atomem lub grupą atomów.
Halogenowanie
Reaguje z bromem lub chlorem w obecności katalizatora.
benzen
+ Br2
kat (FeBr3)
bromobenzen
C6H6 + Br2
C6H5Br + HBr
kat (FeBr3)
+ HBr
Br
Nitrowanie
Reaguje z tzw. mieszaniną nitrującą (mieszaniną stężonych kwasów:
azotowego i siarkowego. Dodatek stężonego kwasu siarkowego sprawia,
że reakcja zachodzi szybciej i w niższej temperaturze.
Jest to reakcja podstawienia atomu wodoru grupą nitrową (reakcja
charakterystyczna dla związków aromatycznych).
H2SO4
+ H2O
kwas azotowy (V)
benzen
nitrobenzen
+ HNO3
NO
2
Alkilowanie pierścienia aromatycznego -Reakcja Friedela
- Craftsa
+ CH3Cl
AlCl3
bezwodny
CH
3
+ HCl
Reaktywność halogenków alkilowych w reakcji alkilowania Friedla-
Craftsa:
jodki < bromki < chlorki; fluorki są niereaktywne w reakcji alkilowania
Friedla-Craftsa - nie stosuje się ich.
Reakcja sulfonowania
Najczęściej stosuje się stężony (>95%) kwas siarkowy lub dymiący
kwas
siarkowy (tzw. oleum) czyli roztwór SO
3
w 100% kwasie siarkowym.
Sulfonowanie jest reakcją odwracalną; w odpowiednich warunkach
można
przeprowadzić desulfonowanie, czyli usunąć grupę sulfonową z
pierścienia.
Sekwencja reakcji sulfonowanie-desulfonowanie jest często
wykorzystywana
w syntezach złożonych pochodnych benzenu.
+ H
2
SO
4
SO
3
H
kwas benzenosulfonowy
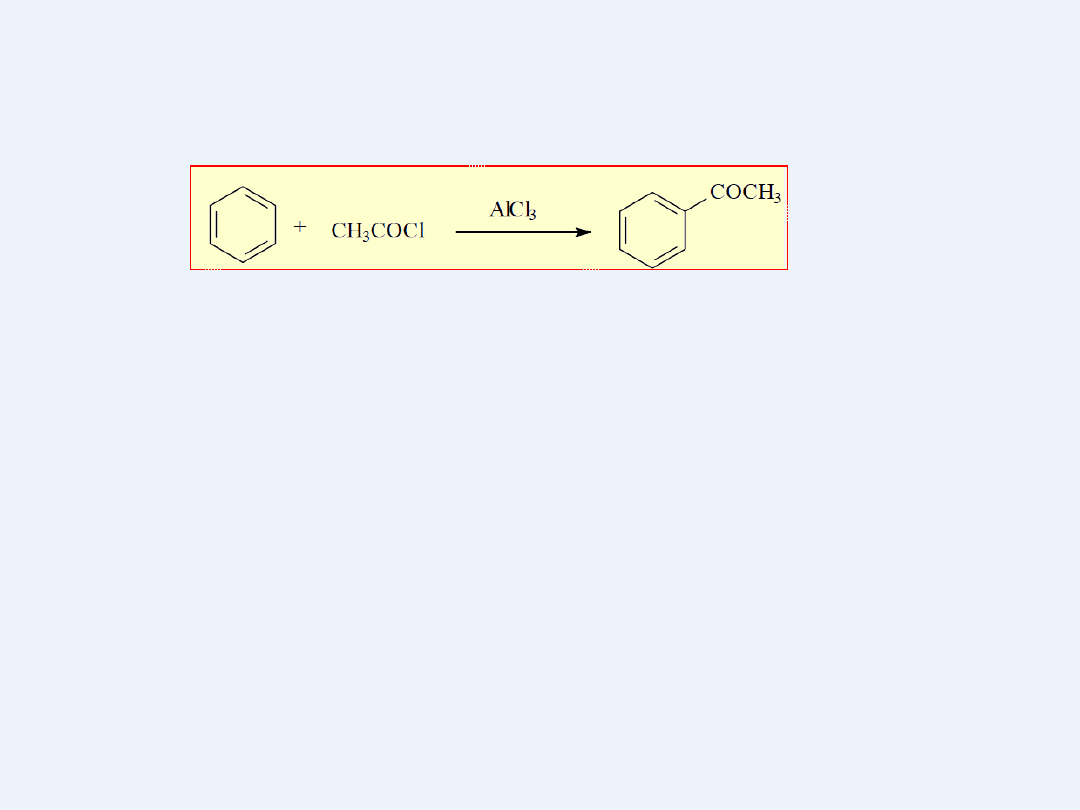
Acylowanie
W reakcjach acylowania na węglowodór aromatyczny działa się
chlorkami lub bromkami kwasowymi (acylowymi)
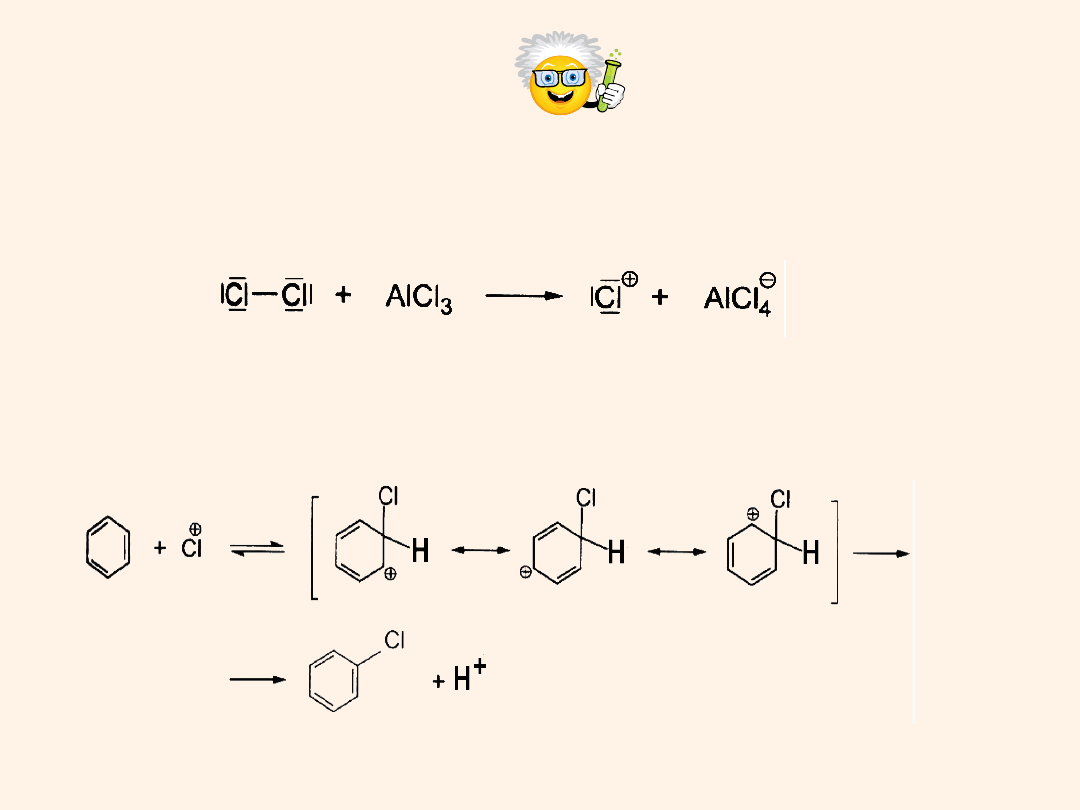
Mechanizm chlorowania arenów
Wytworzenie kationu chlorowego pod wpływem katalizatora:
Przyłączenie elektrofila do pierścienia i stabilizacja karbokationu przez
struktury rezonansowe.
Następnie po odejściu protonu –odnowienie pierścienia
aromatycznego:
Dla
zainteresowanych
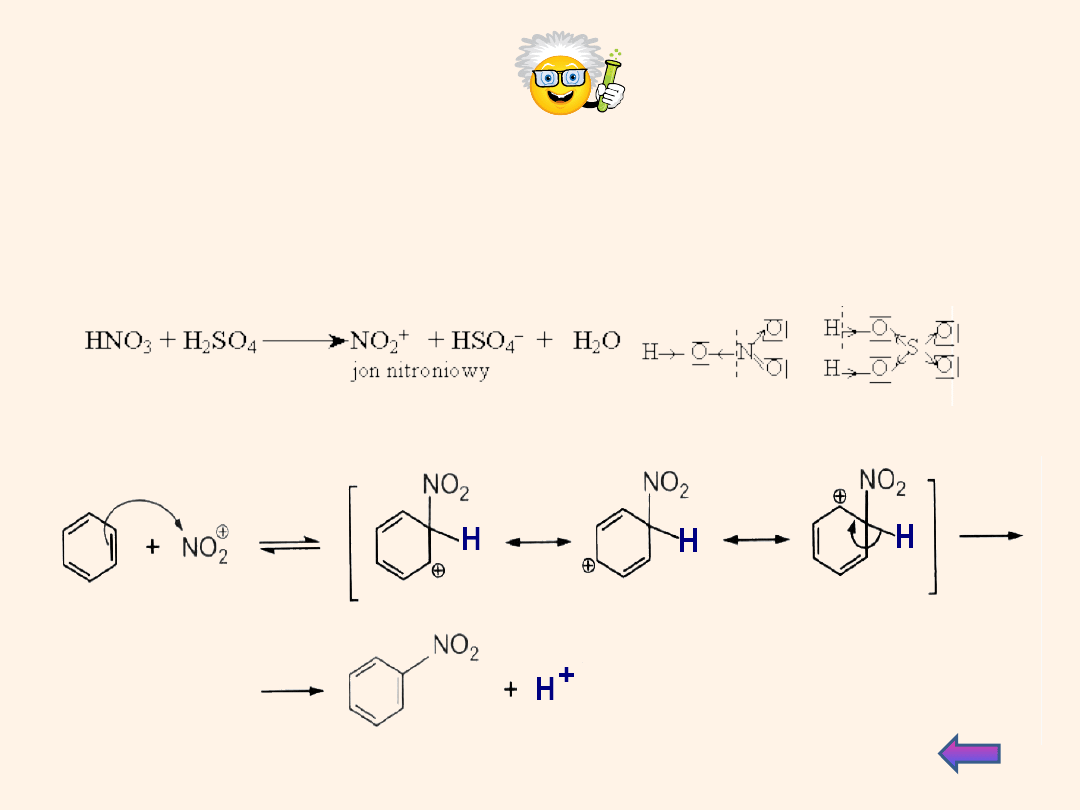
Dla
zainteresowanych
Mechanizm nitrowania arenów
Czynnikiem nitrującym jest kation nitroniowy NO
2
+
, który zabiera
parę elektronów z sekstetu elektronów aromatycznych i
przyłącza się do jednego atomu węgla. Karbokation jest
stabilizowany przez rezonans.
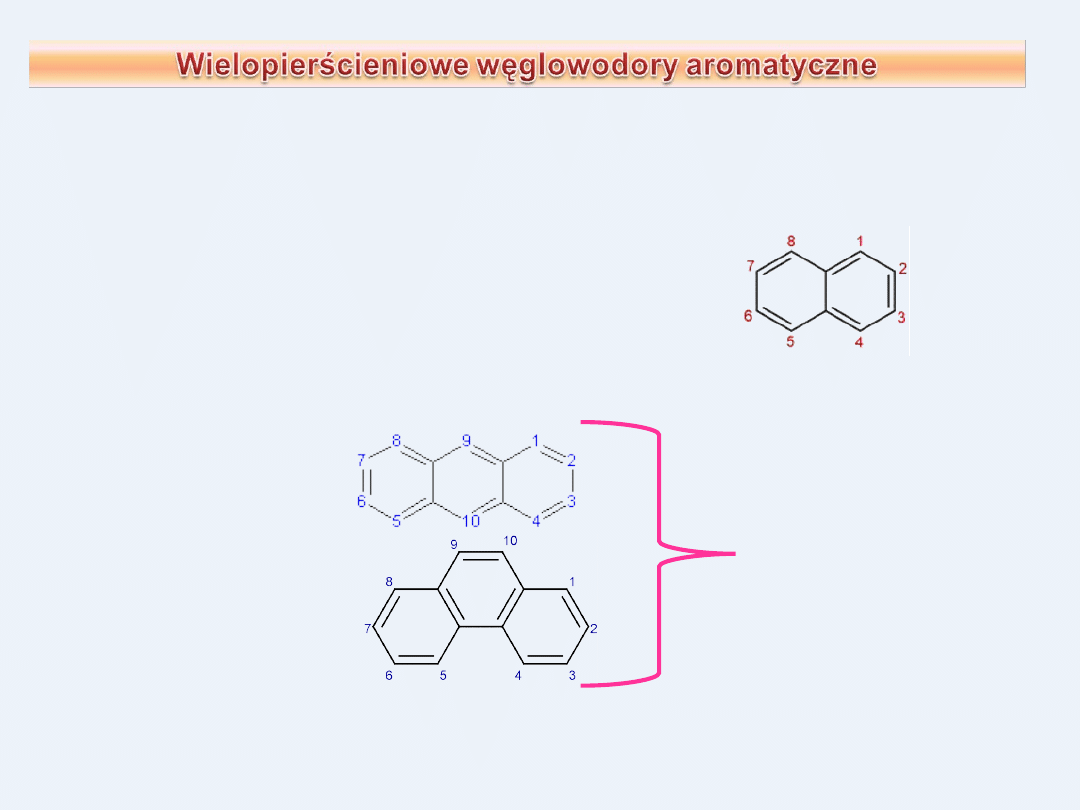
Do aromatycznych węglowodorów o skondensowanych pierścieniach
benzenowych należą naftalen, antracen i fenantren
Naftalen C
10
H
8
posiada dwa skondensowane pierścienie
sześcioczłonowe, zawierające 10 elektronów na
zdelokalizowanych wiążących orbitalach
molekularnych
( n = 2 π = 4∙2+2 = 10)
Fenantren C
14
H
10
Antracen C
14
H
10
Zbudowane z trzech
skondensowanych
pierścieni.
Zawierają po 14
zdelokalizowanych
elektronów π
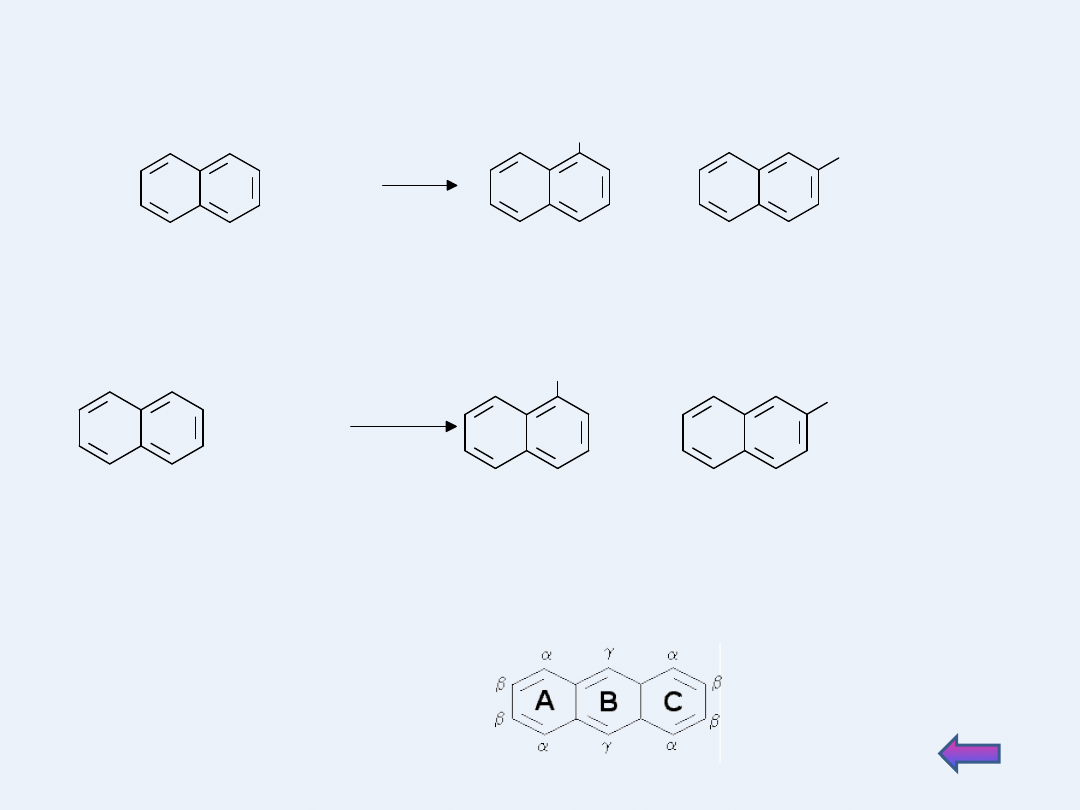
Wielopierścieniowe pochodne benzenu łatwiej ulegają halogenowaniu
niż benzen. Reagują z wodą bromową dając mieszaninę 2 izomerów (1 -
alfa i 2 - beta):
Naftalen nie posiada tak jak benzen wszystkich równocennych atomów
węgla.
Reakcje substytucji zachodzą łatwiej w położeniu α niż β.
Antracen i fenantren posiadają trzy nierównocenne atomy węgla α β γ
Najmniejszą reaktywność wykazują środkowe pierścienie.
Najłatwiej podstawieniu ulega pozycja γ
+ 2 Br2
+
+
2 HBr
2
naftalen
1-bromonaftalen
2-bromonaftalen
Br
Br
kat
+ 2 HNO3
H2SO4
+
+
2 H2O
2
naftalen
1-nitronaftalen
2-nitronaftalen
NO
2
NO
2
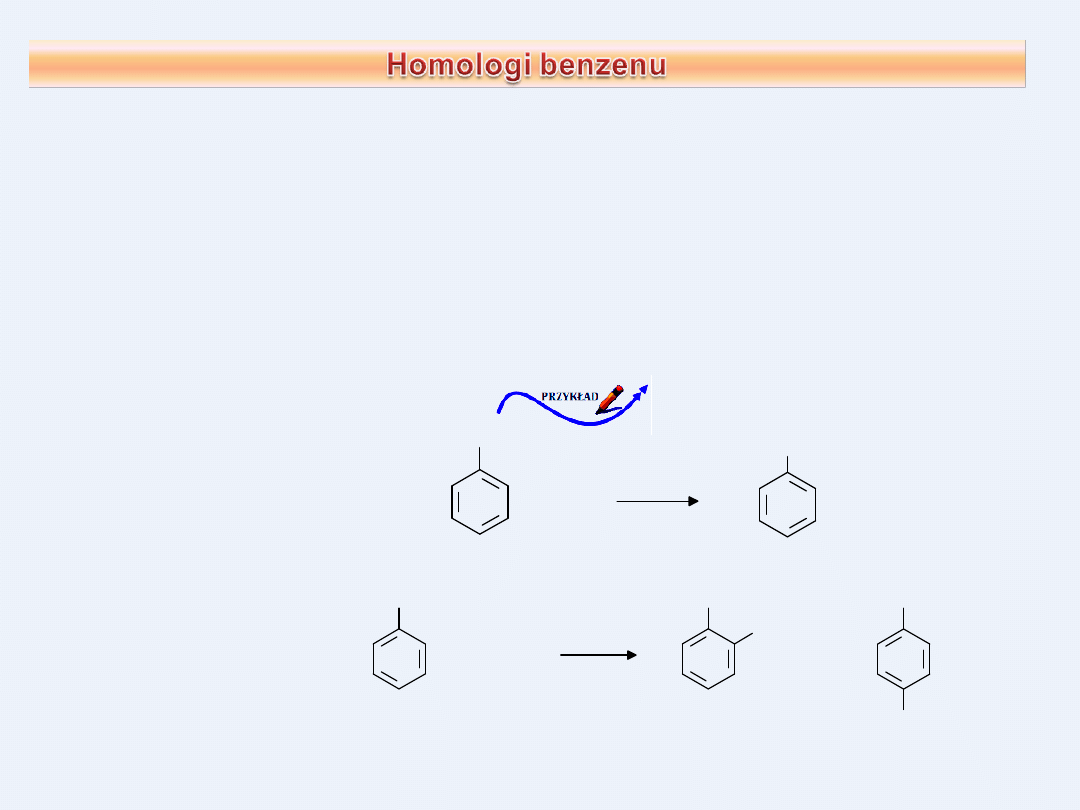
Właściwości chemiczne węglowodorów alifatyczno-
aromatycznych są podobne dla obu typów związków.
Reakcje charakterystyczne dla arenów będą zachodzić na
pierścieniu, reakcje charakterystyczne dla alifatów, będą
zachodzić na łańcuchu bocznym.
Do szeregu homologicznego pochodnych benzenu należą między innymi
toluen / metylobenzen, etylobenzen i dimetylobenzeny / ksyleny
W obecności światła
zachodzi podstawienie
atomu wodoru atomem
bromu, w grupie
alkilowej.
metylobenzen
(toluen)
CH2Br
bromek benzylu
+
+ Br2
światło
HBr
CH
3
Użycie katalizatora
(FeCl
3
, FeBr
3
)
powoduje
podstawienie w
pierścieniu
aromatycznym.
metylobenzen
(toluen)
2-bromotoluen
(o-bromotoluen)
FeBr3
4-bromotoluen
(p-bromotoluen)
CH
3
+ 2 Br2
CH
3
Br
+ + 2 HBr
CH
3
Br
2
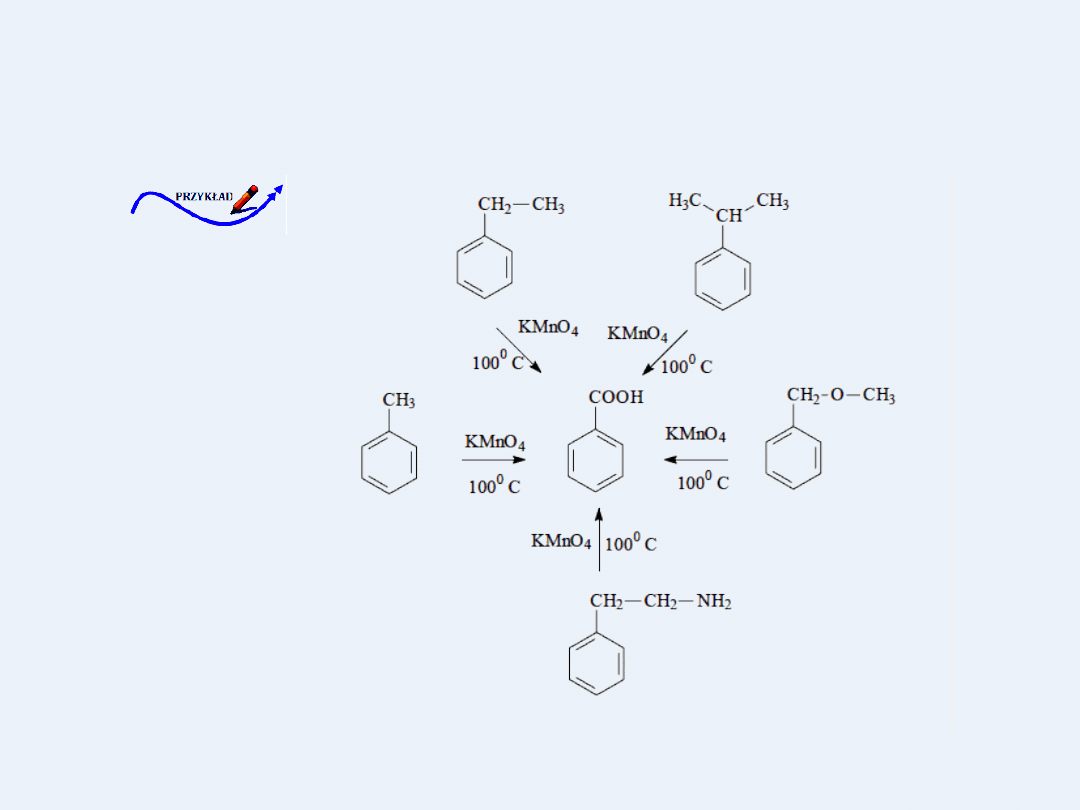
Utlenianie łańcucha bocznego związków alifatyczno-aromatycznych, bez
względu na długość łańcucha i podstawniki zachodzi zawsze na
pierwszym atomie węgla z utworzeniem kwasu benzoesowego.

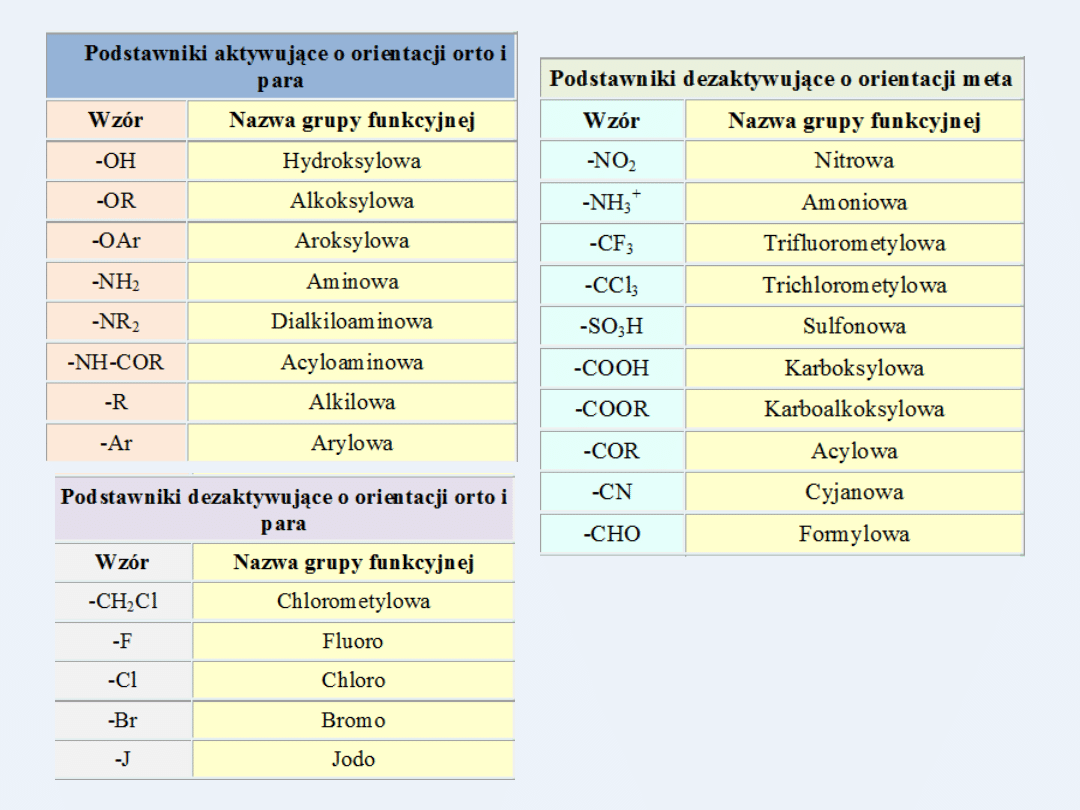
Wpływ podstawników na reakcje podstawiania aromatycznego
Podstawniki połączone z pierścieniem aromatycznym mogą aktywująco
lub dezaktywująco wpływać na reaktywność danego związku w reakcjach
substytucji elektrofilowej.
Rozpatrując wpływ grup funkcyjnych (podstawników) połączonych z
pierścieniem aromatycznym na orientację nowo wprowadzanego
podstawnika możemy wyróżnić dwa rodzaje podstawników.
Jedne z nich skierowują nowy podstawnik głównie w położenie orto i
para, drugie kierują go głównie w położenie meta.
Kombinacja tych dwóch typów oddziaływania na reaktywność i
nowe miejsce podstawienia pozwala nam na zaszeregowanie
każdej grupy funkcyjnej połączonej już z pierścieniem
benzenowym do jednego z następujących trzech typów
podstawników:
a) podstawniki aktywujące o orientacji orto i para, - 1 - go
rodzaju
b) podstawniki dezaktywujące o orientacji orto i para, 1 –go
rodzaju
c) podstawniki dezaktywujące o orientacji meta. – 2 - go rodzaju
Wytłumaczenie wpływu aktywującego lub dezaktywującego oraz
skierowującego podstawników opiera się na wpływach efektu
indukcyjnego i rezonansowego
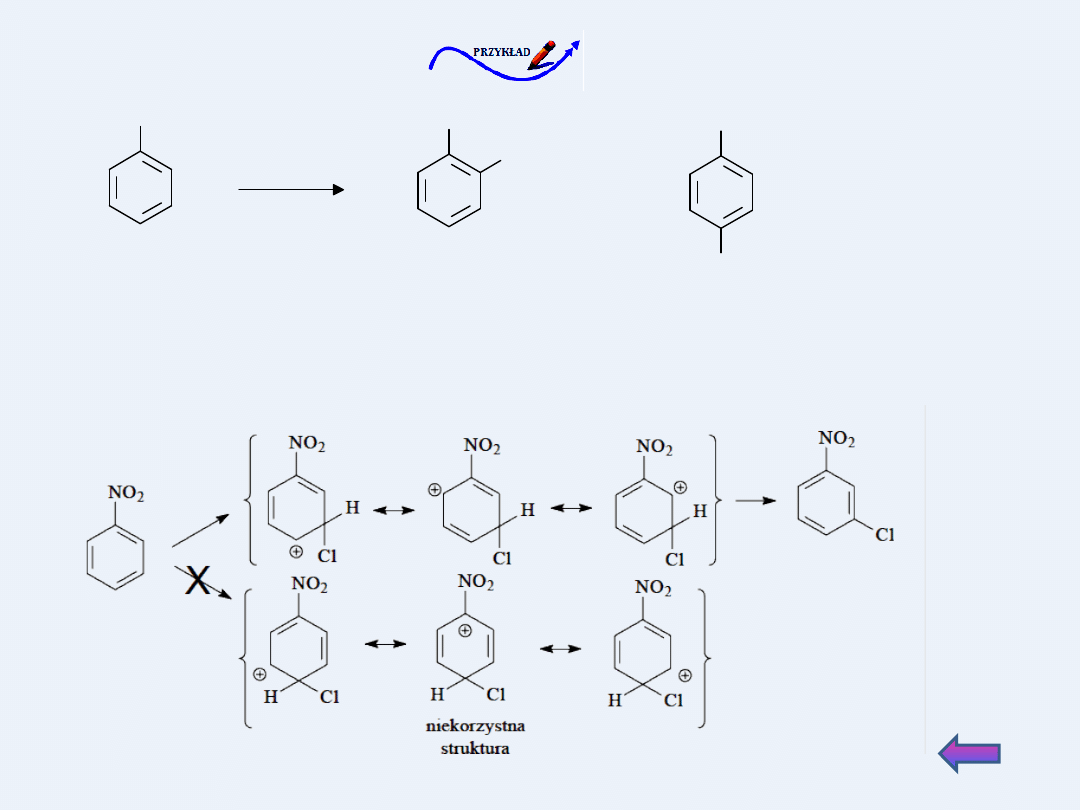
Jeżeli w benzenie znajdują się dwa
podstawniki różnego rodzaju, to o
kierunku podstawienia decyduje
podstawnik 1-go rodzaju
metylobenzen
(toluen)
HNO3
H2SO4
2-nitrotoluen
(o-nitrotoluen)
4-nitrotoluen
(p-nitrotoluen)
+
2 H2O
CH
3
CH
3
CH
3
NO
2
+
NO
2
2
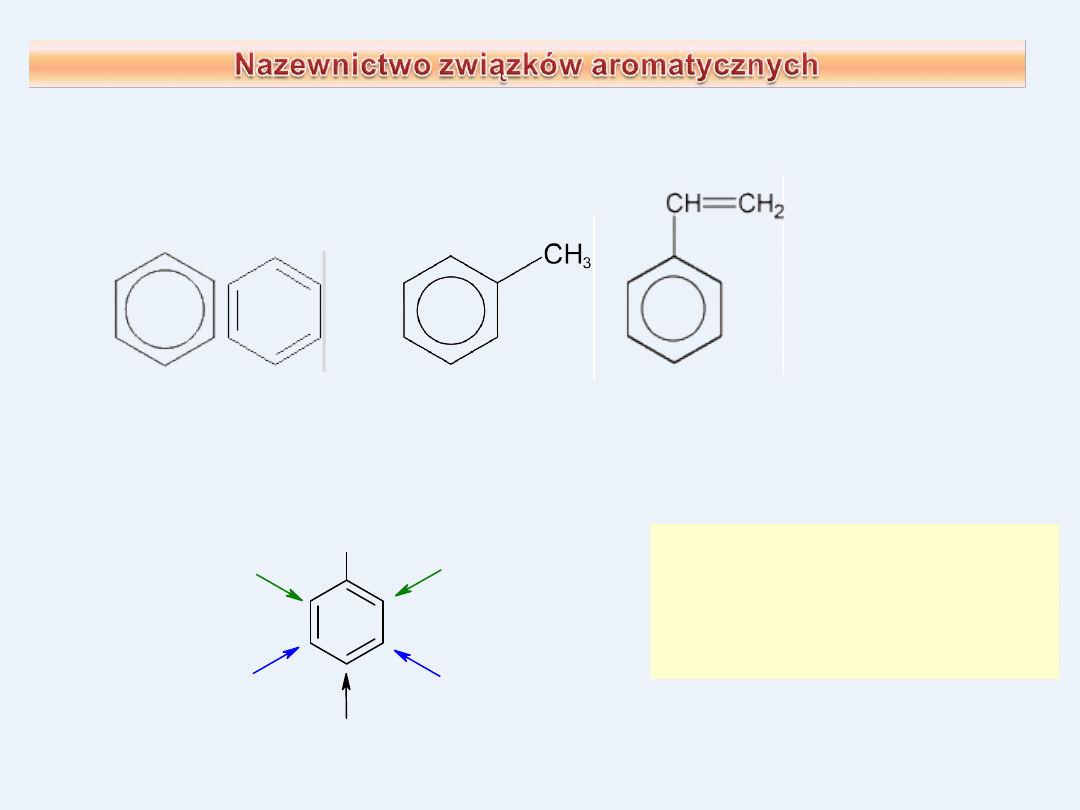
Wiele cząsteczek związków aromatycznych ma nazwy zwyczajowe
zaakceptowane przez IUPAC
benzen
toluen
styren
W przypadku, gdy do pierścienia benzenowego przyłączone są dwa
podstawniki, mogą być umieszczone w cząsteczce na trzy różne sposoby.
A
orto (o-)
meta (m-)
para (p-)
orto (o-)
meta (m-)
Uwaga:
określeń orto, meta, para nie
wolno stosować, gdy
cząsteczka zawiera więcej niż
dwa podstawniki
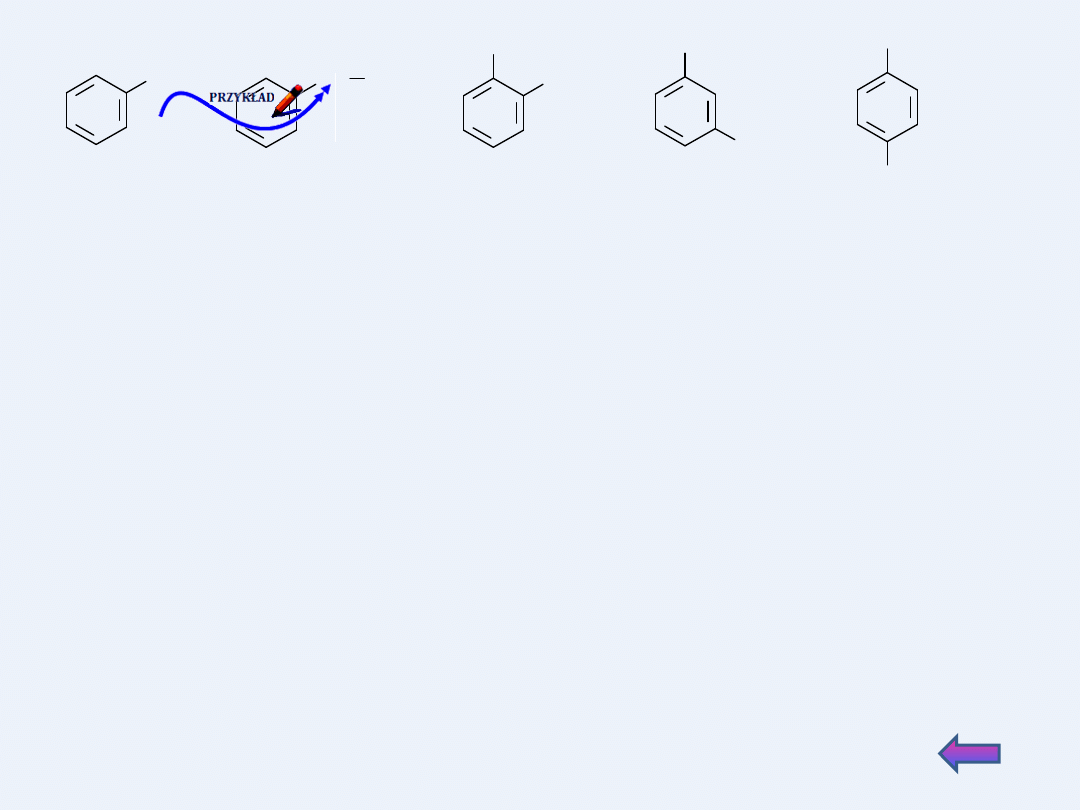
metylobenzen
(toluen)
etylobenzen
1,2-dimetylobenzen
(o-ksylen)
1,4-dimetylobenzen
(p-ksylen)
1,3-dimetylobenzen
(m-ksylen)
CH
3
CH
2
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
Nazwy innych węglowodorów i pochodnych benzenu z grupami
funkcyjnymi tworzy się, dodając nazwę ugrupowania jako przedrostek do
nazwy "benzen" lub do nazw innych węglowodorów aromatycznych.
Jeżeli nowy podstawnik jest identyczny z już obecnym w cząsteczce, to
związek określa się jako pochodną benzenu z dodatkiem odpowiednich
przedrostków na określenie krotności podstawników.
Położenia podstawników określa się za pomocą lokantów liczbowych, a
dla dwupodstawionych pochodnych benzenu można alternatywnie
stosować nazwy orto (o-), meta (m-) i para (p-), odpowiednio dla położeń:
1,2, 1,3 i 1,4.
Numerację pierścienia benzenowego rozpoczyna się zawsze od atomu
węgla związanego z podstawnikiem i prowadzi tak, aby suma lokantów
była najniższa z możliwych.
Występują w ropie naftowej, ale zwykle w małym stężeniu.
W dużych ilościach znajdują się w smole.
Z wsadu węglowego powstaje 3-4% smoły pogazowej.
Obok smoły pogazowej w produktach pirolizy węgla znajduje się gaz
(np. gaz koksowniczy) i koks. Gaz koksowniczy po ochłodzeniu
ulega częściowo skropleniu i ta ciekła frakcja nazywa się benzolem
surowym. Znajduje się w niej głównie benzen (>70%) i toluen (~15%).
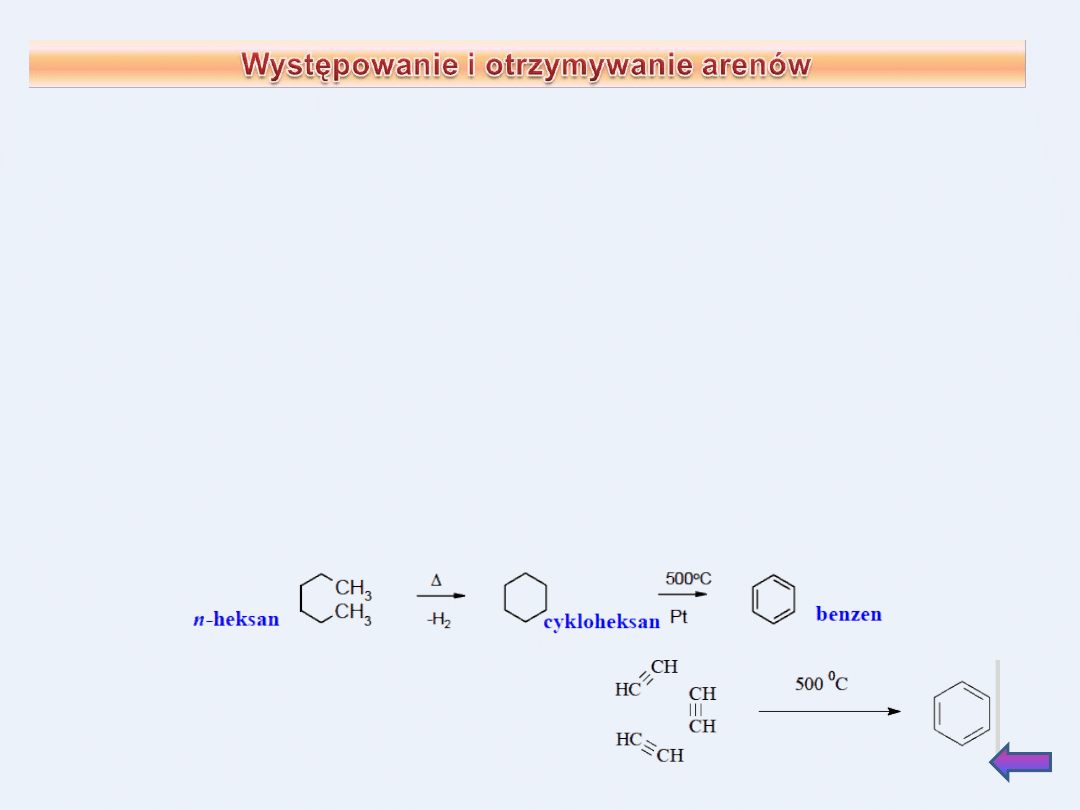
Otrzymywanie z węglowodorów aromatycznych w procesie
reformingu
Proces reformingu, polega na ogrzewaniu węglowodorów alifatycznych
w wysokiej temp. w obecności katalizatorów.
z benzyny lekkiej (frakcji wrzącej w temp. 60-85
o
C) powstaje głównie
benzen,
z frakcji 60-105
o
C przeważają benzen i toluen,
z destylatu 105-140
o
C otrzymuje się przede wszystkim ksyleny i
etylobenzen.
Proces przekształcania alkanów w areny składa się z etapów cyklizacji
i aromatyzacji.
Trimeryzacja etinu – otrzymanie benzenu
:

Bibliografia
„Chemia od A do Z” M. Klimaszewska
„ Chemia 2 ” - S. Hejwowska
http://www.mikdab.user.icpnet.pl/chemia/waromat.htm
http://rafalkubas.webpark.pl/
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
[Beata Świerkocka & Jacek Świerkocki] Węglowodory aromatyczne areny
wyk 4 węglow aromat
WĘGLOWODORY AROMATYCZNE
BT węglowodory aromatyczne (wykład III)
kl 2, kartkowka-benzen, Benzen - C6H6 Wzór Elektronowy - 6¬¬C KL 1H K Węglowodory Aromatyc
Oznaczanie wybranych węglowodorów aromatycznych przy zastosowaniu chromatografii gazowej(1)
Węglowodory aromatyczne (2) ppt
węglowodory aromatyczne
otrzymywanie-i-reakcje-weglowodorow-aromatycznych
Powtórzenie węglowodory nienasycone i areny
Oznaczanie zawartości węglowodorów aromatycznych w paliwach dieslowych
10.Węglowodory aromatyczne, MATERIAŁY NA STUDIA, Chemia
16-WIELOPIERŚCIENIOWE WĘGLOWODORY AROMATYCZNE, kolo1
WĘGLOWODORY AROMATYCZNE
Węglowodory aromatyczne, chemia(2)
Biodegradacja węglowodorów aromatycznych, Naukowe PL, Biotechnologia, Enzymologia, Genetyka
otrzymywanie i reakcje weglowodorow aromatycznych
Reakcje węglowodorów aromatycznych
Węglowodory aromatyczne i alkohole
więcej podobnych podstron