
Reakcje
Reakcje
węglowodorów
węglowodorów
aromatycznych
aromatycznych
Elektrofilowe
Elektrofilowe
podstawienie aromatyczne
podstawienie aromatyczne

Elektrofilowe podstawienie aromatyczne
Elektrofilowe podstawienie aromatyczne
Reakcje dotyczące pierścieni aromatycznych można podzielić na trzy główne
Reakcje dotyczące pierścieni aromatycznych można podzielić na trzy główne
typy:
typy:
Reakcje podstawienia
Reakcje podstawienia
Reakcje przyłączenia
Reakcje przyłączenia
Reakcja utleniania
Reakcja utleniania
Najpospolitsze są reakcje podstawienia benzenowego: chlorowcowanie,
Najpospolitsze są reakcje podstawienia benzenowego: chlorowcowanie,
nitrowanie, sulfonowanie, alkilowanie i acylowanie.
nitrowanie, sulfonowanie, alkilowanie i acylowanie.
Istnieją podobieństwa między reakcjami podstawienia aromatycznego, a
Istnieją podobieństwa między reakcjami podstawienia aromatycznego, a
reakcjami przyłączenia elektrofilowego do alkenów. Wiele czynników,
reakcjami przyłączenia elektrofilowego do alkenów. Wiele czynników,
przyłączających się na ogół do podwójnych wiązań alkenów, podstawia
przyłączających się na ogół do podwójnych wiązań alkenów, podstawia
również atomy wodoru pierścienia aromatycznego. Ponadto obie reakcje
również atomy wodoru pierścienia aromatycznego. Ponadto obie reakcje
należą do reakcji polarnych, dwuetapowych, w których bierze udział czynnik
należą do reakcji polarnych, dwuetapowych, w których bierze udział czynnik
elektrofilowy. Etapem kluczowym jest atak odczynnika elektrofilowego na
elektrofilowy. Etapem kluczowym jest atak odczynnika elektrofilowego na
atom węgla; atak ten prowadzi do powstania kationowego związku
atom węgla; atak ten prowadzi do powstania kationowego związku
przejściowego.
przejściowego.
Czynnikiem atakującym jest formalny kation, albo obojętna, ale
Czynnikiem atakującym jest formalny kation, albo obojętna, ale
spolaryzowana cząsteczka.
spolaryzowana cząsteczka.

Przykładowe reakcje podstawienia
Przykładowe reakcje podstawienia
benzenu
benzenu
NO
2
Br
Cl
CH
2
CH
3
Cl
SO
3
H
CH
CH
3
CH
3
C
O
CH
3
D
H
2
SO
4
D
2
SO
4
AlCl
3
CH
3
CCl
O
CH
3
CH CH
2
H
3
PO
4
AlCl
3
CH
3
CH
2
Cl
Cl
2
FeCl
3
Br
2
FeBr
3
HNO
3
H
2
SO
4
nitrowanie
nitrobenzen
bromowanie
+ HBr
bromobenzen
+ HCl
chlorowanie
chlorobenzen
+ HCl
chlorowanie
chlorobenzen
sulfonowanie
kwas benzenosulfonowy
alkilowanie
etylobenzen
alkilowanie
izopropylobenzen
(kumen)
acylowanie
fenylometyloketon
(acetofenon)
monodeuterobenzen
deuterowanie
stez.
HOCl, H
,Ag
,
,
,
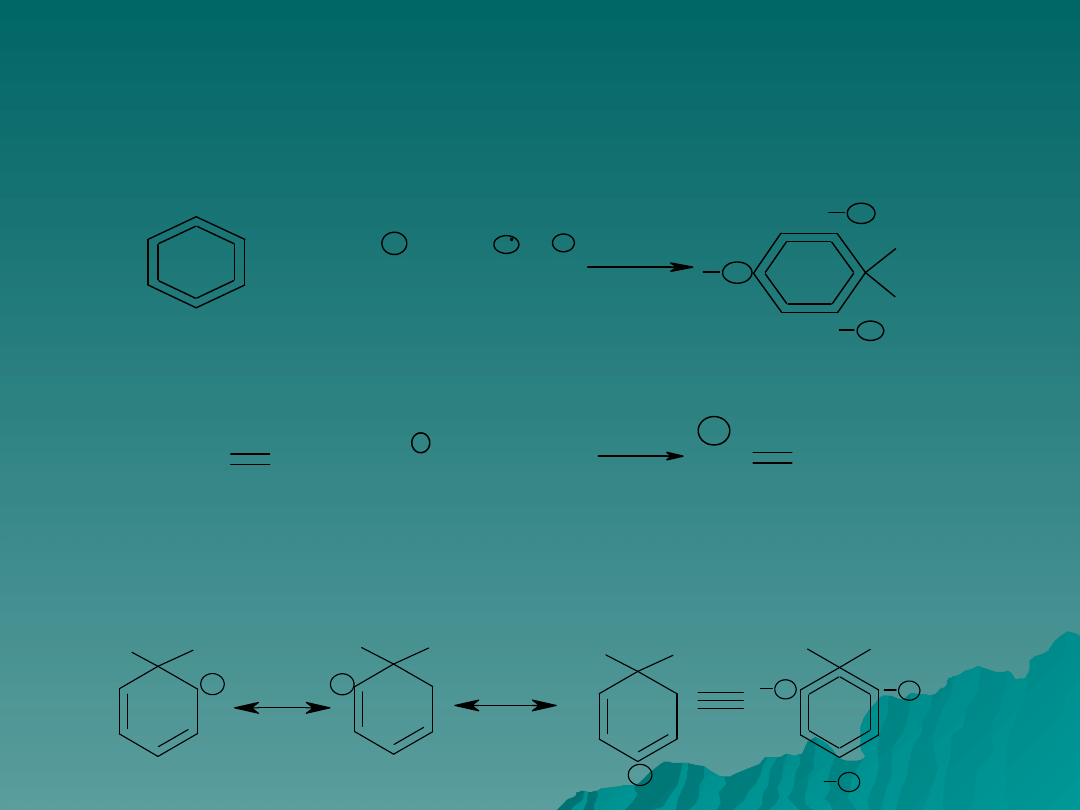
Elektrofilowe podstawienie aromatyczne –
Elektrofilowe podstawienie aromatyczne –
etap pierwszy
etap pierwszy
Elektrofilowe podstawienie aromatyczne
Elektrofilowe podstawienie aromatyczne
Elektrofilowe przyłączenie do alkenów
Elektrofilowe przyłączenie do alkenów
Powstały związek przejściowy nie ma już budowy aromatycznej; jest to
Powstały związek przejściowy nie ma już budowy aromatycznej; jest to
nietrwały kation który można przedstawić za pomocą następujących struktur
nietrwały kation który można przedstawić za pomocą następujących struktur
granicznych, których udziały są równe.
granicznych, których udziały są równe.
H
X
H
X
H
X
H
X
1
3
1
3
1
3
C
H
2
CH
2
X
+
+
C
H
2
CH
2
X
(lub X - Y)
X
+
H
X
1
3
1
3
1
3
_
+
(lub X - Y)
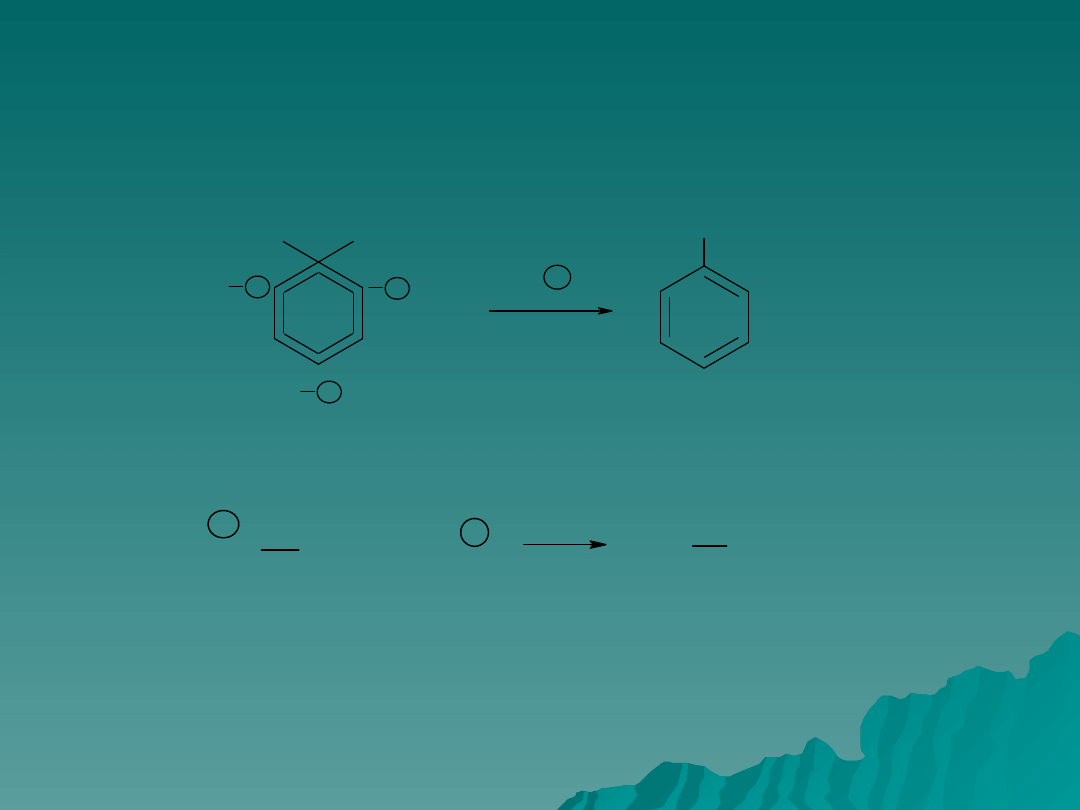
Elektrofilowe podstawienie aromatyczne –
Elektrofilowe podstawienie aromatyczne –
etap drugi
etap drugi
Elektrofilowe podstawienie do związków aromatycznych
Elektrofilowe podstawienie do związków aromatycznych
H
X
1
3
1
3
1
3
X
-H
Elektrofilowe przyłączenie do alkenów
_
Y
YCH
2
CH
2
X
C
H
3
CH
2
X
+
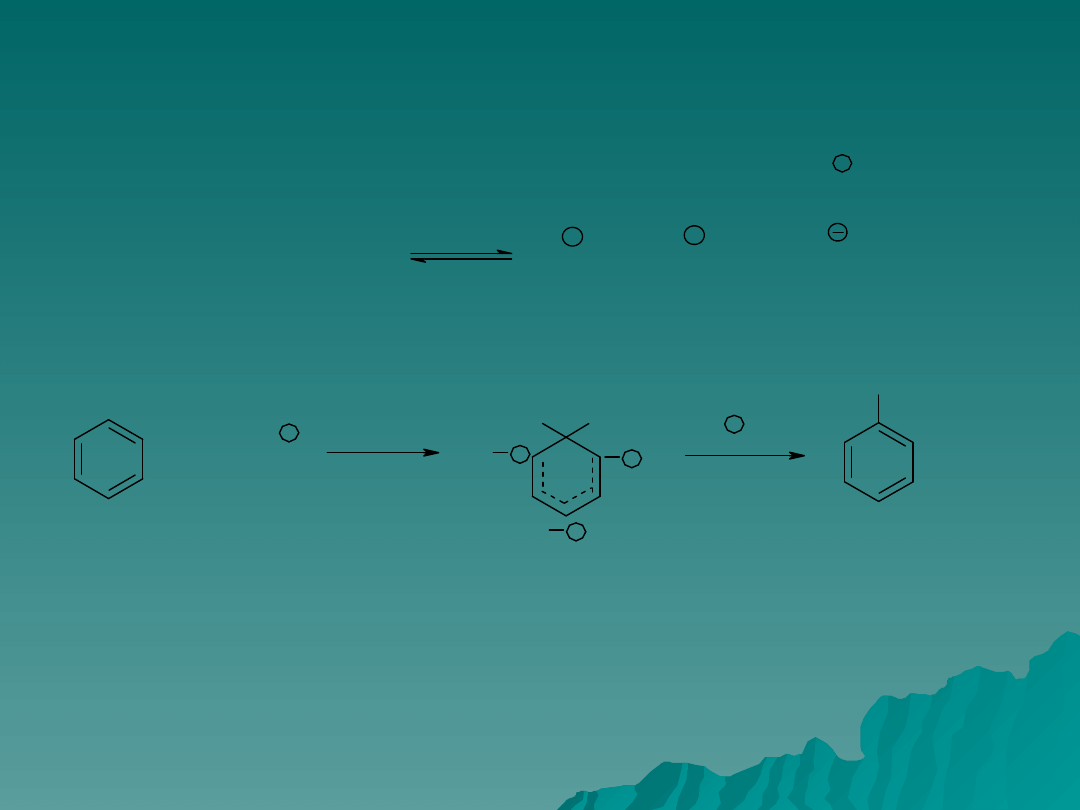
Charakter czynnika podstawiającego
Charakter czynnika podstawiającego
Atakujący czynnik nie musi być identyczny z reagentem wprowadzonym do
mieszaniny reakcyjnej. Na przykład przy nitrowaniu mieszaniną kwasów
azotowego i siarkowego polega na ataku jonu nitrowego
zgodnie z równaniem:
NO
2
+
HNO
3
H
2
SO
4
2
NO
2
+
H
3
O
+
HSO
4
+
+
+
2
Utworzony jon nitroniowy atakuje pierścień tworząc pochodna nitrową.
H
NO
2
NO
2
+
+
1
3
+
1
3
+
1
3
NO
2
+
-H
+
nitrobenzen
Zadanie katalizatora polega na utworzeniu z użytych reagentów właściwego
czynnika podstawiającego. Problem wyboru czynnika podstawiającego nie
jest tak ważny przy przyłączaniu do alkenów, ponieważ są one dużo bardziej
reaktywne od arenów i nie wymagają użycia katalizatora.
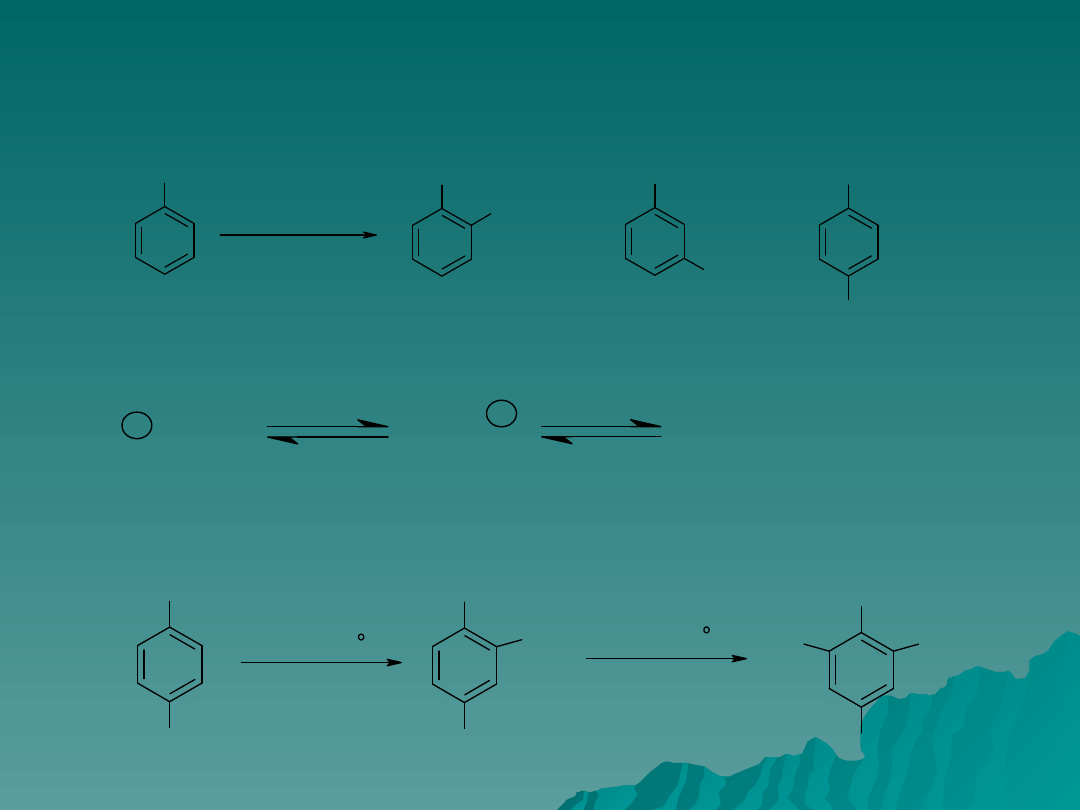
Nitrowanie
Nitrowanie
Typowym przykładem nitrowania jest nitrowanie toluenu. Czynnikiem
nitrującym jest jon nitroniowy, produktem jest mieszanina o-, m- i p-
nitrotoluenów.
CH
3
HNO
3
H
2
SO
4
CH
3
NO
2
CH
3
NO
2
CH
3
NO
2
,
+
+
62%
5%
33%
Niewielka ilość wody cofa reakcję tworzenia się jonu nitroniowego.
NO
2
O
H
2
H
2
NO
3
HNO
3
H
2
SO
HSO
4
+
+
Skuteczność mieszaniny nitrującej można zwiększyć stosując dymiący kwas
azotowy i siarkowy. Mało reaktywny p-nitrotoluen można porzeprowdzić
W di- i tri- nitropochodne poprzez ogrzewanie z nadmiarem kwasu azotowego
w dymiącym kwasie siarkowym.
CH
3
NO
2
CH
3
NO
2
NO
2
HNO
3
SO
3
H
2
SO
4
,120
HNO
3
SO
3
H
2
SO
4
,120
CH
3
NO
2
NO
2
O
2
N
,
p-nitrotoluen
2,4-dinitrotoluen
2,4,6-trinitrotoluen
Nitrowanie – c.d
Nitrowanie – c.d
W warunkach nitrowania związków aromatycznych alkeny ulegają
szybkiemu utlenieniu z rozerwaniem podwójnego wiązania.
HNO
3
CH
2
CH
2
CH
2
CH
2
CO
2
H
CO
2
H
kwas adypinowy
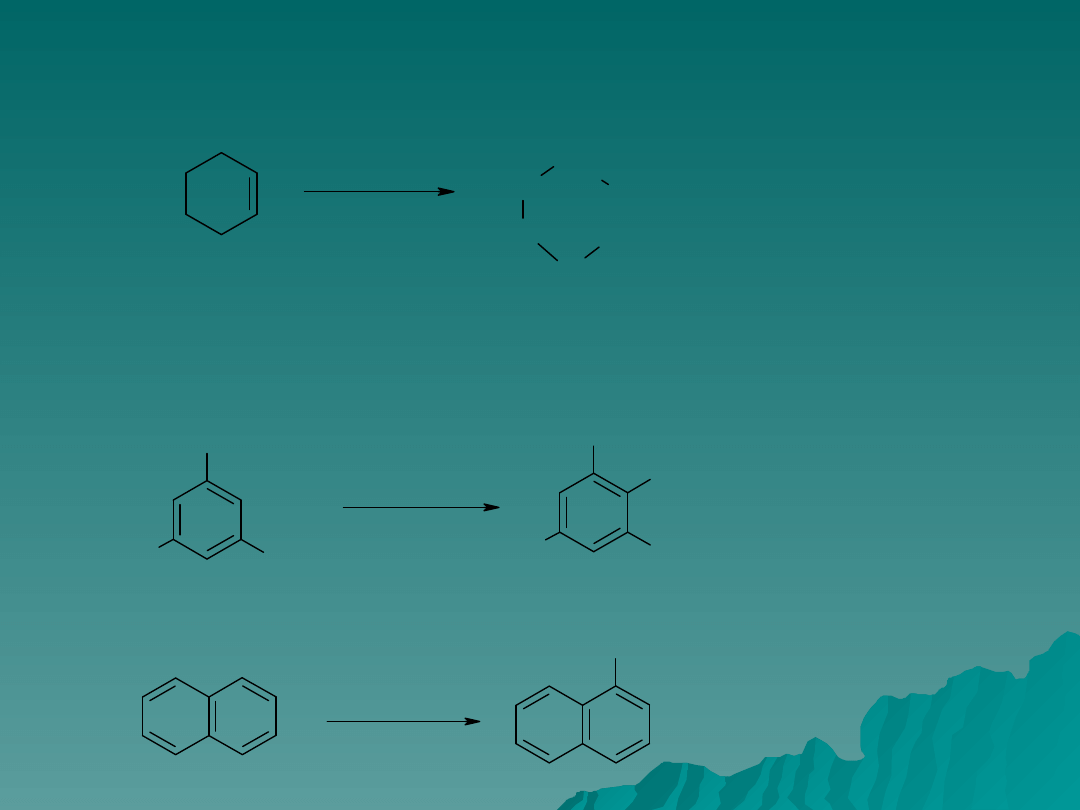
Niektóre związki aromatyczne są na tyle reaktywne, ze mogą ulegać
nitrowaniu kwasem azotowym w kwasie octowym, np. mezytylen i naftalen.
CH
3
CH
3
CH
3
HNO
3
CH
3
CO
2
H
CH
3
CH
3
CH
3
NO
2
nitromezytylen
HNO
3
CH
3
CO
2
H
NO
2
1-nitronaftalen

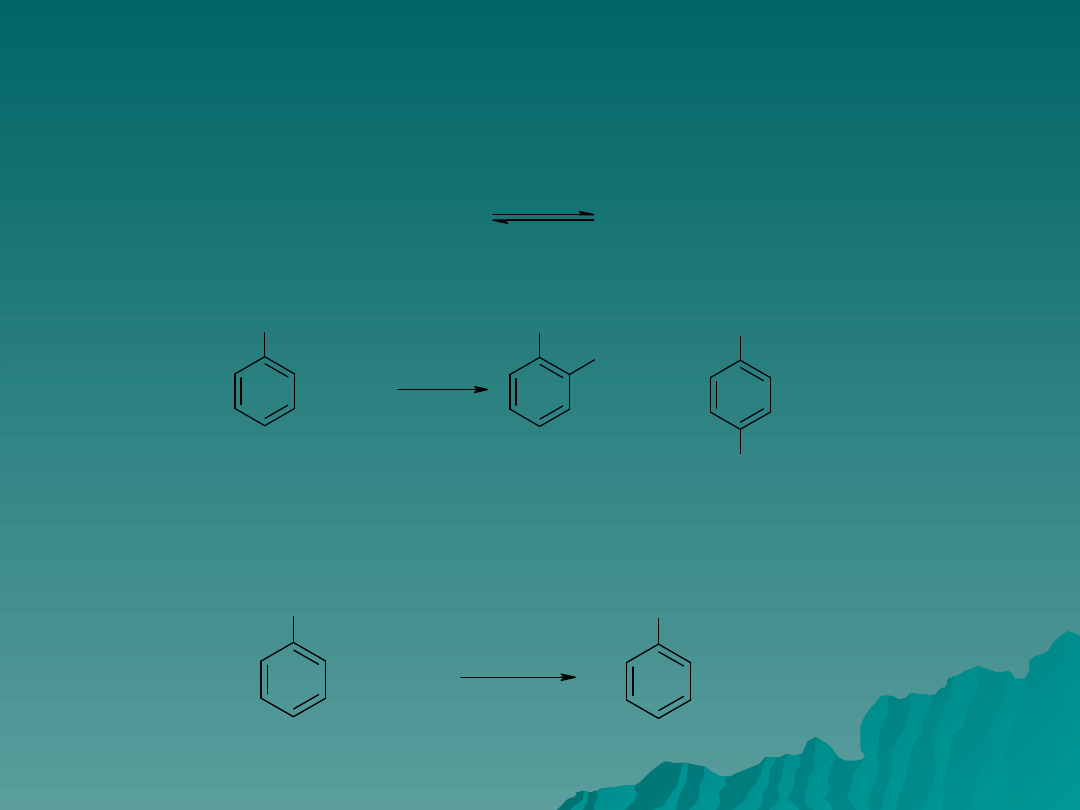
Chlorowcowanie
Chlorowcowanie
Chlorowcowanie związków aromatycznych wymaga użycia katalizatorów
(zwykle FeBr
3
, AlCl
3
i ZnCl
2
)
umożliwiają doprowadzenie reagentów na bliska
odległość co ułatwia utworzenie kompleksu. Działanie katalizatorów polega
na zdolności polaryzacji wiązania chlorowiec – chlorowiec:
+
Br
Br
FeBr
3
Cząsteczka chlorowca atakuje związek aromatyczny dodatnim biegunem,
biegun ujemny tworzy kompleks z katalizatorem:
Utworzenie wiązania pomiędzy Br
+
a pierścieniem jest etapem powolnym.
+
C
6
H
6
Br
2
Br
Br
FeBr
3
Br
Br
FeBr
3
Br
FeBr
3
Br
H
Br
H
+
1
3
+
1
3
+
1
3
FeBr
4
+
+
+
+
Chlorowcowanie – c. d.
Chlorowcowanie – c. d.
Reaktywność chlorowców maleje w szeregu F
2
>Cl
2
>Br
2
>I
2.
Fluor jest mało
reaktywny wiec aromatyczne związki fluorowe otrzymuje się metodami
pośrednimi
.
Jodowanie nie zachodzi, ponieważ reakcje cofa się w wyniku
redukcyjnych własności powstałego jodowodoru.
C
6
H
6
I
2
C
6
H
5
I
I
H
+
Jeden ze sposobów bezpośredniego jodowania polega na przeprowadzeniu za
pomocą czynnika utleniającego jodu w cząsteczkę bardziej aktywną.
CH
3
I
2
HNO
3
CH
3
I
CH
3
I
+
+
p-jodotoluen
o-jodotoluen
Chlorowcowanie chlorem i bromem należy prowadzić z dala od światła. Pod
wpływem światła chlorowiec podstawia się raczej w grupie alkilowej niż w
pierścieniu.
CH
3
Cl
2
CH
2
Cl
Cl
H
+
swiatlo
+
chlorek benzylu
Chlorowcowanie – c. d.
Chlorowcowanie – c. d.
50
Cl
Cl
Cl
Cl
Cl
Cl
Cl
2
hv
heksachlorek benzenu
+
Jasne światło słoneczne może spowodować penie chlorowca do pierścienia
aromatycznego.
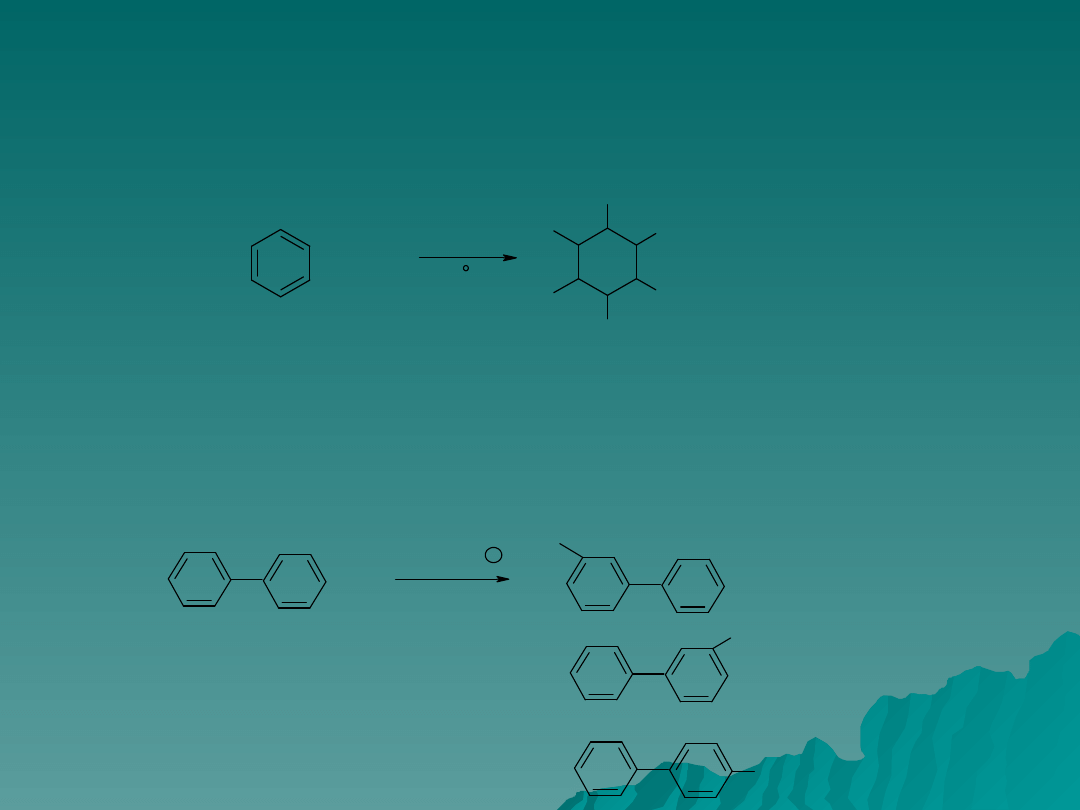
Innymi reagentami podstawienia chlorowców do pierścienia są kwasy
pochlorawy i podbromawy. Są one najbardziej reaktywne w obecności
mocnego kwasu, gdy jednocześnie zapobiega się powstawaniu jonów
halogenkowych.
+
Cl
Cl
Cl
difenyl
HOCl , H
+
+
2-chlorodifenyl
3-chlorodifenyl
4-chlorodifenyl
Chlorowcowanie – c.d.
Chlorowcowanie – c.d.
+
H
+
HOCl
H
+
H
+
HOBr
H
HOCl
+
+
HOBr
H
2
OBr
+
O
H
2
Br
H
+
1
3
+
1
3
+
1
3
+
-H
Br
+
-
H
2
OCl
+
O
H
2
+
Cl
+
H
2
OBr
+
O
H
2
+
+
Br
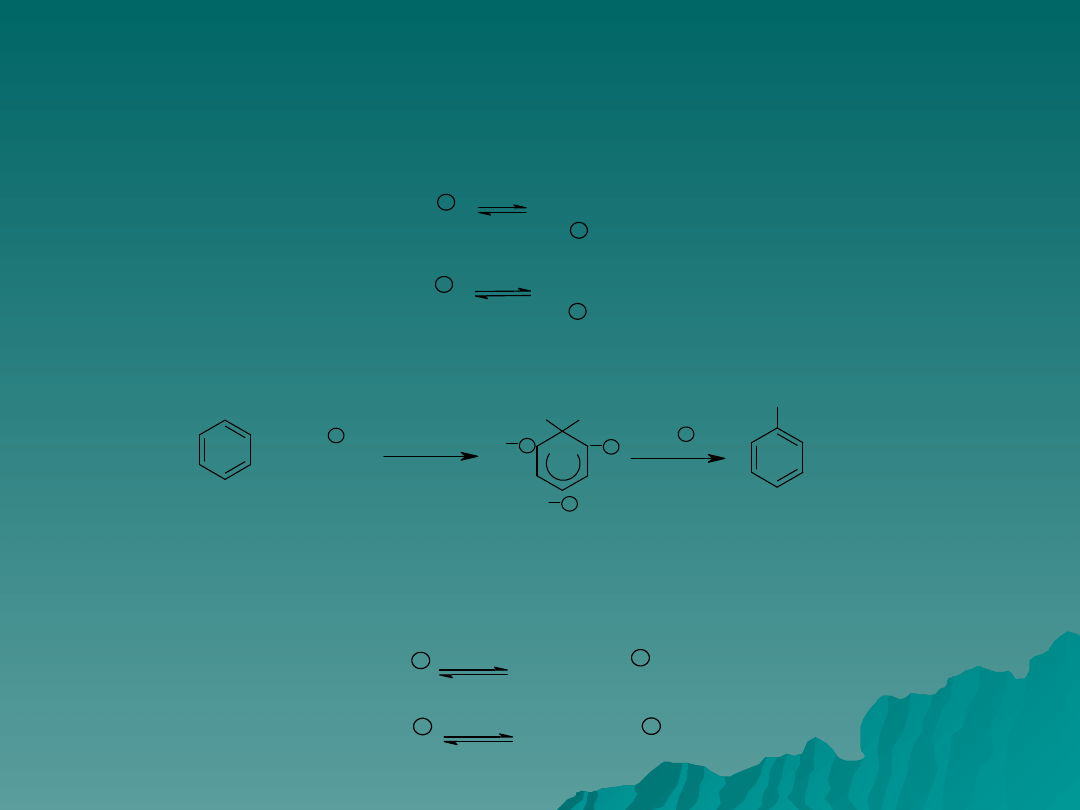
Działanie katalityczne mocnego kwasu polega na protonowaniu
niezdysocjowanej cząsteczki kwasu podhalogenowego.
Powstałe dodatnie jony są silnie elektrofilowe, uważa się je za aktywne
czynniki chlorowcujące.
Tracąc cząsteczkę wody stanowią źródło jonów chlorowych i bromowych
(aktywnych czynników chlorujących).
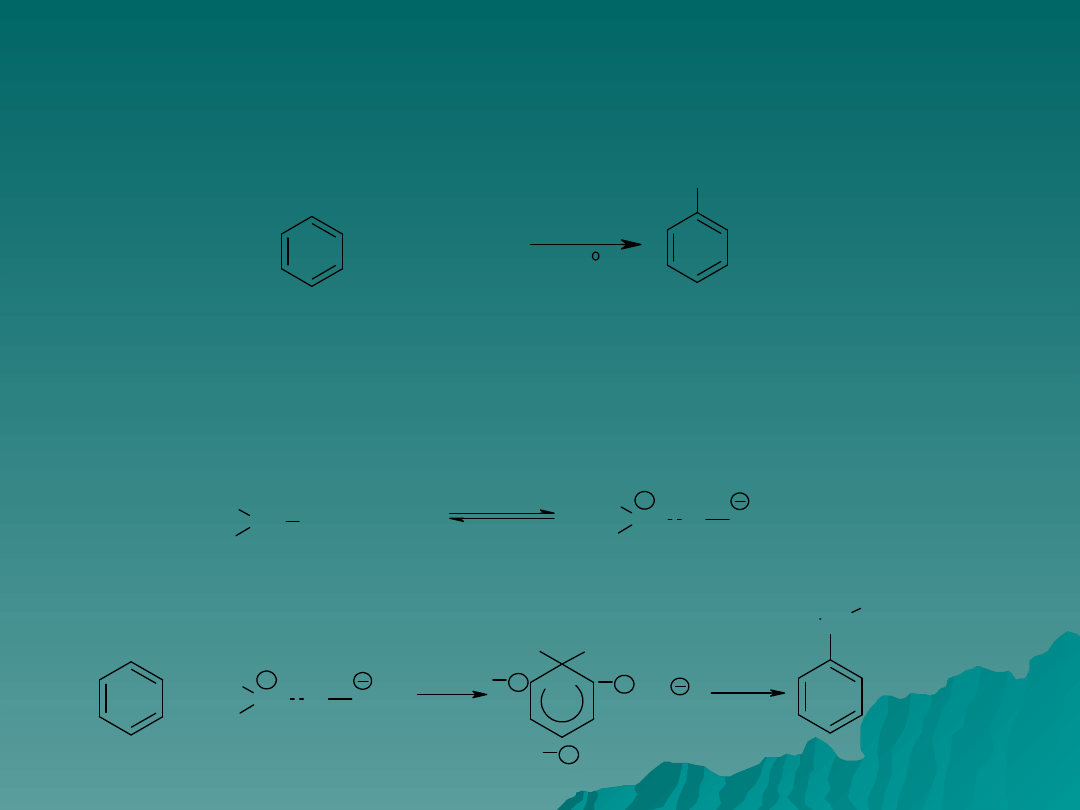
Alkilowanie
Alkilowanie
CH
3
CH
2
Br
AlCl
3
CH
2
CH
3
+
120
benzen
(duzy nadmiar)
bromek
etylu
etylobenzen
(83%)
C
H
3
C
H
3
CH Cl
AlCl
3
C
H
3
C
H
3
CH Cl
AlCl
3
+
+
C
H
3
C
H
3
CH Cl
AlCl
3
+
H
CH(CH
3
)
2
+
1
3
+
1
3
+
1
3
AlCl
4
CH
CH
3
CH
3
AlCl
3
Cl
H
+
+
+
kumen
(izopropylobenzen)
Metoda ta polega na użyciu chlorków alkilowych jako czynników alkilujących
oraz chlorków metali jako katalizatorów. Reakcje te znane są jako alkilowanie
metodą Friedla-Craftsa.
Działanie chlorków metali polega na wytworzeniu czynnika atakującego, który
jest rzeczywistym lub potencjalnym kationem – karbokationem.
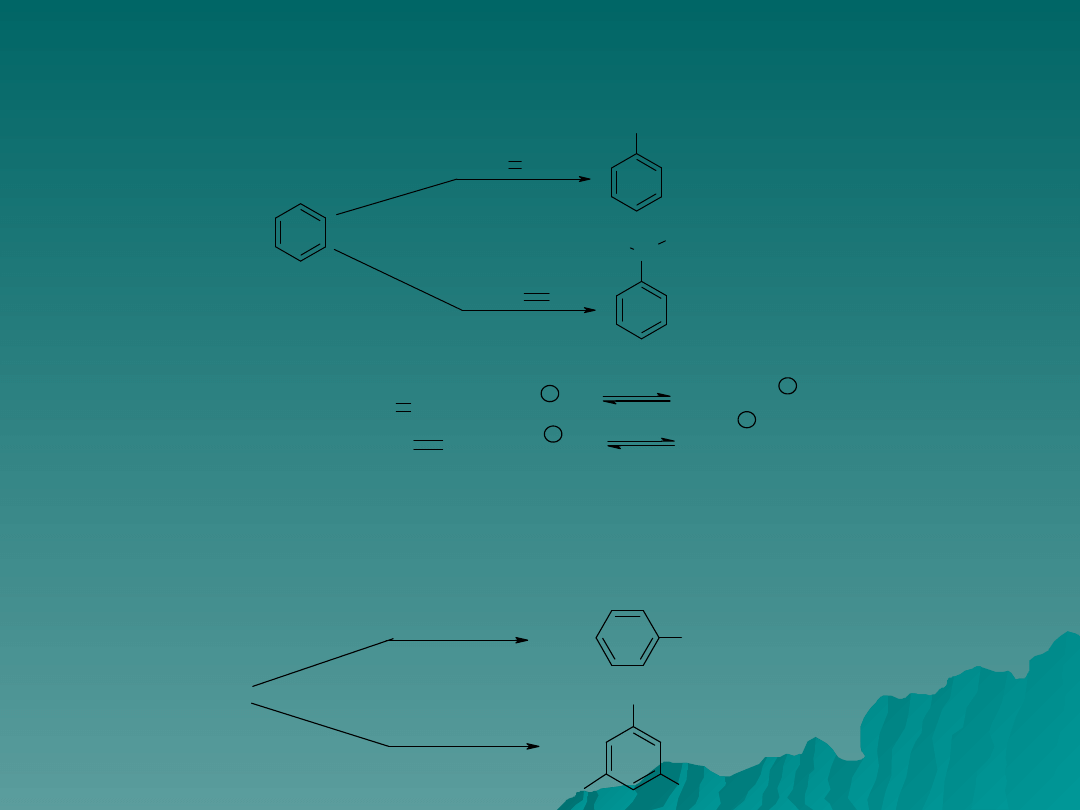
Alkilowanie – c.d.
Alkilowanie – c.d.
CH
2
CH
3
CH
CH
3
CH
3
CH
2
CH
2
H
3
PO
4
CH
3
CH
CH
2
H
3
PO
4
CH
2
CH
2
+
H
CH
3
CH
2
+
+
CH
3
CH
CH
2
+
H
CH
3
CHCH
3
+
+
Alkilowanie można również prowadzić za pomocą alkoholi i alkenów w
obecności katalizatorów kwasowych H
3
PO
4
, H
2
SO
4
, HF itp.
W ten sposób trzymuje się np. etylobenzen:
Karbokation jest w tych warunkach czynnikiem podstawiającym, tworzy się w
wyniku protonowania alkenu.
Alkilowanie jest ograniczone kilkoma czynnikami.
1. Trudno ograniczyć reakcję do powstawania monopochodnych, ponieważ
wprowadzenie jednej grupy alkilowej zwiększa aktywność pierścienia. Aby
uzyskać dość dobra wydajność należy użyć dużego nadmiaru benzenu.
CH
2
CH
3
CH
2
CH
3
CH
2
CH
3
CH
2
CH
3
AlCl
3
AlCl
3
C
2
H
5
Br
benzen(nadmiar)
benzen (0,3 mola)
etylobenzen
1,3,5-trietylobenzen
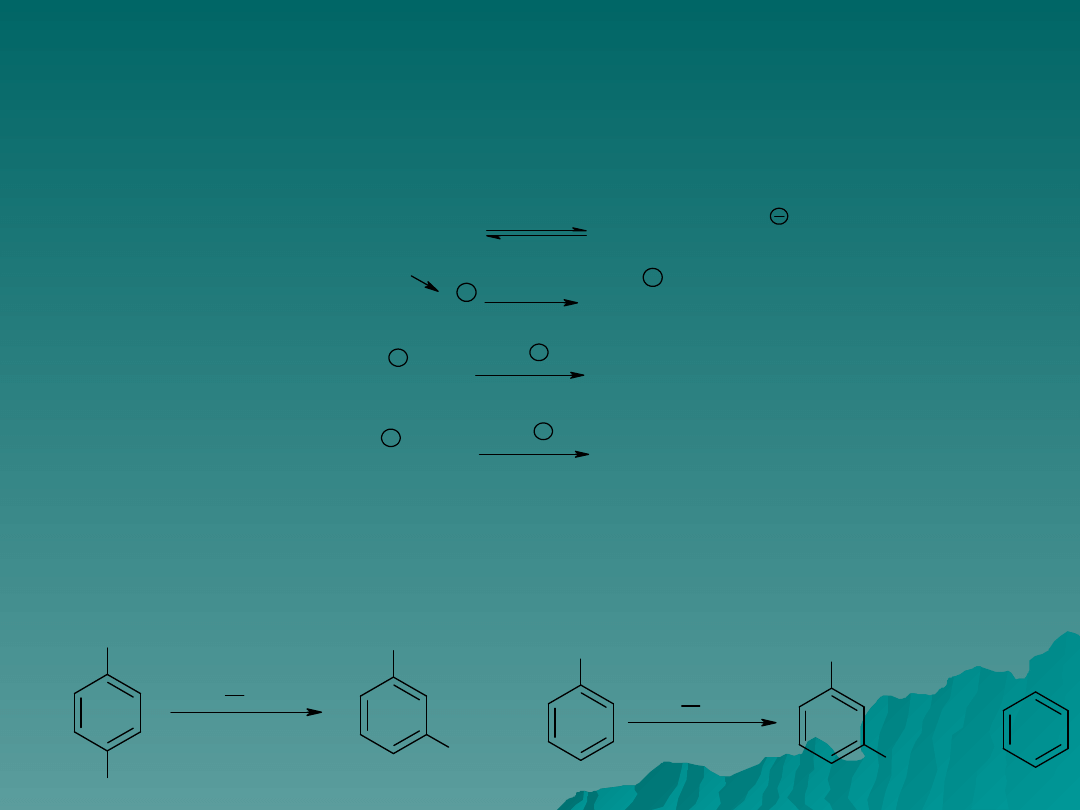
Alkilowanie – c.d.
Alkilowanie – c.d.
CH
3
CH
2
CH
2
Cl
AlCl
3
CH
3
CH
2
CH
2
AlCl
4
C
6
H
6
CH
3
CH
2
CH
3
+
+
H
C
6
H
5
CH
2
CH
2
CH
3
+
-
C
6
H
6
CH
3
CHCH
3
+
+
H
C
6
H
5
CH(CH
3
)
2
+
-
CH
3
CH
3
HF BF
3
CH
3
CH
3
C
2
H
5
HF BF
3
C
2
H
5
C
2
H
5
2
+
2. Czynnik alkilujący ma skłonność do tworzenia przegrupowanych
produktów, wynika to częściowo z dążenia karbokationów do tworzenia jak
najtrwalszych form.
np.. Alkilowanie benzenu chlorkiem n-propylowym prowadzi do
mieszaniny n-propylobenzenu i izopropylobenzenu.
CH
3
CHCH
2
..
H
+
CH
3
CHCH
3
+
3. Często występują izomeryzacje i dysmutacje produktów alkilowania,
zwłaszcza w obecności dużych ilości katalizatora. I tak katalizator
powoduje przemianę o- i p-ksylenu w izomer meta (a) oraz dysmutacje
etylobenzenu do benzenu i 1,3-dietylobenzenu (b).
a) b)

Acylowanie
Acylowanie
CH
3
CO Cl AlCl
3
+
H
COCH
3
+
1
3
+
1
3
AlCl
4
+
1
3
COCH
3
Cl
H
AlCl
3
+
+
+
+
fenylometyloketon
(acetofenon)
C
6
H
5
COCH
3
AlCl
3
C O AlCl
3
C
6
H
5
CH
3
+
kompleks 1:1
(RCO)
2
O
AlCl
3
+
RCO AlCl
4
RCO
2
AlCl
2
+
2
+
Polega na wprowadzeniu grupy acylowej RCO- do pierścienia aromatycznego i
powstawaniu ketonu arylowego. Czynnikami acylującymi są halogenki
kwasowe i bezwodniki kwasowe. Katalizator to zwykle chlorek glinu, jego
zadanie to wytworzenie aktywnego czynnika podstawiającego (zwykle kation
acyliowy).
W odróżnieniu od alkilowania acylowanie prowadzi się w rozpuszczalniku,
wymaga również zastosowania większej ilości katalizatora, jest on bowiem
usuwany ze środowiska w postaci kompleksu z powstałym ketonem.
Użycie bezwodnika kwasowego wymaga zastosowania jeszcze większej ilości
katalizatora, gdyż zużywa się dodatkowo w reakcji tworzenia kationu
acyliowego.
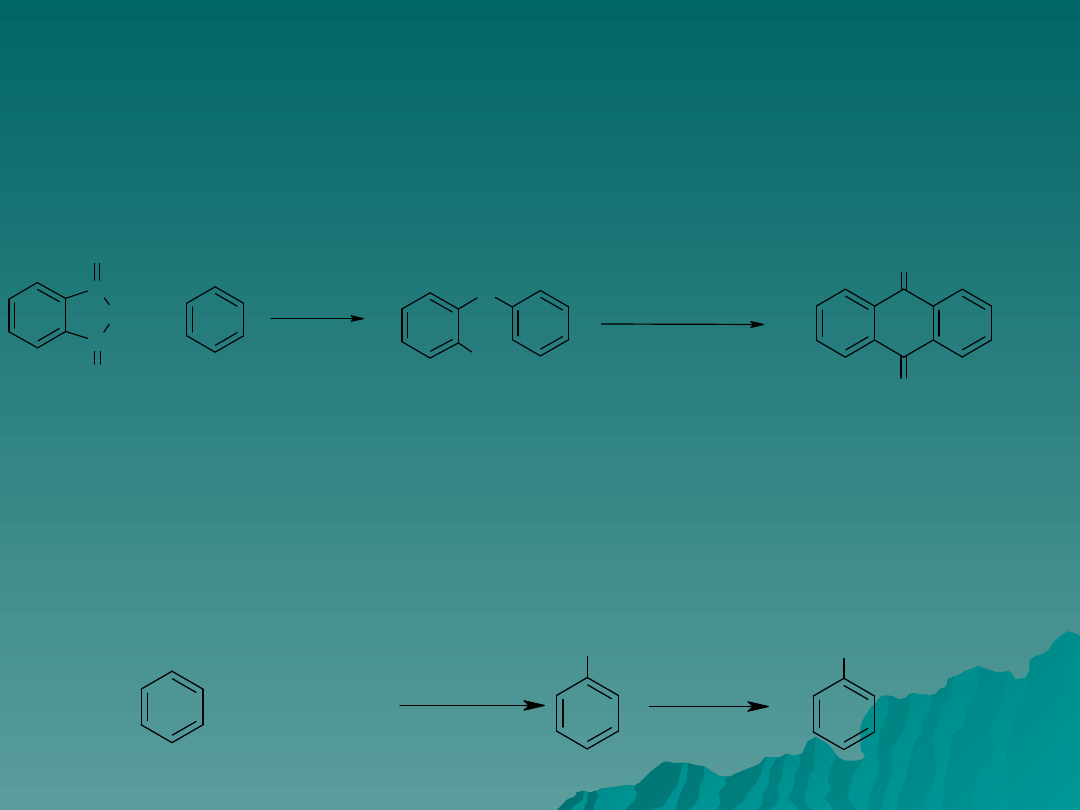
Acylowanie – c.d.
Acylowanie – c.d.
CH
3
CH
2
COCl
AlCl
3
COCH
2
CH
3
CH
2
CH
2
CH
3
n-propylobenzen
+
nitrobenzen
Zn , HCl
chlorek propionylu
H
2
SO
4
SO
3
O
H
2
O
O
,
-
antrachinon
Jako przykład otrzymywania jedynie pochodnych monopodstawionych może
służyć synteza antrachinonu z benzenu i bezwodnika ftalowego, w której
tworzy się bezpośrednio kwas o-benzoilobenzoesowy. Chlorek glinu
dostatecznie czynnym katalizatorem, ale konieczne jest użycie dymiącego
kwasu siarkowego.
C
100
O
C
O
O
AlCl
3
C
CO
2
H
+
kwas o-benzoilobenzoesowy
Reakcję acylowania można łatwo zatrzymać na etapie monopodstawienia,
ponieważ po wprowadzeniu jednej grupy acylowej nie jest możliwe
podstawienie drugiej do tego samego pierścienia.
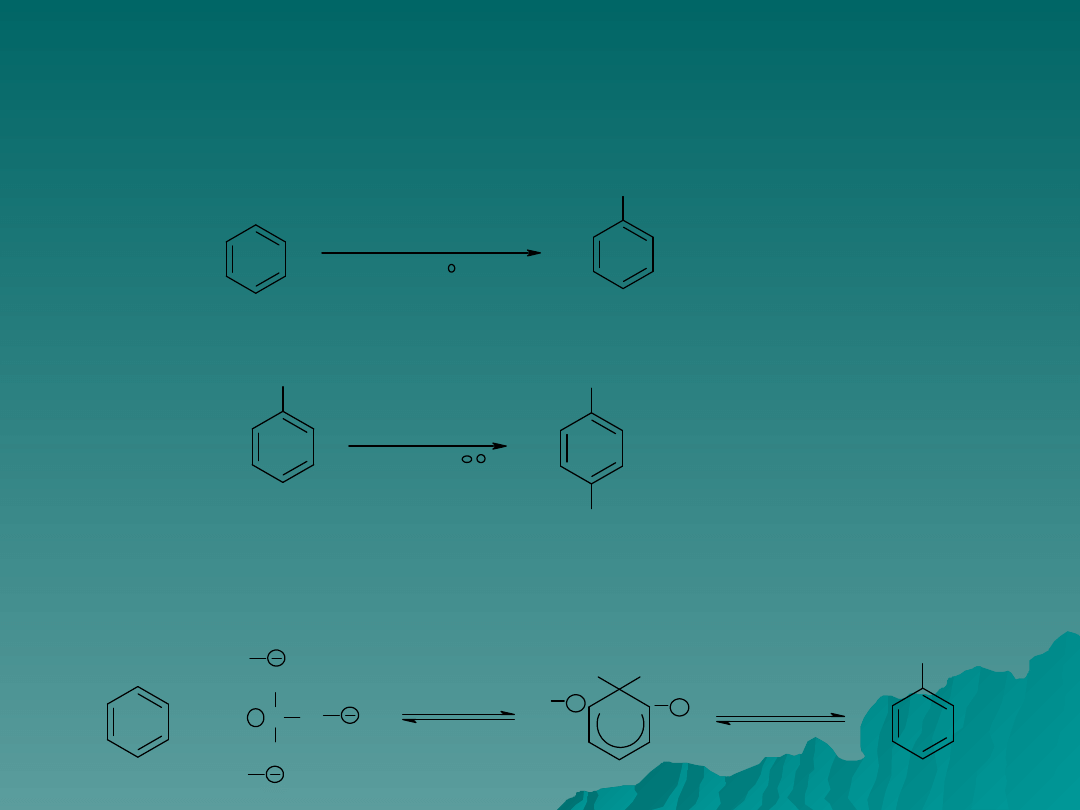
Najlepszym sposobem otrzymywania arenów jest przeprowadzenie reakcji
acylowania a następnie redukcji grupy karbonylowej np. otrzymywanie
n-propylobenzenu w dwustopniowej syntezie:
Sulfonowanie
Sulfonowanie
H
2
SO
4
SO
3
30-50
SO
3
H
,
kwas benzenosulfonowy
CH
3
H
2
SO
4
CH
3
SO
3
H
110 - 120
kwas p-toluenosulfonowy
S
O
O
O
+
1
3
1
3
1
3
SO
3
H
+
1
3
+
1
3
SO
3
H
+
Wymianę wodoru pierścienia aromatycznego na grupę sulfonową
przeprowadza się zwykle przez ogrzanie węglowodoru z niewielkim
nadmiarem stężonego lub dymiącego kwasu siarkowego.
Właściwym czynnikiem sulfonującym jest cząstka SO
3
, która zawiera silnie
elektrofilowy atom siarki.
Sulfonowanie – c.d.
Sulfonowanie – c.d.
SO
3
H
SO
3
H
H
2
SO
4
H
2
SO
4
120
160
-naftalenosulfonowy
kwas
-naftalenosulfonowy
kwas
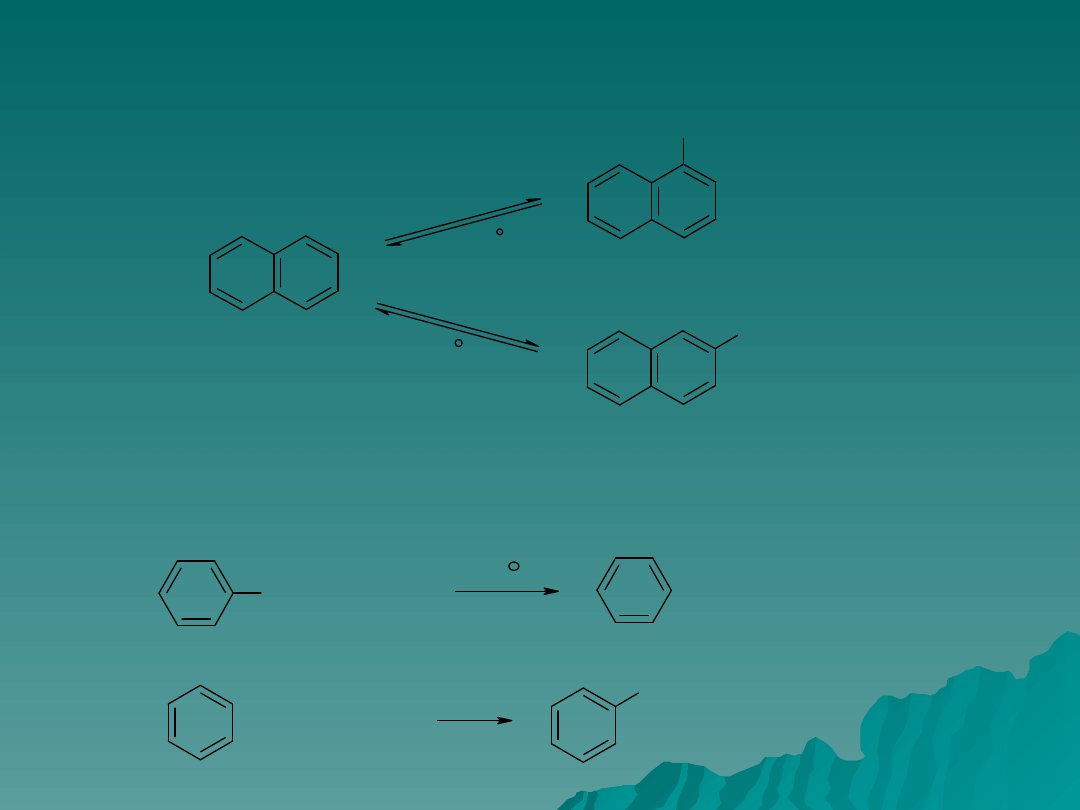
W zależności od temperatury prowadzenia reakcji np. dla naftalenu grupa
sulfonowa może podstawiać się w różnych pozycjach:
SO
3
H
O
H
2
H
2
SO
4
ClSO
3
H
SO
2
Cl
Cl
H
H
2
SO
4
+
180
+
+
2
+
+
chlorekbenzenosulfonylu
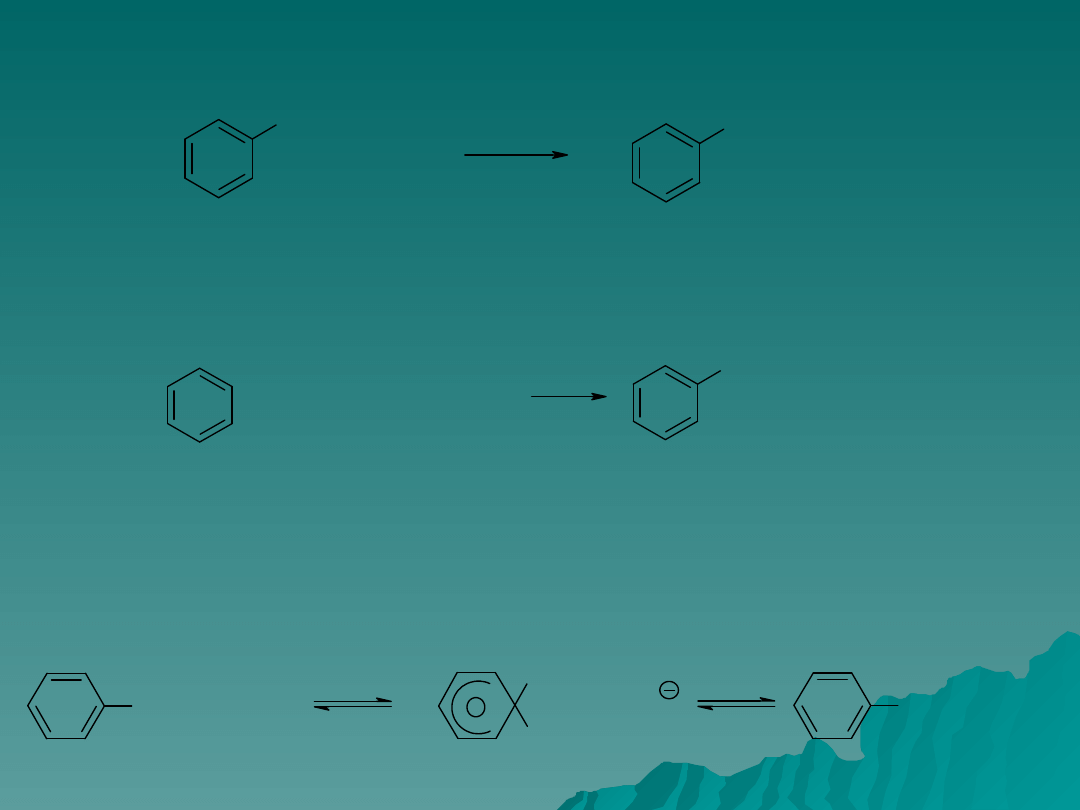
Z kwasów sulfonowych w wyniku dwustopniowej reakcji łatwo można
otrzymywać chlorosulfoniany:
SO
2
Cl
O
H
2
SO
3
H
+
+
HCl
H
2
SO
4
SOCl
2
SO
2
SO
3
H
+
+
+
+
HCl
+
H
D
2
SO
4
H
D
DSO
4
D
HDSO
4
+
+
+
Sulfonowanie – c.d.
Z chlorosulfonianów w wyniku reakcji z wodą powstają kwasy sulfonowe:
Wymianę wodoru pierścienia aromatycznego na grupę sulfonową można
przeprowadzić również w wyniku równoczesnego działania na związek
stężonego kwasu siarkowego i chlorku tionylu:
Deuterowanie
Deuterowanie polega na wymianie wodoru pierścienia aromatycznego na
atom deuteru w wyniku reakcji:

KONIEC
KONIEC
Wykonała:
Wykonała:
Magdalena Dalka
Magdalena Dalka
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
otrzymywanie-i-reakcje-weglowodorow-aromatycznych
otrzymywanie i reakcje weglowodorow aromatycznych
wyk 4 węglow aromat
WĘGLOWODORY AROMATYCZNE
BT węglowodory aromatyczne (wykład III)
kl 2, kartkowka-benzen, Benzen - C6H6 Wzór Elektronowy - 6¬¬C KL 1H K Węglowodory Aromatyc
Oznaczanie wybranych węglowodorów aromatycznych przy zastosowaniu chromatografii gazowej(1)
Węglowodory aromatyczne (2) ppt
Weglowodory aromatyczne Areny
węglowodory aromatyczne
Oznaczanie zawartości węglowodorów aromatycznych w paliwach dieslowych
10.Węglowodory aromatyczne, MATERIAŁY NA STUDIA, Chemia
16-WIELOPIERŚCIENIOWE WĘGLOWODORY AROMATYCZNE, kolo1
WĘGLOWODORY AROMATYCZNE
Węglowodory aromatyczne, chemia(2)
Biodegradacja węglowodorów aromatycznych, Naukowe PL, Biotechnologia, Enzymologia, Genetyka
Węglowodory aromatyczne i alkohole
4 Węglowodory aromatyczne 07 11 2015
więcej podobnych podstron