
Przeciwutleniacze są to substancje przedłużające trwałość środków
spożywczych poprzez zabezpieczenie ich przed rozkładem, takim jak
jełczenie i zmiana barwy, spowodowanym przez utlenianie. Konieczność
stosowania przeciwutleniaczy wynika z dużej podatności niektórych
produktów żywnościowych na utlenianie. Produkty nietłuszczowe ulegają
utlenieniu najczęściej przy udziale enzymów (oksydaz) znajdujących się
w surowcu (ciemnienie owoców, brunatnienie mięsa). Tym niekorzyst-
nym zjawiskom można zapobiegać, stosując termiczną dezaktywację
enzymów (blanszowanie owoców i warzyw). Oksydatywne jełczenie
tłuszczów w znacznym stopniu pogarsza cechy sensoryczne, a także
wartość odżywczą żywności. Wskutek rozrywania łańcuchów węglowych
powstają niskocząsteczkowe produkty, takie jak: węglowodory, aldehydy,
ketony, kwasy, estry, laktony, alkohole i etery. Charakterystyczny zapach
zjełczałego tłuszczu lub produktu żywnościowego zawierającego lipidy
wynika głównie z obecności w nim krótkołańcuchowych aldehydów
oraz powstających z nich kwasów. Przy daleko posuniętych zmianach
oksydacyjnych tłuszczów mogą powstawać również różne substancje
toksyczne, w tym wolne rodniki. Produkty utleniania lipidów mogą
niszczyć biologicznie czynne białka, działać mutagennie na kwasy
tłuszczowe oraz destrukcyjnie na karotenoidy i witaminę A. Utlenianie
lipidów prowadzi również do obniżenia zawartości niezbędnych niena-
syconych kwasów tłuszczowych (NNKT) i tokoferoli. Jełczeniu może
podlegać także żywność o stosunkowo niewielkiej zawartości tłuszczu,
ale dobrze rozwiniętej powierzchni (np. mąka).
Główną przyczyną niepożądanych zmian w wielu produktach spożyw-
czych są przemiany nienasyconych substancji tłuszczowych spowodowa-
ne utlenianiem. Przemiany te mogą zachodzić z udziałem lub bez udziału
enzymów. Utlenianie substancji tłuszczowych może przebiegać w dwóch
różnych kierunkach i według różnych mechanizmów, prowadzących do
nieco innych produktów reakcji. Jednym z kierunków reakcji utleniania
jest autooksydacja, która jest rodnikową reakcją łańcuchową. Zapocząt-
kowanie reakcji odbywa się poprzez oderwanie wodoru i utworzenie
węglowego rodnika alkilowego, który, reagując z tlenem, tworzy rodnik
nadtlenkowy. Utworzony rodnik nadtlenkowy reaguje z nienasyconym
lipidem, tworząc wodoronadtlenek oraz nowy rodnik lipidowy, który
w reakcji z tlenem tworzy nowy rodnik nadtlenkowy itd. Ta łańcucho-
wa reakcja może być zakończona na skutek rekombinacji rodników
z wytworzeniem nierodnikowych produktów. Problem autooksydacji
dotyczy w największym stopniu nienasyconych kwasów tłuszczowych,
a szybkość tej reakcji wzrasta wraz ze wzrostem stopnia nienasycenia.
Ze względu na niestabilność produktów pośrednich, złożony wpływ
katalizatorów i przeciwutleniaczy oraz jednoczesne odbywanie się reakcji
według innych mechanizmów, autooksydacja jest procesem skompliko-
wanym i nie w pełni poznanym. Drugim mechanizmem oksydacji jest
fotoutlenianie, obejmujące reakcje alkenu z tlenem w obecności światła
i odpowiedniego sensybilizatora, który przekształca tlen w jego bardziej
reaktywny stan singletowy. W tym stanie tlen przyłącza się do jednego
z węgli olefinowych podwójnego wiązania bez wytwarzania rodnika.
Reakcji tej towarzyszy migracja podwójnego wiązania i zmiana jego
konformacji cis w trans. Reakcja fotoutleniania jest znacznie szybsza niż
autooksydacji. Fotoutlenianie może być również przyczyną zainicjowa-
nia autooksydacji wskutek rodnikowego rozpadu wodoronadtlenków.
Procesy utleniania mogą być przyspieszane przez energię cieplną,
promieniowanie o dużej energii, katalityczne działanie metali ciężkich
oraz aktywność enzymatyczną. Działanie przeciwutleniaczy, zarówno
tych naturalnie występujących w żywności, jak i celowo dodawanych,
może być związane z bezpośrednim przerywaniem łańcuchowych reakcji
rodnikowych lub działaniem pośrednim poprzez wiązanie tlenu oraz
substancji katalizujących procesy utleniania.
Stosowanie przeciwutleniaczy jako dodatków do żywności reguluje
Rozporządzenie Ministra Zdrowia z dnia 23 kwietnia 2004 roku w spra-
wie dozwolonych substancji dodatkowych i substancji pomagających
w przetwarzaniu (Dz.U. nr 94, poz. 933) z późniejszymi zmianami
(Dz.U. 2005, nr 79, poz. 693). W tabeli 1 (s. 31) zestawiono przeciw-
utleniacze stosowane jako dodatki do żywności, ich symbole według
systemu oznaczeń UE, wartości akceptowanego dziennego pobrania
oraz maksymalne dopuszczalne dawki.
Charakterystyka
wybranych przeciwutleniaczy
Kwas askorbinowy (E 300) i jego sole (E 301 i E 302)
Kwas askorbinowy jest otrzymywany syntetycznie z sorbitolu na drodze
uwodornienia D(+)-glukozy. Jest łatwo rozpuszczalny w wodzie i podat-
ny na utlenianie podczas procesów technologicznych. W roztworach
dr inż. Lesław Juszczak
Katedra Analizy i Oceny Jakości Żywności, Akademia Rolnicza w Krakowie
Streszczenie
Przeciwutleniacze są to substancje przedłużające trwałość środ-
ków spożywczych poprzez zabezpieczenie ich przed rozkładem
spowodowanym utlenianiem. Konieczność ich stosowania wynika
z dużej podatności niektórych produktów żywnościowych na re-
akcje utleniania. W artykule przedstawiono wybrane właściwości
naturalnych i syntetycznych przeciwutleniaczy stosowanych jako
dodatki do żywności. Omówiono również wybrane metody anali-
tyczne stosowane przy ich oznaczaniu.
Summary
Antioxidants are the substances extending food stability by pro-
tecting them from disintegration caused by oxidation. Necessities
of using them result from the high susceptibility of some food
products to oxidation. The article presents some properties of
the natural and synthetic antioxidants used as food additives.
The selected analytical methods applied during their analysis
are also discussed.
Słowa kluczowe
dodatki do żywności, przeciwutleniacze, metody analityczne
Key words
food additives, antioxidants, methods of analysis
Przeciwutleniacze
jako dodatki do żywności oraz metody ich oznaczania
laboratorium przemysłowe
Laboratorium |
4
/2007
28

wodnych łatwo ulega utlenieniu do kwasu dehydroaskorbinowego,
szczególnie w obecności jonów żelaza i miedzi, a także pod wpływem
światła i enzymów. Pełni rolę przeciwutleniacza, regulatora kwasowości
oraz stabilizatora. Utleniając się, usuwa tlen rozpuszczony i wolny
ze środowiska oraz może redukować niektóre utlenione związki (np.
chinony do fenoli). Wykazuje ochronne działanie w krótkich okre-
sach, natomiast w podwyższonej temperaturze może niekorzystnie
wpływać na inne składniki żywności. Jako substancja silnie redukująca
utrwala naturalną barwę wielu surowców i produktów. Sprzyja także
zachowaniu stabilnej barwy mięsa. Chroni produkty żywnościowe,
a szczególnie rozdrobnione owoce i warzywa oraz napoje i soki, przed
oksydatywnym zbrunatnieniem. Zwiększa trwałość i zapobiega jełcze-
niu tłuszczów i substancji smakowych w produktach nietłuszczowych
(mąka, przetwory zbożowe, proszek mleczny, napoje, soki, mrożonki
i konserwy). Pozwala na ograniczenie dodatku azotanów(III) poprzez
znaczne przyspieszenie procesu peklowania mięsa. Jest również stosowa-
ny w piekarstwie jako polepszacz pieczywa. Znajduje także zastosowanie
jako czynnik ograniczający korozję opakowań metalowych. W orga-
nizmie człowieka pełni szereg ważnych funkcji biologicznych, stąd
jego dodatek wzbogaca żywność, produkty dietetyczne i odżywki dla
dzieci. Sole sodu i wapnia kwasu askorbinowego dzięki wolniejszemu
reagowaniu z azotanami(III) są stosowane w mieszankach peklujących.
Działają również jako inhibitory tworzenia się nitrozoamin w peklo-
wanym mięsie i jego przetworach.
Estry kwasów tłuszczowych i kwasu askorbinowego (E 304)
Do najważniejszych estrów kwasów tłuszczowych i kwasu askorbino-
wego należą palmitynian askorbylu (E 304(i)) oraz stearynian askor-
bylu (E 304(ii)). Stosowane są jako przeciwutleniacze i stabilizatory.
Wykazują silny synergizm z innymi przeciwutleniaczami, szczególnie
z tokoferolami. W przeciwieństwie do kwasu askorbinowego dobrze
rozpuszczają się w tłuszczach, co pozwala na ich stosowanie w pro-
duktach tłuszczowych nie poddawanych obróbce termicznej. Wykazują
również działanie emulgujące, a także zdolność kompleksowania ślado-
wych ilości metali. Stosowane są w produkcji suszu ziemniaczanego,
nadzień zawierających tłuszcz, przetworów mięsnych i drobiowych,
proszku mlecznego oraz odżywek dla dzieci.
Kwas izoaskorbinowy (E 315) i izoaskorbinian sodu (E 316)
Utleniają się szybciej niż kwas askorbinowy. Stosuje się je w celu ogra-
niczenia zmian barwy przetworów owocowych oraz mięsa. Znacznie
przyspieszają proces peklowania mięsa, ograniczając również dodatek
azotanów(III).
Tokoferole
Tokoferole otrzymywane są z kondensatów olejów pochodzących z za-
rodków nasion soi, kukurydzy, ryżu i bawełny lub syntetycznie. Dobrze
rozpuszczają się w tłuszczach i rozpuszczalnikach organicznych. Są
odporne na działanie zasad i kwasów, a także światła. Łatwo ulegają
utlenianiu. Funkcję fizjologiczną jako witamina E pełni głównie α-toko-
ferol. Ze względu na mniejszą efektywność oraz wyższą cenę tokoferole
naturalne mają ograniczone zastosowanie w praktyce przemysłowej.
Duże znacznie i zastosowanie jako czynniki przeciwutleniające mają
syntetycznie otrzymane γ- i δ-tokoferol.
Mieszanina tokoferoli (E 306)
Otrzymywana jest z surowców naturalnych na drodze destylacji próż-
niowej. Jest łatwo rozpuszczalna w olejach i tłuszczach oraz w etanolu.
Wykazuje działanie ochronne w stosunku do wielonienasyconych
29
laboratorium przemysłowe
Laboratorium |
4
/2007
29

kwasów tłuszczowych. Chroni również przed utlenianiem witaminę A.
Stosowana jest w odżywkach dla dzieci i preparatach dietetycznych,
a także w przemyśle farmaceutycznym. Tokoferole budzą najmniej
zastrzeżeń zdrowotnych spośród wszystkich przeciwutleniaczy stoso-
wanych jako dodatki do żywności.
α-tokoferol (E 307)
Jest otrzymywany syntetycznie przez kondensację 2,3,5-trimetylo-hy-
drochinonu z fitolem, izofitolem lub halogenkami fitalu. Używany jest
jako przeciwutleniacz oraz składnik odżywczy. Do witaminizowania
żywności stosowany jest w postaci bursztynianów i octanów. Chroni
wielonienasycone kwasy tłuszczowe oraz witaminę A.
γ-tokoferol (E 308) i δ-tokoferol (E 309)
Otrzymywane są syntetycznie jako produkty identyczne z naturalnymi.
Stosowane są jako przeciwutleniacze w produkcji olejów roślinnych,
tłuszczów jadalnych (piekarniczych i kuchennych), koncentratów zup
i sosów, przetworów ziemniaczanych, mas cukierniczych, gum do
żucia, aromatów owocowych oraz granulowanej herbaty. δ-tokoferol
wykazuje największą aktywność przeciwutleniającą spośród wszystkich
tokoferoli.
Galusan propylu (E 310), galusan oktylu (E 311),
galusan dodecylu (E 312)
Galusan propylu jest estrem n-propylowym kwasu 3,4,5-trihydrok-
sybenzoesowego, otrzymanym na drodze estryfikacji kwasu galu-
sowego alkoholem propylowym. Trudno rozpuszcza się w olejach
i tłuszczach, a znacznie lepiej w wodzie i etanolu, co znacznie
ogranicza jego zastosowanie w produktach tłuszczowych. Wykazuje
również ograniczoną stabilność termiczną, szczególnie w środowisku
alkalicznym. Najczęściej jest stosowany z BHT i BHA, z którymi
działa synergicznie. Galusan oktylu wykazuje również ograniczoną
rozpuszczalność w olejach, natomiast dobrze rozpuszcza się w etanolu.
Najlepiej rozpuszczalny w olejach, a najmniej – w wodzie jest galusan
dodecylu, ale jego efektywność przeciwutleniająca jest najmniejsza.
Galusany wykorzystywane są w produkcji olejów, tłuszczów jadalnych,
żywności typu „fast food”, gumy do żucia, płatków śniadaniowych
i innych przetworów zbożowych, past serowych, puree ziemniaczane-
go, pasztetów oraz przetworów mięsnych. W organizmie człowieka
galusany ulegają hydrolizie i są wydalane jako wolny kwas galusowy,
a także w połączeniach z kwasem glikuronowym. Wszystkie galusany
wykazują działanie alergizujące i mogą powodować stany zapalne skóry
i błon śluzowych. Mogą również niekorzystnie wpływać na metabolizm
żelaza w organizmie.
Butylohydroksyanizol (BHA) (E 320)
Stanowi mieszaninę 90-95% 3-tetr-4-hydroksyanizolu i około 5%
2-tetr-butylo-4-hydroksyanizolu. Dobrze rozpuszcza się w olejach
i tłuszczach i jest nierozpuszczalny w wodzie. Jest bardzo efektyw-
nym przeciwutleniaczem w tłuszczach pochodzenia zwierzęcego,
a nieco mniej w olejach roślinnych. Ogranicza jełczenie tłuszczów
oraz chroni przed utlenianiem witaminy rozpuszczalne w tłuszczach,
krótkołańcuchowe kwasy tłuszczowe, aromaty i barwniki. Wykazuje
efekt „carry through”, tj. przeniesienia podczas obróbki termicznej
działania przeciwutleniacza znajdującego się w oleju do produktu
końcowego (np. frytek, chipsów). Wykazuje działanie synergiczne
z BHT i galusanami. Stosowany jest również do impregnowania
materiałów opakowaniowych. Działa także hamująco na rozwój nie-
których pleśni i bakterii. Stosuje się go w produkcji olejów i tłuszczów
jadalnych, tłuszczu mlecznego, aromatów i olejków eterycznych,
płatków śniadaniowych oraz innych przetworów zbożowych, prze-
tworów z ziemniaków, pieczywa cukierniczego, ciast, marcepanu,
koncentratów zup i bulionów oraz gumy do żucia. Nie jest zalecany
w produktach i odżywkach dla dzieci.
Butylohydroksytoluen (BHT) (E 321)
Wykazuje podobne właściwości jak BHA, jednak jest mniej odporny
na podwyższoną temperaturę. Zazwyczaj jest stosowany łącznie z BHA
i galusanem propylu. Wykazuje również działanie bakteriostatyczne.
Nie jest zalecany w produktach i odżywkach dla dzieci. Butylohy-
droksytoluen, podobnie jak BHA, jest dobrze wchłaniany z przewodu
pokarmowego i odkłada się w tkance tłuszczowej. Jego duże dawki
mogą mieć działanie uczulające i teratogenne. Zaburzają również
metabolizm witaminy K.
Obok typowych przeciwutleniaczy istotną rolę w hamowaniu
procesów utleniania składników żywności odgrywa grupa dodatków
zwanych synergentami. Wspomagają one i przedłużają działanie prze-
ciwutleniaczy. Mechanizm ich działania polega na aktywowaniu funkcji
przeciwutleniacza oraz kompleksowaniu śladów metali ciężkich, które
w sposób istotny katalizują procesy utleniania. Do najważniejszych
synergentów zalicza się: wersenian wapniowo-sodowy (EDTA) (E 385),
kwasy: cytrynowy (E 330), winowy (E 334) i jabłkowy (E 296), lecytynę
(E 322), difosforany(V), niektóre aminokwasy i peptydy.
Sól wapniowo-disodowa kwasu etylenodiaminotetraoctowego
(EDTA)
(ADI = 0-2,5 mg/kg mc.) jest bardzo silnym sekwestrantem.
Ma zdolność wiązania jonów metali wielowartościowych, zwiększając
w ten sposób trwałość produktów. Zapobiega zmianom barwy wy-
wołanym obecnością jonów żelaza, miedzi, manganu i cynku. Działa
synergicznie z przeciwutleniaczami i konserwantami. Ponadto wykazuje
działanie bakteriostatyczne. Stosowana jest dla utrzymania właściwej
barwy konserw warzywnych i kompotów, bierze również udział w za-
chowaniu klarowności win i napojów. Znajduje także zastosowanie
w przemyśle koncentratów spożywczych, sosów, dresingów, majonezów
i sałatek warzywnych.
Lista syntetycznych przeciwutleniaczy jest oczywiście znacznie
większa. Niektóre z nich są dopuszczone do stosowania w paszach
i karmach dla zwierząt, przemyśle kosmetycznym oraz w przemyśle
spożywczym w krajach spoza Unii Europejskiej [np. ethoxyquin
(EQ), kwas nordihydrogwajaretowy (NDGA), tetr-butylohydrochinon
(TBHQ)].
Tetr-butylohydrochinon (INS 319), stosowany np. w USA, jest łatwo
rozpuszczalny w tłuszczach i olejach. Tymczasowa wartość akceptowa-
nego dziennego pobrania (ADI) dla TBHQ wynosi 0-0,7 mg/kg masy
ciała. Jest jednym z najbardziej efektywnych przeciwutleniaczy, szcze-
gólnie w odniesieniu do wielonienasyconych kwasów tłuszczowych.
Wykazuje efekt „carry through”. Nie tworzy barwnych kompleksów
z jonami miedzi lub żelaza. Odznacza się również właściwościami bakte-
riostatycznymi w stosunku do niektórych drobnoustrojów. Stosowany
jest w produkcji olejów i tłuszczów jadalnych, pasztetów i wyrobów
garmażeryjnych, żywności typu „fast food”, płatków śniadaniowych
oraz przetworów ziemniaczanych.
Ponieważ zarówno kwas askorbinowy, jak i jego pochodne oraz
tokoferole nie są limitowanymi (z wyjątkiem środków spożywczych
przeznaczonych dla dzieci i niemowląt) dodatkami do żywności i nie
budzą większych obaw toksykologów, a procedury ich oznaczania są
takie same jak dla witamin, w pracy dokonano przeglądu jedynie metod
stosowanych w analizie typowych przeciwutleniaczy syntetycznych.
laboratorium przemysłowe
Laboratorium |
4
/2007
30
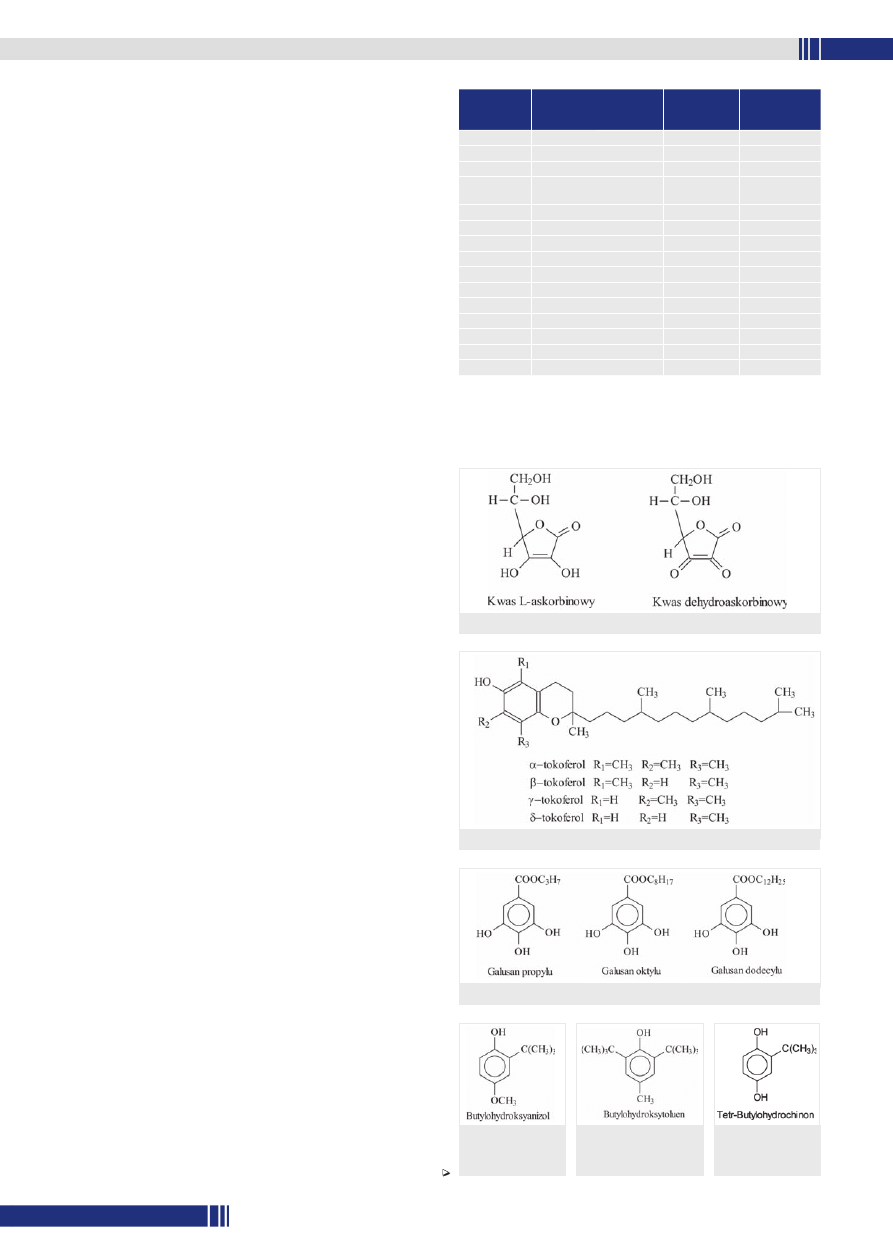
Rys. 4. Struktura
chemiczna butylo-
hydroksyanizolu
Metody analityczne stosowane
w analizie galusanów, BHA i BHT
Większość procedur analitycznych opisujących ilościowe oznacze-
nie syntetycznych przeciwutleniaczy w żywności poprzedzona jest
opisem separacji oznaczanych substancji z matrycy. Stosuje się tutaj
destylację z parą wodną, destylację próżniową oraz ekstrakcję, często
z późniejszym oczyszczaniem uzyskanego ekstraktu na drodze roz-
działu ciecz/ciecz lub na kolumnach wypełnionych odpowiednim
złożem. Jako czynniki ekstrahujące stosuje się acetonitryl, heksan,
chloroform, etanol, metanol, propanol, eter naftowy, dimetylo-
sulfotlenek oraz ich mieszaniny. W przypadku próbek o dużej
zawartości tłuszczu można zastosować ekstrakcję przeciwutleniaczy
wraz z tłuszczem w aparacie Soxhleta za pomocą eteru naftowego
lub innego rozpuszczalnika, a następnie ekstrakcję przeciwutleniaczy
z wyekstrahowanego tłuszczu surowego. Opisane są również proce-
dury podwójnej ekstrakcji – w pierwszej ekstrahowane są galusany
przy użyciu np. octanu amonu, natomiast w drugiej – z roztworem
etanolu lub metanolu – BHA i BHT. Najprostszym testem jakościo-
wym służącym do wykrywania dodatku syntetycznych przeciwutle-
niaczy jest metoda AOAC (965.28). Polega ona na rozpuszczeniu
próbki tłuszczu w eterze naftowym, ekstrakcji, odparowaniu eteru,
rozpuszczeniu pozostałości w alkoholu i dodatku wodorotlenku
amonu. Występowanie różowego zabarwienia świadczy o obecności
galusanu propylu. W tej samej procedurze BHA wykrywany jest
w reakcji z odczynnikiem Ehrlicha [roztwór azotanu(III) sodu
z kwasem sulfanilowym], dając czerwonopurpurowe zabarwienie.
Natomiast w przypadku BHT eterowy roztwór tłuszczu oczyszcza
się za pomocą kolumny wypełnionej Florosilem oraz dodaje diani-
zydynę, roztwór azotanu(III) sodu i chloroform. Jeżeli po wymie-
szaniu i rozdzieleniu faza chloroformowa jest zabarwiona na kolor
różowy lub czerwony, w próbce obecny jest BHT. Do oznaczania
syntetycznych przeciwutleniaczy opracowanych jest również kilka
metod kompleksometrycznych. W jednej z nich próbkę rozpuszcza
się w eterze naftowym, galusan propylu ekstrahuje wodą i następnie
wytrąca z Mg(II), uzyskany osad rozpuszcza się i dodaje EDTA,
którego nadmiar oznacza się z Zn(II).
W metodach spektrofotometrycznych wykorzystuje się absorpcję
roztworów syntetycznych przeciwutleniaczy w zakresie ultrafioletu.
Etanolowe roztwory galusanów wykazują maksimum absorpcji przy
λ = 275 nm, BHA – przy λ = 290 nm, a BHT – przy λ = 278 nm.
Metody te mają zastosowanie dla próbek, w przypadku których łatwo
określić wpływ absorpcji matrycy. W wielu przypadkach konieczne
jest zastosowanie wielokrotnych ekstrakcji z wykorzystaniem różnych
rozpuszczalników lub ich mieszanin oraz dodatkowym oczyszczaniem
ekstraktów. W literaturze opisanych jest również wiele metod spek-
trofotometrycznych opartych na pomiarach absorbancji w zakresie
widzialnym przez barwne kompleksy z odpowiednimi reagentami,
tworzone najczęściej w reakcjach wykorzystujących właściwości
redukujące przeciwutleniaczy. Przykładami takich metod są reakcja
redukcji jonów żelaza(III) i formowanie barwnych kompleksów
w obecności jonów żelaza(II). W oznaczaniu galusanów można
również wykorzystać reakcję z winianem żelaza(II) (AOAC 952.09)
lub siarczanem(VI) żelaza(II), a następnie ekstrakcję alkoholem izo-
amylowym i pomiar absorbancji przy λ = 530-580 nm. W przypadku
BHA stosuje się reakcję z odczynnikiem Gibba, w której powstaje
niebieska pochodna indofenolu, lub z odczynnikiem Ehrlicha, pod-
czas której tworzy się czerwonopurporowy barwnik azowy. Reakcją
specyficzną dla BHT jest wykorzystanie dianizydyny w obecności
kwasu azotowego(III), wskutek czego powstaje barwny chromogen,
Numer wg
systemu
oznaczeń UE
Nazwa
ADI
[mg/kg masy
ciała]
Maksymalna
dawka
[mg/kg]
E 300
Kwas askorbinowy
nie określone
–
1
E 301
Askorbinian sodu
nie określone
–
1, 2
E 302
Askorbinian wapnia
nie określone
–
1, 2
E 304
Estry kwasów tłuszczowych
i kwasu askorbinowego
0-1,25
–
1, 3, 6
E 306
Mieszanina tokoferoli
0-2,0
–
1, 4
E 307
α-tokoferol
0,15-2,0
–
1, 4, 6
E 308
γ-tokoferol
0,15-2,0 –
1, 4, 6
E 309
δ-tokoferol
0,15-2,0
–
1, 4, 6
E 310
Galusan propylu
0-1,4
200-1000
E 311
Galusan oktylu
0-0,1
200
E 312
Galusan dodecylu
nie określone
200
E 320
Butylohydroksyanizol (BHA)
0-0,5
100
E 320
Butylohydroksytoluen (BHT)
0-0,3
25-400
E 315
Kwas izoaskorbinowy
nie określone
500-1500
E 316
Izoaskorbinian sodu
nie określone
500-1500
Tabela 1. Przeciwutleniacze stosowane w przetwórstwie żywności
1 – nie limituje się, 2 – limitowany w odżywkach dla niemowląt i dzieci (0,3 g/kg),
3 – limitowany w odżywkach dla niemowląt i dzieci (0,1 g/kg), 4 – limitowany
w odżywkach dla niemowląt i dzieci (10 mg/l), 5 – limitowany w oliwie z oliwek
(200 mg/l), 6 – limitowany w przetworach zbożowych dla dzieci (0,1 g/kg)
Rys. 1. Struktura chemiczna kwasu L-askorbinowego i dehydroaskorbinowego
Rys. 2. Struktura chemiczna tokoferoli
Rys. 3. Struktura chemiczna galusanów
Rys. 6. Struktura
chemiczna tetr-
butylohydrochinonu
Rys. 5. Struktura
chemiczna butylo-
hydroksytoluenu
31
laboratorium przemysłowe
Laboratorium |
4
/2007
31

który ekstrahuje się chloroformem. Jeszcze innym przykładem ozna-
czania zawartości BHT jest reakcja z p-nitroaniliną.
Metody chromatograficzne są najbardziej rozwiniętymi i najlepiej
opracowanymi technikami analizy substancji przeciwutleniających.
Podstawowymi metodami w tym zakresie są chromatografia bibułowa
i cienkowarstwowa. Ich ogromną zaletą są niskie koszty wyposażenia
oraz prostota analiz. Chromatografia cienkowarstwowa jest znacznie
szybsza niż bibułowa, jednak charakteryzuje się gorszą powtarzalnością.
Ze względu na różną polarność syntetycznych przeciwutleniaczy często
stosuje się również chromatografię bibułową w odwróconym układzie
faz. Rozpuszczalnikami najczęściej stosowanymi do rozdziału przeciw-
utleniaczy metodą chromatografii bibułowej są: roztwory metanolu,
etanolu, dioksanu, octanu etylu i metylu, aceton, tetrachlorek węgla
oraz ich mieszaniny. Natomiast reagentami wywołującymi chromato-
gramy mogą być np. kwas molibdenofosforowy lub azotan(VI) sodu
w obecności amoniaku. W chromatografii cienkowarstwowej jako fazy
stacjonarne są stosowane modyfikowane żele krzemionkowe (czasem
z dodatkiem fluorescencyjnego indykatora), acetylowana celuloza,
tlenek glinu lub poliamidy. Poza rozpuszczalnikami stosowanymi
w chromatografii bibułowej można tu wykorzystać również: benzen,
ksylen, chloroform, propanol, glikol polietylenowy oraz ich mieszaniny.
Jako substancji wywołujących używa się: kwasu fosforomolibdenowego,
kwasu sulfanilowego, azotanu(V) srebra, dianizydyny, siarczanu(VI) że-
laza(III), odczynnika Folin-Ciocalteau, chlorku żelaza(III) w dipirydolu
oraz odczynnika Gibba.
Chromatografia gazowa z wielu względów jest bardzo wartościo-
wym narzędziem w analizie przeciwutleniaczy. Metoda ta charaktery-
zuje się dużą selektywnością, czułością i małą czasochłonnością. Takie
przeciwutleniacze jak BHA i BHT mogą być oznaczane bezpośrednio,
natomiast w przypadku bardziej polarnych galusanów przed rozdziałem
przeprowadza się je w lotne pochodne. Stosuje się zarówno kolumny
nisko polarne, jak i polarne, termostatowane w szerokim zakresie
temperatur. Jako fazy ruchome znajdują zastosowanie azot, argon i hel.
Najczęściej stosowanymi detektorami w analizie przeciwutleniaczy są:
detektor płomieniowo-jonizacyjny, cieplno-przewodnościowy oraz
wychwytu elektronów. Opisane są również procedury z zastosowaniem
technik sprzężonych GC-IR i GC-MS. Przykładem metody oznacza-
nia BHT, BHA i EQ w paszach z wykorzystaniem chromatografii
gazowej jest procedura podana w normie PN-R-64786. Przewiduje
ona ekstrakcję przeciwutleniaczy, w zależności od rodzaju próbki, za
pomocą metanolu, n-heksanu lub aceonitrylu, a następnie rozdział
chromatograficzny w kolumnie szklanej (210°C, gaz nośny – azot)
i detekcję z wykorzystaniem detektora płomieniowo-jonizacyjnego
(250°C). Podobne warunki oznaczania BHT i BHA w zbożowych
płatkach śniadaniowych z ekstrakcją za pomocą disiarczku węgla podaje
norma AOAC 968.17. W przypadku bardziej polarnych i mniej lotnych
galusanów przeprowadza się je przed rozdziałem w lotne pochodne,
na drodze metylacji, acetylacji lub trimetylo-sililacji. Istnieją również
procedury opisujące równoczesne oznaczanie BHA i BHT oraz galu-
sanów po przeprowadzeniu ich w lotne pochodne.
Chromatografia cieczowa, a w szczególności wysokosprawna
chromatografia cieczowa, znajduje szerokie zastosowanie w analizie
przeciwutleniaczy w żywności. Pozwala na szybki rozdział i analizę
ilościową nielotnych i termicznie labilnych związków. W literaturze
opisanych jest wiele procedur oznaczania pojedynczych, a częściej
mieszanin syntetycznych przeciwutleniaczy w żywności. Pozwala
ona także na rozdział izomerów BHA. Sam proces rozdzielania
oznaczanych przeciwutleniaczy może odbywać się w normalnym lub
odwróconym układzie faz, a także z zastosowaniem chromatografii
par jonowych, jonowymiennej lub micelarnej. Zastosowanie znajduje
szeroka gama faz stacjonarnych oraz eluentów, zarówno w elucji
izokratycznej, jak i gradientowej. Najczęściej stosuje się kolumny
typu: BondaPak C18, z wypełnieniem Corasil II, LiChrosorb RP18,
NovaPak C18, Spherisorb i Ultrasphere ODS, LiChrosrb NH
2
i inne. Fazami ruchomymi, często w elucji gradientowej, mogą być:
cykloheksan, tetrahydrofuran, n-heptan, dichlorometan, metanol,
acetonitryl, dioksan, octan amonu, propanol oraz różne bufory
i ich mieszaniny. Podstawową detekcją jest detekcja w ultrafiolecie
w zakresie od około 235 nm do 360 nm. Opisane są również pro-
cedury z zastosowaniem innych detektorów: fluorymetrycznego,
amperometrycznego, z matrycą diodową oraz elektrochemicznego.
Przykładem procedury z zastosowaniem HPLC jest metoda AOAC
983.15, opisująca oznaczanie przeciwutleniaczy w olejach i tłuszczach
jadalnych. Według niej przeciwutleniacze ekstrahuje się acetonitrylem,
a ekstrakt zagęszcza i rozpuszcza w propanolu. Rozdziału dokonuje
się w kolumnie typu C18 z żelem krzemionkowym, stosując elucję
gradientową (roztwór kwasu octowego i acetonitryl-metanol) oraz
detekcję przy λ = 280 nm.
Pozostałe metody. Wśród innych metod analitycznych stoso-
wanych w oznaczaniu syntetycznych przeciwutleniaczy w żywności
należy wymienić techniki woltametryczne z zastosowaniem elektrod
rtęciowych, węglowych i platynowych. Opracowano także metody
wykorzystujące analizę przepływowo-wstrzykową z detekcją elektro-
chemiczną lub z biosensorem enzymatycznym, które ze względu na
możliwości zanalizowania wielu próbek w krótkim czasie mogą być
wykorzystywane w rutynowych analizach. Opisane są również metody
fluorymetryczne oznaczania przeciwutleniaczy z wykorzystaniem np.
reakcji galusanu propylu z terbem(III) w obecności siarczanu dode-
cylu. Opracowano również metodę chemiluminescencyjną opartą
na unieruchomionym na membranie celulozowej układzie luminal/
/hematyna. Ponadto do oznaczania syntetycznych przeciwutleniaczy
zaproponowano takie metody instrumentalne, jak: spektroskopia
w podczerwieni, micelarna elektrokinetyczna chromatografia kapi-
larna oraz strefowa elektroforeza kapilarna.
Piśmiennictwo
1. AOAC Official Methods of Analysis. 1995.
2. Gertig H.: Żywność a zdrowie. Wydawnictwo Lekarskie PZWL,
Warszawa 1996.
3. Karovičcová J., Šimko P.: Determination of synthetic phenolic antioxi-
dants in food by high-performance liquid chromatography. “Journal of
Chromatography A”, 2000, 882, 271-281.
4. Nollet L.M.L. (ed.): Food analysis by HPLC. Second edition. Marcel
Dekker, Inc., New York, Basel 2000.
5. Nollet L.M.L. (ed.): Handbook of food analysis. Second edition. Vol. 2.
Residues and other food component analysis. Marcel Dekker, Inc., New
York, Basel 2004.
6. PN-R-64786-1997 Pasze. Oznaczanie BHT, BHA, EQ.
7. Pokorny J., Yanishlieva N., Gordon M. (eds.): Antioxidants in food.
Practical applications. CRC Press, Woodhead Publishing Limited,
Cambridge, England 2001.
8. Rutkowski A., Gwiazda S., Dąbrowski K.: Kompendium dodatków do
żywności. Hortimex, Konin 2003.
9. Sikorski Z.E. (red.): Chemia żywności – skład, przemiany i właściwości
żywności. WNT, Warszawa 2000.
10. Wood R., Foster L., Damant A., Key P.: Analytical methods for food
additives. CRC Press, Woodhead Publishing Limited, Cambridge,
England 2000.
laboratorium przemysłowe
Laboratorium |
4
/2007
32
Wyszukiwarka
Podobne podstrony:
Syntetyczne barwniki jako dodatki do żywnosci
Skrobie modyfikowane jako dodatki do żywności
instrumenty ochrony powietrza oraz metody ich wykorzystania
Dodatki do żywności – Lista E
ZNACZENIE I KONSEKWENCJE STOSOWANIA DODATKOW DO ZYWNOSCI W TYM KONSERWANTOW
Autentyczność i zafałszowania produktów zbożowych i jaj oraz metody ich wykrywania(1)(1)(1)
3 Mechanizm powstawania odruchów warunkowych oraz metody ich badania
Środki konserwujące w zywności i metody ich oznaczania
rozporzadzenie dodatków do żywności
dodatki do żywności [office 97]
żywienie-folie, DODATKI DO ŻYWNOŚCI , DODATKI DO ZYWNOSCI
LISTA DODATKÓW DO ŻYWNOŚCI, Medycyna Naturalna
II rok Dodatki do żywności material
Chemia 3 12 2010 Dodatki do żywności
OSTRE ZATRUCIA ORAZ METODY ICH LECZENIA
dodatki do żywności
w jaki sposob dodatki do zywnosci i konserwanty
Chemiczne zanieczyszczenia żywności i metody ich oznaczania
więcej podobnych podstron