
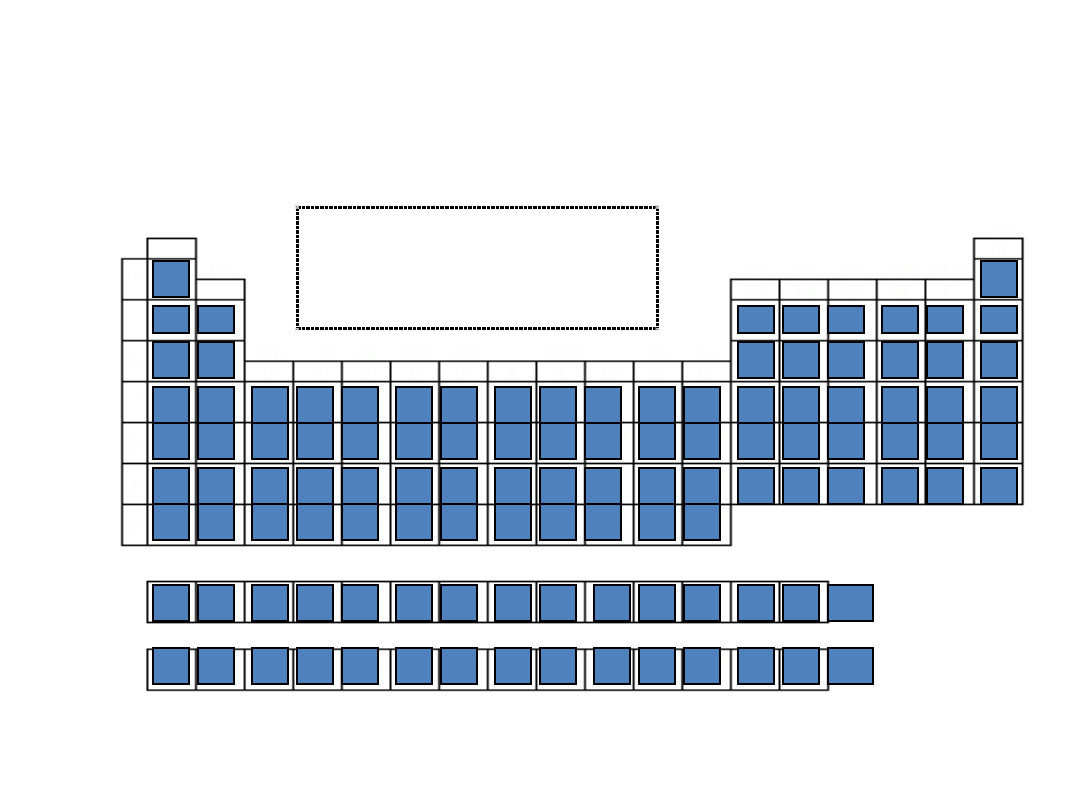
Układ okresowy
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
8
H
He
Li
Na
Be
B
C
N
O
F
Ne
Mg
Al
Legenda:
Niemetale
Półmetale
Metale
Si
P
S
Cl
Ar
K
Ca
Sc Ti
V
Cr Mn Fe Co Ni
Cu Zn
Ga
Ge As
Se Br
Kr
Rb Sr
Y
Zr Nb
Mo Tc
Ru Rh Pd
Ag Cd
In
Sn
Sb
Te
I
Xe
Cs Ba
*
Hf Ta
W Re
Os Ir
Pt
Au Hg
Tl
Pb Bi
Po
At
Rn
Fr
Ra
** Rf Db
Sg Bh
Hs Mt Uun Uuu Uub
1
2
3
4
5
6
7
La Ce
Pr Nd Pm Sm Eu
Gd Tb
Dy Ho Er
Tm Yb Lu
Ac Th
Pa U
Np
Pu Am Cm Bk
Cf Es Fm Md No Lr
Strona główna
*Lantanowce
**Aktynowce
Astat
Astat
85
At - pierwiastek chem. z bloku p, grupy 17; niestabilny półmetal, otrzymywany jest
przez bombardowanie tarcz bizmutowych cząstkami α o wysokiej energii (po raz pierwszy
dokonali tego 1940 D.R. Corson, K.R. McKenzie i E.G. Segré):
209
Bi +
42
He ŕ
212
At + 210 n
Astat jest łatwo lotny, rozpuszcza się w niektórych substancjach organicznych. Znanych
jest 29 izotopów astatu, najdłużej życiowy
210
At ma okres półrozpadu T
1/2
= 8,3 godz. W
związkach chemicznych astat przyjmuje stopnie utlenienia: -1, +1, +5. Występuje w
roztworach w postaci jonów At
-
lub AtO
-
, AtO
3-
.
rok odkrycia 1940
liczba atomowa 85
masa atomowa (209,987)
elektroujemność (2,2)
wartościowość 1, 3, 5, 7
zawartość w skorupie ziemskiej (litosfera + atmosfera + hydrosfera) 10
-24
%
temperatura topnienia (
o
C)
temperatura wrzenia (
o
C, p = 1 atm)
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 29(0)
konfiguracja elektronowa stanu podstawowego:
[Xe] 4f
14
5d
10
6s
2
6p
5
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
6
4f
14
5d
10
6s
2
6p
5
Układ okresowy
Radon
Radon
86
Rn - pierwiastek chem. z bloku p, grupy 18 (helowców); radioaktywny gaz,
najcięższy z gazów szlachetnych, powstaje w wyniku rozpadu radu. Występuje w
źródłach mineralnych ( 2·10
-10
procentu masowego). Radon tworzy 30 izotopów,
wszystkie są promieniotwórcze. Jest bezbarwnym, bezwonnym gazem o gęstości 9,7
g/dm
3
i temperaturze topnienia -110°C. Najdłużej życiowy izotop
222
Rn ma okres
półrozpadu T
1/2
=3,8 dnia. Stosowany w leczniczych kąpielach i inhalacjach.
rok odkrycia 1901
liczba atomowa 86
masa atomowa (222,018)
elektroujemność -
wartościowość 2
zawartość w skorupie ziemskiej
(litosfera + atmosfera + hydrosfera) 6
.
10
-16
%
temperatura topnienia (
o
C) -71
temperatura wrzenia (
o
C, p = 1 atm) -62
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 30(0)
konfiguracja elektronowa stanu podstawowego:
[Xe] 4f
14
5d
10
6s
2
6p
6
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
6
4f
14
5d
10
6s
2
6p
6
Układ okresowy
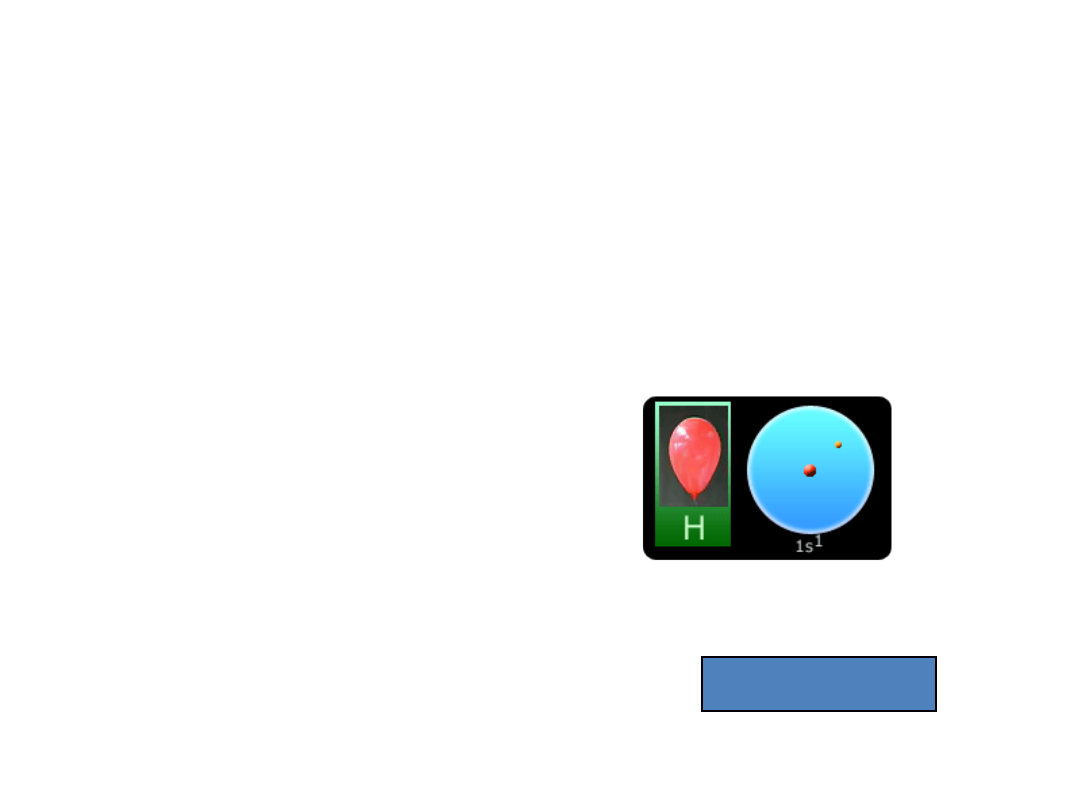
Wodór
Wodór
1
H- pierwiastek chem. z bloku s, silnie wybuchowy, bezwonny, najlżejszy
gaz; występuje głównie w przestrzeni kosmicznej, z tlenem i powietrzem tworzy
tzw. mieszaninę piorunującą; otrzymywanie głównie przez rozkład wody (np.
elektrolitycznie); szeroko stosowany w przemyśle chemicznym, np. do syntezy
amoniaku oraz jako paliwo rakietowe i w przemyśle spożywczym do utwardzania
tłuszczów.
rok odkrycia 1766
liczba atomowa 1
masa atomowa 1,00794
elektroujemność 2,1
wartościowość 1
zawartość w skorupie ziemskiej
(litosfera + atmosfera + hydrosfera) 0,00023%
temperatura topnienia (
o
C) -259,32
temperatura wrzenia (
o
C, p = 1 atm) -252,88
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 3(2)
konfiguracja elektronowa stanu podstawowego:
1s
1
Układ okresowy

Azot
Azot
7
N - pierwiastek chem. z bloku p, grupy 15, bezwonny, niepalny gaz, słabo
rozpuszczalny w wodzie, bierny chemicznie, główny składnik powietrza (78% obj.),
stosowany głównie do produkcji amoniaku i nawozów azotowych oraz do
napełniania żarówek i termometrów. Związki azotu (np. białka) są niezbędne do
życia. Sole kwasu azotowego (V)(HNO
3
) - azotany mają silne właściwości utleniające;
stosowane jako nawozy mineralne, materiały wybuchowe i w lecznictwie.
Azot
otrzymuje się przez destylację frakcjonowaną ciekłego powietrza oraz spalanie
metanu w powietrzu (dla celów technicznych) albo rozkład azotynu amonu bądź
azydku sodu (dla celów laboratoryjnych). Pod wpływem promieniowania
kosmicznego z izotopu azotu
14
N powstaje promieniotwórczy izotop węgla,
wykorzystywany w metodzie datowania
14
C.
rok odkrycia 1772 (Ernest Rutherford)
liczba atomowa 7
masa atomowa 14,00674
elektroujemność 3,0
wartościowość -3, -2, +2, +3, +5
zawartość w skorupie ziemskiej
(litosfera + atmosfera + hydrosfera) 0,0019%
temperatura topnienia (
o
C) -210
temperatura wrzenia (
o
C, p = 1 atm) -195,8
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 12(2)
konfiguracja elektronowa stanu podstawowego:
[He] 2s
2
2p
3
1s
2
2s
2
2p
3
Układ okresowy
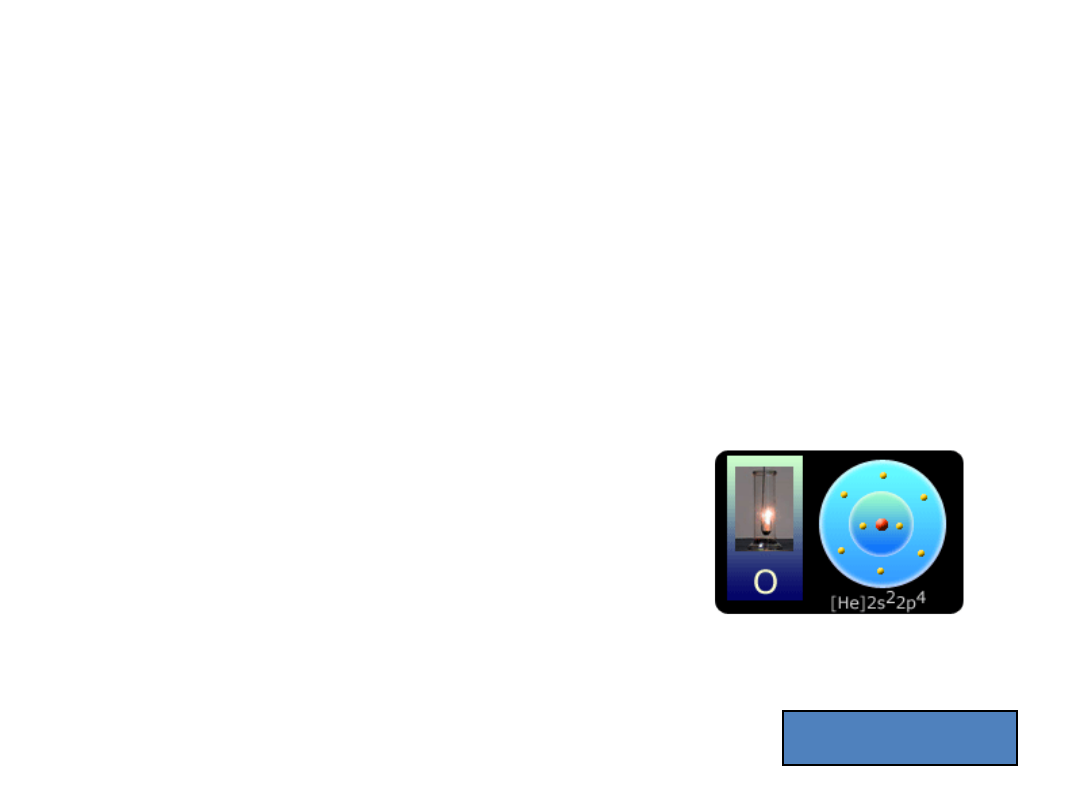
Tlen
Tlen
8
O - pierwiastek z bloku p, grupy 16; bardzo aktywny gaz, słabo rozpuszczalny w
wodzie; w stanie wolnym znajduje się w powietrzu (ok. 23% wag.), najpospolitszy
pierwiastek na Ziemi; niezbędny do oddychania i spalania. Otrzymywany głównie
przez destylację frakcjonującą ciekłego powietrza. Odkryty w 1774 r. przez Josepha
Priestley'a, który stwierdził, że zwiększona masa metali podczas ogrzewania
(utleniania) nie pochodzi od tajemniczych cząstek wydobywających się z ognia,
przenikających przez szkło i pochłanianych przez metal - jak dotychczas twierdzono -
lecz od jednego ze składników powietrza, tlenu.
rok odkrycia 1774 (Joseph Priestley)
liczba atomowa 8
masa atomowa 15,9994
elektroujemność 3,5
wartościowość -2
zawartość w skorupie ziemskiej
(litosfera + atmosfera + hydrosfera)
temperatura topnienia (
o
C) -218,78
temperatura wrzenia (
o
C, p = 1 atm) -182,96
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 10(3)
konfiguracja elektronowa stanu podstawowego:
[He] 2s
2
2p
4
1s
2
2s+ 2p
Układ okresowy
Fluor
Fluor
9
F - pierwiastek chem. z bloku p, grupy 17; zielonożółty gaz, o drażniącym
zapachu, silnie trujący; najaktywniejszy pierwiastek chemiczny - łączy się z
większością innych. Kwas fluorowowodorowy trawi nawet szkło. W przyrodzie fluor
występuje wyłącznie w stanie związanym w minerałach: fluorycie CaF
2
, kriolicie
Na
3
AlF
6
, apatycie 3Ca
3
(PO
4
)
2
·CaF
2
. Do ważniejszych związków fluoru należą także
fluorogliniany (sole kwasu fluoroglinowego H
2
3[AlF
6
]) i fluorokrzemiany (sole kwasu
fluorokrzemowego H
2
[SiF
2
]). Fluor łatwo wchodzi w reakcje fluorowania węglowodorów
nasyconych. Poza samym fluorem dogodnymi środkami fluorującymi są fluorki
nieorganiczne np. CoF
3
, Hg
2
F
2
, SbF
3
. Do otrzymywania fluorków arylów wykorzystywany
jest kwas tetrafluoroborowy HBF
4
.
rok odkrycia 1886
liczba atomowa 9
masa atomowa 18,998403
elektroujemność 4,0
wartościowość -1
zawartość w skorupie ziemskiej (litosfera + atmosfera + hydrosfera) 0,054%
temperatura topnienia (
o
C) -218,6
temperatura wrzenia (
o
C, p = 1 atm) -188,1
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 9(1)
konfiguracja elektronowa stanu podstawowego:
[He] 2s
2
2p
5
1s
2
2s
2
2p
5
Układ okresowy
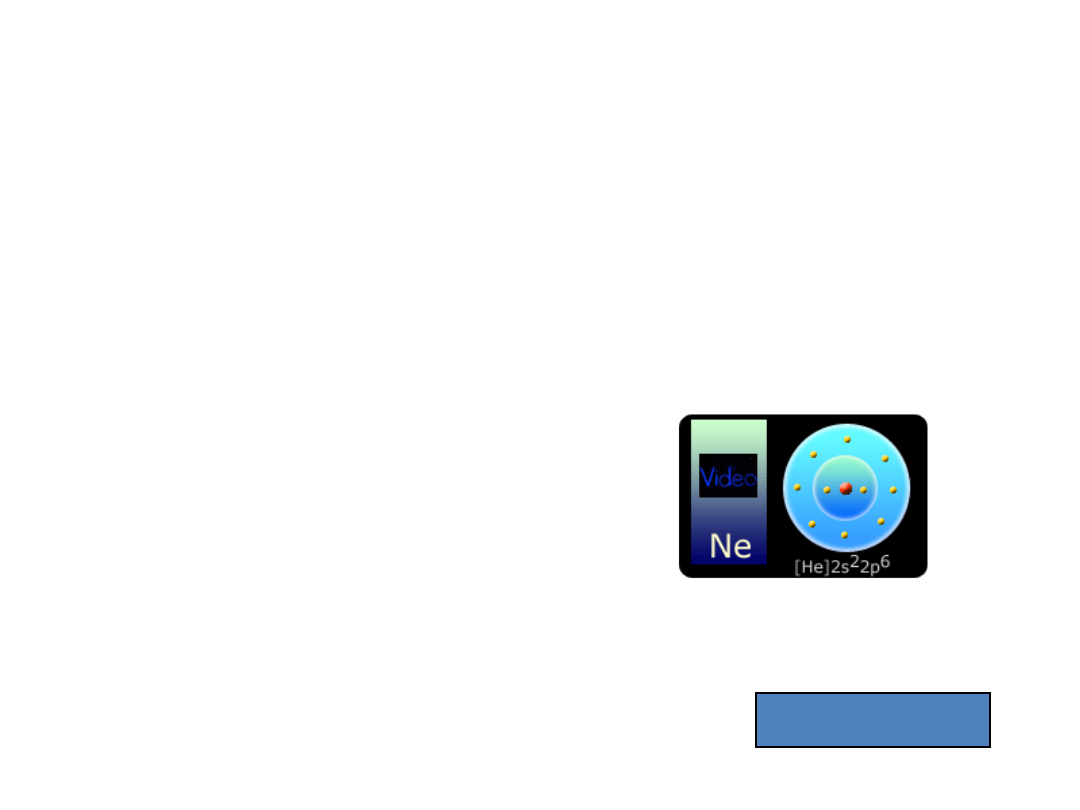
Neon
Neon
10
Ne - pierwiastek chemiczny z bloku p, grupy 18; (z gr. - nowy) bezwonny gaz
szlachetny. Ze względu na b. niską aktywność chemiczną (cecha wszystkich gazów
szlachetnych); cząsteczki neonu - jednoatomowe. Zawartość neonu w powietrzu
atmosferycznym wynosi 0,001818% objętościowych (czyli 18,18 ppm [parts per
milion]). Neon znajduje zastosowanie do napełniania lamp jarzeniowych (tzw.
neonów) o żywym, czerwonym świetle, lamp przeciwmgielnych oraz małych lampek
kontrolnych (tzw. neonówek).
rok odkrycia 1898
liczba atomowa 10
masa atomowa 20,1797
elektroujemność -
wartościowość -
zawartość w skorupie ziemskiej
(litosfera + atmosfera + hydrosfera) 5
.
10
-7
%
temperatura topnienia (
o
C) -248,58
temperatura wrzenia (
o
C, p = 1 atm) -246,05
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 10(3)
konfiguracja elektronowa stanu podstawowego:
[He] 2s
2
2p
6
1s
2
2s
2
2p
6
Układ okresowy
Fosfor
Fosfor
15
P - (fosforos - gr. niosący światło) pierwiastek chem. z bloku p, grupy 15;
niemetal występujący w kilku odmianach alotropowych, z czego najważniejsze to:
Fosfor biały jest miękką, żółtawą (od domieszek) masą, odznaczającą się nieprzyjemnym
czosnkowym zapachem; praktycznie nie rozpuszcza się w wodzie, natomiast jest dobrze
rozpuszczalny w wielu innych rozpuszczalnikach, jak na przykład w dwusiarczku węgla (CS
2
),
terpentynie, eterze itp. Przechowywany pod wodą, gdyż w powietrzu łatwo się utlenia, obserwujemy
przy tym przemianę energii chemicznej w promienistą (chemiluminescencja). Dzięki temu biały
fosfor utleniając się świeci w ciemności i stąd pochodzi jego nazwa. Fosfor biały jest substancją tak
aktywną, że ogrzany do temperatury ok. 50
o
C, lub potarty jakimkolwiek przedmiotem zapala się i
płonie białożółtym płomieniem. Może również zapalać się samorzutnie, gdyż podczas powolnego
utleniania jest wydzielana dostateczna ilość ciepła.
Fosfor czerwony jest proszkiem o barwie ciemnoczerwonej. Nie rozpuszcza się w wodzie i innych
rozpuszczalnikach, wskutek czego nie ma właściwości trujących. Nie jest tak aktywny jak fosfor
biały, nie świeci, nie utlenia się w zwykłych warunkach, zapala się dopiero po ogrzaniu powyżej 400
o
C.
Fosfor czarny – przypominający grafit, dobry przewodnik elektryczności i ciepła
rok odkrycia 1669 (H. Brandt)
liczba atomowa 15
masa atomowa 28,0855
elektroujemność 2,1
wartościowość +3 +5
zawartość w skorupie ziemskiej (litosfera + atmosfera + hydrosfera) 0,11%
temperatura topnienia (
o
C): fosfor biały: 44 fosfor czerwony: sublimuje w 416
temperatura wrzenia (
o
C, p = 1 atm) fosfor biały: 280
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 17(1)
konfiguracja elektronowa stanu podstawowego:
[Ne] 3s
2
3p
3
1s
2
2s
2
2p
6
3s
2
3p
3
Układ okresowy

Siarka
Siarka
16
S - pierwiastek chem. z bloku p, grupy 16; aktywny niemetal, tworzy kilka odmian
alotropowych, z czego najbardziej znana to żółte kryształy. Złoża siarki rodzimej w Polsce zaliczają się
do największych na świecie. Służy m.in. do produkcji kwasu siarkowego, zapałek, środków leczniczych,
do wulkanizacji kauczuku. Kwasy siarkowe:
· H
2
SO
4
- kwas siarkowy (VI)
SO
3
+ H
2
O ŕ H2SO4
· H
2
SO
3
- kwas siarkowy (IV) (dawniej - kwas siarkawy)
SO
2
+ H
2
O ŕ H2SO3
· H
2
S
2
O
3
- kwas tiosiarkowy (theion - gr. siarka)
H
2
SO
3
+ S ŕ H
2
S
2
O
3
(w rzeczywistości kwas tiosiarkowy nie istnieje w stanie wolnym, a w roztworze wodnym wkrótce
rozpada się na wodę, siarkę i dwutlenek siarki, która powoduje zmętnienie wody:
H
2
S
2
O
3
ŕ H
2
O + SO
2
+ S )
rok odkrycia starożytność
liczba atomowa 16
masa atomowa 32,066
elektroujemność 2,5
wartościowość 2, 4, 6
zawartość w skorupie ziemskiej
(litosfera + atmosfera + hydrosfera) 0,04%
temperatura topnienia (
o
C) 119,6
temperatura wrzenia (
o
C, p = 1 atm) 444,6
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 15(4)
konfiguracja elektronowa stanu podstawowego:
[Ne] 3s
2
3p
4
1s
2
2s
2
2p
6
3s
2
3p
4
Układ okresowy

Chlor
Chlor
17
Cl - pierwiastek chemiczny z bloku p, grupy 17; niemetal, zielonożółty gaz o
drażniącym zapachu, trujący, b. aktywny chem., rozpuszczony w wodzie tworzy tzw.
wodę chlorową.
W przyrodzie chlor występuje w stanie wolnym w gazach wulkanicznych, a w stanie
związanym w wielu minerałach: halicie NaCl, sylwinie KCl, sylwinicie KCl×NaCl, karnalicie
KCl×MgCl
2
×6H
2
O, kainicie KCl×MgSO
4
×3H
2
O, oraz pod postacią licznych chlorków
litowców i berylowców w wodzie morskiej. Chlor jest otrzymywany w skali przemysłowej
przez elektrolizę wodnych roztworów soli lub elektrolizę stopionych soli. Dla potrzeb
laboratoryjnych chlor wydziela się z HCl działaniem środków utleniających np. MnO
2
lub
KMnO
4
. Cząsteczki chloru są dwuatomowe. Rozpuszcza się w wodzie, częściowo ulegając
dysproporcjonowaniu do chlorków i nietrwałego kwasu podchlorawego HClO. Chlor
wykazuje dużą aktywność chemiczną - z siarką, fosforem, arsenem i wieloma metalami
reaguje bezpośrednio, niekiedy bardzo gwałtownie. Chlor utlenia jony bromkowe lub
jodkowe w środowisku wodnym do wolnego fluorowca. Z wodorem chlor tworzy
chlorowodór HCl. Chlor jest stosowany jako środek bielący i dezynfekujący, surowiec do
produkcji podchlorynów, chloranów, czterochlorku węgla, chloroformu, barwników,
insektycydów oraz do syntez organicznych.
rok odkrycia 1774
liczba atomowa 17
masa atomowa 35,4527
elektroujemność 3,0
wartościowość -1, +1, +3, +4, +5, +7
zawartość w skorupie ziemskiej (litosfera + atmosfera + hydrosfera) 0,19%
temperatura topnienia (
o
C) -101,0
temperatura wrzenia (
o
C, p = 1 atm) -34,0
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 13(2)
konfiguracja elektronowa stanu podstawowego: [Ne] 3s
2
3p
5
1s
2
2s
2
2p
6
3s
2
3p
Układ okresowy
Argon
Argon
18
Ar - pierwiastek chem. z bloku p, grupy 18; (gr. - nieczynny) gaz szlachetny;
używany do napełniania żarówek i lamp jarzeniowych oraz jako atmosfera ochronna przy
spawaniu. Zawartość argonu w atmosferze wynosi 0,93% objętości (najpospolitszy gaz
szlachetny). Otrzymuje się go przez destylację ciekłego powietrza. Argon jest gazem
jednoatomowym o bardzo słabych siłach van der Waalsa, bezwonnym, bezbarwnym,
obojętnym chemicznie (argon znaczy po grecku nieczynny) i pozbawionym działania
fizjologicznego. Z niektórymi związkami organicznymi i nieorganicznymi tworzy klatraty.
rok odkrycia 1894
liczba atomowa 18
masa atomowa 39,948
elektroujemność -
wartościowość -
zawartość w skorupie ziemskiej (litosfera +atmosfera + hydrosfera) 0,0004%
temperatura topnienia (
o
C) -189,33
temperatura wrzenia (
o
C, p = 1 atm) -185,86
liczba znanych izotopów (wtym trwałe tzn. o okresie półrozpadu ponad 1 mld lat)
15(3)
konfiguracja elektronowa stanu podstawowego:
[Ne] 3s
2
3p
6
1s
2
2s
2
2p
6
3s
2
3p
Układ okresowy
Selen
Selen
34
Se - pierwiastek chem. z bloku p, grupy 16; trujący niemetal występujący w
kilku odmianach alotropowych. Metaliczna odmiana przewodzi prąd lepiej w świetle niż
w ciemności, co sprawiło, że pierwiastek ten znalazł zastosowanie w elektrotechnice do
budowy fotokomórek i światłomierzy oraz prostowników prądu. Występuje w rudach
zawierających siarkę , jak np. piryt.
rok odkrycia 1818
liczba atomowa 34
masa atomowa 78,96
elektroujemność 2,8
wartościowość -2, +4, +6
zawartość w skorupie ziemskiej
(litosfera + atmosfera + hydrosfera) 5
.
10
-6
%
temperatura topnienia (
o
C) 219
temperatura wrzenia (
o
C, p = 1 atm) 685
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 24(6)
konfiguracja elektronowa stanu podstawowego:
[Ar] 3d
10
4s
2
4p
4
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
4
Układ okresowy
Brom
Brom
35
Br - pierwiastek chem. z bloku p, grupy 17; trujący niemetal, brunatna, lotna ciecz
o przykrym zapachu, aktywny chem.; rozpuszczona w wodzie tworzy wodę bromową.
Używany w syntezach organicznych, zwłaszcza leków. Bromek srebra znalazł zastosowanie
w fotografii będąc emulsją światłoczułą na kliszy. W przyrodzie występuje w pokładach
solnych, w minerałach: bromokarnalicie KCl·Mg(Cl,Br)2·6H
2
O i bromosylwinicie K(Cl,Br), a
także w wodzie morskiej. Można go wydzielić z bromków za pomocą utleniaczy lub
elektrolitycznie. Rozpuszcza się w wodzie, częściowo ulegając dysproporcjonowaniu do
bromków i nietrwałego kwasu podbromawego HBrO. Drugim znanym kwasem tlenowym
bromu jest znacznie trwalszy kwas bromowy HBrO
3
, otrzymywany przez
dysproporcjonowanie podbrominów. Brom jest dobrze rozpuszczalny w niektórych
rozpuszczalnikach organicznych. Wykazuje dużą aktywność chemiczną - z siarką,
fosforem, arsenem i wieloma metalami reaguje bezpośrednio. Z wodorem tworzy
bromowodór HBr, który jest gazem rozpuszczającym się w wodzie z utworzeniem kwasu
bromowodorowego. Związki z tlenem (Br
2
O, BrO
2
, BrO
2
) są nietrwałe. Brom tworzy
połączenia także z innymi fluorowcami. Jest stosowany (w postaci dwubromku etylenu)
jako środek przeciwstukowy w paliwie samochodowym, a ponadto - do produkcji leków,
barwników.
rok odkrycia 1825
liczba atomowa 35
masa atomowa 79,904
elektroujemność 2,8
wartościowość -1, +1, +3, +4, +5, +6, +7
zawartość w skorupie ziemskiej (litosfera + atmosfera + hydrosfera) 0,00025 %
temperatura topnienia (
o
C) -7,25 temperatura wrzenia (
o
C, p = 1 atm) 59,5
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 25(2)
konfiguracja elektronowa stanu podstawowego:
[Ar] 3d
10
4s
2
4p
5
s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
5
Układ okresowy
Krypton
Krypton
36
Kr - pierwiastek chem. z bloku p, grupy 18; (gr. - ukryty) niemetal, gaz
szlachetny, składnik powietrza, stosowany do wypełniania żarówek, lamp
jarzeniowych i spektralnych. Zawartość kryptonu w powietrzu atmosferycznym wynosi
0,000114% objętości. W specjalnych warunkach udało się uzyskać nieliczne związki
kryptonu na stopniach utlenienia +2 i +4 jak fluorek kryptonu (II), KrF
2
, oraz fluorek
kryptonu (IV), KrF
4
. Krypton otrzymuje się przez frakcyjną destylację skroplonego
powietrza.
rok odkrycia 1898
liczba atomowa 36
masa atomowa 79,904
elektroujemność 2,8
wartościowość (2)
zawartość w skorupie ziemskiej
(litosfera + atmosfera + hydrosfera) 2
.
10
-8
%
temperatura topnienia (
o
C) -157,2
temperatura wrzenia (
o
C, p = 1 atm) 153,4
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 25(6)
konfiguracja elektronowa stanu podstawowego:
[Ar] 3d
10
4s
2
4p
6
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
Układ okresowy
Jod
Jod
53
I (dawniej symbol J) - pierwiastek chem. z bloku p, grupy 17; aktywny chemicznie
ciemnofioletowe blaszki, które topią się w temp. 114
o
C. W temperaturze 185
o
C
przechodzi w stan gazowy tworząc fioletowe pary. Dzięki temu zawdzięcza swoją nazwę
(ioeides - gr. w kolorze fiołków). Jeśli jednak powoli ogrzewać jod do 185
o
C, to przejdzie
on w stan gazowy z pominięciem stanu ciekłego (sublimacja). Cząsteczki -
dwuatomowe. Jest otrzymywany w skali przemysłowej z ługów pokrystalizacyjnych
powstających podczas oczyszczania saletry sodowej. Stosowany w fotografice,
medycynie (jodyna - jod rozpuszczony w alkoholowym roztworze jodku potasu; płyn
Lugola - wodny roztwór jodu w jodku potasu), w lampach halogenowych. Brak jodu w
organizmie prowadzi do powstawania wola. Jod występuje wyłącznie w związkach m.in.
w wodzie morskiej, w saletrze chilijskiej oraz w wodorostach i gąbkach morskich.
Bardziej znane kwasy tlenowe jodu to: kwas podjodawy HIO, kwas jodowy HIO
3
, kwas
nadjodowy H
5
IO
6
. Dwa ostatnie można otrzymać w stanie czystym.
rok odkrycia 1812
liczba atomowa 53
masa atomowa 126,90477
elektroujemność 2,5
wartościowość -1, +3, +5, +7
zawartość w skorupie ziemskiej
(litosfera + atmosfera + hydrosfera) 2
.
10
-7
%
temperatura topnienia (
o
C) 115
temperatura wrzenia (
o
C, p = 1 atm) 185
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 32(1)
konfiguracja elektronowa stanu podstawowego:
[Kr] 4d
10
5s
2
5p
5
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
5
Układ okresowy
Ksenon
Ksenon
54
Xe - pierwiastek chem. z bloku p, grupy 18, (gr. - obcy, wrogi); gaz szlachetny,
stosowany do wypełniania żarówek dużej mocy. Zawartość ksenonu w powietrzu
atmosferycznym wynosi jedynie 0,0000087% objętości. Jest mało reaktywny chemicznie
i występuje w postaci monoatomowej. Z wieloma związkami tworzy klatraty, np.
z hydrochinonem [C
6
H
4
(OH)
2
]
3
·0,88Xe. W 1960 udało się otrzymać pierwsze związki
chemiczne ksenonu, w których występuje na stopniach utlenienia +2, +4, +6 oraz +8.
Do najlepiej poznanych związków ksenonu należą: trójtlenek ksenonu XeO
3
(bardzo
energiczny utleniacz), a także fluorki XeF
2,
XeF
4
oraz XeF
6.
Ksenon jest otrzymywany
przez frakcyjną destylację skroplonego powietrza. Zastosowania podobne jak kryptonu.
Światowa roczna produkcja ksenonu wynosi ok. 10 t, a jego orientacyjna cena 60
dolarów za litr gazu.
rok odkrycia 1898
liczba atomowa 54
masa atomowa 131,29
elektroujemność -
wartościowość (2, 4, 6, 8)
zawartość w skorupie ziemskiej
(litosfera + atmosfera + hydrosfera) 2
.
10
-9
%
temperatura topnienia (
o
C) -118,8
temperatura wrzenia (
o
C, p = 1 atm) -108,1
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 36(9)
konfiguracja elektronowa stanu podstawowego:
[Kr] 4d
10
5s
2
5p
6
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
6
Układ okresowy
Hel
Hel
2
He - pierwiastek chemiczny z bloku s, grupy18; gaz szlachetny, najlżejszy po
wodorze pierwiastek, występuje m.in. w gazie ziemnym, źródłach mineralnych. W
atmosferze Słońca odkryty w 1842 r. (Helios, gr. - Słońce), na Ziemi w roku 1868
przez Williama Ramsay`a. Przy wyładowaniu elektr. w rozrzedzonej atmosferze
daje światło żółte, z parami rtęci – niebieskie; chemicznie obojętny składnik
gwiazd i materii międzygwiezdnej; stosowany do wyrobu barwnych neonów,
napełniania balonów, uzyskiwania b. niskich temperatur bliskich zeru
bezwzględnemu, jako czynnik chłodzący w reaktorach jądrowych, a w mieszaninie
z tlenem jako powietrze dla nurków (zapobiega to chorobie kesonowej nurków)
oraz przy leczeniu astmy.
rok odkrycia 1868
liczba atomowa 2
masa atomowa 4,002602
elektroujemność –
wartościowość –
zawartość w skorupie ziemskiej (litosfera + atmosfera + hydrosfera) 4.10
-7
%
temperatura topnienia (
o
C) (poniżej zera absolutnego < -273,15
o
C (0 kelwinów))
temperatura wrzenia (
o
C, p = 1 atm) -268,93
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 4(2)
konfiguracja elektronowa stanu podstawowego:
1s
2
Układ okresowy
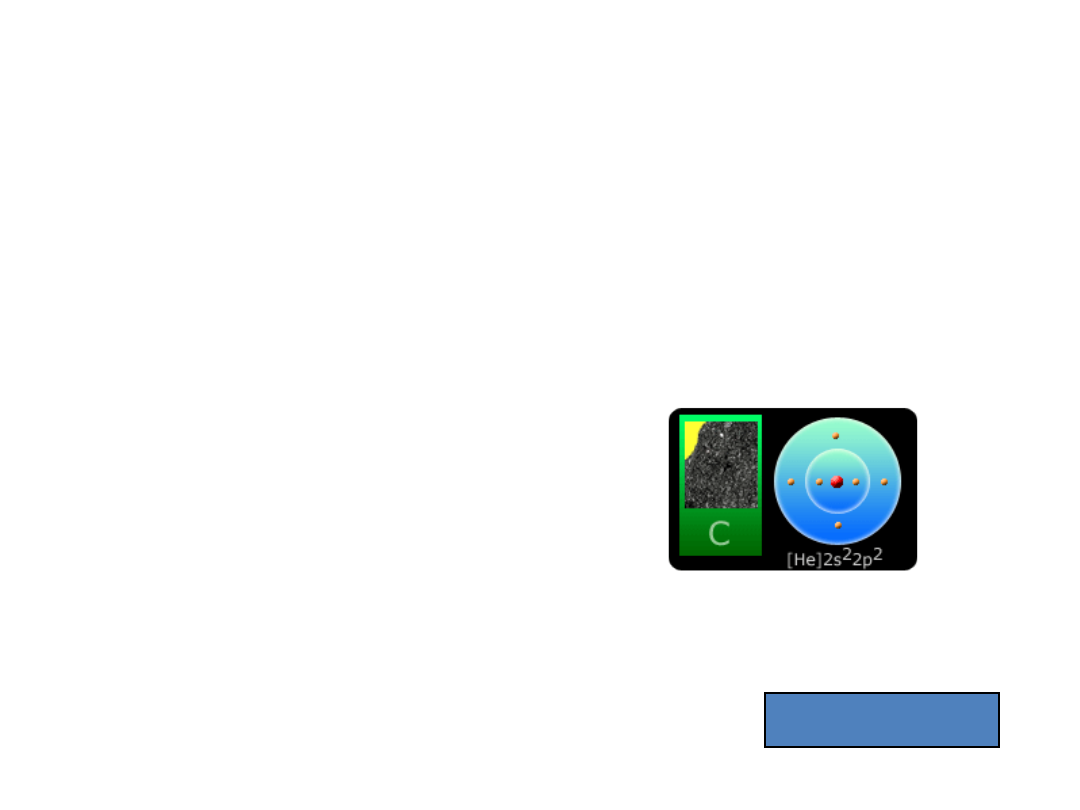
Węgiel
Węgiel
6
C - pierwiastek z bloku p, grupy 14, niemetal; występuje w dwóch odmianach
alotropowych: grafit i diament; wchodzi, w postaci związków, w skład wszystkich
organizmów żywych.
1/12 masy atomu węgla
12
C jest przyjęta za międzynarodową jednostkę masy
atomowej u i wynosi około 1,66054
.
10
-24
g. Jest to w dobrym przybliżeniu masa
protonu.
rok odkrycia starożytność
liczba atomowa 6
masa atomowa 12,011
elektroujemność 2,5
wartościowość -4, +2, +4
zawartość w skorupie ziemskiej
(litosfera + atmosfera + hydrosfera) 0,018%
temperatura topnienia (
o
C) 3850
temperatura wrzenia (
o
C, p = 1 atm) 3600
liczba znanych izotopów (w tym trwałe tzn.
o okresie półrozpadu ponad 1 mld lat) 12(2)
konfiguracja elektronowa stanu podstawowego:
[He] 2s
2
2p
2
1s
2
2s
2
2p
2
Układ okresowy
Document Outline
- Slide 1
- Układ okresowy
- Astat
- Radon
- Wodór
- Azot
- Tlen
- Fluor
- Neon
- Fosfor
- Siarka
- Chlor
- Argon
- Selen
- Brom
- Krypton
- Jod
- Ksenon
- Hel
- Węgiel
Wyszukiwarka
Podobne podstrony:
prezentacja chemia leków
prezentacja chemia IIIb 2
Cukier prezentacja chemia
Prezentacje chemia 14 15
Prezentacja Chemia Organiczna 2
prezentacja chemia leków
prezentacja chemia IIIb 2
Rodzaje opakowań prezentacja chemia
prezentacja chemia 2
prezentacja chemia
ogniwa galwaniczne, Chemia, Prezentacje
niemetale, chemia
0 chemia prezentacja 08 hyhdok ppt
Chemia analityczna wykład prezentacja
podwójna warstwa elektrochemiczna, Chemia, Prezentacje
text prezentacji, Płyta farmacja Poznań, III rok, Chemia leków, seminaria, seminaria mix
prezentacja tekst, budownictwo pb, semestr 1, chemia budowlana
,chemia L,korozja materiałów niemetalicznych
chemia leków prezentacja 2, prezentacje
więcej podobnych podstron