
Modyfikacje enzymów
1

Grupy funkcyjne enzymów
Podział ze względu na rolę w procesie
katalizy:
- grupy funkcyjne zlokalizowane w
centrum aktywnym
- grupy pomocnicze, obecne w
centrum aktywnym
- grupy z poza obszaru centrum
aktywnego.
2

Modyfikacja grup
funkcyjnych
Chemiczne metody identyfikacji enzymów
opierają się na modyfikacji grup funkcyjnych.
Stosuje się 2 metody:
- selektywne modyfikacje (znakowanie) grup
w centrum aktywnym
- modyfikacje z użyciem odczynników
przekształcających wszystkie dostępne
grupy funkcyjne w enzymie.
3

Selektywne modyfikacje
(znakowanie) grup w centrum
aktywnym
• Znakowanie substratami
• Znakowanie pseudosubstratami
• Znakowanie innymi odczynnikami
podobnymi do substratów
Affinity labelig- szczególne
powinowactwo związku
modyfikującego do miejsca
wiążącego substrat w centrum
aktywnym.
4

Znakowanie substratami
Metodę można stosować gdy:
- w czasie reakcji katalicznej powstaje
przejsciowo kowalencyjne wiązanie
substratu z grupą funkcyjną
- można dobrać warunki, w których rozpad
połączenia będzie zahamowany, tak by
wyodrębnić fragment łańcucha
zawierający aminokwas podstawiony przez
substrat.
Np. dla proteaz serynowo-histydynowych
połączeniem jest acyloenzym, który
powstaje w środowisku o pH 5,0.
5

Znakowanie substratami
Przykłady zastosowania metody:
- reakcja fosfoglukomutazy z substratem
znakowanym radioaktywnym fosforem;
podstawionym substratem jest seryna
- wykazanie obecności lizyny w centrum aktywnym
aldolaz i transaldolaz dzięki uzyskaniu stabilnych
połączeń tych enzymów z dihydroksyacetonem,
fosforanem dihydroksyacetonu i 6-fosfofruktozą
- wykazanie obecności lizyny w centrum aktywnym
dekarboksylazy acetooctanu i enzymów wiążących
fosforan pirydoksalu.
6
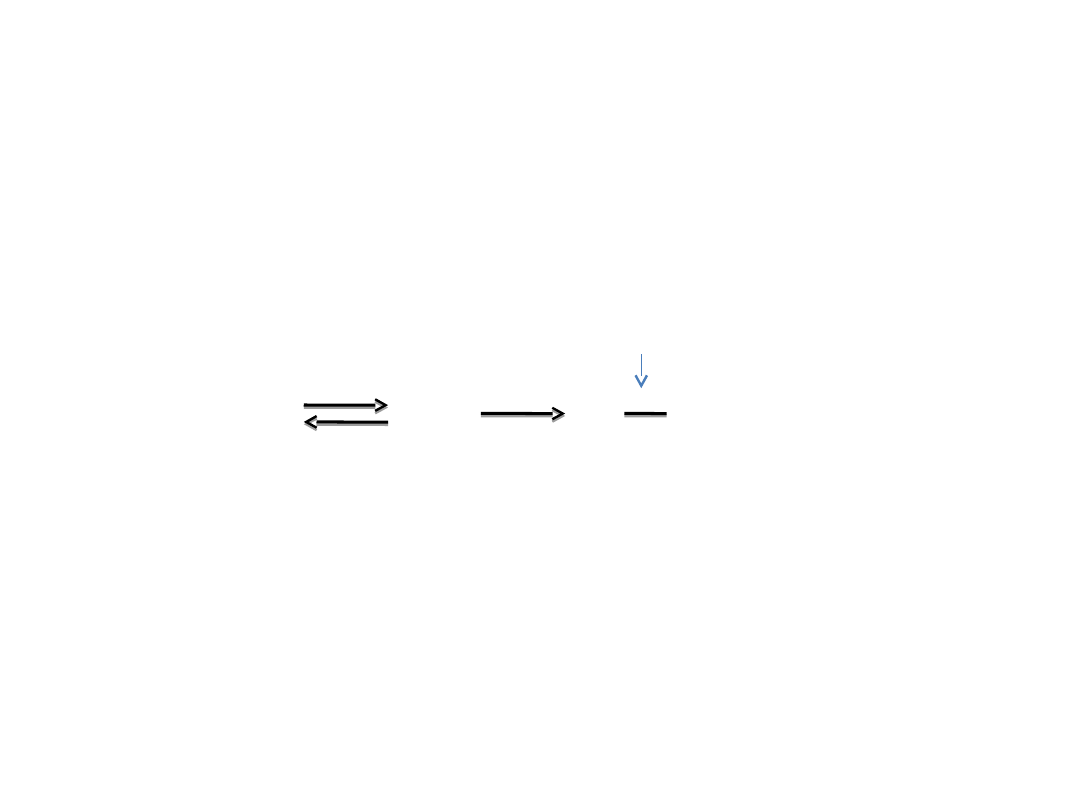
Znakowanie
pseudosubstratami
Pseudosubstrat – związek zbliżony do substratów
strukturą przestrzenna.
stabilne poł. kowalencyjne; inaktywacja enzymu
E + P
s
EP
s
E P
s
kompleks modyfik. enzym
Pseudosubstraty mogą wytwarzać kompleks
tylko
z centrum aktywnym, a nie z innymi obszarami
cząsteczki enzymu.
7
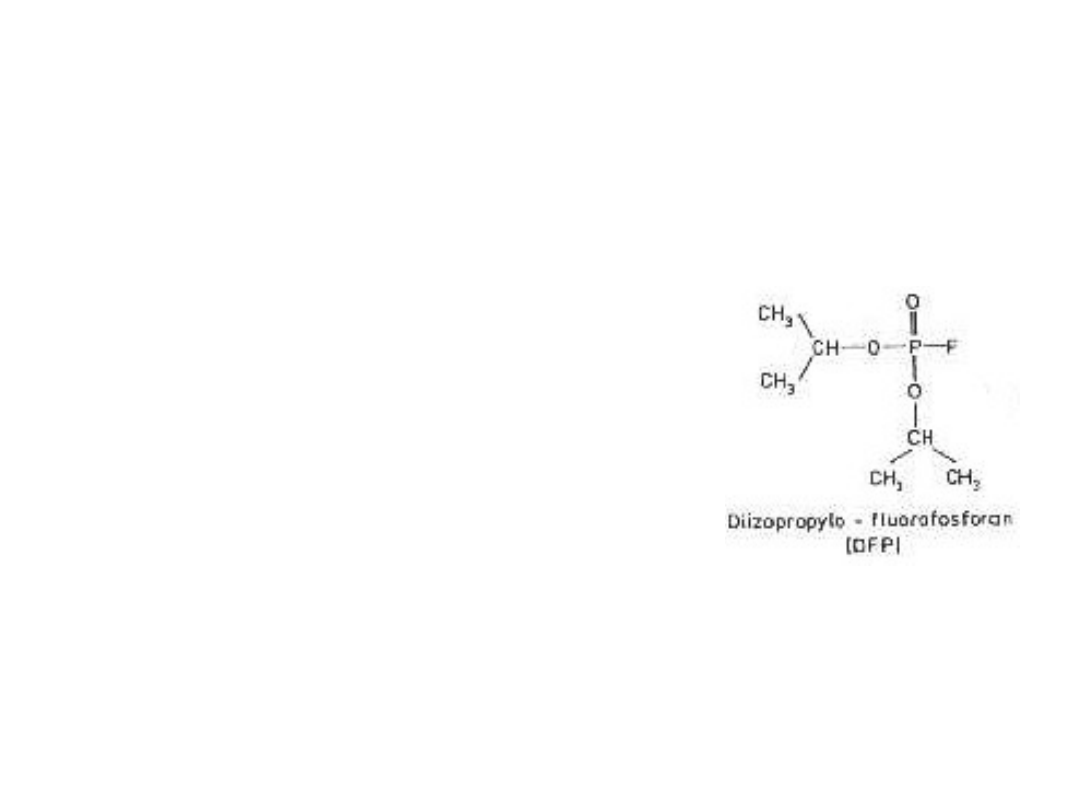
Znakowanie
pseudosubstratami
Pseudosubstraty esteraz i
proteaz serynowych oraz
niektórych lipaz:
organiczne związki
fosforu np. DFP
(diizopropylofluorofosfora
n)
DFP fosforyluje aktywną
grupę -OH seryny w
trypsynie,
chymotrypsynie,
elastazie, plazminie i
wielu innych.
8
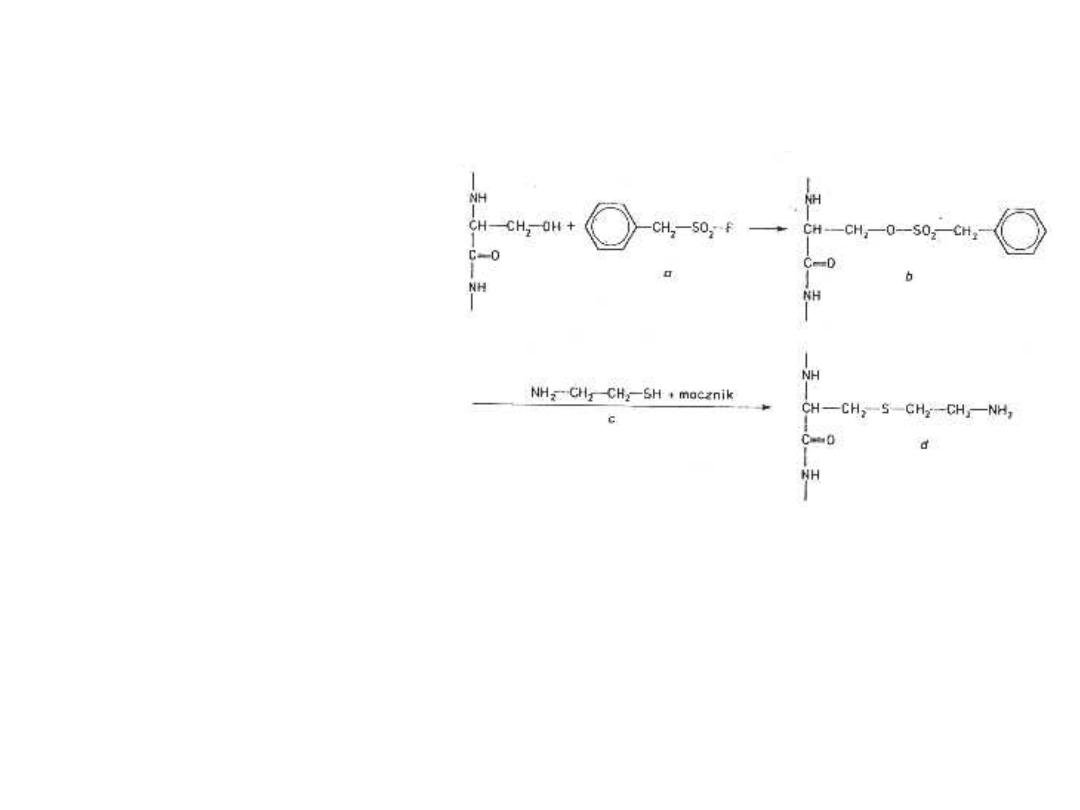
Znakowanie
pseudosubstratami
Pseudosubstratami
proteaz i esteraz
serynowo-
histydynowych
mogą być również
sulfonylofluorki.
Fenylometylosulfo-
nylofluorek: silny
inhibitor
chymotrypsyny;
sulfonuje resztę
seryny w centrum
aktywnym.
Schemat modyfikacji reszty
serylowej w cząsteczce
chymotrypsyny
pseudosubstratem
9

Znakowanie innymi
odczynnikami podobnymi
do substratów
Związki te cechują się odpowiednią struktura
przestrzenną, lecz łączą się z innymi
aminokwasami niż substrat i pseudosubstrat.
Tworzenie wiązania kowalencyjnego w trakcie
reakcji poprzedzone jest tworzeniem się
kompleksu odczynnika z atomami znajdującymi
się w centrum aktywnym.
Za pomocą tej metody, przy użyciu związków o
charakterze chlorometyloketonów
zidentyfikowano np. grupy czynne niektórych
proteaz.
10
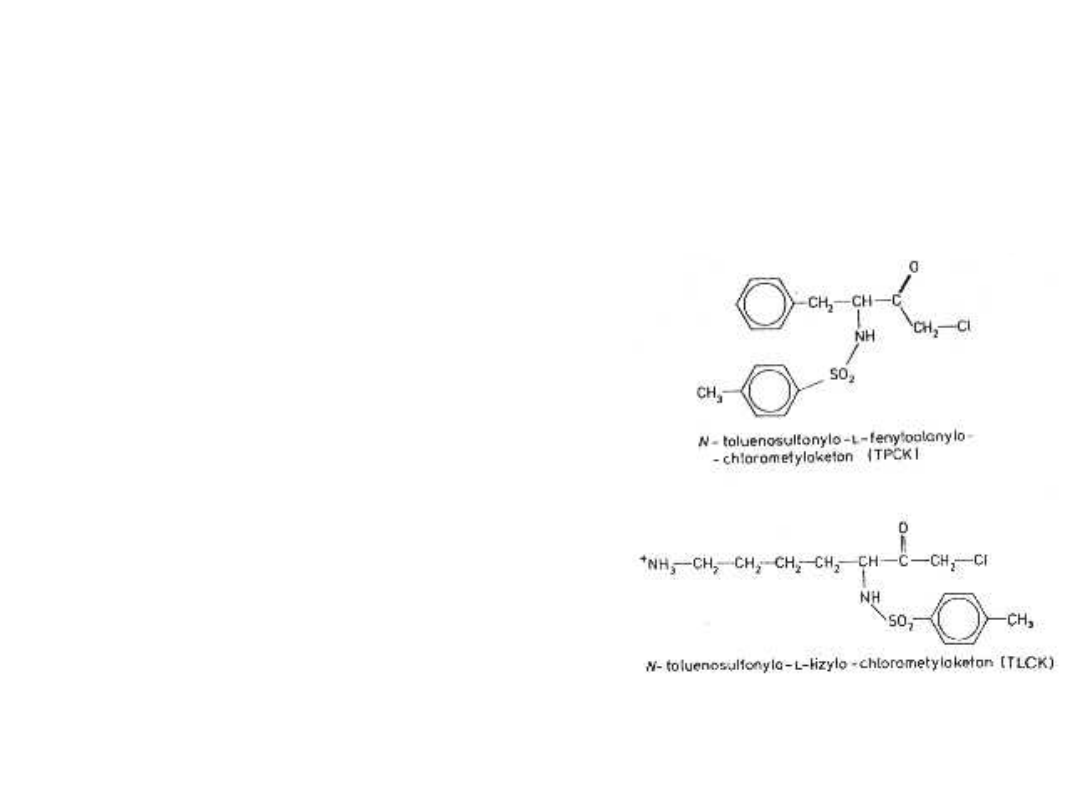
TPCK (N-toluenosulfonylo-L-
fenyloalanina) wiąże się
nieodwracalnie z histydyną w
centrum aktywnym α-
chymotrypsyny.
TLCK (N-toluenosulfonylo-L-
lizyna) stosowana jest do
modyfikacji trypsyny.
Oba związki reagują również z
grupami sulfhydrylowymi.
Znakowanie innymi
odczynnikami podobnymi
do substratów
11
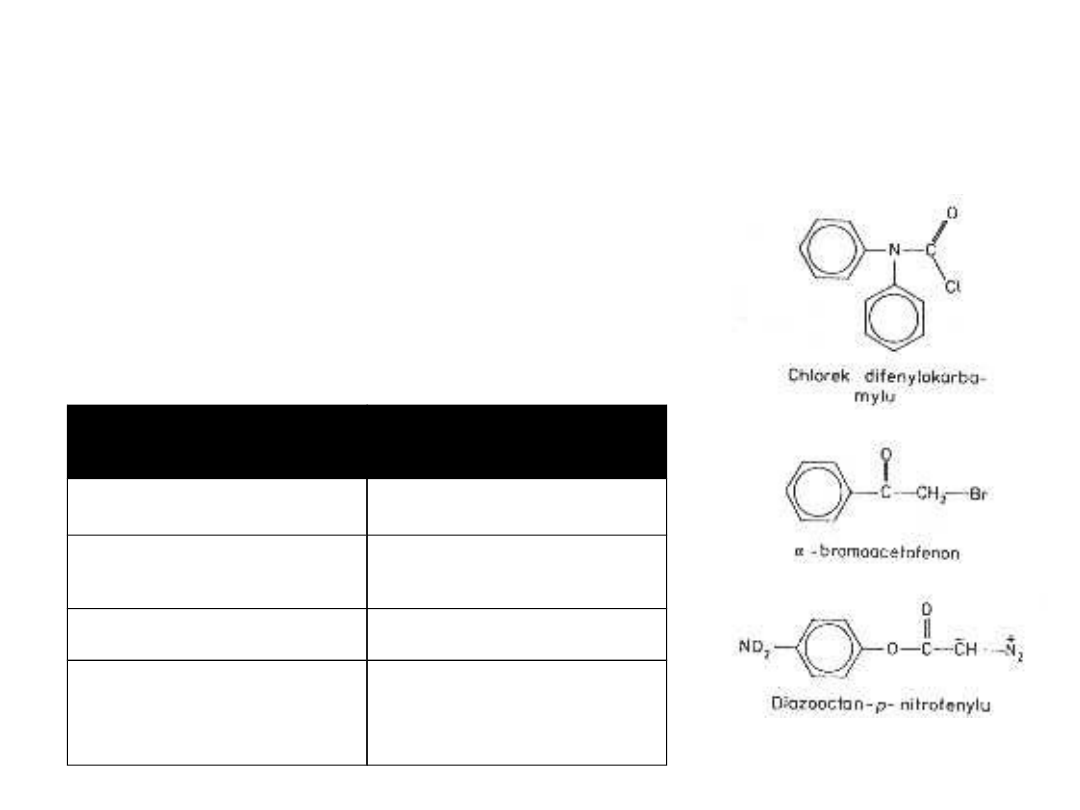
Do badania centrum
aktywnego α-
chymotrypsyny zastosować
można także inne związki
swoiste.
Znakowanie innymi
odczynnikami podobnymi
do substratów
Odczynnik
swoisty
Znakowana reszta
TPCK
histydyna
Chlorek
difenylokarbamylu
serylowa
α-bromoacetofenon
metionylowa
Diazooctan p-
nitrofenylu
serylowa,
histydylowa,
tyrozylowa
12
Odczynniki nieselektywne do
centrum aktywnego
Modyfikacja grup funkcyjnych w
enzymie odczynnikami
nieselektywnymi polega na tym że
reagują ze wszystkimi dostępnymi
grupami w enzymie.
13
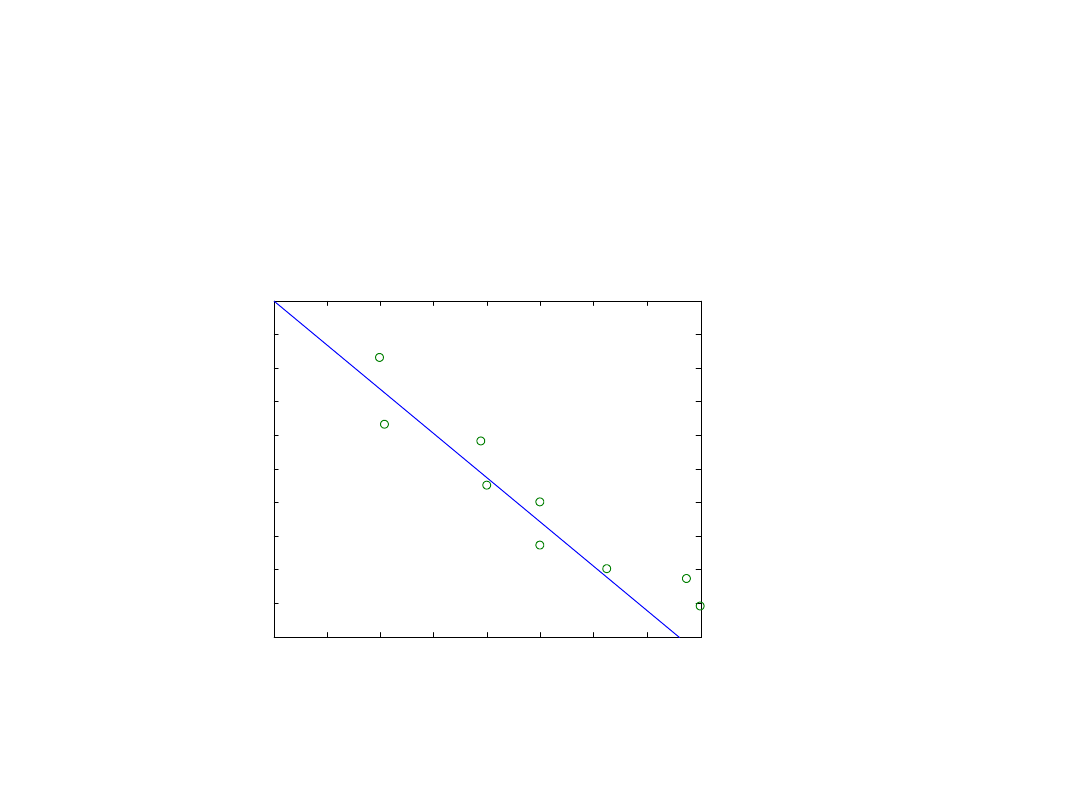
Identyfikacja grup czynnych
enzymów
Polega na badaniu zależności pomiędzy rodzajem i liczbą
zmodyfikowanych grup funkcyjnych a aktywnością enzymu.
Zależność aktywności enzymatycznej od ilości utlenionych
reszt histydylowych.
0
1
2
3
4
5
6
7
8
0
10
20
30
40
50
60
70
80
90
100
Liczba zmodyfikowanych reszt w czasteczce bialka
A
ty
w
no
sc
%
Wplyw fotooksydacji na aktywosc L-asparaginazy
14
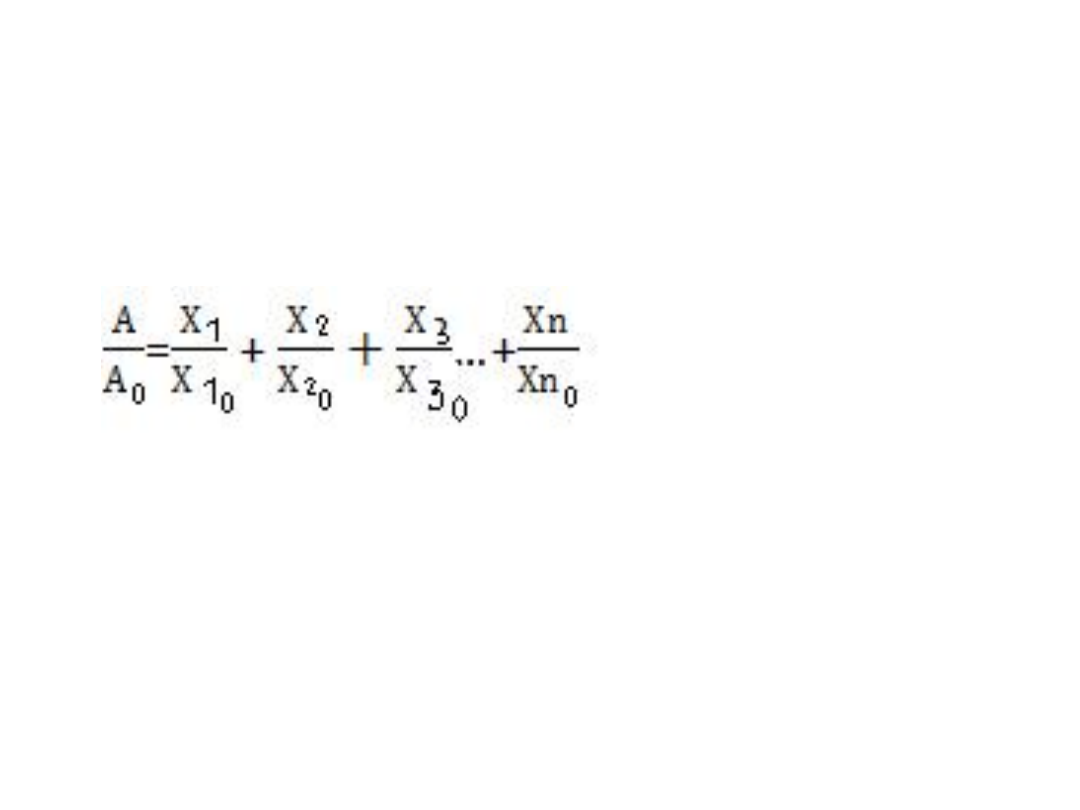
Kinetyczna analiza utraty aktywności
katalitycznej towarzysząca
modyfikacji aminokwasów
A
0
-aktywność po czasie zerowym
A-aktywność po czasie t
X
10
,X
20
,X
no
– stężenie odpowiednich
aminokwasów w czasie zerowym
X
1
,X
2
,X
n
– stężenie odpowiednich
aminokwasów(w stanie
niemodyfikowanym) w czasie t
15
K
m
i k
cat
enzymów modyfikowanych
Po oznaczeniu K
m
i k
cat
można
roztrzygnąć jakiego rodzaju grup
czynnych dotyczy modyfikacja
Przykład: Papaina zmodyfikowana w
wyniku
działania karbodiimidu
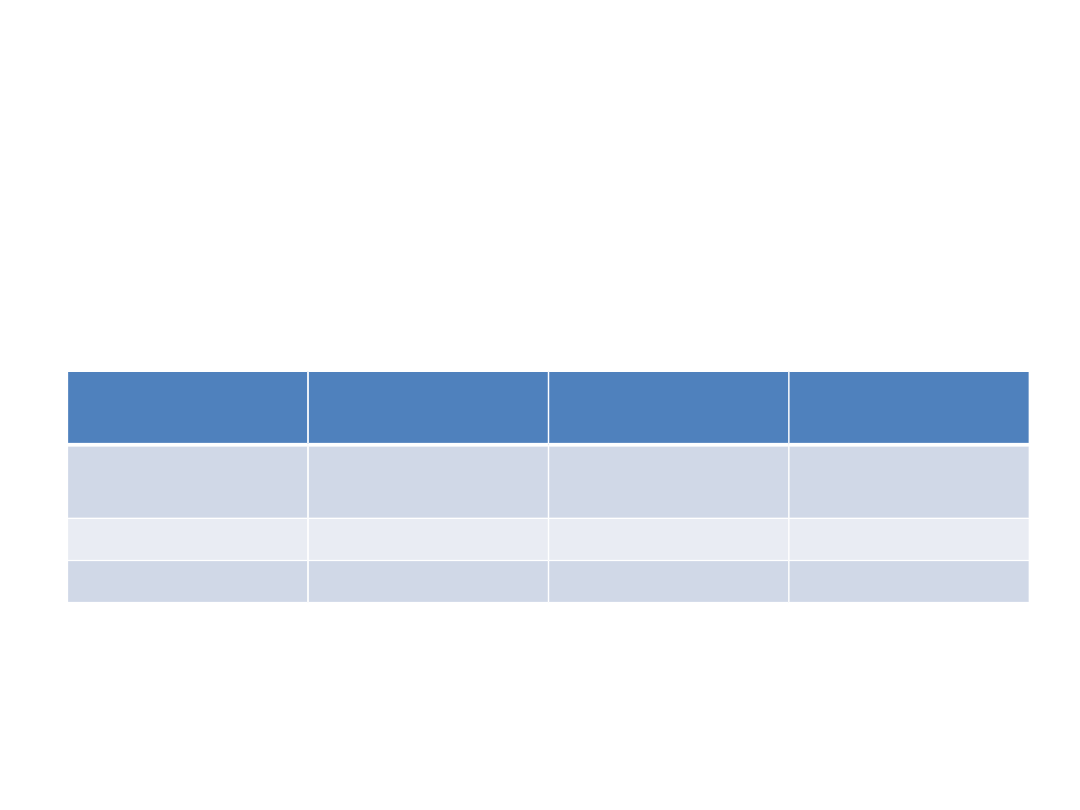
Enzym
% aktywności Kcat (1/s)
K
m
(mol/1*10²)
Niezmodyfikow
any
100
23,1+-0,4
1,79+-0,04
Zmodyfikowany 10
2,7+-0,5
3,4+-0,8
Kontrola
101
24,1+-2,9
1,9+-0,3
16

Różnicowe modyfikacje enzymów
W różnicowym modyfikowaniu białek
enzymatycznych wykorzystuje się
fakt że substraty i inhibitory
kompetycyjne osłaniają grupy
funkcyjne biorące bezpośredni udział
w katalizie enzymatycznej.
17

Modyfikacje grup funkcyjnych
enzymów a zmiany
konformacyjne
Modyfikacje chemiczne grup funkcyjnych
powodują czasem zmiany konformacyjne
białka, dlatego też przeprowadza się
badania mające na celu ustalenie czy
białka po modyfikacji zachowują swoją
natywną konformacje. W razie
stwierdzenia jakichkolwiek zmian w
strukturze przestrzennej nie można
przypisać utraty aktywności
bezpośredniemu efektowi modyfikacji.
18

Ograniczenia i wskazania w
zakresie doboru odczynników:
•Modyfikacje należy przeprowadzić w warunkach, w
których nie dochodzi do denaturacji białka
•Nadmiar odczynnika jest szkodliwy
•Grupy wprowadzane do cząsteczki białka w czasie
modyfikacji powinny mieć możliwie jak najmniejszą
cząsteczkę oraz jak najmniejszy ładunek
•Odczynnik modyfikujący był możliwie selektywny
•Zmodyfikowana grupa wykazywała pochłanianie światła
•Zmodyfikowana grupa była stabilna w warunkach
hydrolizy
•Zmodyfikowana grupa daje się przeprowadzić w formę
pierwotną
19
Rodzaje modyfikacji
przeprowadzane za pomocą
powszechnie stosowanych
odczynników
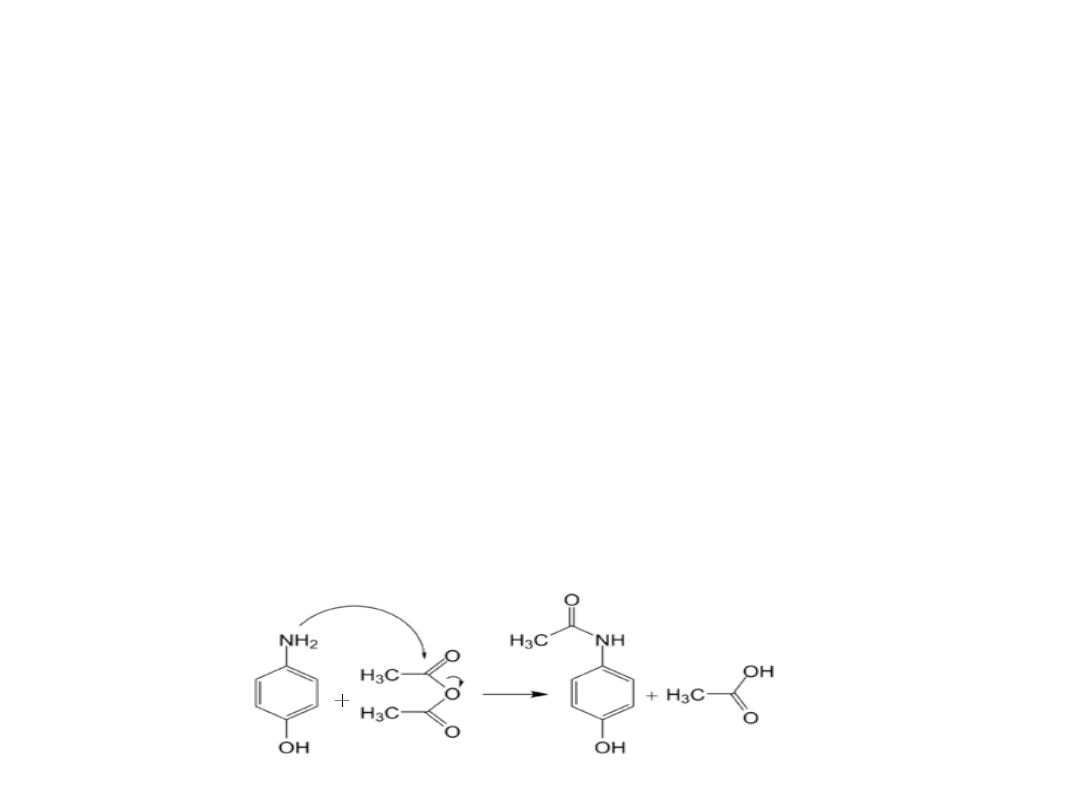
Acylowanie - jedna z metod modyfikacji grup
aminowych. Reakcji tej ulegają ponadto grupy
hydroksylowe tyrozyny, seryny i treoniny oraz
grupy tiolowe cysteiny. Odczynniki stosowane do
acylowania różnią się strukturą i reaktywnością.
1. Reakcja modyfikowania grupy aminowej
z wykorzystaniem bezwodnika kwasu
octowego ( przy pH > 7)
20
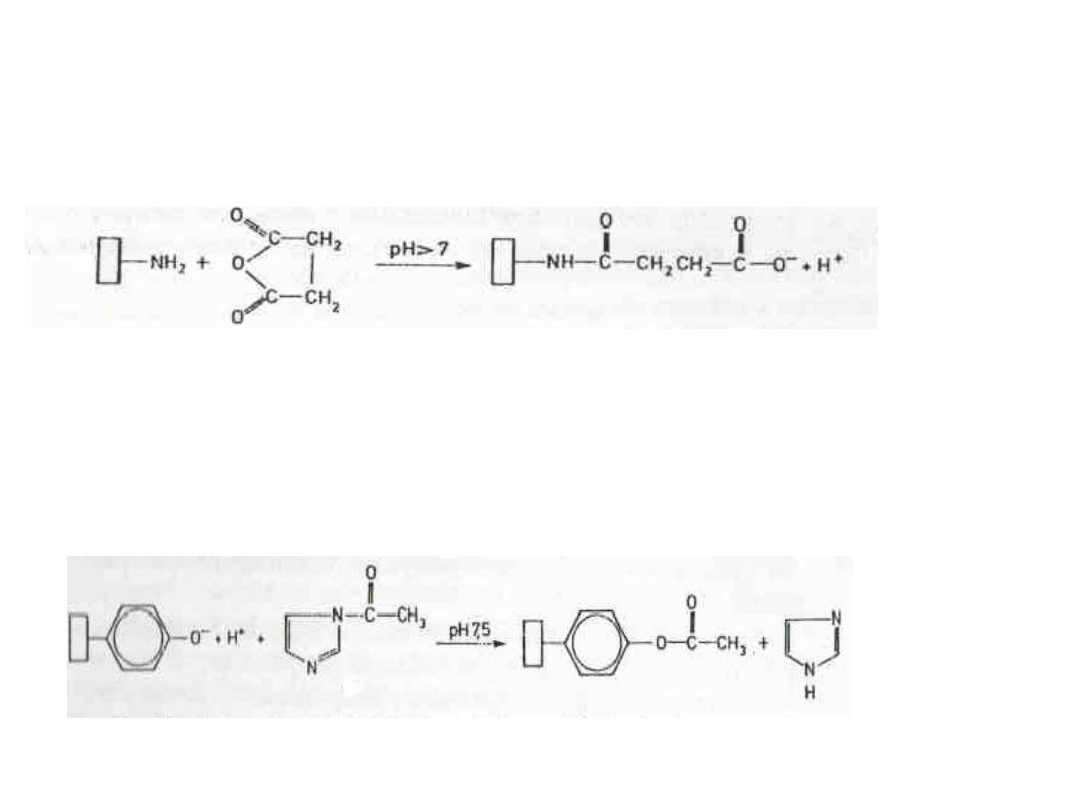
2. Modyfikacje grup aminowych bezwodnikiem
kwasu bursztynowego:
3. Modyfikacja grup hydroksylowych N-
acetyloimidazolem:
21
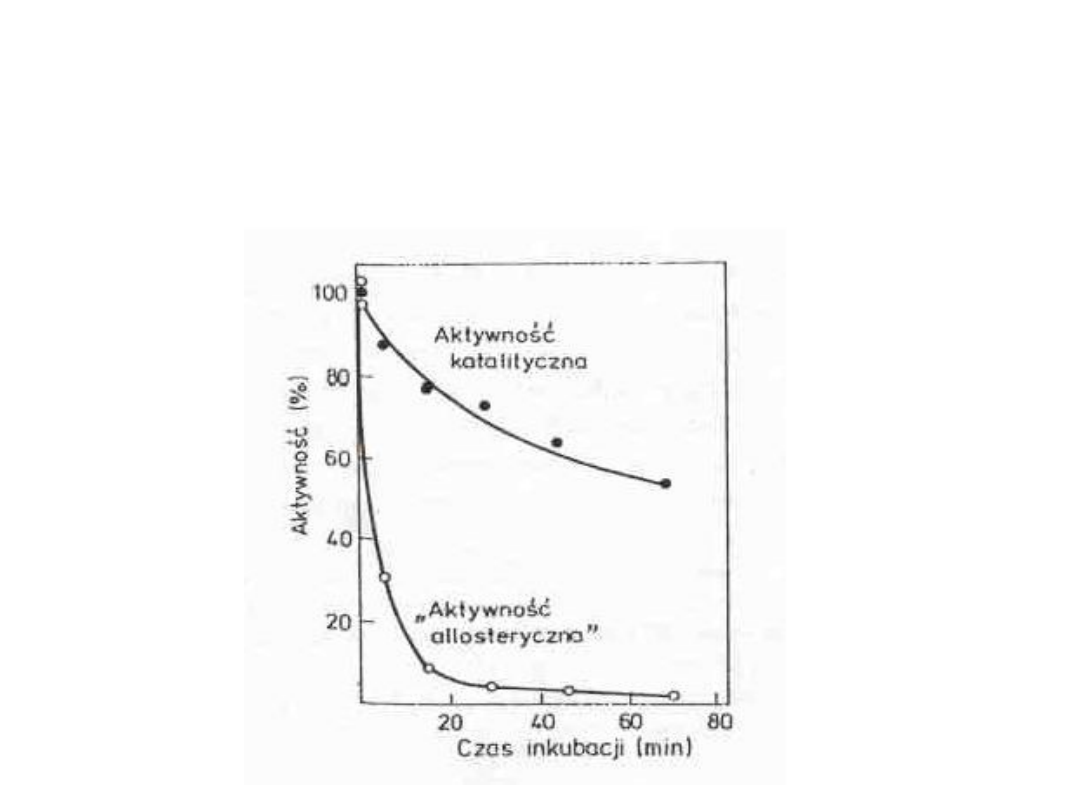
Wpływ N-acetyloimidazolu na
aktywność katalityczną i
właściwości allosteryczne
fosfofruktokinazy
22
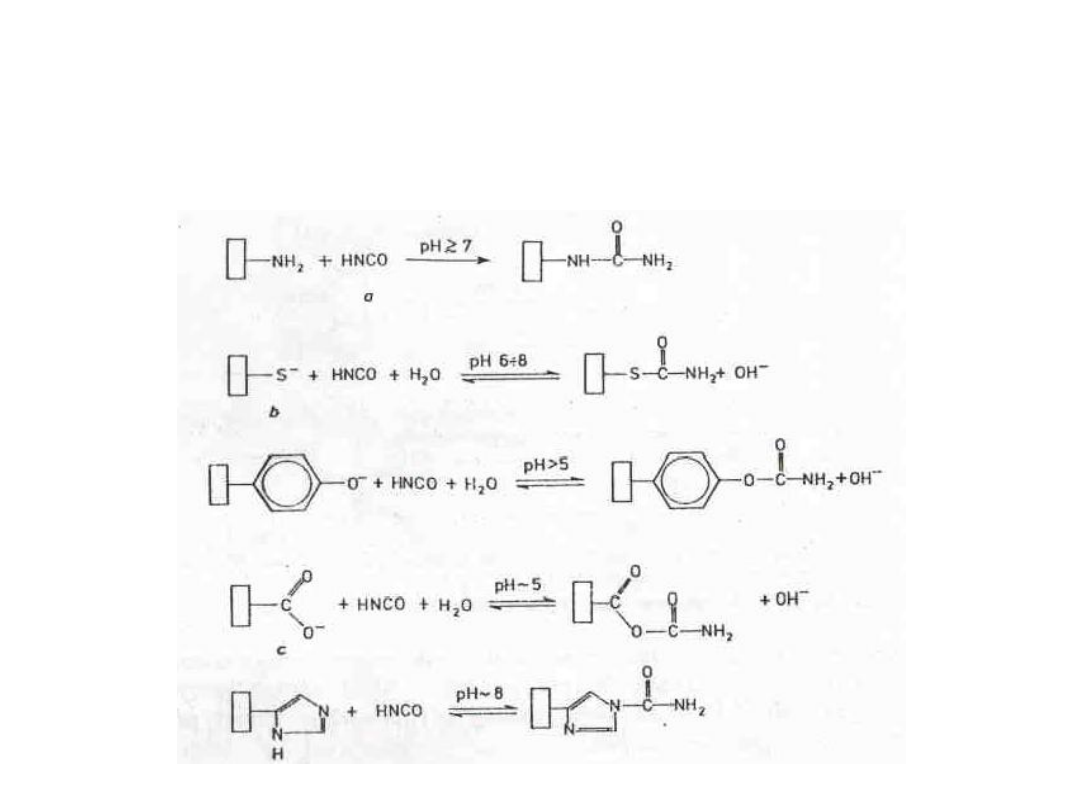
Modyfikacje grup aminowych,
tiolowych, fenolowych,
karboksylowych i imidazolowych
cyjaninami
23

Alkilowanie i arylowanie
tlenki alkilenów
amid kwasu diazooctowego
chlorowcopochodne kwasów alifatycznych
N-etyloimid kwasu maleinowego
etylenoimina
akrylonitryle
dinitrofluorobenzen
bromek 2-hydroksy-5-nitrobenzylowy
24
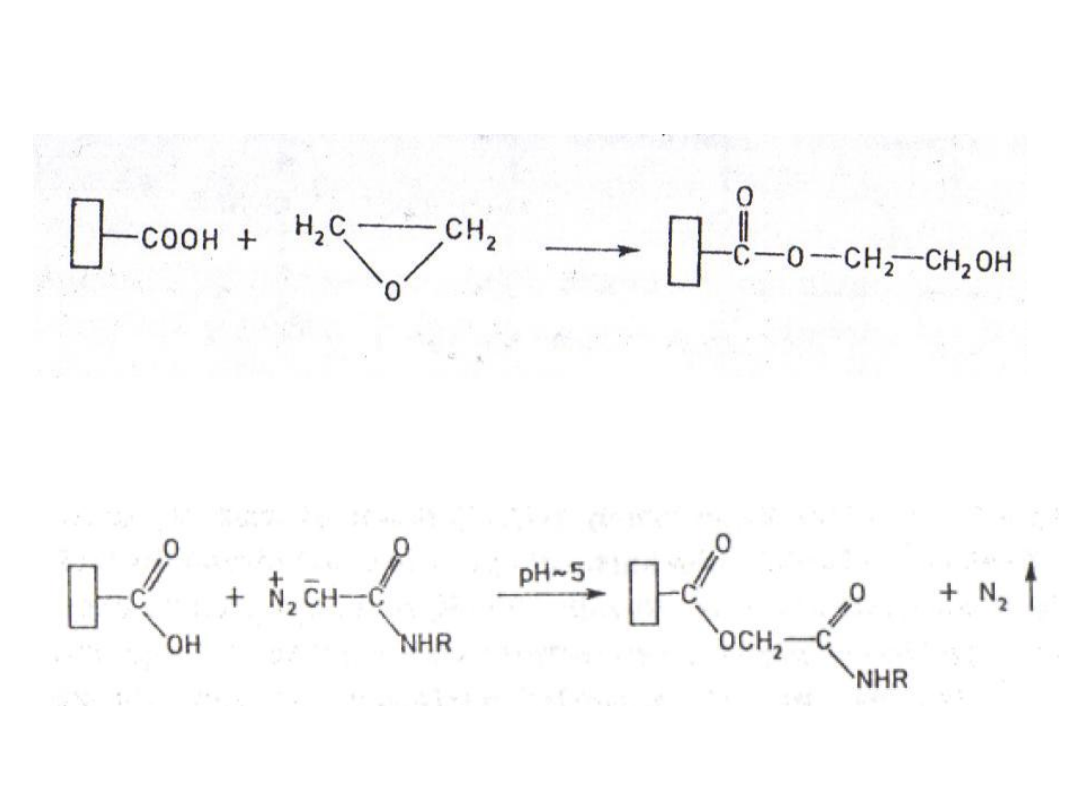
1. Alkilowanie grup karboksylowych
tlenkiem etylenu:
2. Alkilowanie grup karboksylowych amidem
kwasu diazooctowego:
25
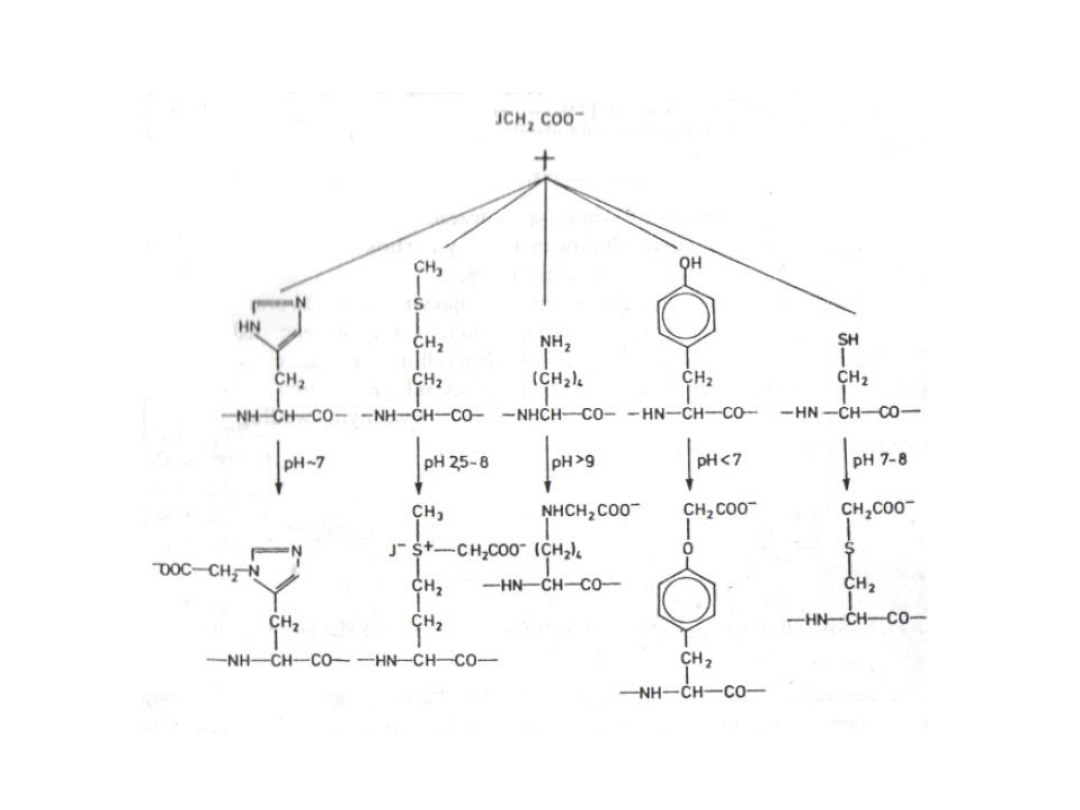
Karboksyalkilowanie
3. Karboksymetylowanie grup
reaktywnych białek:
Reszty w
białku:
histydylowa metionylowa
lizylowa
tyrozylow
a
cysteilowa
26
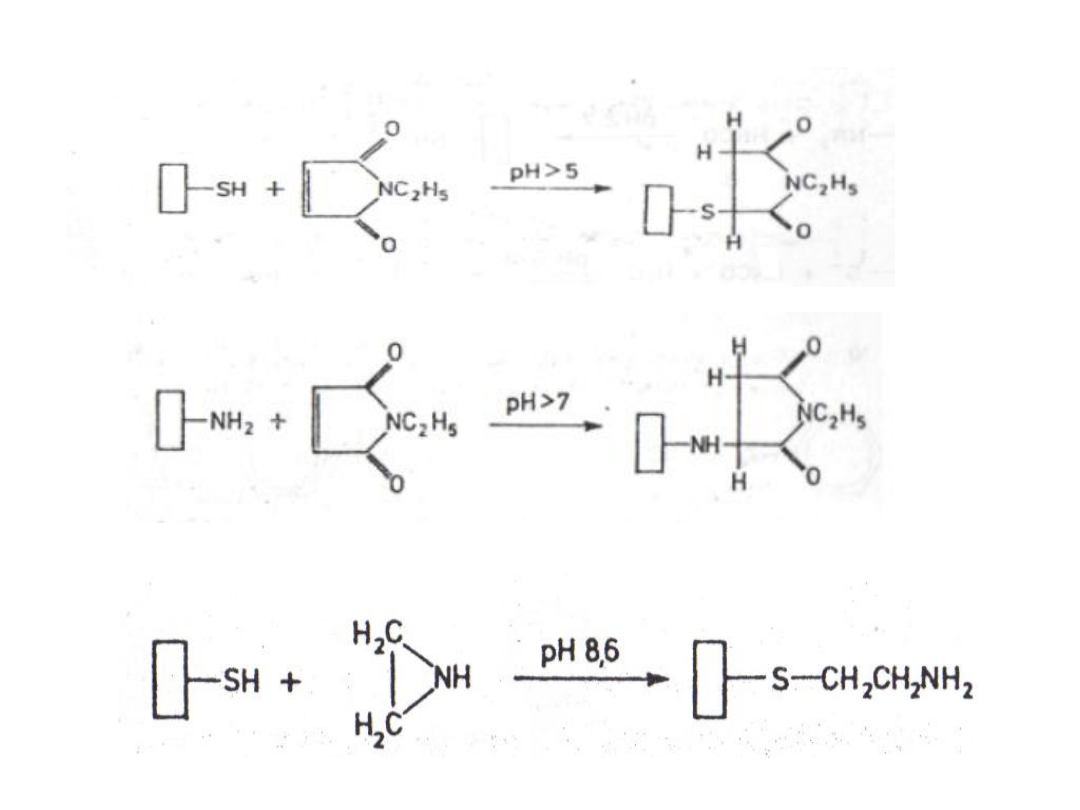
a) grup tiolowych
b) grup aminowych
5. Modyfikacja grup tiolowych za pomocą
etylenoiminy
:
4. Modyfikacja za pomocą N-etyloimidu kwasu
maleinowego:
27
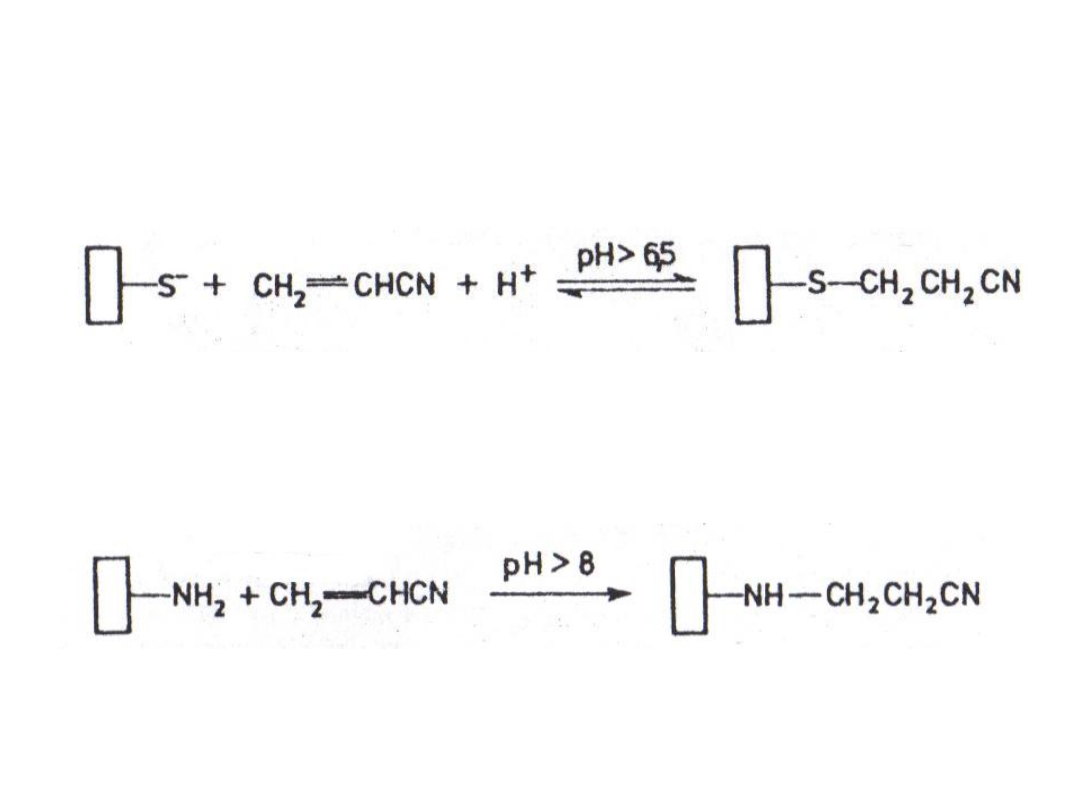
6. Modyfikacja akrylonitrylem:
a) Grup tiolowych
b) Grup aminowych
Reszta S-
cyjanoetylocysteilowa
Reszta N-cyjanoetylolizylowa
28
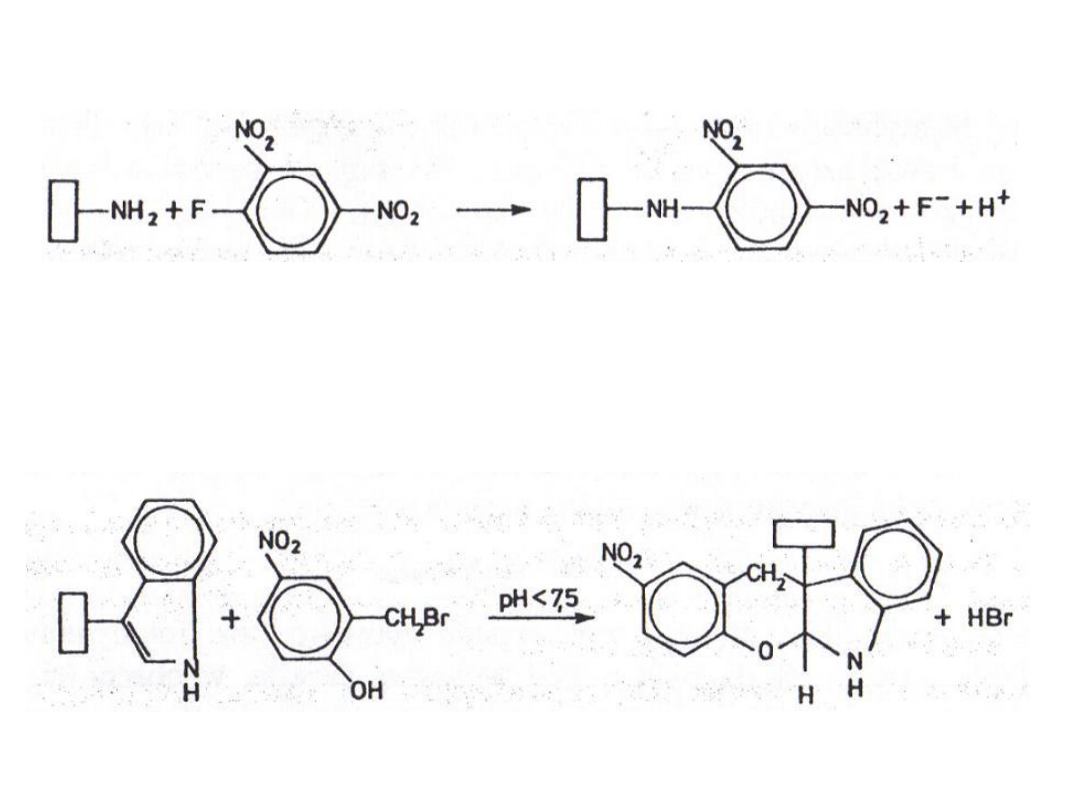
7. Modyfikacja grup aminowych
dinitrofluorobenzenem:
8. Modyfikacja grup indolowych bromkiem 2-
hydroksy-5-nitrobenzylowym
:
29

Utlenianie za pomocą odczynników
chemicznych
Największą wrażliwość na działanie związków
utleniających wykazują reszty:
• tryptofanylowe
• metionylowe
• cysteilowe
• tyrozylowe
Typy związków utleniających najczęściej stosowanych
do modyfikowania grup czynnych enzymów:
1. odczynniki disulfidowe
2. o-jodozobenzoesan
3. N-bromoimid kwasu bursztynowego
30
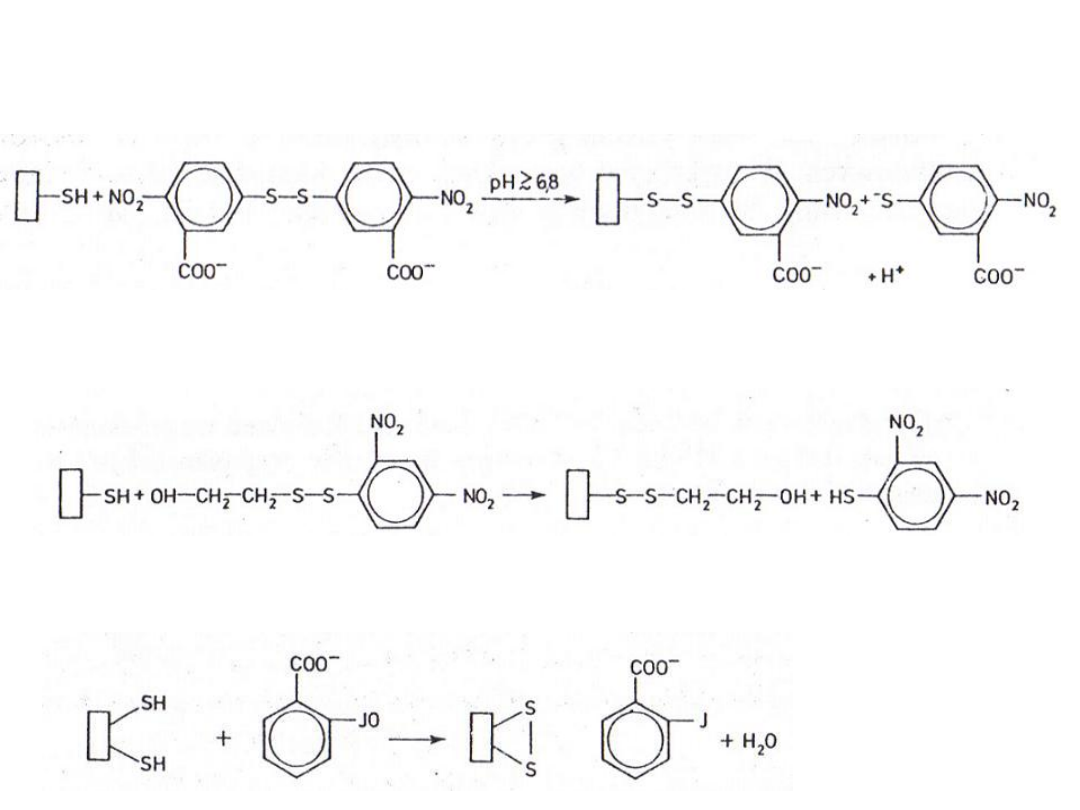
1. Reakcja modyfikacji grup tiolowych za pomocą
kwasu 5,5-ditio-bis-2-nitrobenzoesowego (DTNB):
2. Reakcja podstawienia grup tiolowych za
pomocą disulfidu β-hydroksy-etylo-2,4-
dinitrofenylu (HEDD):
3. Utlenianie grup tiolowych o-
jodozobenzoesanem:
dinitrotiofenol
31
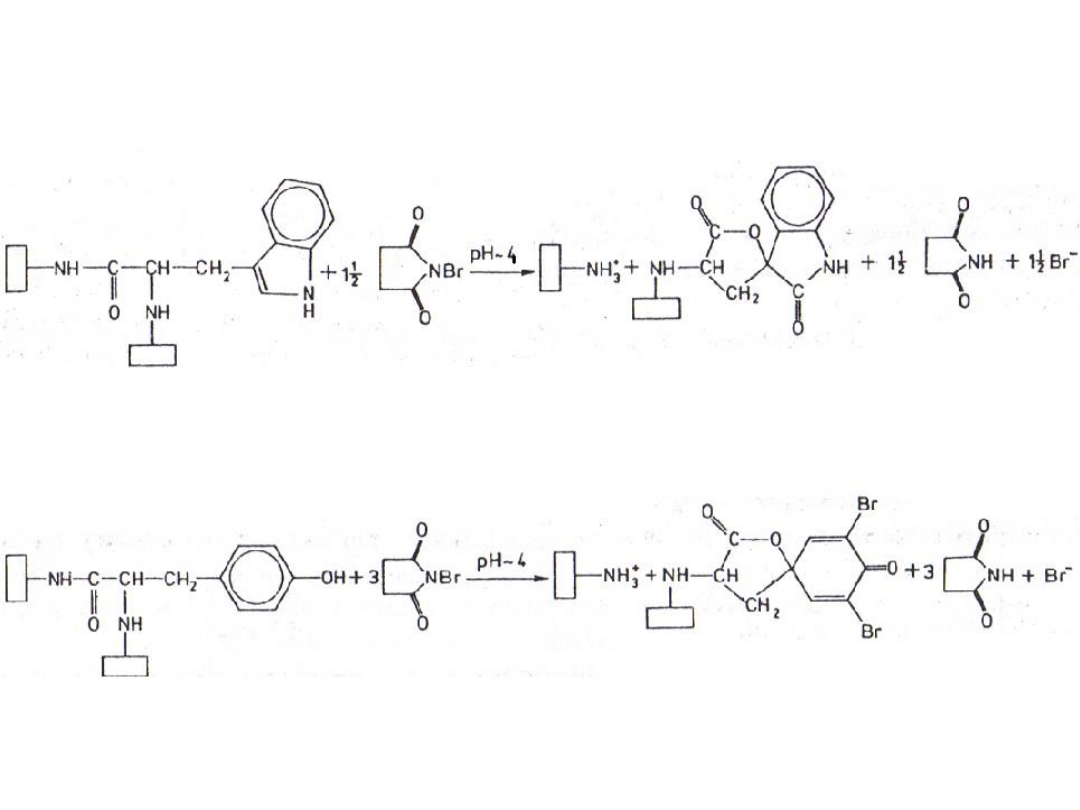
4. Utlenianie N-bromoimidem kwasu
bursztynowego:
a) reszt tryptofanylowych:
b) reszt tyrozylowych
Łańcuch peptydowy
zawierający resztę
tryptofanylową
Fragment łańcucha
peptydowego
zawierający
zmodyfikowaną
resztę tryptofanylową
Łańcuch peptydowy
zawierający resztę
tyrozylową
Fragment łańcucha
peptydowego ze
zmodyfikowaną
resztą tyrozylową
b) reszt
tyrozylowych:
32
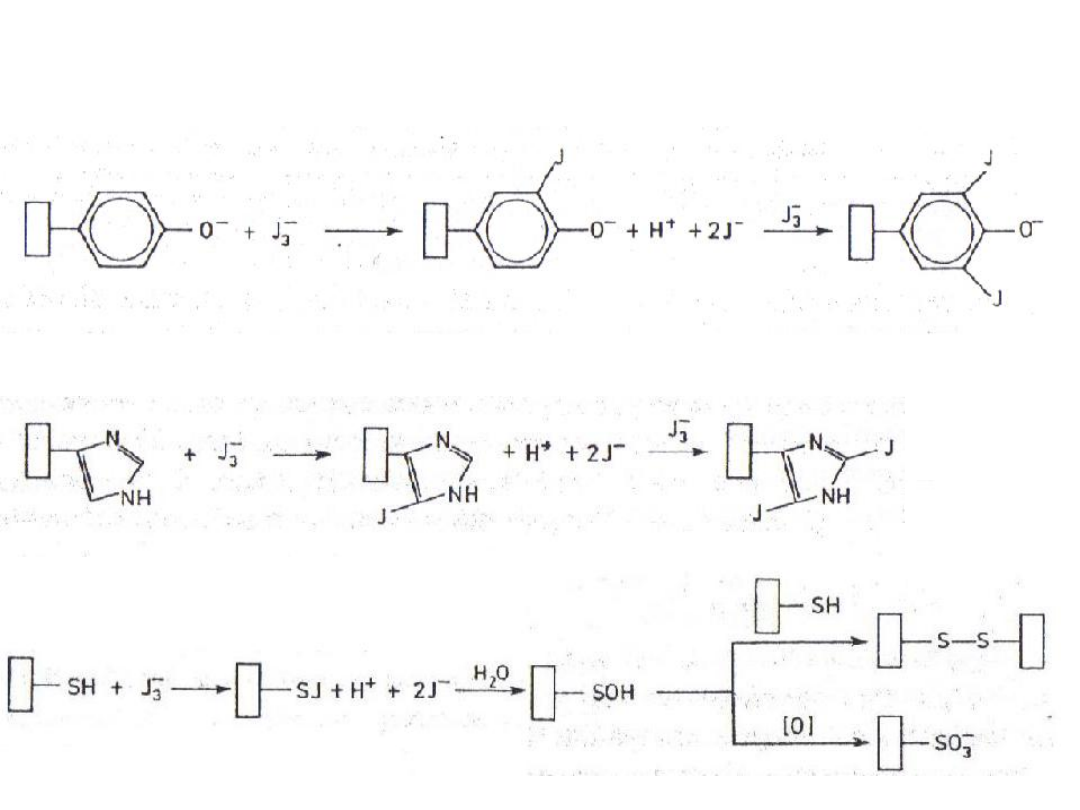
Jodowanie
1. Pierścienia aromatycznego
tyrozyny:
2. Pierścienia imidazolowego
histydyny:
3. Grup tiolowych cysteiny w
białkach:
33
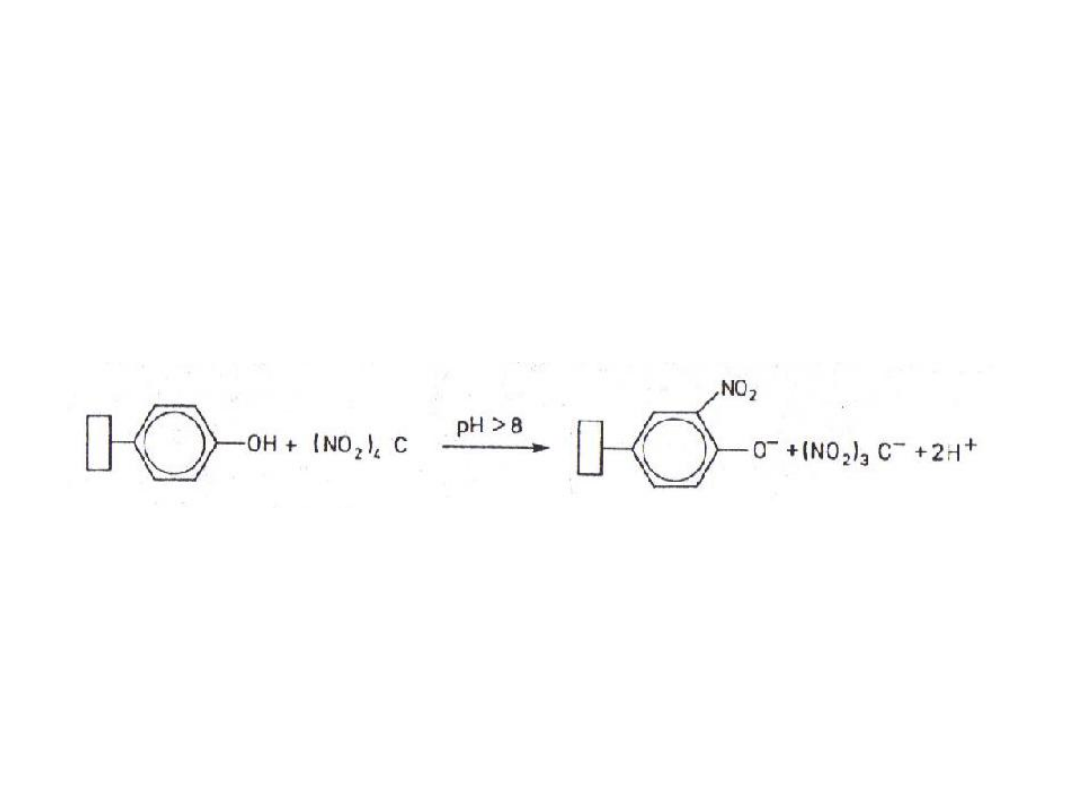
Nitrowanie
Nitrowanie reszt tyrozylowych
tetranitrometanem:
3-nitrotyrozyna
34
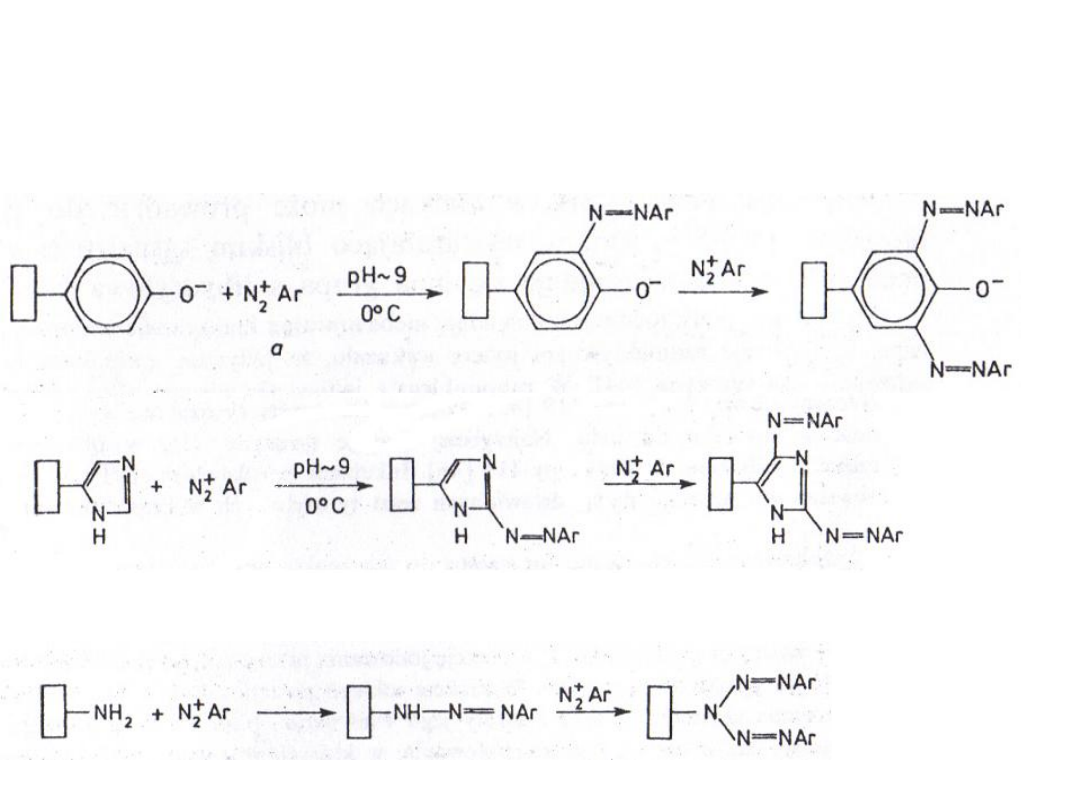
Sprzęganie z solami
diazoniowymi
1. Grup
tyrozylowych:
2. Grup
imidazolowych:
3. Grup
aminowych:
35
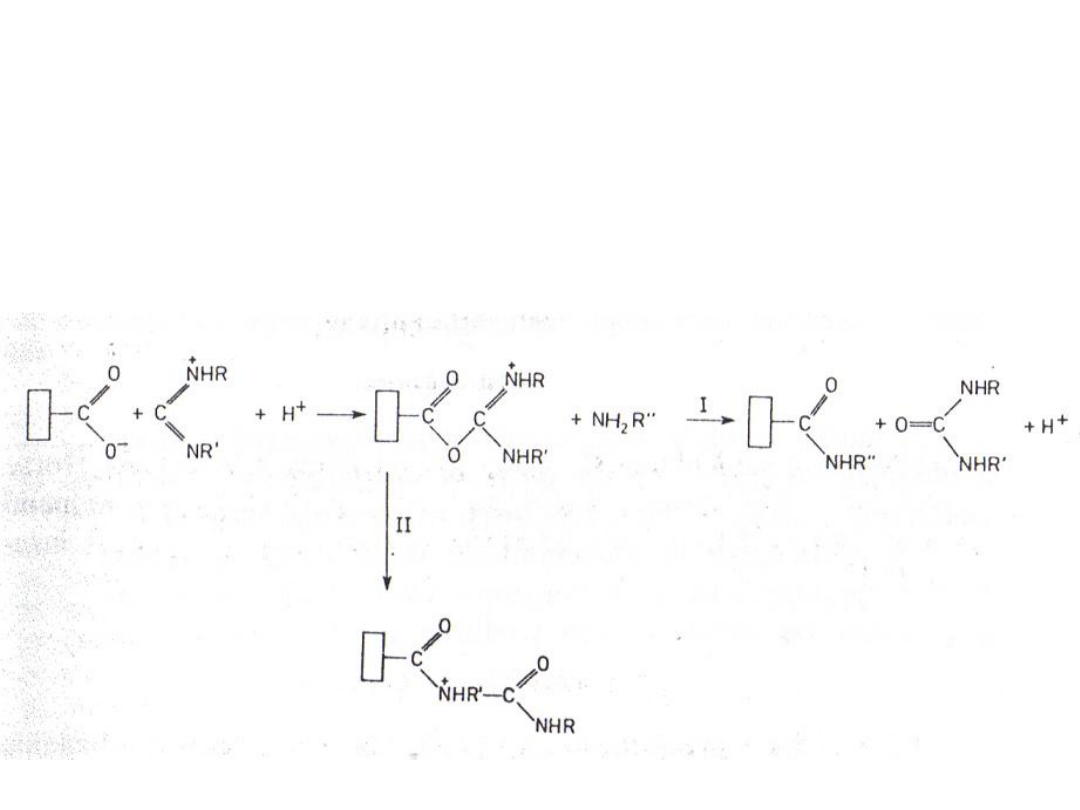
Reakcje z karbodiimidami
Modyfikowanie grup karboksylowych białek
poprzez przeprowadzenie w grupy amidowe za
pomocą dwustopniowej reakcji z karbodiimidami i
aminami:
Pochodna o-
acyloizomocznika
N-acyloizomocznik
36

Literatura
:
1. „Elementy enzymologii”, Praca zbiorowa pod
redakcja Jerzego Witwickiego i Wojciecha Ardelta,
2. Źródła internetowe.
Dziękujemy za uwagę
37
Document Outline
- Slide 1
- Grupy funkcyjne enzymów
- Modyfikacja grup funkcyjnych
- Selektywne modyfikacje (znakowanie) grup w centrum aktywnym
- Znakowanie substratami
- Znakowanie substratami
- Znakowanie pseudosubstratami
- Znakowanie pseudosubstratami
- Znakowanie pseudosubstratami
- Znakowanie innymi odczynnikami podobnymi do substratów
- Znakowanie innymi odczynnikami podobnymi do substratów
- Znakowanie innymi odczynnikami podobnymi do substratów
- Odczynniki nieselektywne do centrum aktywnego
- Identyfikacja grup czynnych enzymów
- Slide 15
- Km i kcat enzymów modyfikowanych
- Różnicowe modyfikacje enzymów
- Modyfikacje grup funkcyjnych enzymów a zmiany konformacyjne
- Ograniczenia i wskazania w zakresie doboru odczynników:
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Alkilowanie i arylowanie
- Slide 25
- Karboksyalkilowanie
- Slide 27
- Slide 28
- Slide 29
- Utlenianie za pomocą odczynników chemicznych
- Slide 31
- Slide 32
- Jodowanie
- Nitrowanie
- Sprzęganie z solami diazoniowymi
- Reakcje z karbodiimidami
- Slide 37
Wyszukiwarka
Podobne podstrony:
07 Magazyn, struktura i otoczenie 2id 6892 ppt
07 Wskaźniki i struktury
07 Liczby Pierwsze algorytmyid 6722 ppt
07 operacje na danychid 7063 ppt
(12535) równowaga przedsiębiorstwa w różnych strukturach rynkowychid 839 ppt
07 Parcie gruntu newid 6767 ppt
Rodzaje i typy struktur, ich wady i ppt
07 Masa cząsteczkowa polimerówid 6896 ppt
07 opis struktury dokumentacji systemu, Towaroznawstwo UR, SEMESTR VI, SBŻ
EKOSYSTEM I JEGO STRUKTURA, Prezentacje Biologiczne PPT, Ekologia
07 BIOCHEMIA lancuch odechowyid 6841 ppt
07 Rośliny motylkowate drobnonasienneid 6738 ppt
07 Dobór dławików zwarciowychid 6853 ppt
12Ana m brzucha 09 06 07 komentarz dla studentówid 14232 ppt
2 ogolna budowa i struktura wirionuid 20594 ppt
więcej podobnych podstron