
Teoria orbitali molekularnych:
- drobiny heterodwurdzeniowe,
- drobiny trójrdzeniowe i
wielordzeniowe
- wiązanie pojedyncze, podwójne,
potrójne i poczwórne
Teoria wiązań walencyjnych:
- hybrydyzacja
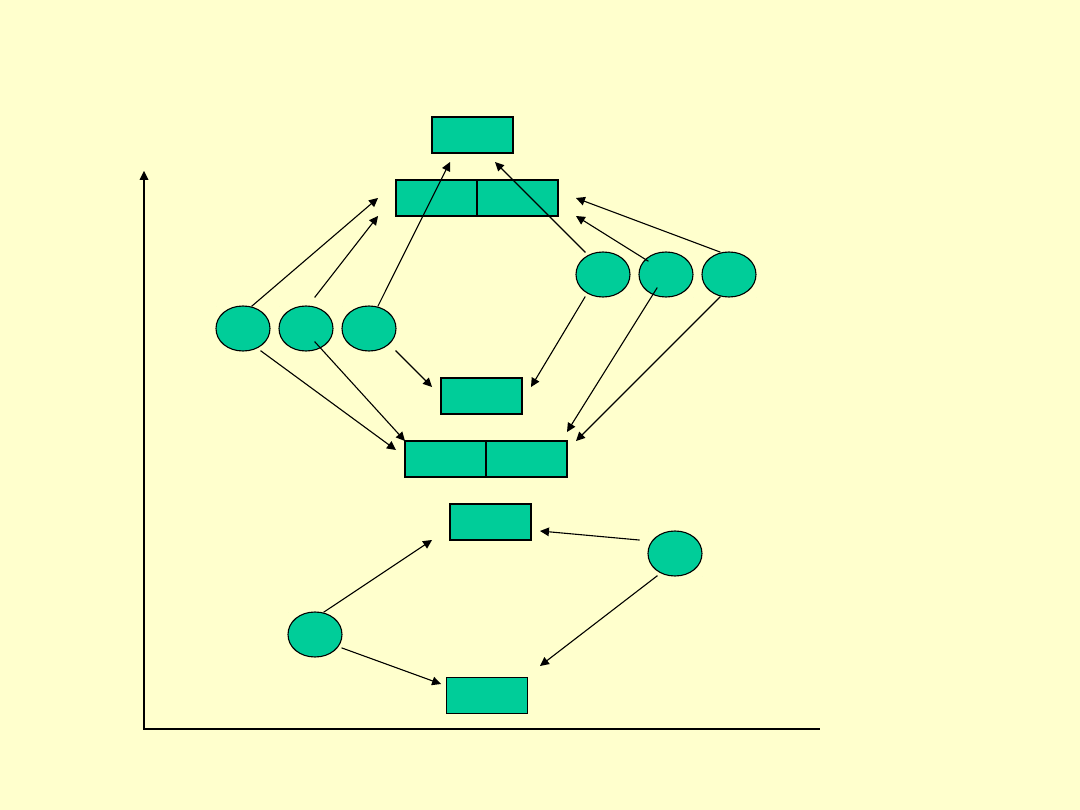
Orbitale molekularne w układzie dwóch różnych rdzeni
pierwiastków bloku
sp
np.
NO
•
O
•
N
E
•
.....................
s
s
•
E
sA
E
pA
p
z
p
z
p
y
p
x
p
y
p
x
σ
b
σ
a
π
b
π
b
σ
*
b
*
a
π
a
π
a
•
E
sB
.................................................................
.......
•
E
pB
.......................................................
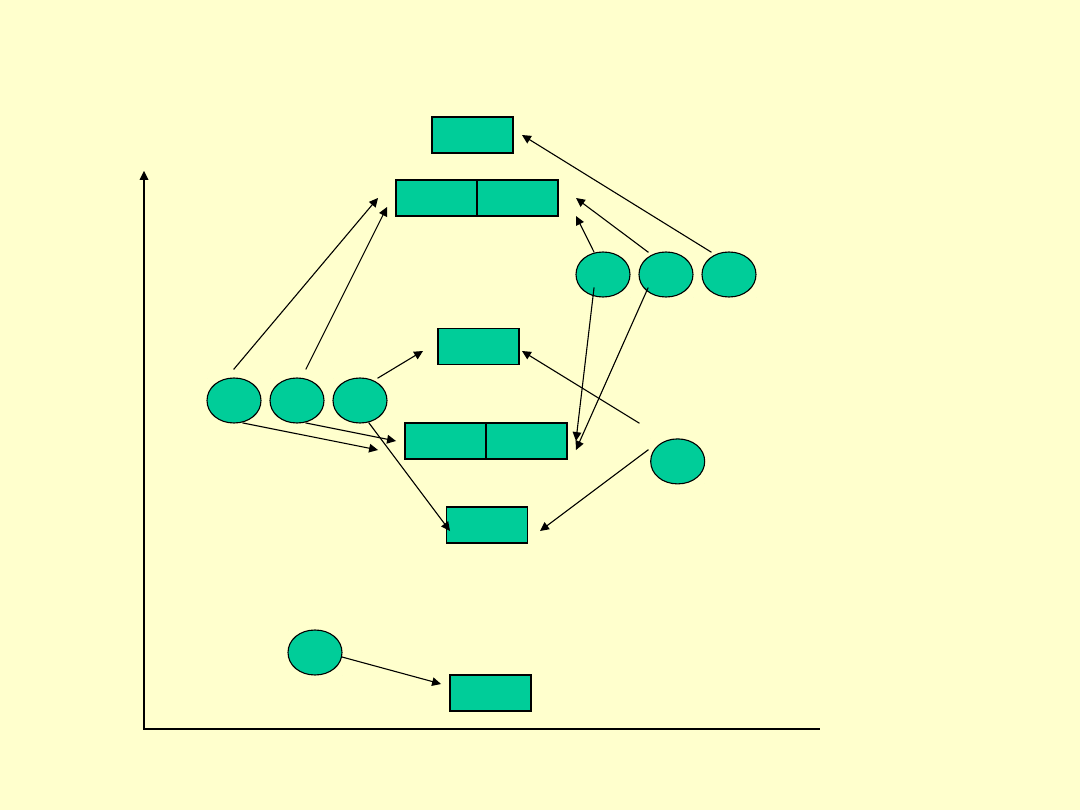
Orbitale molekularne w układzie dwóch różnych rdzeni
pierwiastków bloku
sp
różniących się znacznie elektroujemnością np.
CO
•
O
•
C
E
s
s
2e
2e
2e
2e
2e
p
z
p
z
p
y
p
x
p
y
p
x
s
b
b
b
a
p
a
a

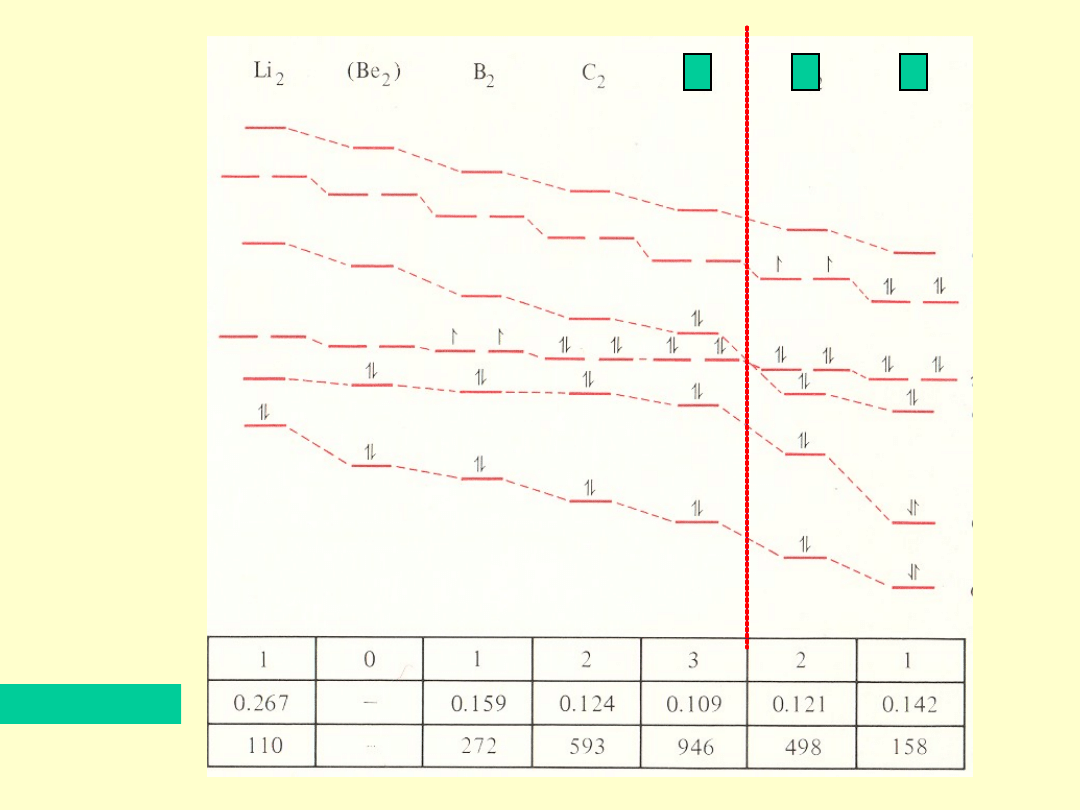
Wiązania pojedyncze, podwójne, potrójne i poczwórne
w drobinach pierwiastków układu okresowego
-dwuelektronowe wiązania
Rząd wiązania
R =
n
e
b
-
m
e
a
2
n
e
b
-
liczba elektronów na
orbitalach wiążących
n
e
a
-
liczba elektronów na orbitalach
antywiążących
Np. w N
2
8 elektronów na orbitalach wiążących
2 elektrony na orbitalach antywiążących
R =
8 - 2
2
= 3
b
b
a
a
*
b
*
b
b
b
a
a
*
a
*
a
Rząd
wiązania
Długość [nm]
Energia
[kJ/mol]
N
2
O
2
F
2

b
2
b
2
b
2
a
a
2
a
E
Wiązanie wielokrotne w drobinach pierwiastków dsp
z udziałem orbitali
d
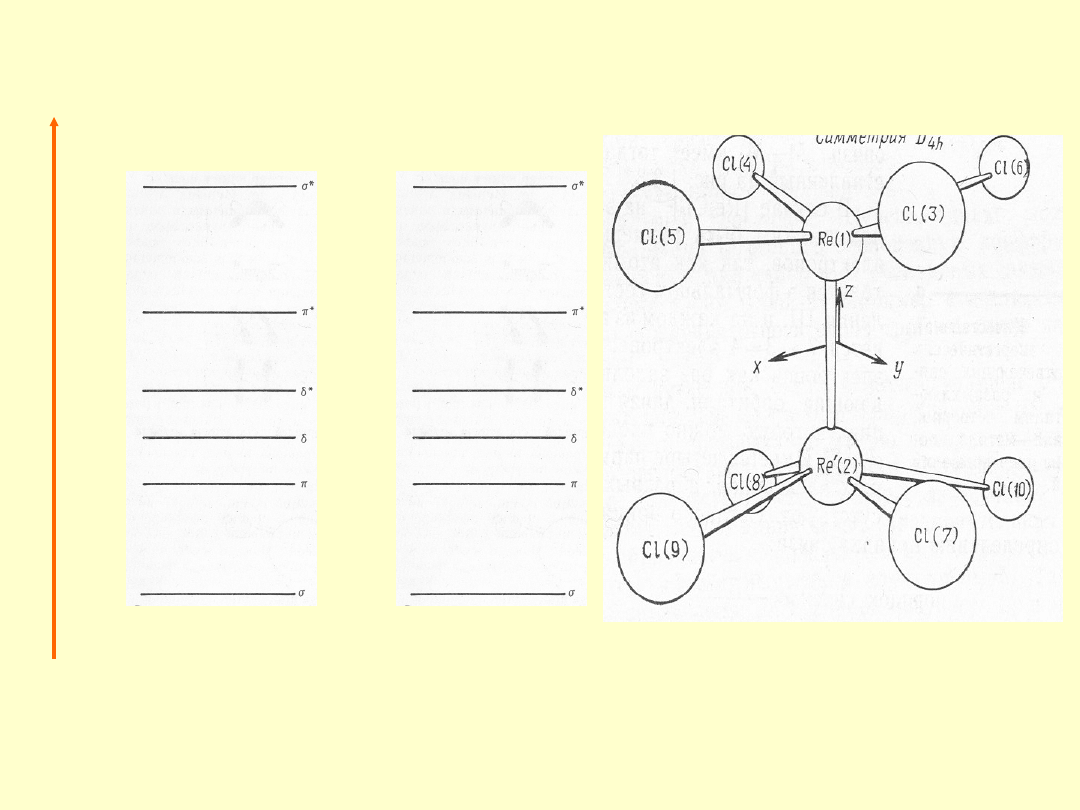
b
2
b
2
b
2
a
a
2
a
E
b
2
b
b
a
2
a
a
dla
M
2
dla
M
2
X
8
Re
2
Cl
8
2-
w K
2
Re
2
Cl
8
·2H
2
O (
224,1 pm
)

b
2 2 2 2 2 2 2 2 2
2 2 2 2
2
b
2-2 2-2 2-2 2-2 2-2 2-1 2-2 1-1 2-2
1 2-2 2-2
b
2 1 2 2 2 2
2 2
2
a
1 1-1 2-1 2-2
a
a
1 2 2 2
2 2
E
Rząd wiązania 4 3,5 3,5 3 3 2,5 2,5 2
2 1,5 1,5 1 1
Liczba e 8 7 9 6 10 5 11 4
12 13 14

Związki z wiązaniem poczwórnym (
d M-M
):
Re
2
Br
8
2-
w Cs
2
Re
2
Br
8
(
222,8 pm
)
Re
2
Cl
8
2-
w K
2
Re
2
Cl
8
·2H
2
O (
224,1 pm
)
Re
2
Cl
6
(PEt
3
)
2
(
222,2 pm
)
Re
2
(SO
4
)
4
(H
2
O)
2
2-
w Na
2
Re
2
(SO
4
)
4
(H
2
O)
2
·6H
2
O
(
221,4 pm
)
Mo
2
Cl
8
4-
w K
4
Mo
2
Cl
8
·2H
2
O (
213,8 pm
)
Mo
2
(SO
4
)
4
(H
2
O)
2
4-
w K
4
Mo
2
(SO
4
)
4
·2H
2
O) (
211,0
pm
)
W
2
(CH
3
)
8
4-
w Li
4
W
2
(CH
3
)
8
4Et
2
O (
226,4 pm
)

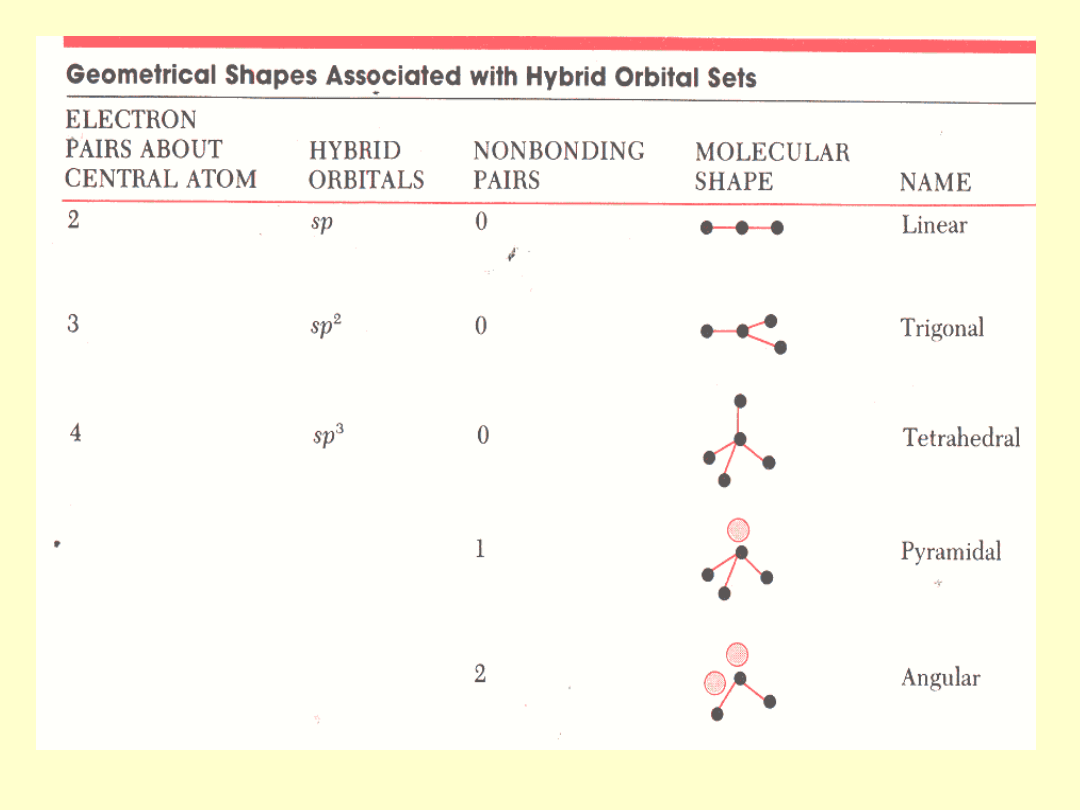
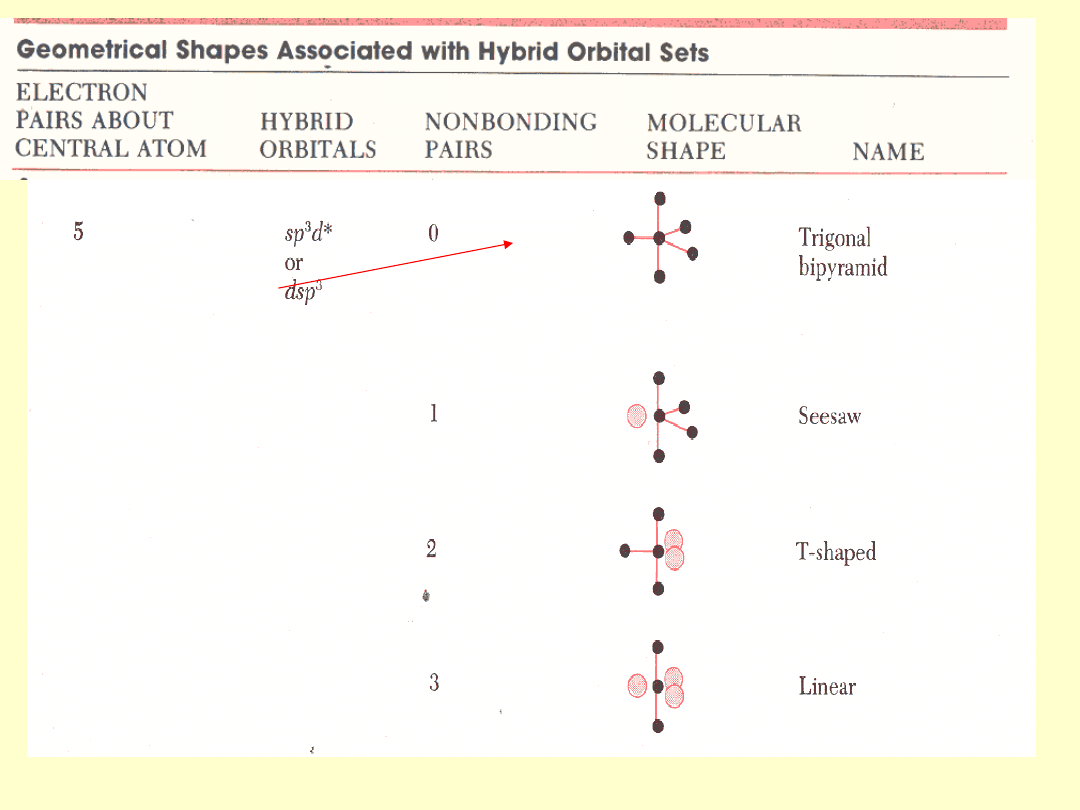
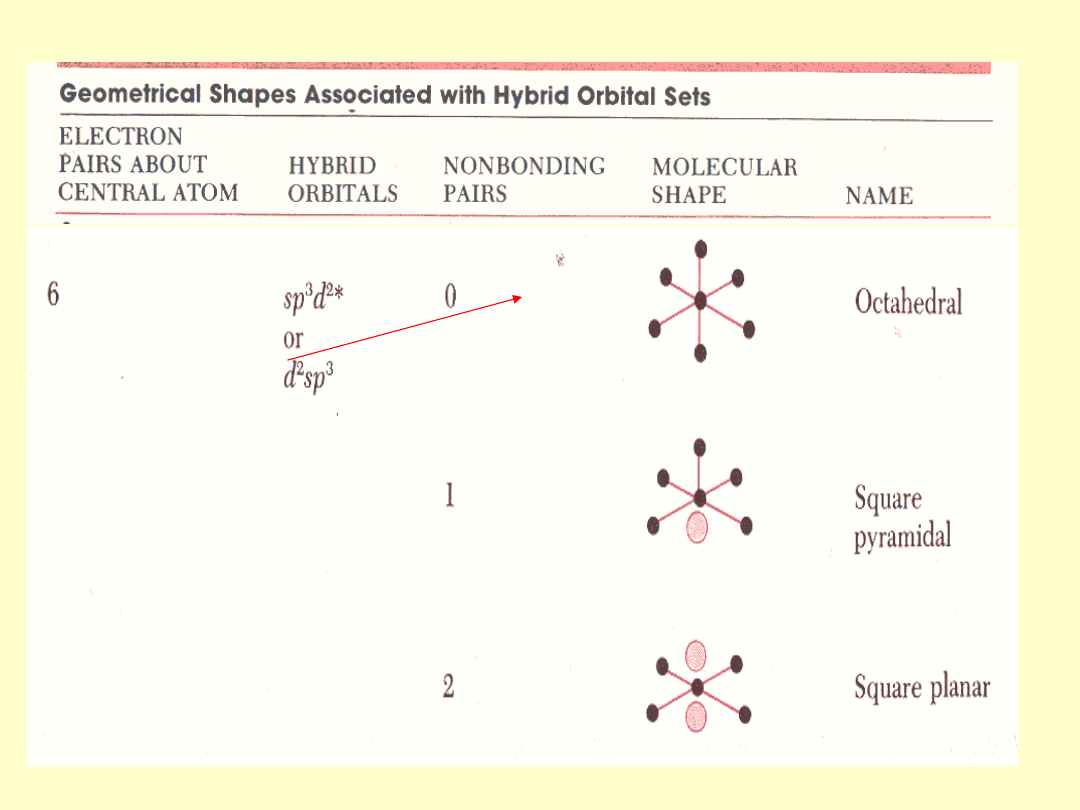
Teoria wiązań walencyjnych
VB
Wiązanie chemiczne jest związane z dwoma
orbitalami
atomowymi
należącymi do różnych rdzeni i jest
zlokalizowane
pomiędzy nimi. Funkcje jednoelektronowe są nie zmienionymi
orbitalami atomowymi, najczęściej zhybrydyzowanymi.
Funkcja falowa:
kow
AB
=
c
1
{[
A
(1)
B
(2)
]
+
[
A
(2)
B
(1)
]}
+
c
2
[
A
(1)
A
(2)
] +
c
2
[
B
(1)
B
(2)
]
Opis form rezonansowych:
czę
ść
kowalencyjna
-
kow
czę
ść
jonowa
-
[
A
(1)
A
(2)
]
czę
ść
jonowa
-
[
B
(1)
B
(2)
]
np. Opis
H
2
jako
H
A
-H
B
;
H
A
+
H
B
-
;
H
A
-
H
B
+

Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
Wyszukiwarka
Podobne podstrony:
E wyk11 id 827343 Nieznany
IB wyk11
Makro 1S Cykl koniunkturalny
fp-wyk11, UE Katowice FiR, finanse publiczne
ekonomika, Materiały studia, II rok, 1s, ekonomika przedsiębiorstw żywności
umowa 1S 2K
ssf-wyk11
WYK12 1S
Otrzymywanie (1S) ( ) 2,10 kamforosultamu
IB wyk11 11
BP20122013 lab 1s id 92526 Nieznany
WYK15 1S
WYK11
PO wyk11 v2
dzienne zużycie energii 1s 0001
budowa ciała 1s 0001
Makro 1S Wzrost a rozwoj gospod Nieznany
F' Test z wykładów 1s 2r 14
więcej podobnych podstron