
WYKŁAD
Typy wiązań
chemicznych w
drobinach (1)

WYKŁAD
Opis budowy drobin:
-
centrum koordynacji
i
ligand
-
schemat walencyjny
-
wzór elektronowy
-
budowa przestrzenna

WYKŁAD
Opis budowy drobin:
- centrum koordynacji
(C
K
)
- dla ligandów wodorowych
H
+
- C
k
stanowią rdzenie pierwiastków bloku
sp
z
elektronami:
- jako wolne jony:
O
2-
w OH
-
, H
2
O, H
3
O
+
itd..
-
jako ligandy w złożonych drobinach:
O
2-
w
HSO
4
-
,
N
3-
w CH
3
NH
2
itd.,
- dla ligandów posiadających wolne elektrony (
O
2-
,
CO
0
, NO
3
-
itd.):
- C
k
stanowią rdzenie pierwiastków
posiadające
wolne stany walencyjne
, np.: B
3+
, Zn
2+
,
N
5+
, I
7+
itd

WYKŁAD
Opis budowy drobin:
- jako ligandy (L)
- anion wodorkowy
H
-
: w BH
4
-
, AlH
6
3-
,
ReH
9
2-
, itd.,
-
drobiny ośmioelektronowe i ich pochodne
wodorowe
-
O
2-
w CO
2
, NO
2
+
, NO
3
-
, SO
3
2-
, MnO
4
2-
,
IO
6
5-
,
-
OH
-
w HCO
3
-
, H
2
PO
4
-
, H
6
TeO
6
,
B(OH)
4
-
,
-
F
-
w BF
3
, NF
4
+
, CF
4
, PF
6
-
, IF
7
,
-
N
3-
w BN
2
3-
, CN
2
2-
, P
3
N
5
, PN
4
7-
,
-
NH
2-
i
NH
2
-
w CNH(NH
2
)
2
,
-
NH
3
0
w Zn(NH
3
)
4
2+
, Co(NH
3
)
6
3-
,
- itd.. .......

WYKŁAD
Opis budowy drobin:
- jako ligandy (L)
- drobiny dwurdzeniowe i wielordzeniowe:
-
CO
0
w Fe(CO)
5
i innych
karbonylkach,
-
CN
-
w Cr(CN)
6
3-
, Fe(CN)
6
4-
-
C
2
O
4
2-
w [Co(C
2
O
4
)
3
]
3-
,
-
NO
3
-
w Cu(NO
3
)
2
, [Al(NO
3
)
6
]
3-
,
-
NO
2
-
w [C(NO
2
)
3
]
-
, HC(NO
2
)
3
-
nitroform
-
CH
3
O
-
w B(OCH
3
)
3
,
-
C
6
H
6
0
w Fe(C
6
H
6
)
2
, Cr(C
6
H
6
)
2
,
-
NH
2
C
2
H
4
NH
2
0
w [Co(en)
3
]
3+
,
- itd.. .......

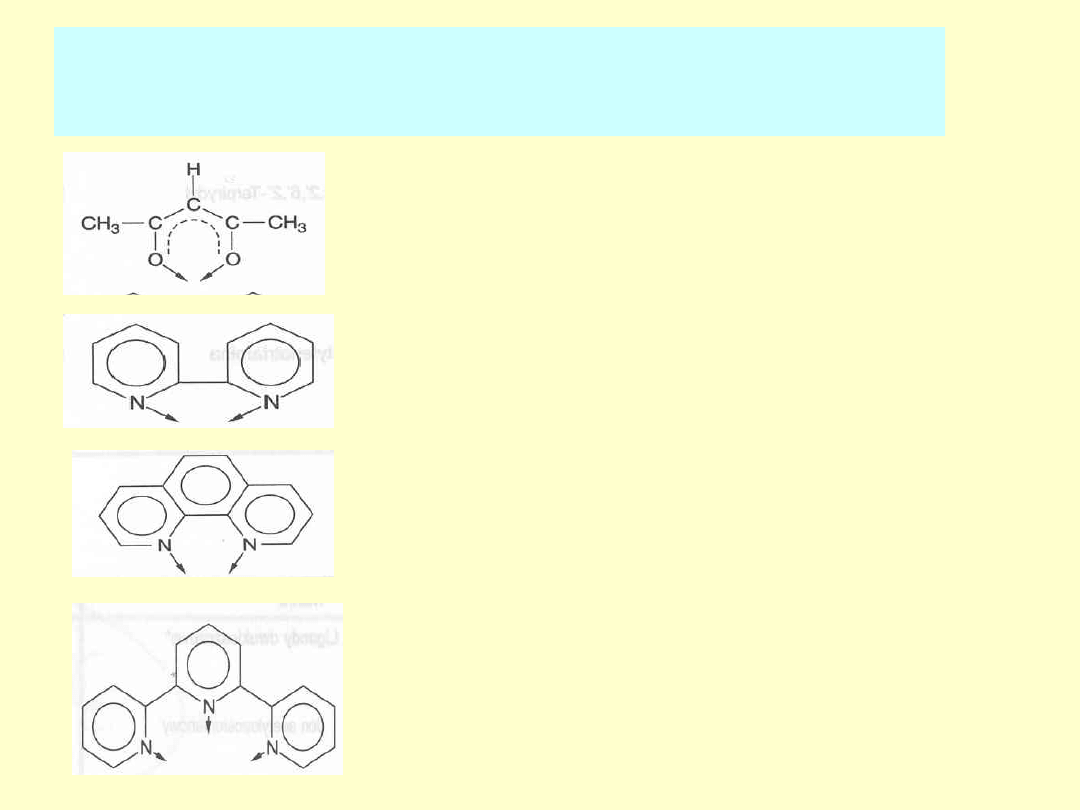
Opis budowy drobin:
- jako ligandy (L) wielokleszczowe:
acac - jon acetyloacetonianowy
bpy - bipirydyl
phen - 1,10 fenantrolina
terpy - 2,2’,6’,2’ terpirydyl
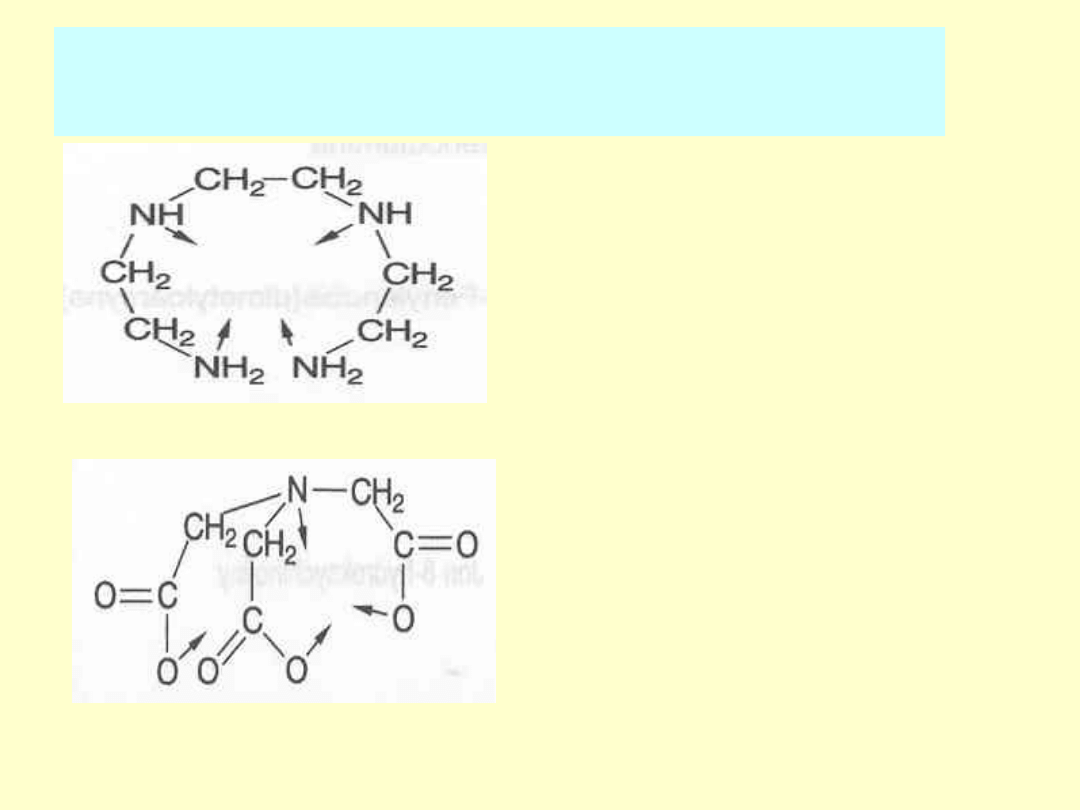
Opis budowy drobin:
- jako ligandy (L) wielokleszczowe:
trien - trietylenotetraamina
NTA - nitrylotrioctanowy
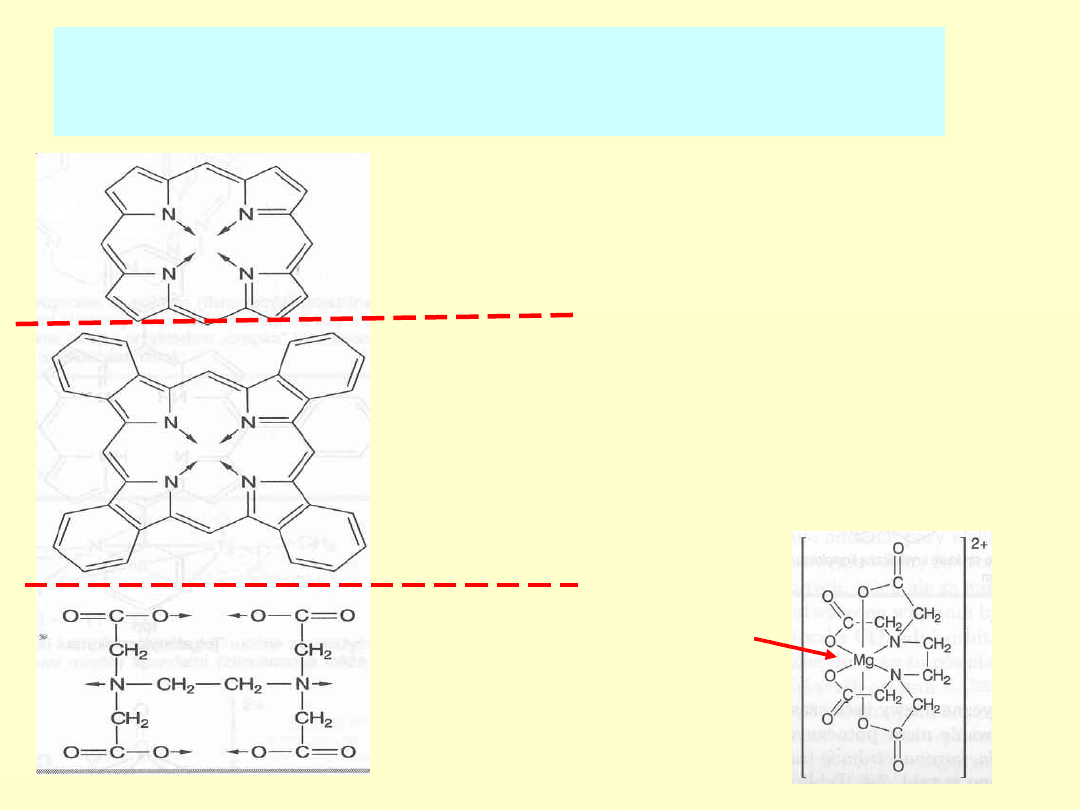
Opis budowy drobin:
- jako ligandy (L) wielokleszczowe:
p - porfiryna
pc - ftalocyjanina, kompleks z Cu
2+
,
niebieski
barwnik
EDTA
- anion kwasu
etylenodiaminotetraoctowego
Cu
2+
Mg2+


Typy wiązań chemicznych w drobinach:
-
wiązania
donorowe
i
akceptorowe
- wiązania
akceptorowe
- wiązania
donorowe
- wiązania
donorowe
p donorowe
- wiązania
donorowe
d donorowe
- wiązania
donorowe
akceptorowe
- wiązania
donorowe
- wiązania z deficytem elektronów
- wiązania wodorowe

WYKŁAD
Typy wiązań chemicznych w drobinach:
-
wiązania
donorowe
i
akceptorowe
Donorowość lub akceptorowość wiązania rozpatrujemy
z punktu widzenia ligandu,:
- w wiązaniu
donorowym
ligand jest donorem
elektronów na tworzące się wiązanie, pierwiastek
ligandu jest bardziej elektroujemny niż centrum
koordynacji, np..
N-O
,
B-F
,
Mn-O
,
Fe-CN
.......,
polaryzacja wiązania jest w kierunku ligandu.
- w wiązaniu
akceptorowym
ligand jest akceptorem
elektronów w tworzącym się wiązaniu, pierwiastek
ligandu lub orbital jest mniej elektroujemny niż
centrum koordynacji, np.:
O-H
,
N-H
,
Cl-H
,
P-H
,
Fe-
CN......,
polaryzacja wiązania jest w kierunku centrum
koordynacji.
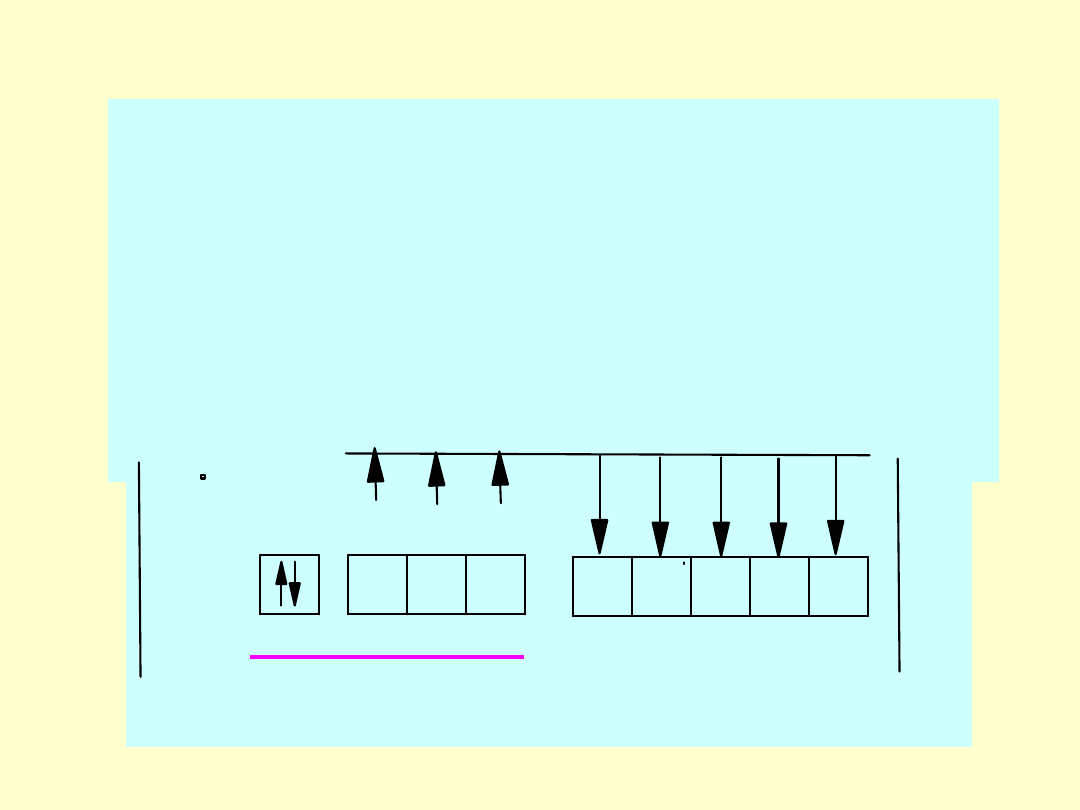
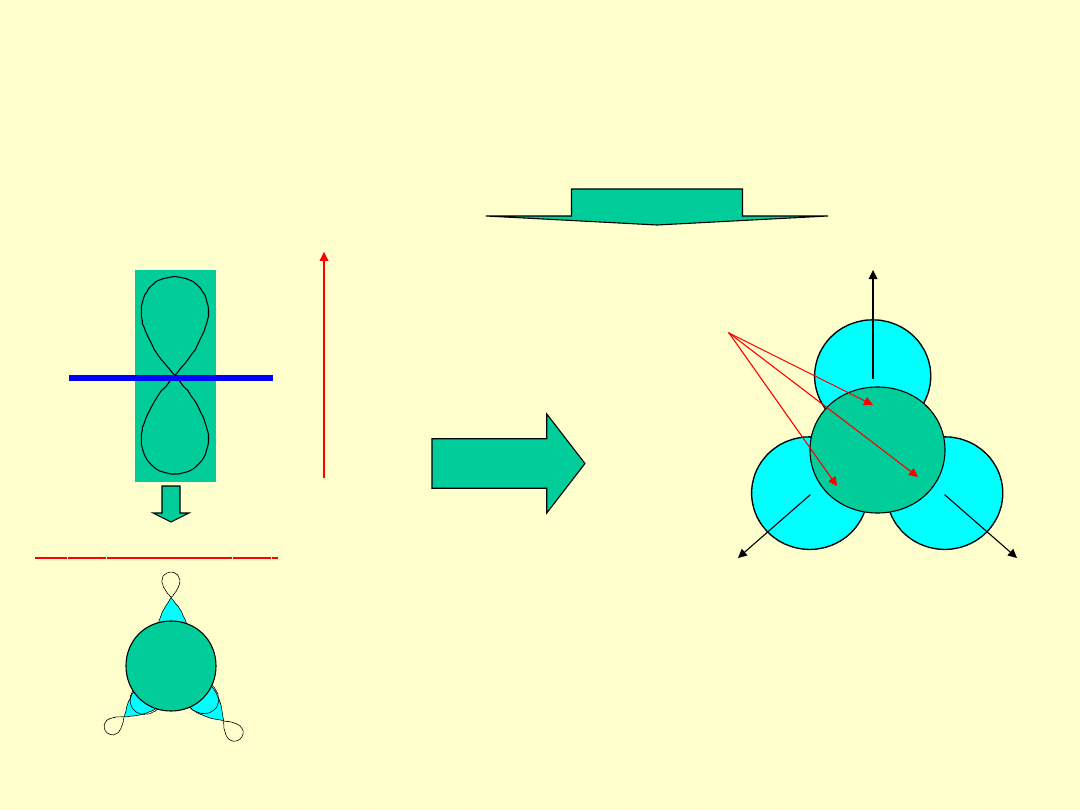
Opis budowy drobin:
-
schemat walencyjny (
struktura rdzeniowo
walencyjna pierwiastka stanowiącego centrum
koordynacji oraz rozmieszczone w stanach
walencyjnych C
K
wolne elektrony oraz elektrony
wiązań z ligandami). W schemacie walencyjnym
rozmieszczone są wszystkie rdzenie drobiny oraz
wszystkie elektrony walencyjne - zarówno przy C
K
jak i L
np. w SO
3
2-
s
p
sp
3
_
IOI
I
_
IOI
I
S
6+
_
IOI
I
2-
d
d
d
d
WYKŁAD
d
d
Opis budowy drobin:
-
wzór elektronowy (
rozmieszczenie
wszystkich rdzeni w drobinie i powiązanie ich
poprzez elektrony wiązań z uwzględnieniem
wszystkich elektronów walencyjnych i
wypełnieniem wszystkich stanów walencyjnych C
K
i
L
), np.
_
_
s
_
OI
IO
I
IOI
I
IOI
_
_
_
_ _
2-
WYKŁAD
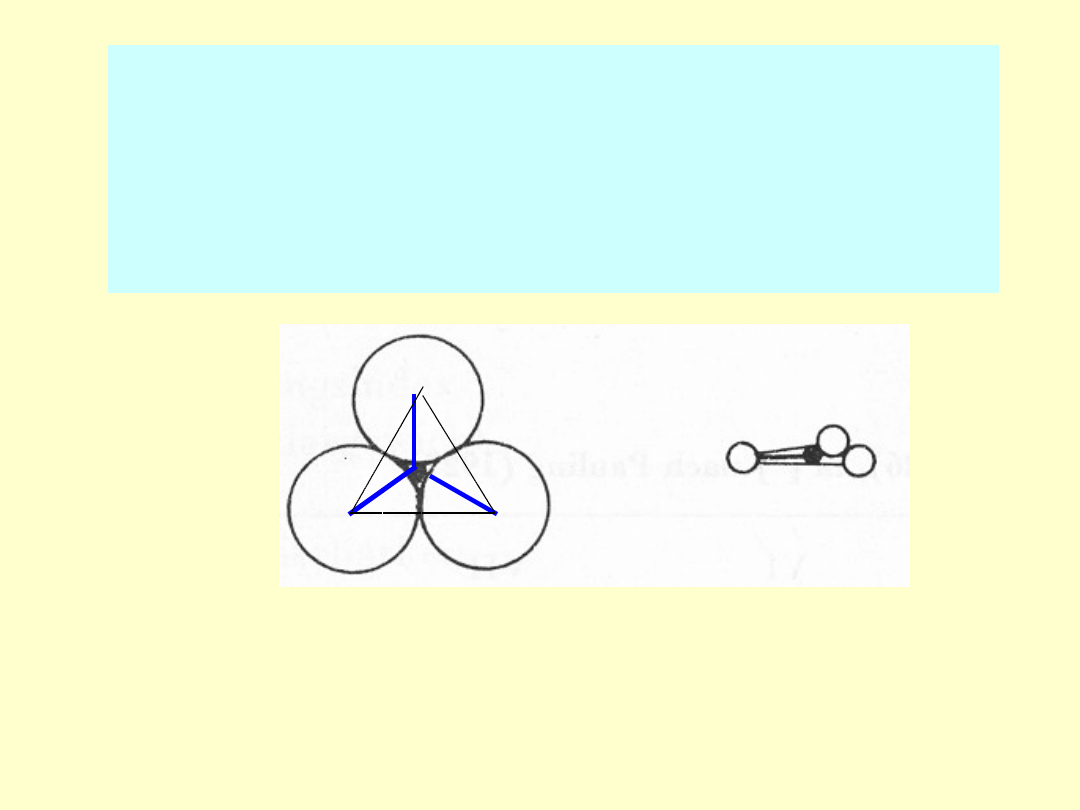
Opis budowy drobin:
-
budowa przestrzenna (
podaje
wzajemne przestrzenne rozmieszczenie wszystkich
rdzeni w drobinie, tj. otoczenie C
K
przez ligandy L z
uwzględnieniem wpływu na strukturę drobiny
wolnych elektronów przy C
K
)
, np.
•
o
o
o
o

Typy wiązań chemicznych w drobinach
(1a):
- wiązania
akceptorowe
Wszystkie wiązania
A-H
:
-
A
jest pierwiastkiem bloku
sp
o
elektroujemności większej od wodoru,
wodór jest w postaci liganda
H
+
:
np., wszystkie wiązania:
C-H, N-H, O-H,
F-H, Cl-H, P-H, S-H, Se-H, Te-H
w różnych
drobinach związków chemicznych.
Polaryzacja wiązania jest w kierunku centrum
koordynacji
A
.

Typy wiązań chemicznych w drobinach
(1b):
- wiązania
akceptorowe
schemat walencyjny:

Typy wiązań chemicznych w drobinach
(1c):
- wiązania
akceptorowe
wzór elektronowy:

Typy wiązań chemicznych w drobinach
(1d):
- wiązania
akceptorowe
budowa przestrzenna:

Wpływ H
+
na kształt drobin:(oddziaływanie par
elektronowych wolnych i z H+
CH
4
NH
3
OH
2
109,5˚ > 107,3˚ >
104,5˚
SiH
4
PH
3
SH
2
109,5 ˚ > 93,5˚ >
92,3 ˚
GeH
4
AsH
3
SeH
2
109,5˚
> 92,0˚ >
91,0˚
SnH
4
SbH
3
TeH
2
109,5˚
>
91,5˚ >
89,5˚

Typy wiązań chemicznych w drobinach
(1e):
- wiązania
akceptorowe
przykłady drobin:
- OH
-
, H
3
O
+
, NH
2
-
, NH
2
-
, NH
4
+
, PH
3
,
H
2
S,
HCl, CH
4
, H
2
Se, HF,
H
2
F
+
, HBr, HI, .... itd.,
- w drobinach bardziej złożonych jako
jedno z
wiązań:
H
3
BO
3
, HCO
3
-
, H
2
PO
4
-
, HPO
3
2-
,
CO(NH
2
)
2
,
H
3
PO
2
, H
6
TeO
6
, CH
3
OH, ...
Itd..


Typy wiązań chemicznych w drobinach (2a):
- wiązania
donorowe
- gdy są wysycone wiązaniami
wszystkie orbitale
walencyjne centrum koordynacji drobiny i nie ma
wiązań
.

Typy wiązań chemicznych w drobinach
(2b):
- wiązania
donorowe
schemat walencyjny, np. CF
4
0
:

Typy wiązań chemicznych w drobinach
(2c):
- wiązania
donorowe
wzór elektronowy, np.
NF
4
+
:

Typy wiązań chemicznych w drobinach
(2d):
- wiązania
donorowe
budowa przestrzenna, , np.
NF
4
+
:

Typy wiązań chemicznych w drobinach
(2e):
- wiązania
donorowe
przykłady:
NF
4
+
, CF
4
0
, CCl
4
0
, BF
4
-
, BH
4
-
, BeCl
4
2-
,
NO
4
3-
,
[Zn(NH
3
)
4
]
2+
, B(C
6
H
5
)
4
-
, ReH
9
2-
, .....
Typy wiązań chemicznych w drobinach
(3a):
- wiązania
donorowe
]
p donorowe
N
5+
sp
2
O
2-
sp
3
O
2-
sp
3
O
2-
sp
3
d
d
d
Typy wiązań chemicznych w drobinach
(3a):
- wiązania
donorowe
p donorowe
]
d
z
x,y
p
z
d
d
d
p
Typy wiązań chemicznych w drobinach
(3b):
- wiązania
donorowe
p donorowe
schemat walencyjny:
s
p
sp
2
_
IOI
I
_
IOI
I
N
5+
_
IOI
I
-
d
d
d
p d
NO
3
-

Typy wiązań chemicznych w drobinach
(3c):
- wiązania
donorowe
p donorowe
wzór elektronowy:
N
O
O
O
I
I
I I
I
II
I
_
_
-
i dwie struktury rezonansowe z wiązaniami „=’’
do dwóch pozostałych rdzeni tlenu
Typy wiązań chemicznych w drobinach
(3d):
- wiązania
donorowe
p donorowe
budowa przestrzenna:
•
•
•

Typy wiązań chemicznych w drobinach
(3e):
- wiązania
donorowe
p donorowe
przykłady:
NO, NO
2
, NO
2
+
, NO
2
-
, NO
3
-
,
N
2
O
2
2-
, NO
+
,
CO, CO
2
, CO
3
2-
, BO
3
3-
, BF
3
, SO
2
,
HCO
2
-
,
H
3
BO
3
, SO
3 (g)
, CN
-
, CN
2
2-
, CNO
-
,
itd..

Typy wiązań chemicznych w drobinach
(4a):
- wiązania
donorowe
d donorowe
dla
pierwiastków bloku sp są najsilniejsze w drobinach
tlenowych II okresu rdzeniowego.
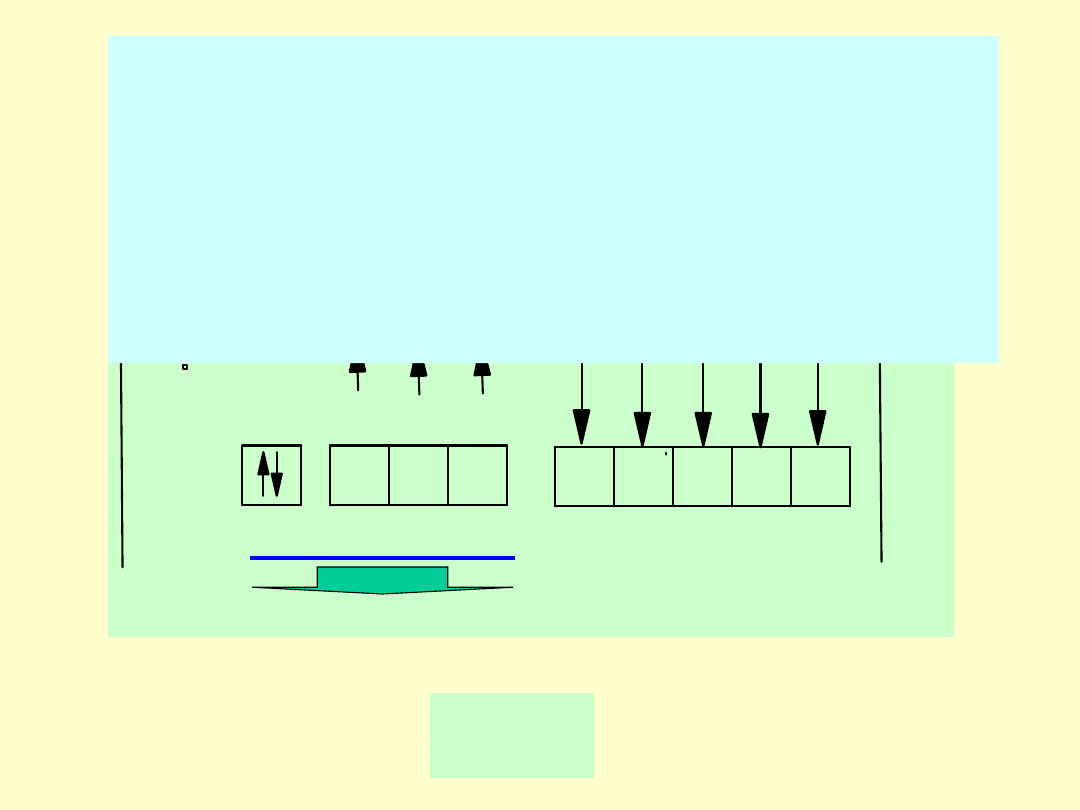
s
p
sp
3
_
IOI
I
_
IOI
I
S
6+
_
IOI
I
2-
d
d
d
d
d d
SO
3
2-
Typy wiązań chemicznych w drobinach
(4b):
- wiązania
donorowe
d donorowe
dla
pierwiastków bloku sp
schemat walencyjny:
Typy wiązań chemicznych w drobinach
(4c):
- wiązania
donorowe
d donorowe
dla
pierwiastków bloku sp
wzór elektronowy:
_
_
s
_
OI
IO
I
IOI
I
IOI
_
_
_
_ _
2-
Typy wiązań chemicznych w drobinach
(4d):
- wiązania
donorowe
d donorowe
dla
pierwiastków bloku sp
budowa przestrzenna:
•
o
o
o

Typy wiązań chemicznych w drobinach (4e):
- wiązania
donorowe
d donorowe
dla
pierwiastków bloku sp
przykłady:
ClO
4
-
, ClO
3
-
, ClO
2
0
, SO
4
2-
,
SO
3
2-
, S
2
O
6
2-
, S
2
O
5
2-
, S
2
O
7
2-
,
PO
4
3-
, P
2
O
7
4-
, SiO
4
4-
,
SNF
3
,
[PR
3
O, N(SiH
3
)
3
, R
3
PO, gdzie R
- CH
3
-
, C
2
H
5
-
, ...R
-
]

Typy wiązań chemicznych w drobinach
(5a):
- wiązania
donorowe
d donorowe
dla
pierwiastków bloku dsp
d
d
d
p d
d

Typy wiązań chemicznych w drobinach
(5b):
- wiązania
donorowe
d donorowe
dla
pierwiastków bloku dsp
schemat walencyjny:
d
d
d
d d
MnO
4
2-
Typy wiązań chemicznych w drobinach
(5c):
- wiązania
donorowe
d donorowe
dla
pierwiastków bloku dsp
wzór elektronowy:
2-
Typy wiązań chemicznych w drobinach
(5d):
- wiązania
donorowe
d donorowe
dla
pierwiastków bloku dsp
budowa przestrzenna:

Typy wiązań chemicznych w drobinach
(5e):
-
wiązania
donorowe
d donorowe
dla pierwiastków
bloku dsp
przykłady:
MnO
4
-
, MnO
4
3-
, CrO
4
2-
, CrO
4
2-
,
VO
4
3-
, Cr
2
O
7
2-
, ReO
4
, OsO
4
,

Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
Wyszukiwarka
Podobne podstrony:
wyk12 Indukcja
wyk12 aminy
Wyk12 term
Makro 1S Cykl koniunkturalny
ekonomika, Materiały studia, II rok, 1s, ekonomika przedsiębiorstw żywności
umowa 1S 2K
pra-wyk12, UE Katowice FiR, prawo
wyk12
WYK12
Otrzymywanie (1S) ( ) 2,10 kamforosultamu
BP20122013 lab 1s id 92526 Nieznany
WYK15 1S
dzienne zużycie energii 1s 0001
budowa ciała 1s 0001
Makro 1S Wzrost a rozwoj gospod Nieznany
ub-wyk12, FIR UE Katowice, SEMESTR IV, Ubezpieczenia, ubezpieczenia
wyk12
więcej podobnych podstron