
Porównanie struktury
Porównanie struktury
wewnętrznej
wewnętrznej
komórek
komórek
Prokariota
Prokariota
(bakterie i sinice) najliczniej występujące
(bakterie i sinice) najliczniej występujące
i
najbardziej
rozpowszechnione
i
najbardziej
rozpowszechnione
organizmy na Ziemi
organizmy na Ziemi
Eukariota
Eukariota
1.
1.
Posiada
błonę
Posiada
błonę
cytoplazmatyczną, która jest
cytoplazmatyczną, która jest
miejscem tworzenia energii,
miejscem tworzenia energii,
otoczona
sztywną
ścianą
otoczona
sztywną
ścianą
komórkową.
komórkową.
2.
2.
Nie
zawiera
jądra
Nie
zawiera
jądra
otoczonego błoną.
otoczonego błoną.
3.
3.
Nie
występują
organelle
Nie
występują
organelle
komórkowe, a jedynie błona
komórkowe, a jedynie błona
komórkowa
tworzy
komórkowa
tworzy
uwypuklenia (mezosomy –
uwypuklenia (mezosomy –
miejsce replikacji DNA)
miejsce replikacji DNA)
4.
4.
DNA występuje w cytozolu w
DNA występuje w cytozolu w
formie
skondensowanego
formie
skondensowanego
nukleoidu.
nukleoidu.
1.
1.
Występuje
błona
Występuje
błona
cytoplazmatyczna ale nie
cytoplazmatyczna ale nie
zawsze
otoczona
jest
zawsze
otoczona
jest
sztywną ścianą komórkową.
sztywną ścianą komórkową.
2.
2.
Posiadają otoczone błonami
Posiadają otoczone błonami
jądro komórkowe
jądro komórkowe
3.
3.
W cytoplazmie położone są
W cytoplazmie położone są
organelle:
mitochondria,
organelle:
mitochondria,
rybosomy
retikulum
rybosomy
retikulum
endoplazmatyczne,
aparat
endoplazmatyczne,
aparat
Golgiego,
lizosomy,
Golgiego,
lizosomy,
peroksysomy,
cytozol,
peroksysomy,
cytozol,
mikrotubule,
wakuola,
mikrotubule,
wakuola,
chloroplasty – w komórce
chloroplasty – w komórce
roślinnej.
roślinnej.

Organelle komórki eukariotycznej
Organelle komórki eukariotycznej
Organelle
Organelle
komórkowe
komórkowe
Funkcja
Funkcja
Błona komórkowa
Błona komórkowa
błona półprzepuszczalna oddzielająca wnętrze
błona półprzepuszczalna oddzielająca wnętrze
komórki od świata zewnętrznego
komórki od świata zewnętrznego
Jądro komórkowe
Jądro komórkowe
przechowuje informację genetyczną komórki jako
przechowuje informację genetyczną komórki jako
DNA - owinięty wokół białek histonowych
DNA - owinięty wokół białek histonowych
jąderko- miejsce syntezy rRNA.
jąderko- miejsce syntezy rRNA.
Retikulum
Retikulum
endoplazmatyczne
endoplazmatyczne
szorstkie ER (RER) rybosomy – miejsce biosyntezy
szorstkie ER (RER) rybosomy – miejsce biosyntezy
białek błonowych i sekrecyjnych. W jego świetle
białek błonowych i sekrecyjnych. W jego świetle
występują enzymy przeprowadzające potranslacyjną
występują enzymy przeprowadzające potranslacyjną
modyfikację białek.
modyfikację białek.
gładkie ER (SER) bez rybosomów - miejsce biosyntezy
gładkie ER (SER) bez rybosomów - miejsce biosyntezy
fosfolipidów reakcje detoksykacyjne
fosfolipidów reakcje detoksykacyjne
Aparat Golgiego
Aparat Golgiego
ośrodek sortujący, enzymy, które zmieniają strukturę
ośrodek sortujący, enzymy, które zmieniają strukturę
cząsteczek białka, przyłączając do nich reszty cukrowe
cząsteczek białka, przyłączając do nich reszty cukrowe
Mitochondrium
Mitochondrium
transport elektronów i fosforylacja oksydacyjnej (ATP)
transport elektronów i fosforylacja oksydacyjnej (ATP)
cykl kwasu cytrynowego, szlak rozkładu kwasów
cykl kwasu cytrynowego, szlak rozkładu kwasów
tłuszczowych.
tłuszczowych.

Organelle komórki eukariotycznej
Organelle komórki eukariotycznej
Organelle
Organelle
komórkowe
komórkowe
Funkcja
Funkcja
Lizosomy
Lizosomy
proteazy degradują białka, lipazy degradują lipidy,
proteazy degradują białka, lipazy degradują lipidy,
fosfatazy usuwają grupy fosforanowe z nukleotydów
fosfatazy usuwają grupy fosforanowe z nukleotydów
i fosfolipidów, a nukleazy degradują DNA i RNA (pH
i fosfolipidów, a nukleazy degradują DNA i RNA (pH
kwaśne)
kwaśne)
Peroksysomy
Peroksysomy
zawierają enzymy degradujące kwasy tłuszczowe i
zawierają enzymy degradujące kwasy tłuszczowe i
aminokwasy zawierają enzym – katalazę, która
aminokwasy zawierają enzym – katalazę, która
rozkłada nadtlenek wodoru do produktów
rozkłada nadtlenek wodoru do produktów
nieszkodliwych dla komórki (wodę i tlen)
nieszkodliwych dla komórki (wodę i tlen)
Chloroplasty
Chloroplasty
zielony barwnik chlorofil oraz enzymy, co stanowi
zielony barwnik chlorofil oraz enzymy, co stanowi
układ wychwytujący energię świetlną i zamieniający
układ wychwytujący energię świetlną i zamieniający
ją w energię chemiczną w formie ATP, stroma- jest
ją w energię chemiczną w formie ATP, stroma- jest
miejscem wiązania CO
miejscem wiązania CO
2
2
Wakuola
Wakuola
woda, jony: K
woda, jony: K
+
+
, Na
, Na
+
+
, Ca
, Ca
+,
+,
Mg
Mg
+
+
, Zn
, Zn
+
+
, Cl
, Cl
-
-
, SO
, SO
4
4
2-
2-
,
,
PO
PO
4
4
3-
3-
,utrzymanie turgoru komórki; u roślin -
,utrzymanie turgoru komórki; u roślin -
magazynowanie zbędnych produktów przemiany
magazynowanie zbędnych produktów przemiany
materii
materii
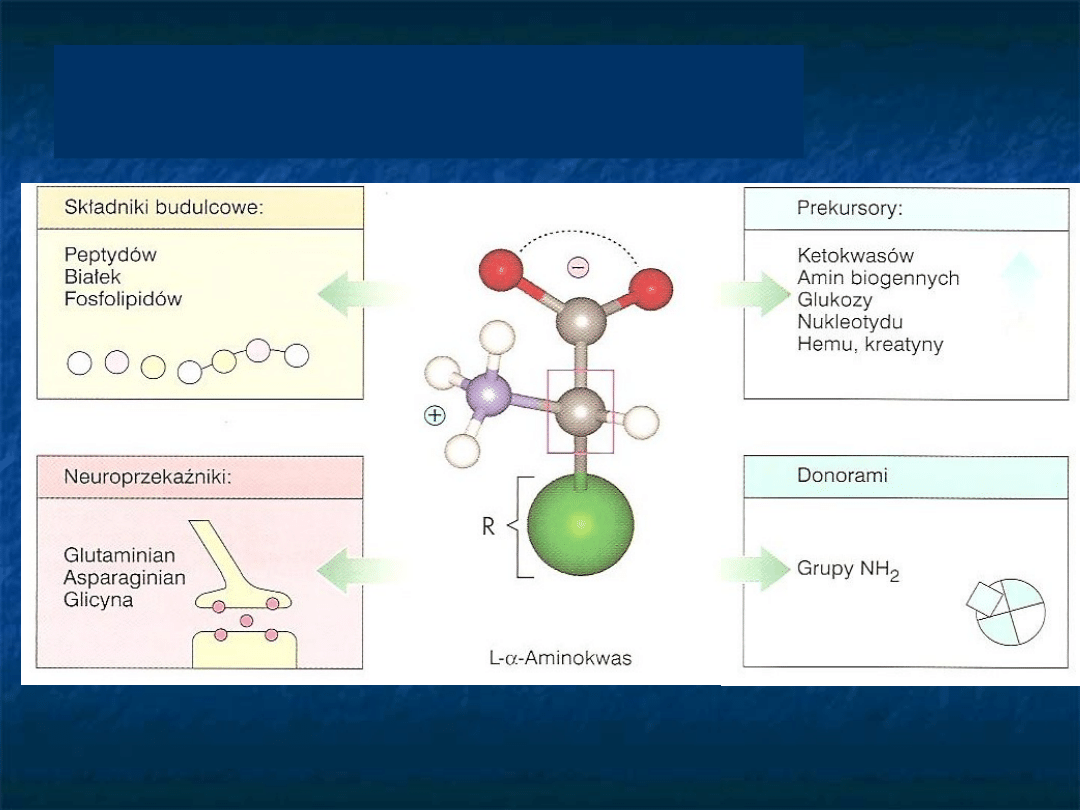
Jak zbudowane są
Jak zbudowane są
aminokwasy?
aminokwasy?
R
C
H
NH
2
COOH
Aminokwas
Aminokwas
O
R
1
C
R
2
H
Peptyd
Peptyd
N
N
Aminokwasy są związkami chemicznymi,
zawierającymi grupę aminową -NH
2
(zasadową)
oraz grupę karboksylową
-COOH (kwasową) oraz resztę biogenną, która
może zawierać pierścień aromatyczny, łańcuch
alifatyczny, siarkę, grupę wodorotlenową,
dodatkową grupę aminową bądź karboksylową

Jakimi właściwościami charakteryzują się
Jakimi właściwościami charakteryzują się
aminokwasy?
aminokwasy?
są rozpuszczalne w wodzie
są nierozpuszczalne w rozpuszczalnikach organicznych ( np. w eterze)
wszystkie charakteryzują się bardzo wysoką temperaturą topnienia
mają dwojaką naturę ze względu na ich budowę:
Kwasową – ze względu na występowanie grupy karboksylowej
-COOH
Zasadową – ze względu na występowanie grupy aminowej -NH
2
występują powszechnie w organizmach roślinnych i zwierzęcych
(aminokwasy α)
Jakie funkcje spełniają
Jakie funkcje spełniają
aminokwasy?
aminokwasy?

Aminokwasy można podzielić:
1.
Ze względu na usytuowanie grupy aminowej względem
węgla w cząsteczce aminokwasu: α , β ........
2.
Ze względu na usytuowanie grupy aminowej względem
asymetrycznego węgla w trójwymiarowym modelu cząsteczki
(dotyczy jedynie aminokwasów α): Aminokwasy D i aminokwasy L
3.
Ze względu na możliwość syntetyzowania aminokwasów
przez zwierzęta i ludzi na: - egzogenne (muszą być
dostarczone organizmowi z zewnątrz –
Val, Leu, Ile, Phe, Tyr, Thr, Trp, Lys, Met)
- endogenne (mogą być syntetyzowane w organizmie).
4.
Ze względu na występowanie w białkach na:
- białkowe
- niebiałkowe (ornityna, cytrulina,-alanina)
5.
Ze względu na budowę reszty aminokwasowej:
- z resztą alifatyczną, niepolarną – Gly, Ala, Val, Leu, Ile, Pro
- z grupą alkoholową lub siarką – Ser, Thr, Cys i Met
- z resztą zawierającą pierścień aromatyczny – Phe, Trp, Tyr
- z resztą zasadową – Lys, Arg, His
- z resztą kwasową – Asp, Glu
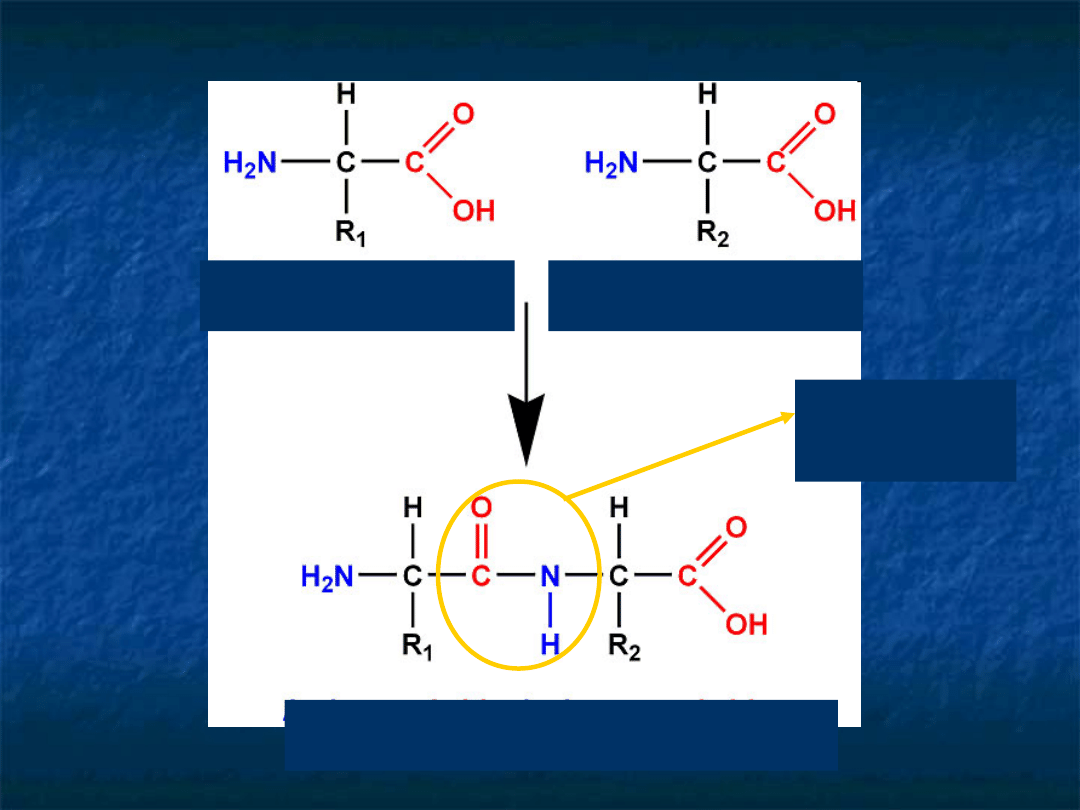
aminokwas 1
aminokwas 1
aminokwas 2
aminokwas 2
dipeptyd
dipeptyd
wiązanie
wiązanie
peptydowe
peptydowe

Peptydy naturalne
Peptydy naturalne
Glutation (
Glutation (
-
-
glutamylocysteinyloglicyna
glutamylocysteinyloglicyna
)
)
Dzięki zawartości grupy
Dzięki zawartości grupy
hydrosulfidowej łatwo ulega
hydrosulfidowej łatwo ulega
odwodorowaniu, tworzy się
odwodorowaniu, tworzy się
glutation utleniony. Ze względu
glutation utleniony. Ze względu
na odwracalność tej reakcji jest
na odwracalność tej reakcji jest
przenośnikiem elektronów.
przenośnikiem elektronów.
Jest koenzymem glioksalazy –
Jest koenzymem glioksalazy –
przemiana metyloglioksalu do
przemiana metyloglioksalu do
kwasu mlekowego.
kwasu mlekowego.
Hormony
Hormony
- wazopresyna i oksytocyna
- wazopresyna i oksytocyna
(tylny płat przysadki
(tylny płat przysadki
mózgowej) – kontrakcja
mózgowej) – kontrakcja
mięśni gładkich macicy i
mięśni gładkich macicy i
gruczołu mlecznego
gruczołu mlecznego
- adrenokortykotropina
- adrenokortykotropina
(przedni płat przysadki
(przedni płat przysadki
mózgowej)
mózgowej)
- insulina (trzustka) –
- insulina (trzustka) –
obniża poziom glukozy we
obniża poziom glukozy we
krwi, zwiększa
krwi, zwiększa
przepuszczalność błon
przepuszczalność błon
komórkowych dla
komórkowych dla
monosacharydów i
monosacharydów i
aminokwasów, przyspiesza
aminokwasów, przyspiesza
proces glikolizy
proces glikolizy
Antybiotyki
Antybiotyki
- gramicydyny
- gramicydyny
- polimyksyny
- polimyksyny
- aktynomycyny
- aktynomycyny

Struktury białkowe
Struktury białkowe
Struktura pierwszorzędowa
Struktura pierwszorzędowa
– liniowa sekwencja aminokwasów
– liniowa sekwencja aminokwasów
połączonych wiązaniem peptydowym. W strukturze tej zawarte
połączonych wiązaniem peptydowym. W strukturze tej zawarte
jest położenie wszystkich innych wiązań kowalencyjnych.-
jest położenie wszystkich innych wiązań kowalencyjnych.-
głównie wiązania disiarczkowe między resztami cysteiny.
głównie wiązania disiarczkowe między resztami cysteiny.
Struktura drugorzędowa
Struktura drugorzędowa
– regularne pofałdowanie regionów
– regularne pofałdowanie regionów
łańcucha polipeptydowego. Najczęściej występujące pofałdowanie
łańcucha polipeptydowego. Najczęściej występujące pofałdowanie
–
–
-helisa i struktura
-helisa i struktura
.
.
Struktura trzeciorzędowa
Struktura trzeciorzędowa
– przestrzenne ułożenie aminokwasów
– przestrzenne ułożenie aminokwasów
zarówno odległych w sekwencji liniowej jak i sąsiadujących.
zarówno odległych w sekwencji liniowej jak i sąsiadujących.
Łańcuch polipeptydowy fałduje się spontanicznie, jednak
Łańcuch polipeptydowy fałduje się spontanicznie, jednak
większość jego hydrofobowych łańcuchów bocznych zostaje
większość jego hydrofobowych łańcuchów bocznych zostaje
skierowana do wewnątrz struktury.
skierowana do wewnątrz struktury.
Struktura czwartorzędowa
Struktura czwartorzędowa
– występuje w przypadku białek
– występuje w przypadku białek
zawierających więcej niż jeden łańcuch polipeptydowy (np.
zawierających więcej niż jeden łańcuch polipeptydowy (np.
hemoglobina). Struktura ta dotyczy przestrzennego ułożenia
hemoglobina). Struktura ta dotyczy przestrzennego ułożenia
polipeptydowych podjednostek i natury oddziaływań między nimi.
polipeptydowych podjednostek i natury oddziaływań między nimi.
Tymi oddziaływaniami mogą być wiązania kowalencyjne (wiązania
Tymi oddziaływaniami mogą być wiązania kowalencyjne (wiązania
disiarczkowe) lub niekowalencyjne (siły elektrostatyczne,
disiarczkowe) lub niekowalencyjne (siły elektrostatyczne,
wiązania wodorowe i oddziaływania hydrofobowe)
wiązania wodorowe i oddziaływania hydrofobowe)
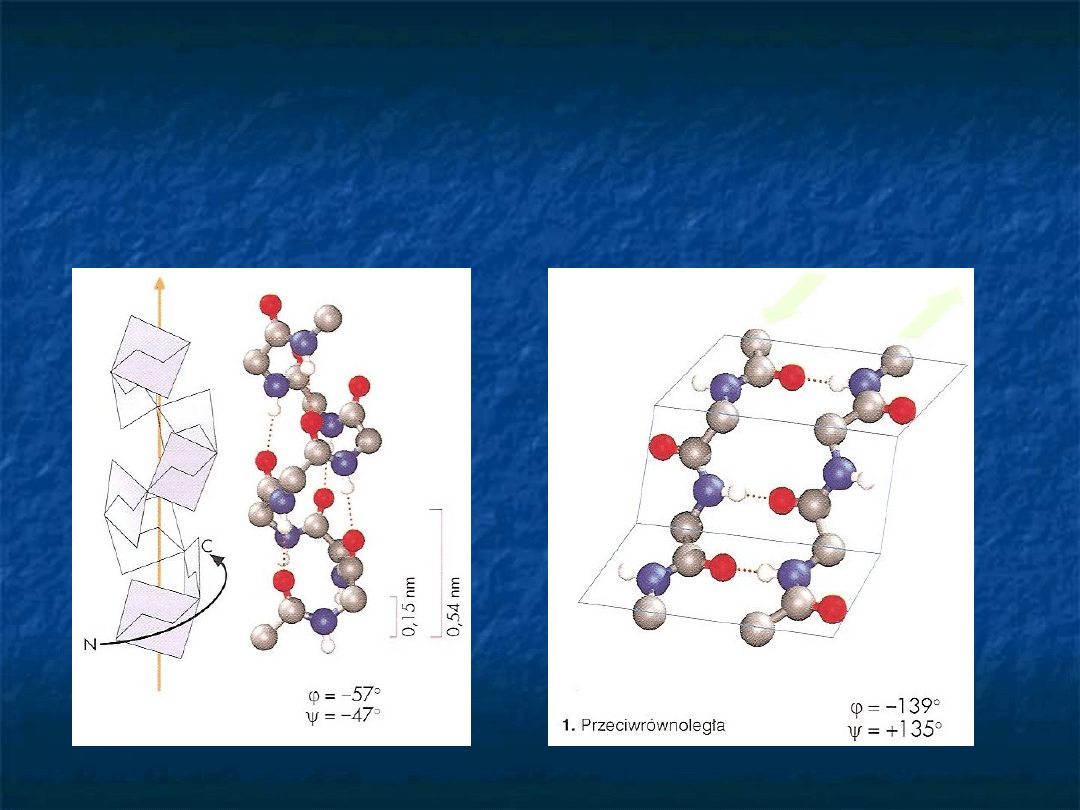
Struktura drugorzędowa
Struktura drugorzędowa
struktura
struktura
pofałdowanej
pofałdowanej
kartki typu
kartki typu
-heliks
-heliks

Główną funkcją mioglobiny jest magazynowanie tlenu w mięśniach
Główną funkcją mioglobiny jest magazynowanie tlenu w mięśniach
czerwonych (poprzecznie prążkowanych). Podczas nadmiernego
czerwonych (poprzecznie prążkowanych). Podczas nadmiernego
wysiłku mięśni, kiedy ciśnienie cząsteczkowe tlenu spada,
wysiłku mięśni, kiedy ciśnienie cząsteczkowe tlenu spada,
mioglobina uwalnia zmagazynowane cząsteczki O
mioglobina uwalnia zmagazynowane cząsteczki O
2
2
i pozwala
i pozwala
mitochondriom na syntezę ATP na drodze fosforylacji oksydacyjnej.
mitochondriom na syntezę ATP na drodze fosforylacji oksydacyjnej.
Kolagen
Kolagen
- główne białko tkanki łącznej. Posiada ono bardzo
- główne białko tkanki łącznej. Posiada ono bardzo
wysoką odporność na rozciąganie i stanowi główny składnik
wysoką odporność na rozciąganie i stanowi główny składnik
ścięgien. Jest odpowiedzialny za elastyczność skóry. Ubytek
ścięgien. Jest odpowiedzialny za elastyczność skóry. Ubytek
kolagenu ze skóry powoduje powstawanie zmarszczek, w
kolagenu ze skóry powoduje powstawanie zmarszczek, w
trakcie jej starzenia. Kolagen wypełnia także rogówkę oka,
trakcie jej starzenia. Kolagen wypełnia także rogówkę oka,
gdzie występuje w formie krystalicznej. Kolagen zawiera duże
gdzie występuje w formie krystalicznej. Kolagen zawiera duże
ilości glicyny i proliny oraz - hydroksyprolinę i hydroksylizynę.
ilości glicyny i proliny oraz - hydroksyprolinę i hydroksylizynę.
Hemoglobina
Hemoglobina
Białko zawarte w erytrocytach, którego zasadniczą funkcją jest
Białko zawarte w erytrocytach, którego zasadniczą funkcją jest
przenoszenie tlenu - przyłączanie go w płucach i uwalnianie w
przenoszenie tlenu - przyłączanie go w płucach i uwalnianie w
tkankach.
tkankach.
Cząsteczka hemoglobiny jest tetramerem złożonym z dwóch par
Cząsteczka hemoglobiny jest tetramerem złożonym z dwóch par
białkowych
podjednostek.
Każda
podjednostka
zawiera
białkowych
podjednostek.
Każda
podjednostka
zawiera
cząsteczkę hemu. Cząsteczka hemu zawiera położony centralnie
cząsteczkę hemu. Cząsteczka hemu zawiera położony centralnie
atom żelaza (Fe
atom żelaza (Fe
2+
2+
) umożliwiający jej wiązanie tlenu (O
) umożliwiający jej wiązanie tlenu (O
2
2
). Jedna
). Jedna
cząsteczka hemoglobiny może przyłączyć od jednej do czterech
cząsteczka hemoglobiny może przyłączyć od jednej do czterech
cząsteczek tlenu, co powoduje, że hemoglobina może
cząsteczek tlenu, co powoduje, że hemoglobina może
występować albo w stanie
występować albo w stanie
"odtlenowanym" (
"odtlenowanym" (
deoxyHb
deoxyHb
)
)
lub w
lub w
różnym stopniu
różnym stopniu
"utlenowania" (
"utlenowania" (
oxyHb
oxyHb
).
).

Białka
Proste
Złożone
Fibrylarne
(włókienkowe)
skleroproteiny
fosfoproteiny, glikoproteiny
chromoproteiny, nukleoproteiny
lipoproteiny, metaloproteiny
hemoproteiny
Globularne
(kuliste)
właściwe
histony, albuminy
globuliny, prolaminy, gluteiny
polipeptydy
protaminy

Skleroproteiny
Skleroproteiny
– składniki tkanki łącznej i strukturalnej
– składniki tkanki łącznej i strukturalnej
występujące u zwierząt np. keratyna (duża zawartość cysteiny),
występujące u zwierząt np. keratyna (duża zawartość cysteiny),
kolagen, elastyna (prolina i hydroksyprolina), fibroina.
kolagen, elastyna (prolina i hydroksyprolina), fibroina.
Histony
Histony
– białka jądra komórkowego, gdzie występują w
– białka jądra komórkowego, gdzie występują w
połączeniu z kwasami nukleinowymi. Charakter silnie zasadowy.
połączeniu z kwasami nukleinowymi. Charakter silnie zasadowy.
Albuminy
Albuminy
– występują w płynach ustrojowych oraz ziarnach
– występują w płynach ustrojowych oraz ziarnach
roślin uprawnych. W ich skład wchodzą wszystkie aminokwasy,
roślin uprawnych. W ich skład wchodzą wszystkie aminokwasy,
szczególnie o charakterze kwaśnym. Funkcja- regulacja
szczególnie o charakterze kwaśnym. Funkcja- regulacja
ciśnienia osmotycznego płynów ustrojowych oraz wiązanie
ciśnienia osmotycznego płynów ustrojowych oraz wiązanie
różnych składników.
różnych składników.
Globuliny
Globuliny
– najbardziej rozpowszechnione białka (większość
– najbardziej rozpowszechnione białka (większość
enzymów i glikoprotein). Występują w płynach ustrojowych
enzymów i glikoprotein). Występują w płynach ustrojowych
zwierząt (
zwierząt (
,
,
i
i
globuliny). Immunoglobuliny – przeciwciała –
globuliny). Immunoglobuliny – przeciwciała –
specyficzne białka obronne.
specyficzne białka obronne.
Prolaminy
Prolaminy
–występują tylko w nasionach traw, gdzie stanowią
–występują tylko w nasionach traw, gdzie stanowią
frakcję gliadyny związanej z glutenem.
frakcję gliadyny związanej z glutenem.
Gluteiny
Gluteiny
– występują w nasionach roślin jednoliściennych.
– występują w nasionach roślin jednoliściennych.
Podobne do prolamin.
Podobne do prolamin.
Białka proste
Białka proste

Białka złożone
Białka złożone
Fosfoproteiny
Fosfoproteiny
– zawierają ok. 1% fosforanu związanego estrowo z
– zawierają ok. 1% fosforanu związanego estrowo z
grupami alkoholowymi seryny lub treoniny. (kazeina mleka i witelina
grupami alkoholowymi seryny lub treoniny. (kazeina mleka i witelina
żółtka jaja kurzego).
żółtka jaja kurzego).
Glikoproteiny
Glikoproteiny
– zawierają oligosacharydy (N-acetyloglukozoaminy,
– zawierają oligosacharydy (N-acetyloglukozoaminy,
galaktozy lub mannozy). Stanowią podstawowy składnik krwi.
galaktozy lub mannozy). Stanowią podstawowy składnik krwi.
Chromoproteiny
Chromoproteiny
– składnikiem niebiałkowym jest substancja barwna.
– składnikiem niebiałkowym jest substancja barwna.
Należą do nich hemoglobina i mioglobina, cytochromy, enzymy –
Należą do nich hemoglobina i mioglobina, cytochromy, enzymy –
peroksydaza i katalaza, substancje barwne skóry oraz rodopsyny (proces
peroksydaza i katalaza, substancje barwne skóry oraz rodopsyny (proces
widzenia)
widzenia)
Metaloproteiny
Metaloproteiny
– zawierają jony metali. Należą do nich ferredoksyny
– zawierają jony metali. Należą do nich ferredoksyny
(białka żelazowo-siarkowe), ferrytyna, flawoproteiny oraz enzymy :
(białka żelazowo-siarkowe), ferrytyna, flawoproteiny oraz enzymy :
fosfatazy (Mg), arginaza (Mn), insulina (Zn), oksydazy (Cu), reduktaza
fosfatazy (Mg), arginaza (Mn), insulina (Zn), oksydazy (Cu), reduktaza
azotanowa (Mo).
azotanowa (Mo).
Nukleoproteiny
Nukleoproteiny
- kompleksy z kwasami nukleinowymi za pomocą wiązań
- kompleksy z kwasami nukleinowymi za pomocą wiązań
kowalencyjnych. Występują w jądrach komórkowych, gdzie stanowią
kowalencyjnych. Występują w jądrach komórkowych, gdzie stanowią
materiał genetyczny (chromatyna) oraz w rybosomach – kompleks RNA z
materiał genetyczny (chromatyna) oraz w rybosomach – kompleks RNA z
białkiem.
białkiem.
Lipoproteiny
Lipoproteiny
– białka sprzężone z lipidami. Błony komórkowe, plazma
– białka sprzężone z lipidami. Błony komórkowe, plazma
krwi, cytoplazma i żółtko jaja. Transport i rozprzestrzenianie lipidów,
krwi, cytoplazma i żółtko jaja. Transport i rozprzestrzenianie lipidów,
hormonów i witamin rozpuszczalnych w tłuszczach.
hormonów i witamin rozpuszczalnych w tłuszczach.
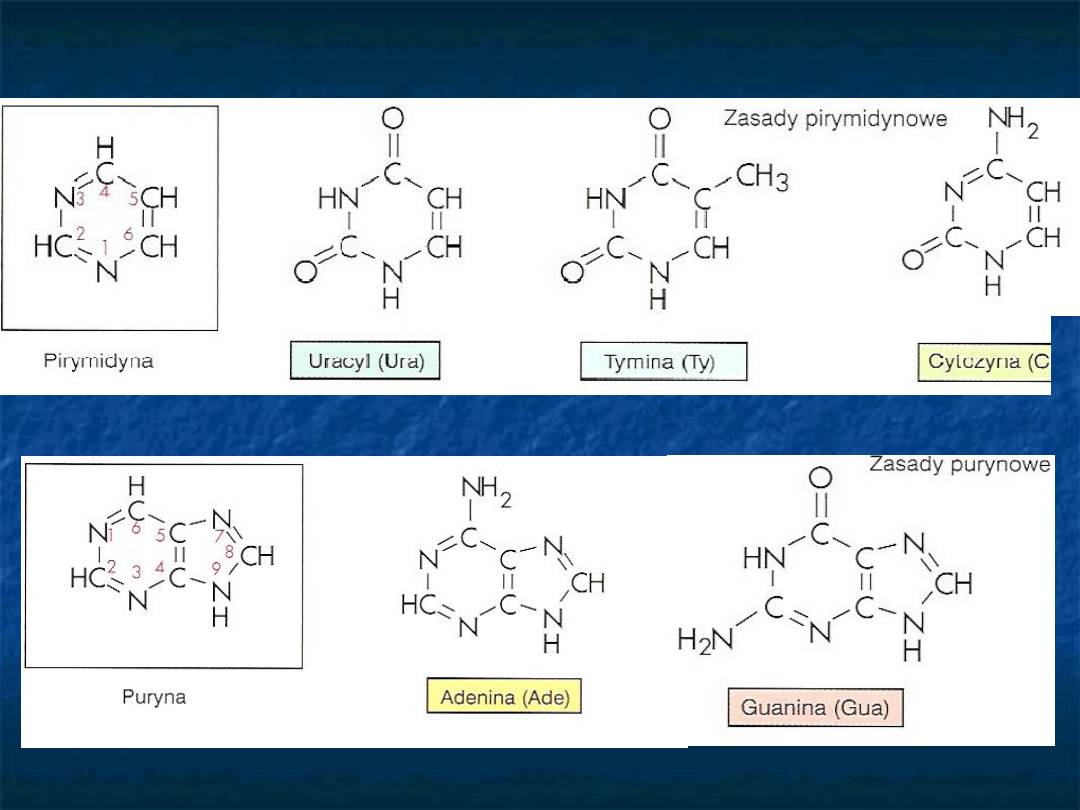
Zasady azotowe
Zasady azotowe
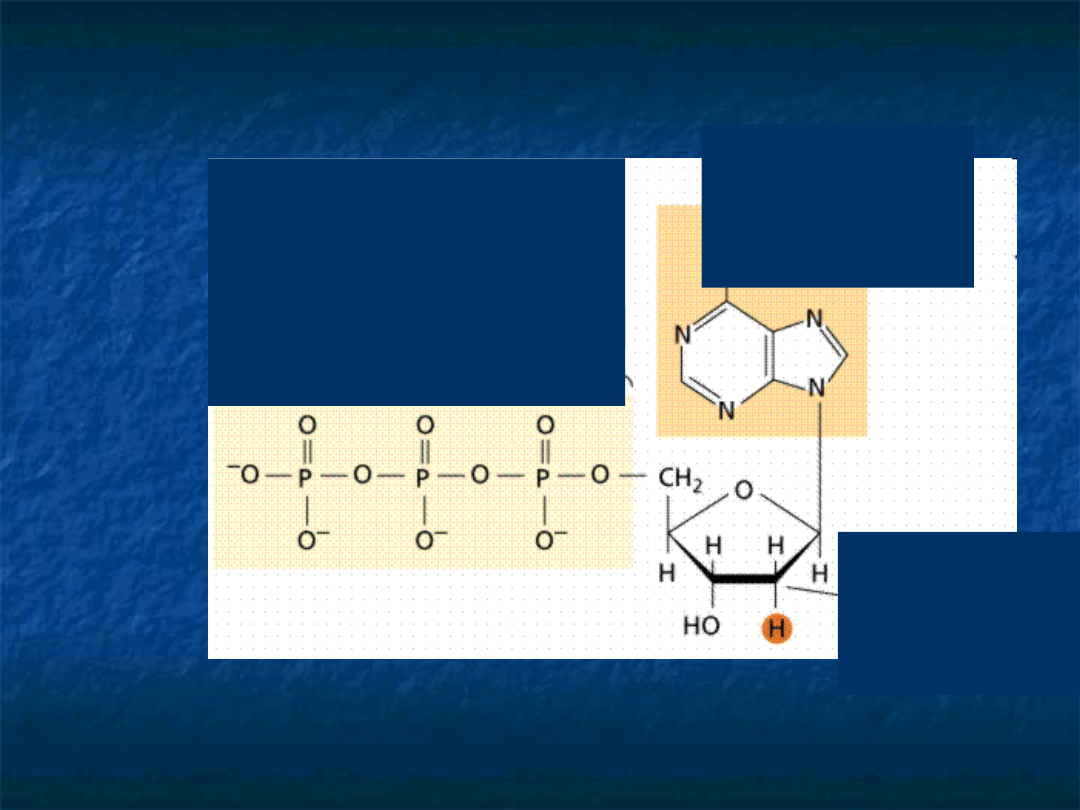
ATP
ATP
adenozynotrifosf
adenozynotrifosf
oran
oran
cukier
cukier
deoksyryb
deoksyryb
oza
oza
zasada
zasada
azotowa
azotowa
adenina
adenina
trzy reszty
trzy reszty
fosforanowe
fosforanowe
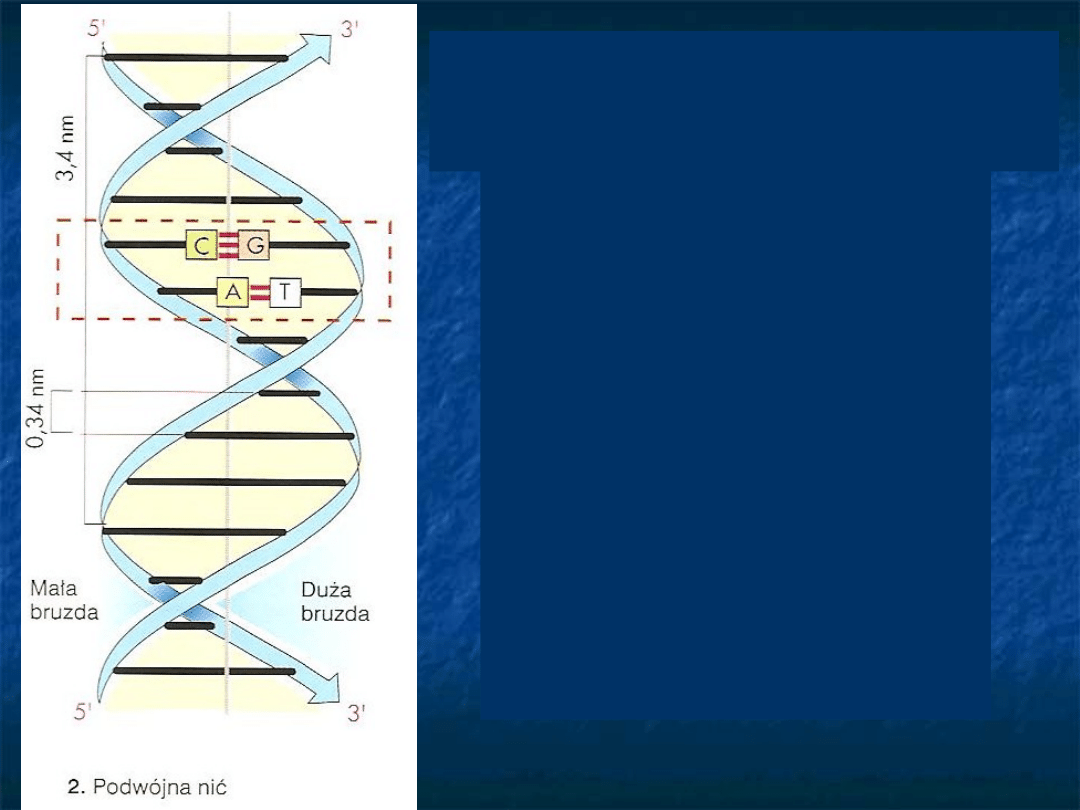
Dwa helikalne łańcuchy
Dwa helikalne łańcuchy
polinukleotydowe oplatają
polinukleotydowe oplatają
wspólną oś; łańcuchy te biegną
wspólną oś; łańcuchy te biegną
w przeciwnych kierunkach.
w przeciwnych kierunkach.
Zasady purynowe i
Zasady purynowe i
pirymidynowe znajdują się
pirymidynowe znajdują się
wewnątrz, a grupy fosforanowe i
wewnątrz, a grupy fosforanowe i
reszty deoksyrybozy na zewnątrz
reszty deoksyrybozy na zewnątrz
helisy.
helisy.
Płaszczyzny
zasad
są
Płaszczyzny
zasad
są
prostopadłe do osi helisy.
prostopadłe do osi helisy.
Średnica helisy 2nm, okres
Średnica helisy 2nm, okres
powtarzalności wzdłuż osi helisy
powtarzalności wzdłuż osi helisy
wynosi 3.4nm, co odpowiada 10
wynosi 3.4nm, co odpowiada 10
nukleotydom
w
każdym
nukleotydom
w
każdym
łańcuchu.
łańcuchu.
1953 r – odkrycie przez
1953 r – odkrycie przez
J.Watsona i F.Cricka
J.Watsona i F.Cricka
dwuniciowej struktury DNA
dwuniciowej struktury DNA

Dwa łańcuchy łączą się ze sobą wiązaniami
wodorowymi między zasadami tworzącymi
komplementarne pary
Adenina –Tymina
Guanina – Cytozyna
Kolejność zasad w łańcuchu
polinukleotydowym nie jest w żaden sposób
ograniczona. Ściśle określona sekwencja
zasad niesie informacje genetyczną.
Najważniejszą cechą dwuniciowej helisy DNA
jest specyficzność parowania zasad
(komplementarność zasad)
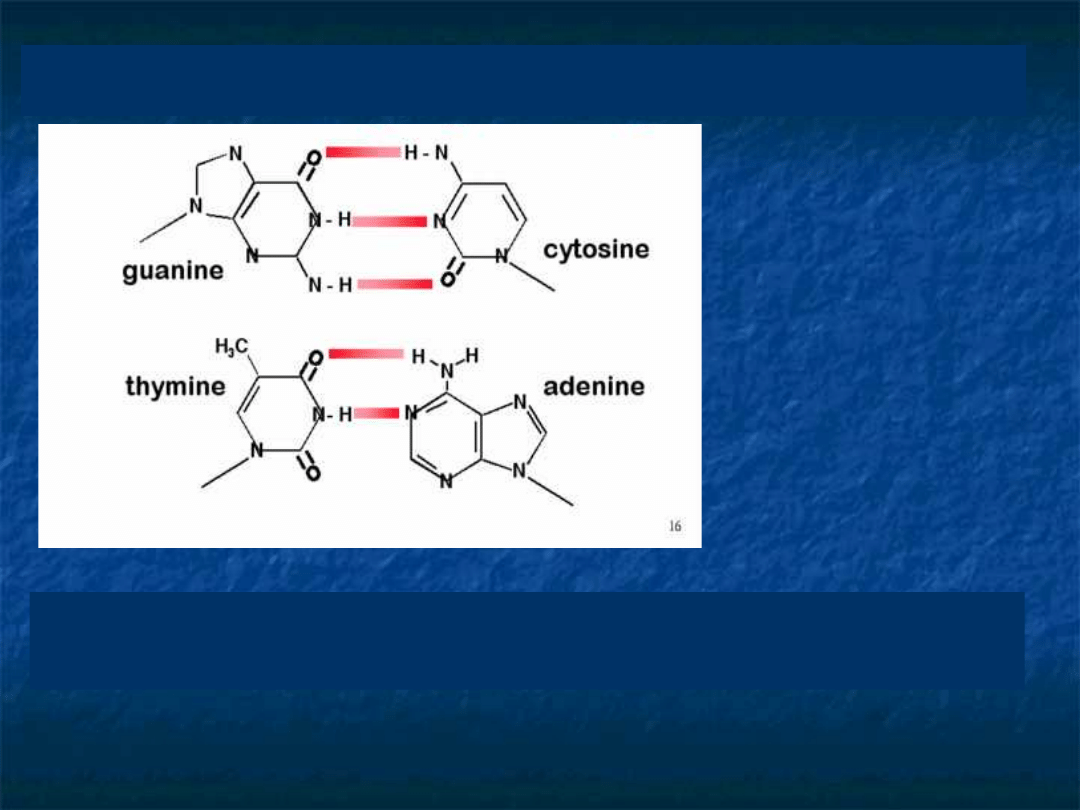
Komplementarność Zasad – Wiązania
Komplementarność Zasad – Wiązania
Wodorowe
Wodorowe
w procesie transkrypcji – przepisanie informacji z
w procesie transkrypcji – przepisanie informacji z
DNA na mRNA A=U
DNA na mRNA A=U
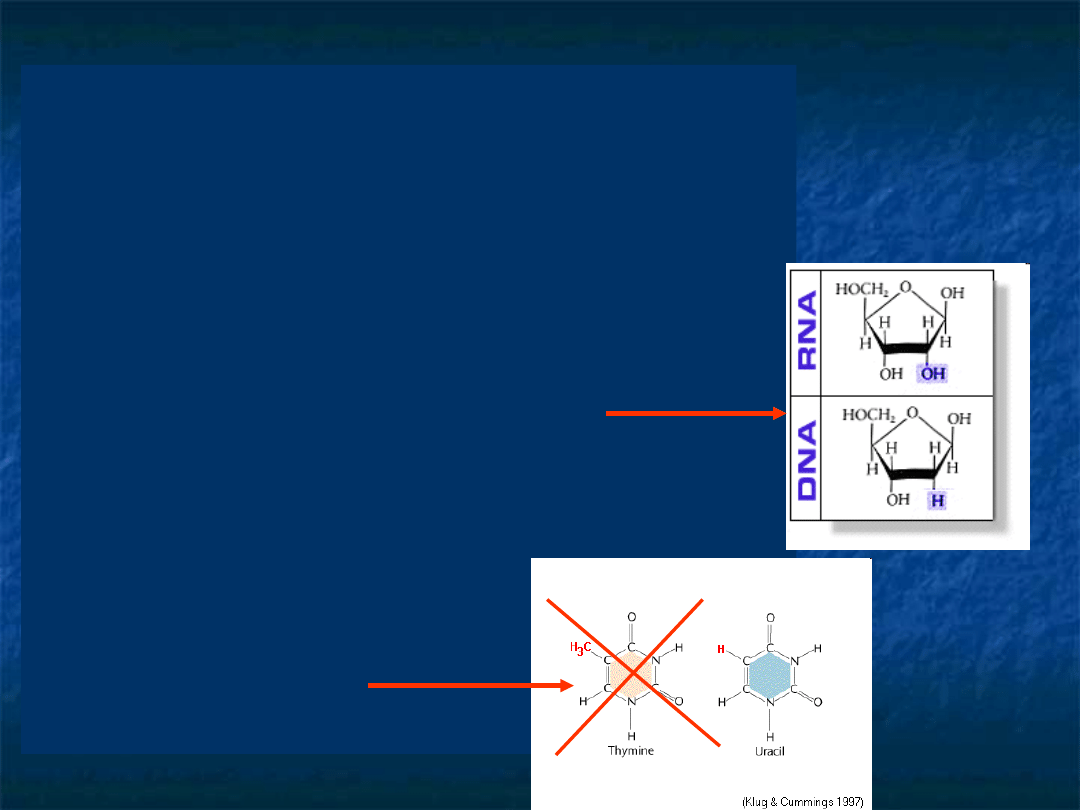
Dwie fundamentalne
Dwie fundamentalne
różnice między
różnice między
strukturą RNA i DNA:
strukturą RNA i DNA:
RNA zawiera rybozę a
RNA zawiera rybozę a
nie deoksyrybozę
nie deoksyrybozę
W skład RNA wchodzi
W skład RNA wchodzi
uracyl zamiast
uracyl zamiast
tyminy.
tyminy.
Rodzaje RNA
Rodzaje RNA
t-RNA
t-RNA
–
–
transportujący
transportujący
RNA
RNA
przyłączanie wolnych aminokwasów w
przyłączanie wolnych aminokwasów w
cytoplazmie i transportowanie ich do
cytoplazmie i transportowanie ich do
rybosomów, gdzie w trakcie procesu
rybosomów, gdzie w trakcie procesu
translacji zostają włączone do
translacji zostają włączone do
powstającego łańcucha polipeptydowego.
powstającego łańcucha polipeptydowego.
mRNA, matrycowy
mRNA, matrycowy
(lub informacyjny)
(lub informacyjny)
RNA
RNA
zawierające przepisaną z genów,
zawierające przepisaną z genów,
zakodowaną informację genetyczną o
zakodowaną informację genetyczną o
sekwencji poszczególnych polipeptydów.
sekwencji poszczególnych polipeptydów.
Cząsteczki te po przyłączeniu się do
Cząsteczki te po przyłączeniu się do
rybosomów stanowią matrycę - kolejne
rybosomów stanowią matrycę - kolejne
trójki nukleotydów mRNA (tzw. kodony)
trójki nukleotydów mRNA (tzw. kodony)
są rozpoznawane przez odpowiednie
są rozpoznawane przez odpowiednie
fragmenty (tzw. antykodony) cząsteczek
fragmenty (tzw. antykodony) cząsteczek
transportujących aminokwasy (tRNA),
transportujących aminokwasy (tRNA),
dzięki czemu w procesie translacji
dzięki czemu w procesie translacji
powstaje właściwa sekwencja peptydu
powstaje właściwa sekwencja peptydu
rRNA - rybosomalny,
rRNA - rybosomalny,
rybosomowy RNA
rybosomowy RNA
Cząsteczki kwasu rybonukleinowego
Cząsteczki kwasu rybonukleinowego
wchodzące w skład rybosomów, które
wchodzące w skład rybosomów, które
biorą udział w procesie biosyntezy
biorą udział w procesie biosyntezy
polipeptydów.
polipeptydów.

t-RNA
t-RNA
– transportujący RNA - zadaniem jest
– transportujący RNA - zadaniem jest
przyłączanie wolnych aminokwasów w cytoplazmie i
przyłączanie wolnych aminokwasów w cytoplazmie i
transportowanie ich do rybosomów. Cząsteczki tRNA
transportowanie ich do rybosomów. Cząsteczki tRNA
występują w komórkach w stanie wolnym bądź też
występują w komórkach w stanie wolnym bądź też
związane ze specyficznym aminokwasem. Kompleks
związane ze specyficznym aminokwasem. Kompleks
tRNA-aminokwas nosi nazwę
tRNA-aminokwas nosi nazwę
aminoacylo-tRNA
aminoacylo-tRNA
.
.
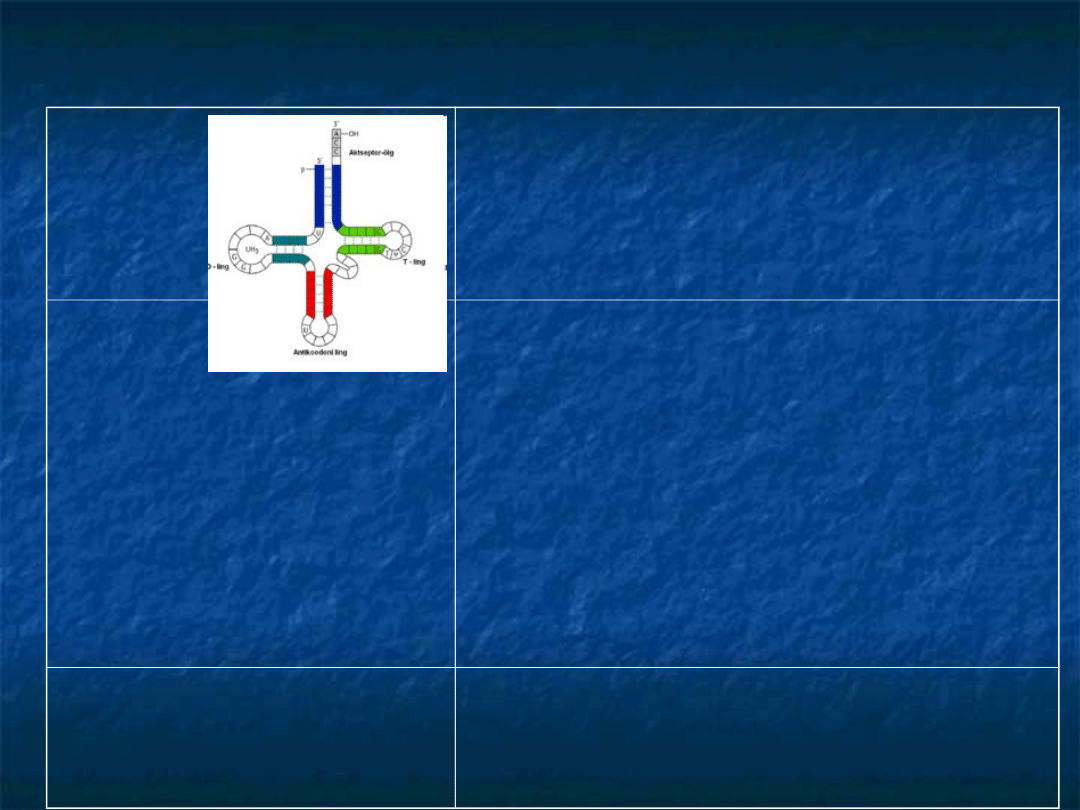
Wzór strukturalny tRNA ma budowę palczastą i
Wzór strukturalny tRNA ma budowę palczastą i
przyjmuje kształt czterolistnej koniczyny w którym
przyjmuje kształt czterolistnej koniczyny w którym
można wyróżnić 4 ramiona:
można wyróżnić 4 ramiona:
1.
1.
ramię akceptorowe
ramię akceptorowe
- sparowane zasady końców 3' i 5',
- sparowane zasady końców 3' i 5',
do którego przyłączają się chemicznie aktywowane
do którego przyłączają się chemicznie aktywowane
aminokwasy za pomocą wiązania estrowego
aminokwasy za pomocą wiązania estrowego
2.
2.
pętla antykodonowa
pętla antykodonowa
- odpowiedzialna za rozpoznanie i
- odpowiedzialna za rozpoznanie i
związanie z kodonem w mRNA.
związanie z kodonem w mRNA.

mRNA
mRNA
, matrycowy (lub informacyjny
, matrycowy (lub informacyjny
) - cząsteczki
) - cząsteczki
kwasu rybonukleinowego zawierające przepisaną z
kwasu rybonukleinowego zawierające przepisaną z
genów,
zakodowaną
informację
genetyczną
o
genów,
zakodowaną
informację
genetyczną
o
sekwencji poszczególnych polipeptydów. Cząsteczki te
sekwencji poszczególnych polipeptydów. Cząsteczki te
po przyłączeniu się do rybosomów stanowią matrycę -
po przyłączeniu się do rybosomów stanowią matrycę -
kolejne trójki nukleotydów mRNA (tzw. kodony) są
kolejne trójki nukleotydów mRNA (tzw. kodony) są
rozpoznawane przez odpowiednie fragmenty (tzw.
rozpoznawane przez odpowiednie fragmenty (tzw.
antykodony) cząsteczek transportujących aminokwasy
antykodony) cząsteczek transportujących aminokwasy
(tRNA), dzięki czemu w procesie translacji powstaje
(tRNA), dzięki czemu w procesie translacji powstaje
właściwa sekwencja peptydu.
właściwa sekwencja peptydu.
rRNA
rRNA
– rybosomalny RNA. Cząsteczki kwasu
– rybosomalny RNA. Cząsteczki kwasu
rybonukleinowego wchodzące w skład rybosomów,
rybonukleinowego wchodzące w skład rybosomów,
które
biorą
udział
w
procesie
biosyntezy
które
biorą
udział
w
procesie
biosyntezy
polipeptydów. rRNA powstaje w wyniku procesu
polipeptydów. rRNA powstaje w wyniku procesu
transkrypcji DNA. U organizmów eukariotycznych za
transkrypcji DNA. U organizmów eukariotycznych za
jego transkrypcję odpowiada polimeraza RNA I . rRNA
jego transkrypcję odpowiada polimeraza RNA I . rRNA
stanowi ok. 80% całkowitego RNA komórki.
stanowi ok. 80% całkowitego RNA komórki.
T
C
C
G
A
A
G
T
C
C
A
G
G
C
T
T
C
A
G
G
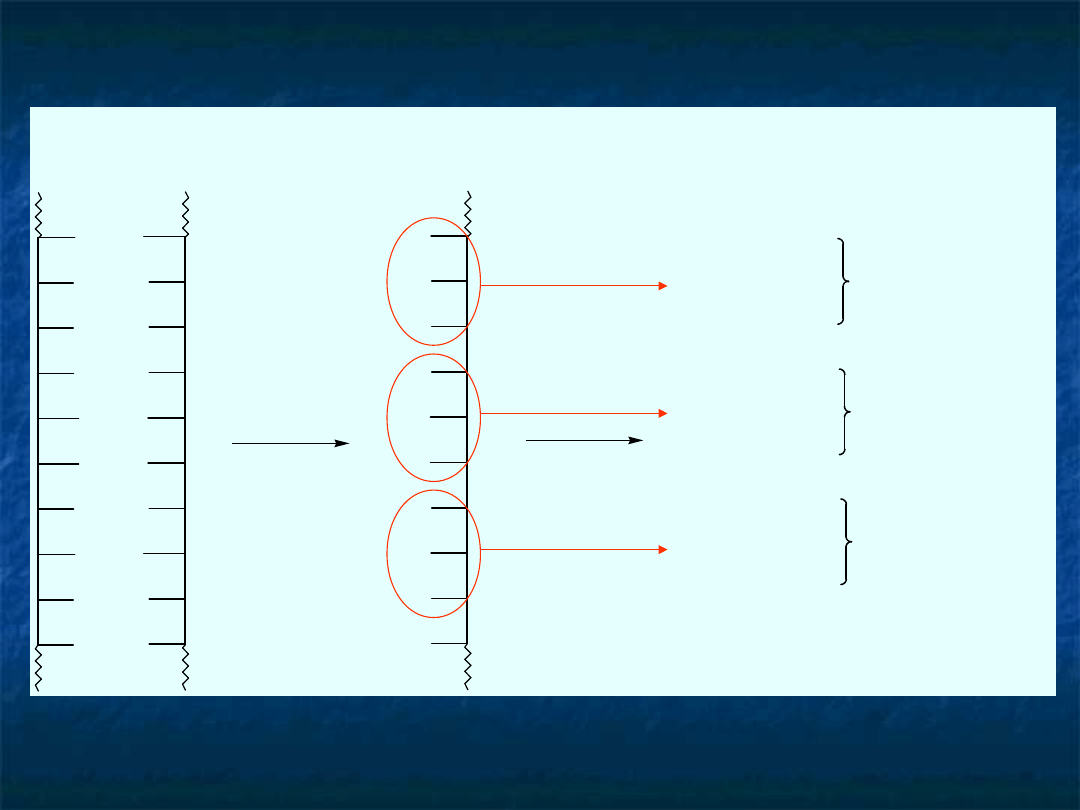
Fragment DNA
Transkrypcja
Fragment mRNA
po replikacji nici+ DNA
(+)
(-)
U
C
C
G
A
A
G
U
C
C
Translacja
Fragment polipeptydu zbudowanego
na podstawie instrukcji przechowywanej
w DNA, skopiowanej jako mRNA i odczytanej
przez zespoly enzymow
kodon UCC
kodon GAA
kodon GUC
Ser
Glu
Val

Biosynteza
Biosynteza
białka
białka
w komórkach Eucaryota
w komórkach Eucaryota
TRANSLACJA
TRANSLACJA
odbywa się w rybosomach. Rybosom składa się z
odbywa się w rybosomach. Rybosom składa się z
białek i rRNA. Jest on mniej więcej w kształcie kuli z pokrywką
białek i rRNA. Jest on mniej więcej w kształcie kuli z pokrywką
na zawiasach. Po zamknięciu "pokrywy" pozostaje jednak
na zawiasach. Po zamknięciu "pokrywy" pozostaje jednak
prześwit, przez który może przesuwać się mRNA.
prześwit, przez który może przesuwać się mRNA.
tRNA
tRNA
przenosi poszczególne rodzaje aminokwasów, w zależności
przenosi poszczególne rodzaje aminokwasów, w zależności
od tego jaki kod zawiera na "stopce". Kod na "stopce" tRNA
od tego jaki kod zawiera na "stopce". Kod na "stopce" tRNA
składa się z 3 nukleotydów. Fragment kwasu RNA lub DNA,
składa się z 3 nukleotydów. Fragment kwasu RNA lub DNA,
kodujący cząsteczkę aminokwasu nazywamy kodonem. tRNA,
kodujący cząsteczkę aminokwasu nazywamy kodonem. tRNA,
którego antykodon pasuje do kodu na łańcuchu mRNA na
którego antykodon pasuje do kodu na łańcuchu mRNA na
rybosomie, pozostawia swój aminokwas na tym rybosomie,
rybosomie, pozostawia swój aminokwas na tym rybosomie,
łańcuch mRNA przesuwa się o trójkę, i następny tRNA, który
łańcuch mRNA przesuwa się o trójkę, i następny tRNA, który
się dopasuje, pozostawia z kolei swój aminokwas, który tworzy
się dopasuje, pozostawia z kolei swój aminokwas, który tworzy
wiązanie z poprzednim aminokwasem, wydłużając stopniowo
wiązanie z poprzednim aminokwasem, wydłużając stopniowo
łańcuch peptydowy.
łańcuch peptydowy.
Jeżeli ten proces dojdzie do trójki kończącej (kod UGA, UAG lub
Jeżeli ten proces dojdzie do trójki kończącej (kod UGA, UAG lub
UAA), to łańcuch peptydowy odrywa się od rybosomu.
UAA), to łańcuch peptydowy odrywa się od rybosomu.

TRANSLACJA
TRANSLACJA
odbywa się w rybosomach. Rybosom składa się
odbywa się w rybosomach. Rybosom składa się
z białek i rRNA. Jest on mniej więcej w kształcie kuli z
z białek i rRNA. Jest on mniej więcej w kształcie kuli z
pokrywką na zawiasach. Po zamknięciu "pokrywy" pozostaje
pokrywką na zawiasach. Po zamknięciu "pokrywy" pozostaje
jednak prześwit, przez który może przesuwać się mRNA,
jednak prześwit, przez który może przesuwać się mRNA,
zawierający informację o sekwencji aminokwasów w białku.
zawierający informację o sekwencji aminokwasów w białku.
Następny rodzaj kwasu RNA, tzw. tRNA przenosi poszczególne
Następny rodzaj kwasu RNA, tzw. tRNA przenosi poszczególne
rodzaje aminokwasów, w zależności od tego jaki kod zawiera
rodzaje aminokwasów, w zależności od tego jaki kod zawiera
na "stopce". Kod na "stopce" tRNA składa się z 3 nukleotydów.
na "stopce". Kod na "stopce" tRNA składa się z 3 nukleotydów.
Fragment kwasu nukleinowego (RNA lub DNA), kodujący
Fragment kwasu nukleinowego (RNA lub DNA), kodujący
cząsteczkę aminokwasu nazywamy kodonem. W komórce musi
cząsteczkę aminokwasu nazywamy kodonem. W komórce musi
być co najmniej tyle rodzajów tRNA z różnymi kodami, ile jest
być co najmniej tyle rodzajów tRNA z różnymi kodami, ile jest
rodzajów aminokwasów wchodzących w skład białek. tRNA,
rodzajów aminokwasów wchodzących w skład białek. tRNA,
którego antykodon pasuje do kodu prezentowanego przez
którego antykodon pasuje do kodu prezentowanego przez
łańcuch mRNA na rybosomie, pozostawia swój aminokwas na
łańcuch mRNA na rybosomie, pozostawia swój aminokwas na
tym rybosomie, łańcuch mRNA przesuwa się o trójkę, i
tym rybosomie, łańcuch mRNA przesuwa się o trójkę, i
następny tRNA, który się dopasuje, pozostawia z kolei swój
następny tRNA, który się dopasuje, pozostawia z kolei swój
aminokwas,
który
tworzy
wiązanie
z
poprzednim
aminokwas,
który
tworzy
wiązanie
z
poprzednim
aminokwasem, wydłużając stopniowo łańcuch peptydowy.
aminokwasem, wydłużając stopniowo łańcuch peptydowy.
Jeżeli ten proces dojdzie do trójki kończącej (kod UGA, UAG
Jeżeli ten proces dojdzie do trójki kończącej (kod UGA, UAG
lub UAA), to łańcuch peptydowy odrywa się od rybosomu i
lub UAA), to łańcuch peptydowy odrywa się od rybosomu i
wchodzi do "woreczka" retikulum endoplazmatycznego, gdzie
wchodzi do "woreczka" retikulum endoplazmatycznego, gdzie
odbywają się następne fazy syntezy białek - modyfikacje
odbywają się następne fazy syntezy białek - modyfikacje
posttranslacyjne.
posttranslacyjne.

Enzymy
Enzymy
(budowa, mechanizm katalizy enzymatycznej,
(budowa, mechanizm katalizy enzymatycznej,
kinetyka reakcji enzymatycznej, specyficzność
kinetyka reakcji enzymatycznej, specyficzność
oraz swoistość kierunku działania enzymu,
oraz swoistość kierunku działania enzymu,
inhibicja, klasyfikacja enzymów).
inhibicja, klasyfikacja enzymów).
Koenzymy i grupy prostetyczne. Witaminy.
Koenzymy i grupy prostetyczne. Witaminy.

Enzymy
Enzymy
są biokatalizatorami tzn. związkami
są biokatalizatorami tzn. związkami
pochodzenia biologicznego, które
pochodzenia biologicznego, które
przyspieszają reakcje chemiczne, nie
przyspieszają reakcje chemiczne, nie
zużywając się w trakcie działania
zużywając się w trakcie działania
Holoenzym = apoenzym + koenzym
Holoenzym = apoenzym + koenzym
(substancja (substancja
(substancja (substancja
białkowa) niebiałkowa)
białkowa) niebiałkowa)
Centrum aktywne
Centrum aktywne
(katalityczne) – strefa łańcucha
(katalityczne) – strefa łańcucha
polipeptydowego bezpośrednio wiążąca substrat w czasie
polipeptydowego bezpośrednio wiążąca substrat w czasie
reakcji – aminokwasy kontaktowe (His, Ser, Lys, Cys, Asp,
reakcji – aminokwasy kontaktowe (His, Ser, Lys, Cys, Asp,
Glu)
Glu)

Zasada działania
Zasada działania
enzymu
enzymu
Efektywnie działające katalizatory:
Efektywnie działające katalizatory:
zwiększają
prawdopodobieństwo
zwiększają
prawdopodobieństwo
zderzeń cząsteczek,
zderzeń cząsteczek,
ukierunkowują
cząsteczki
ukierunkowują
cząsteczki
substratów względem siebie
substratów względem siebie
obniżają energię aktywacji (taka
obniżają energię aktywacji (taka
porcja energii, którą układ musi
porcja energii, którą układ musi
pobrać,
aby
przezwyciężyć
pobrać,
aby
przezwyciężyć
„bezwładność
chemiczną”
„bezwładność
chemiczną”
cząsteczek)
cząsteczek)
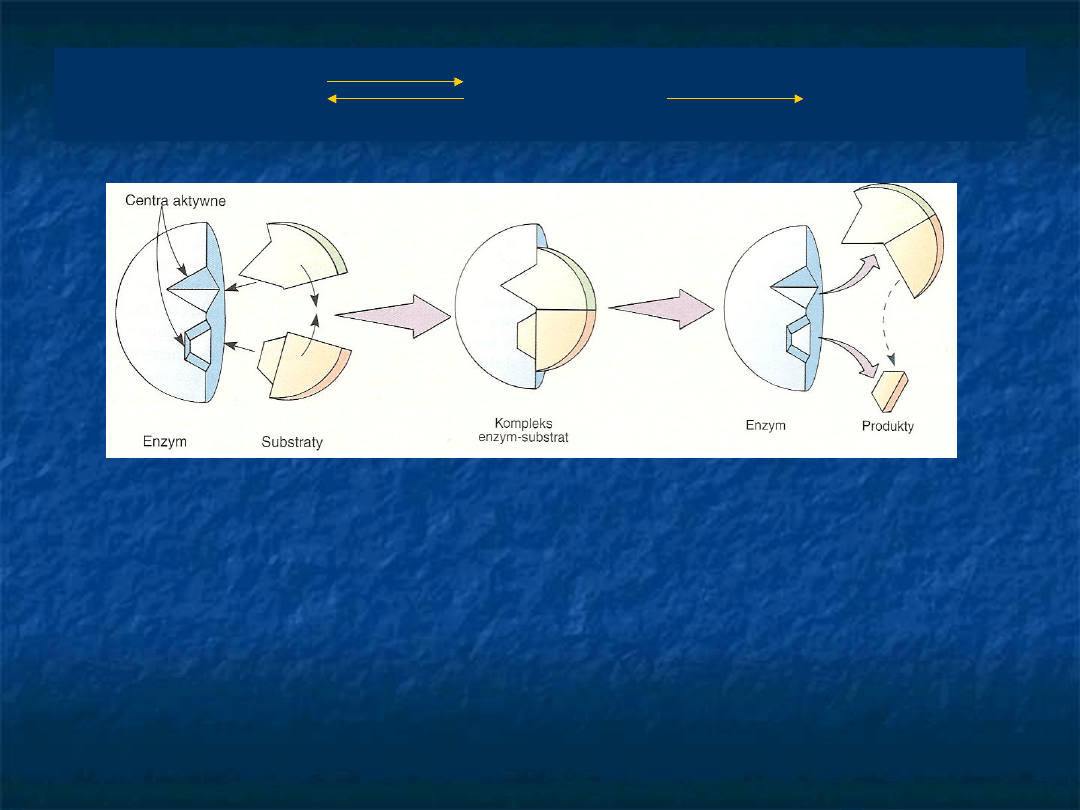
E + S ES E + P
E + S ES E + P
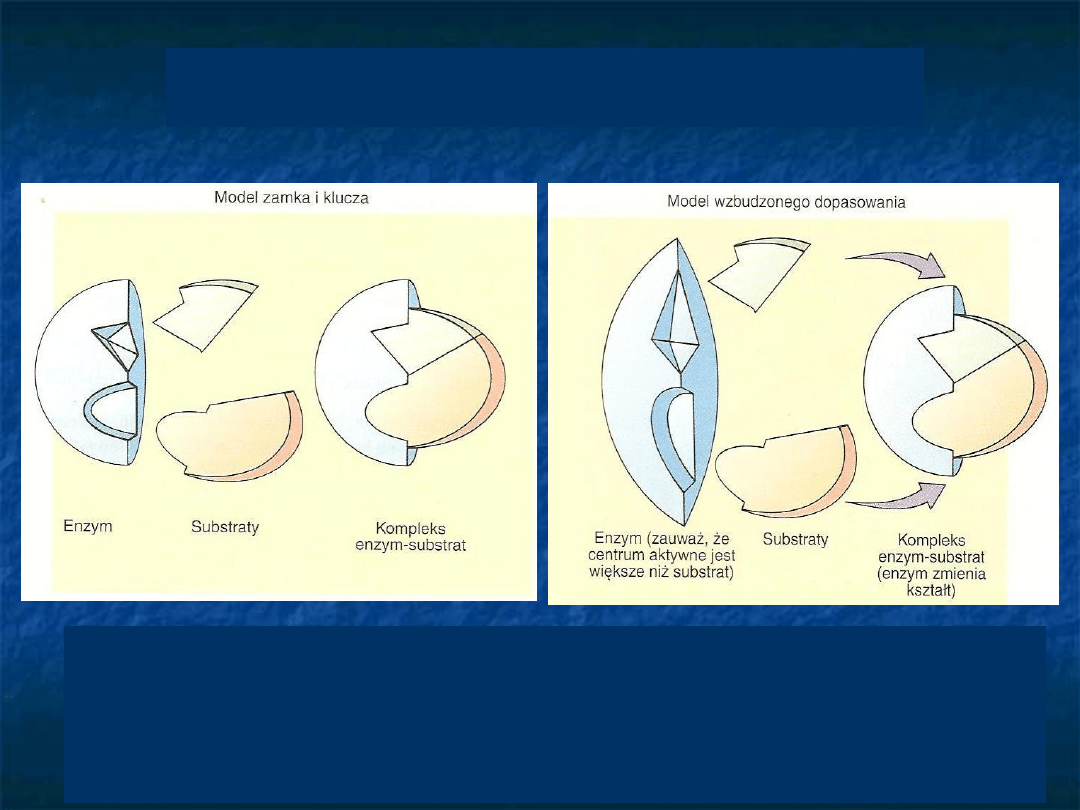
Wiązanie substratu do
Wiązanie substratu do
enzymu
enzymu
E. Fisher układ [E-S] D.E Koshland, Jr. –
model „klucz-zamek”
„wymuszonego -
indukowanego
dopasowania”

Specyficzność substratowa
Specyficzność substratowa
możliwość wyboru przez enzym jednego lub grupy
możliwość wyboru przez enzym jednego lub grupy
strukturalnie podobnych związków, z którymi wchodzi on w
strukturalnie podobnych związków, z którymi wchodzi on w
kompleks zdolny do dalszej reakcji
kompleks zdolny do dalszej reakcji
Specyficzność grupowa
Specyficzność grupowa
–
–
enzymy mogą wykorzystywać jako
enzymy mogą wykorzystywać jako
substrat określoną grupę podobnych do siebie substancji (np.
substrat określoną grupę podobnych do siebie substancji (np.
oksydaza aminokwasowa katalizuje oksydację wielu aminokwasów)
oksydaza aminokwasowa katalizuje oksydację wielu aminokwasów)
Specyficzność absolutna
Specyficzność absolutna
– zdolność enzymu do katalizowania
– zdolność enzymu do katalizowania
reakcji wyłącznie jednego substratu (np. ureaza katalizuje rozkład
reakcji wyłącznie jednego substratu (np. ureaza katalizuje rozkład
mocznika)
mocznika)
Specyficzność przestrzenna
Specyficzność przestrzenna
(stereospecyficzność) – odpowiednie
(stereospecyficzność) – odpowiednie
dopasowanie konfiguracji substratu do układu zaczepienia w centrum
dopasowanie konfiguracji substratu do układu zaczepienia w centrum
aktywnym enzymu (np. syntetaza L-glutaminowa nie katalizuje
aktywnym enzymu (np. syntetaza L-glutaminowa nie katalizuje
przemian D-aminokwasu)
przemian D-aminokwasu)
Swoistość kierunku działania enzymu
Swoistość kierunku działania enzymu
- zdolność enzymu do katalizowania jednej z termodynamicznie
- zdolność enzymu do katalizowania jednej z termodynamicznie
możliwych reakcji, jakim może podlegać substrat wchodzący z
możliwych reakcji, jakim może podlegać substrat wchodzący z
nim w kompleks
nim w kompleks

Od czego zależy szybkość reakcji
Od czego zależy szybkość reakcji
enzymatycznej?
enzymatycznej?
stężenie
stężenie
substratu
substratu
stężenie enzymu
stężenie enzymu
pH
pH
temperatura
temperatura
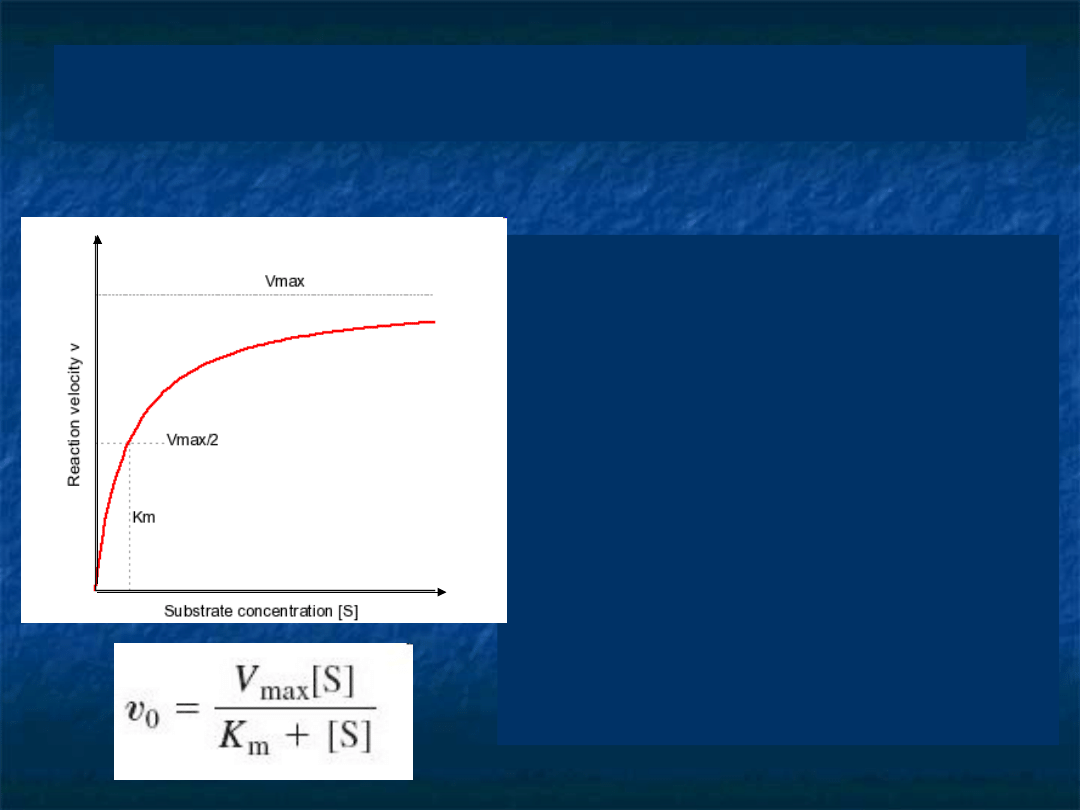
Zależność szybkości reakcji od stężenia
Zależność szybkości reakcji od stężenia
substratu dla prostej reakcji przedstawia
substratu dla prostej reakcji przedstawia
krzywa Michaelisa-Menten
krzywa Michaelisa-Menten
Wysycanie
enzymu
substratem
Wysycanie
enzymu
substratem
(zbliżanie
się
do
szybkości
(zbliżanie
się
do
szybkości
maksymalnej) oznacza, że maleje
maksymalnej) oznacza, że maleje
liczba wolnych cząsteczek enzymu,
liczba wolnych cząsteczek enzymu,
gdyż rośnie ilość tych związanych
gdyż rośnie ilość tych związanych
w kompleksie z substratem (ES).
w kompleksie z substratem (ES).
Maksymalna
szybkość
(Vmax)
Maksymalna
szybkość
(Vmax)
reakcji enzymatycznej, oznacza, że
reakcji enzymatycznej, oznacza, że
praktycznie
wszystkie
miejsca
praktycznie
wszystkie
miejsca
aktywne enzymu zostają wysycone
aktywne enzymu zostają wysycone
substratem.
substratem.
Stała Michaelisa-Menten
Stała Michaelisa-Menten
(
(
Km
Km
),
),
która
jest
takim
stężeniem
która
jest
takim
stężeniem
substratu
substratu
,
,
przy którym szybkość
przy którym szybkość
reakcji osiąga połowę swojej
reakcji osiąga połowę swojej
maksymalnej wartości. Stanowi
maksymalnej wartości. Stanowi
ona wyraz powinowactwa enzymu
ona wyraz powinowactwa enzymu
do substratu.
do substratu.
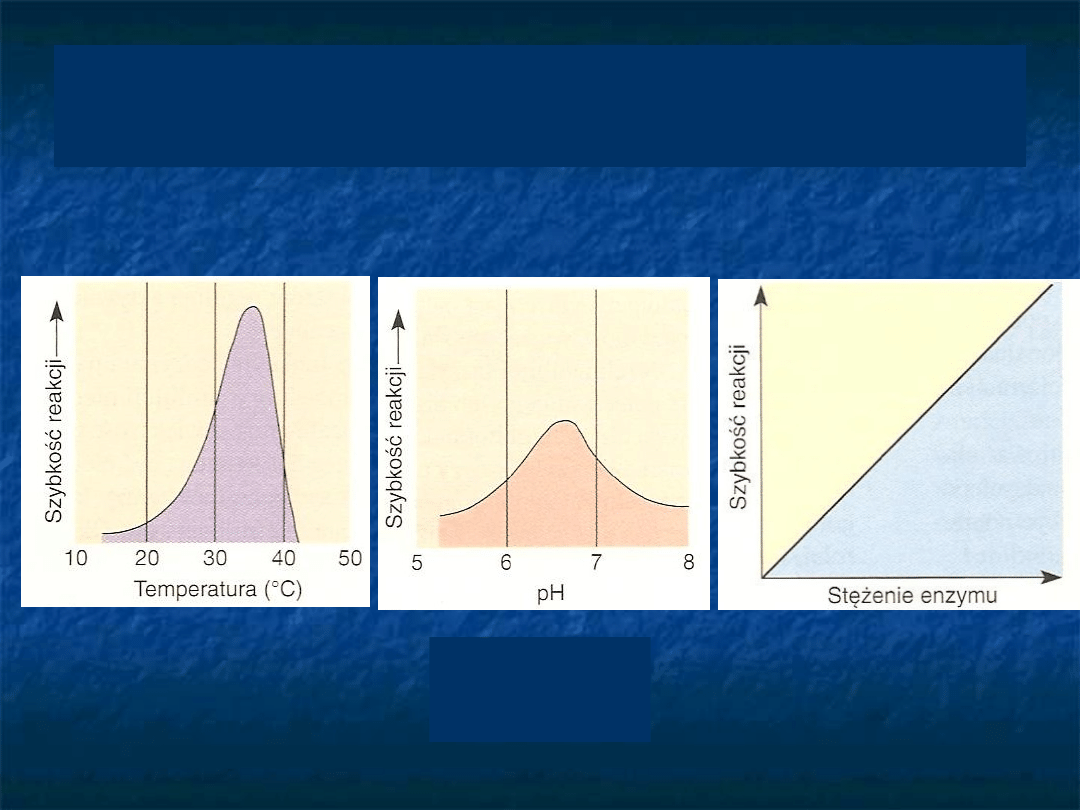
Wpływ stężenia enzymu, temperatury i
Wpływ stężenia enzymu, temperatury i
pH na szybkość reakcji enzymatycznej
pH na szybkość reakcji enzymatycznej
Pepsyna 1,
Arginaza 10

Aktywatory enzymatyczne
Aktywatory enzymatyczne
- jony metali (najczęściej dwuwartościowych np. Mg lub Ca,
- jony metali (najczęściej dwuwartościowych np. Mg lub Ca,
Mn, Zn, Co) lub Cl
Mn, Zn, Co) lub Cl
- -
- -
działanie aktywatorów ułatwia
działanie aktywatorów ułatwia
powstawanie kompleksu ES
powstawanie kompleksu ES
w soku żołądkowym
w soku żołądkowym
kwaśne środowisko Cl
kwaśne środowisko Cl
-
-
pepsynogen pepsyna
pepsynogen pepsyna
+ inhibitor
+ inhibitor
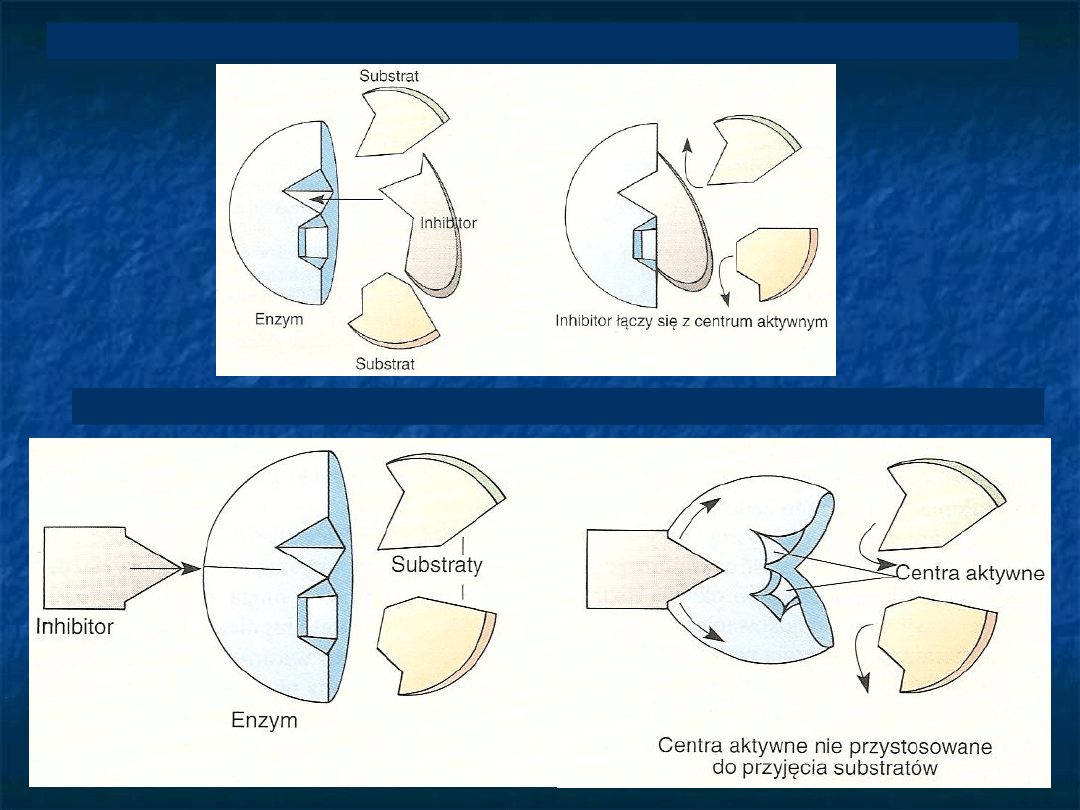
Inhibicja współzawodnicząca (kompetycyjna)
Inhibicja współzawodnicząca (kompetycyjna)
Inhibicja niewspółzawodnicząca (niekompetycyjna)
Inhibicja niewspółzawodnicząca (niekompetycyjna)

Klasyfikacja enzymów
Klasyfikacja enzymów
wg Międzynarodowej Unii Biochemicznej
wg Międzynarodowej Unii Biochemicznej
Klasa
Klasa
Podklasa
Podklasa
Typ reakcji
Typ reakcji
1.Oksydoredukt
1.Oksydoredukt
azy
azy
utleniana grupa w
utleniana grupa w
donorze : CH-OH,
donorze : CH-OH,
CHO, CH-NH
CHO, CH-NH
2
2
,
,
CH=CH
CH=CH
enzymy
katalizujące
reakcje
enzymy
katalizujące
reakcje
oksydoreduk-cyjne
–
przemiany
oksydoreduk-cyjne
–
przemiany
związane z przeniesieniem protonów,
związane z przeniesieniem protonów,
elektronów i tlenu (np. reduktazy,
elektronów i tlenu (np. reduktazy,
dehydrogenazy,
oksydazy,
dehydrogenazy,
oksydazy,
peroksydazy)
peroksydazy)
2. Transferazy
2. Transferazy
przenoszona grupa
przenoszona grupa
– C
– C
1
1
, C=O, acyl,
, C=O, acyl,
alkile, glikozyl,
alkile, glikozyl,
NH
NH
2
2
, PO
, PO
3
3
przeniesienie grup między związkami
przeniesienie grup między związkami
(np.
amino-,
acylo-,
glikozylo-
(np.
amino-,
acylo-,
glikozylo-
transferazy)
transferazy)
3. Hydrolazy
3. Hydrolazy
hydrolizują
hydrolizują
wiązania
wiązania
peptydowe,
peptydowe,
estrowe,
estrowe,
glikozydowe
glikozydowe
katalizują rozkład wiązań przy udziale
katalizują rozkład wiązań przy udziale
wody (np. peptydazy, esterazy,
wody (np. peptydazy, esterazy,
glikozydazy, amidazy)
glikozydazy, amidazy)
4. Liazy
4. Liazy
(Syntazy)
(Syntazy)
rozszczepiane
rozszczepiane
wiązanie: C-C, C-O,
wiązanie: C-C, C-O,
C-N, C-S
C-N, C-S
katalizują odłączanie grup od
katalizują odłączanie grup od
substratu bez udziału wody (np.
substratu bez udziału wody (np.
dekarboksylazy, hydroliazy)
dekarboksylazy, hydroliazy)
5. Izomerazy
5. Izomerazy
typ izomeryzacji:
typ izomeryzacji:
racemizacja, cis-
racemizacja, cis-
trans,
trans,
oksydoredukcja
oksydoredukcja
wewn.
wewn.
katalizują reakcje izomeryzacji :
katalizują reakcje izomeryzacji :
racemizacja, epimeryzacja,
racemizacja, epimeryzacja,
izomeryzacja
izomeryzacja
cis-trans
cis-trans
6. Ligazy
6. Ligazy
(Syntetazy)
(Syntetazy)
wytwarzanie
wytwarzanie
wiązań:
wiązań:
C-O, C-S, C-N, C-C
C-O, C-S, C-N, C-C
katalizują wytwarzanie wiązań miedzy
katalizują wytwarzanie wiązań miedzy
dwiema cząsteczkami (np. syntetazy
dwiema cząsteczkami (np. syntetazy
aminoacylo-tRNA, karboksylazy)
aminoacylo-tRNA, karboksylazy)
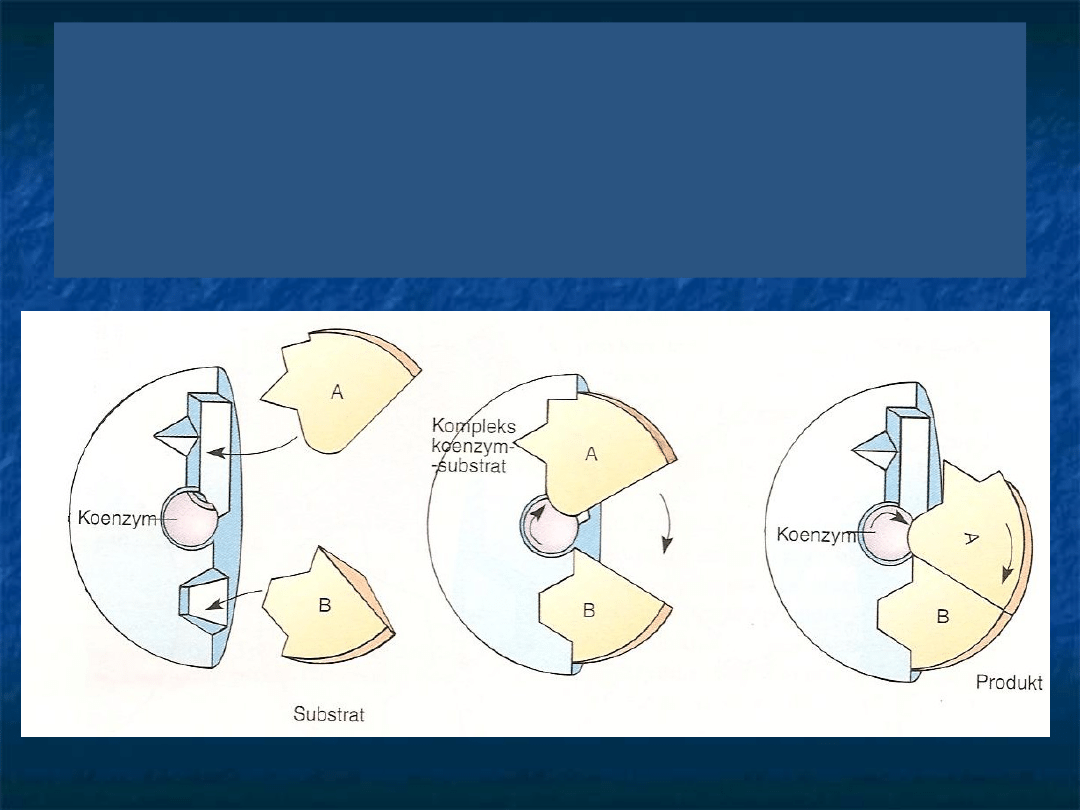
Niektóre enzymy nie są zdolne do bezpośredniego
Niektóre enzymy nie są zdolne do bezpośredniego
przyłączania substratów. Wówczas enzym wprzęga do pomocy
przyłączania substratów. Wówczas enzym wprzęga do pomocy
koenzym jako łącznik w wiązaniu substratu z centrami
koenzym jako łącznik w wiązaniu substratu z centrami
aktywnymi enzymu. Najpierw jeden substrat łączy się z
aktywnymi enzymu. Najpierw jeden substrat łączy się z
koenzymem, tworząc kompleks koenzym-substrat. Następnie
koenzymem, tworząc kompleks koenzym-substrat. Następnie
kompleks ten łączy się z drugim substratem i powstaje
kompleks ten łączy się z drugim substratem i powstaje
kompleks, który dostarcza produktów i uwalnia koenzym.
kompleks, który dostarcza produktów i uwalnia koenzym.

Klasa
Klasa
Koenzym
Koenzym
Witamina
Witamina
1.Oksydoreduk
1.Oksydoreduk
tazy
tazy
dinukleotyd nikotynoamidoadeninowy (
dinukleotyd nikotynoamidoadeninowy (
NAD
NAD
+
+
i NADP
i NADP
+
+
)
)
dinukleotyd flawinoadeninowy (
dinukleotyd flawinoadeninowy (
FAD
FAD
+
+
)
)
mononukleotyd flawinowy (
mononukleotyd flawinowy (
FMN
FMN
)
)
koenzym Q (
koenzym Q (
CoQ
CoQ
)
)
wit.
B2
wit.
B2
(ryboflawina)
(ryboflawina)
wit.
B2
wit.
B2
(ryboflawina)
(ryboflawina)
2. Transferazy
2. Transferazy
adenozynotrifosforan (
adenozynotrifosforan (
ATP
ATP
) (
) (
UTP, CTP
UTP, CTP
)
)
koenzym A (
koenzym A (
CoA
CoA
)
)
kwas tetrahydofoliowy (
kwas tetrahydofoliowy (
THF
THF
)
)
biotyna
biotyna
difosforan tiaminy (
difosforan tiaminy (
DPT
DPT
)
)
fosforan pirydoksalu (
fosforan pirydoksalu (
PLP
PLP
)
)
wit. PP (niacyna)
wit. PP (niacyna)
kwas foliowy
kwas foliowy
wit. H
wit. H
wit. B1 (tiamina)
wit. B1 (tiamina)
wit.
B6
wit.
B6
(pirydoksal)
(pirydoksal)
3. Hydrolazy
3. Hydrolazy
nie posiadają
nie posiadają
koenzymów
koenzymów
4. Liazy
4. Liazy
(Syntazy)
(Syntazy)
koenzym B12
koenzym B12
wit. B12
wit. B12
(cyjanokobalamina
(cyjanokobalamina
)
)
5. Izomerazy
5. Izomerazy
difosforan tiaminy (
difosforan tiaminy (
DPT
DPT
)
)
fosforan pirydoksalu (
fosforan pirydoksalu (
PLP
PLP
)
)
wit. B1 (tiamina)
wit. B1 (tiamina)
wit.
B6
wit.
B6
(pirydoksal)
(pirydoksal)
6. Ligazy
6. Ligazy
(Syntetazy)
(Syntetazy)
urydynotrifosforan (
urydynotrifosforan (
UTP
UTP
)
)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
Wyszukiwarka
Podobne podstrony:
PU-wykład III i IV-10-11.05.08, prawo pracy i prawo urzędnicze
PU-wyklad III i IV-10-11.05.08, prawo pracy i prawo urzędnicze
Wyklad VI � 10.11.09 (Fizjologia) , Wykład VI - 10
Prawo Karne - wykład II Semestr 10-11, Prawo karne
Wykłady Filozofia 01 10 11
HISTORIA KULTURY POLSKIEJ W XIX wieku, WYKŁAD II, 14 10 11
CSSTiRL Struktura organizacyjna polityki spolecznej 10 11 skrot
statystyka zarz nst 10 11
HISTORIA KULTURY POLSKIEJ W XIX WIEKU, WYKŁAD III, 28 10 11
Psychologia społeczna wykład$ 10 11
Notatki z wykładów, Prawo Konstytucyjne - Wykład 10, 11 - Partie Polityczne, DEMOKRACJA POŚREDNIA (r
Wyklad 11 i 12; 10452, Wykład 10 i 11
wyklad 9 10 11
WYKŁAD 10 11[1] 03 05
Algebra 10 10 11 Wyklad
F II wyklad 10 11
Wykład z ćwiczeń 23.10.2010 (sobota) R. Gałuszka, UJK.Fizjoterapia, - Notatki - Rok I -, Kinezyterap
Wykład z ćwiczeń 17.10.2010 (niedziela) J. Dobrowolski, UJK.Fizjoterapia, - Notatki - Rok I -, Fizjo
więcej podobnych podstron