
Marian Kamiński
PODSTAWOWE POJĘCIA I PARAMETRY OPISUJĄCE UKŁADY
CHROMATOGRAFICZNE. PODSTAWOWE ZASADY EFEKTYWNEGO
STOSOWANIA CHROMATOGRAFII CIECZOWEJ DO ROZDZIELANIA I
OZNACZANIA SKŁADU MIESZANIN
Znaczenie i zastosowania chromatografii oraz rodzaje technik chromatograficznych
Chromatografia jest jedną z technik rozdzielania mieszanin substancji (związków,
albo grup związków chemicznych) w układzie dwufazowym - faza stacjonarna / faza
ruchoma. Gdy fazą ruchomą (eluentem) jest gaz obojętny, przenoszący cząsteczki „oparów”
(czasem produktów pirolizy) składników rozdzielanej mieszaniny - mówimy o
chromatografii gazowej (GC, GLC, CGC), w tym – niekiedy – o gazowej chromatografii
pirolitycznej. Gdy eluentem jest ciecz – o chromatografii cieczowej (LC, HPLC, TLC,
PLC), a gdy płyn w stanie nadkrytycznym - o chromatografii nadkrytycznej, albo
chromatografii z eluentem w stanie nadkrytycznym (SFC). Do kategorii technik i metod
chromatograficznych zalicza się także techniki elektroforezy żelowej (GE) i kapilarnej (CE)
oraz elektrochromatografię i izotachoforezę.
Techniki i metody chromatografii zrobiły ogromną karierę w okresie ostatniego
stulecia, a zwłaszcza w okresie drugiej jego połowy. Obecnie nie ma, już chyba laboratorium,
albo pracowni badawczej, czy zakładu produkcyjnego, działających w dziedzinie chemii
organicznej, nieorganicznej, fizykochemicznej, biochemicznej, farmaceutycznej, produktów
kosmetycznych, polimerów, inżynierii i ochrony środowiska, technologii żywności,
biotechnologii i wielu innych, aby nie stosowano tam chromatografii w celach
analitycznych, także coraz częściej –w zastosowaniach preparatywnych lub procesowych.
Należy podkreślić, że właśnie zdolność do rozdzielania wieloskładnikowych
mieszanin substancji o bardzo zbliżonych właściwościach stała się przyczyną tak wielkiego
spektrum współczesnych zastosowań chromatografii, tak w analityce, jak i w technologii
leków ze źródeł pochodzenia naturalnego, w biotechnologii czy w innych obszarach.
Możliwość otrzymywania określonych czystych składników z ich
wieloskładnikowych mieszanin o podobnych, albo wręcz bardzo podobnych, właściwościach
(izomery strukturalne, izomery optyczne) z zastosowaniem chromatografii elucyjnej w skali
preparatywnej, albo procesowej jest oczywistą zaletą technik chromatograficznych. Gdy jest
możliwość wykorzystania do rozdzielania innych technik, kwestią warunkującą powszechne
stosowanie chromatografii pozostaje wówczas tylko koszt jej stosowania, który okazuje się
być wysoce konkurencyjny. Gdy nie ma alternatywnej techniki rozdzielania – mamy sytuację
„monopolistyczną”.
W przypadku analityki, oznaczenie składników w mieszaninie z innymi - szczególnie
o podobnych właściwościach fizykochemicznych - jest zawsze bardzo trudne i czaso- i
pracochłonne, a często, niemożliwe. Natomiast, po rozdzieleniu – prawie zawsze - łatwe i
szybkie. Jednocześnie, dzięki zastosowaniu przepływowych
detektorów
chromatograficznych - w warunkach chromatografii gazowej, wysokosprawnej elucyjnej
chromatografii kolumnowej (HPLC), albo chromatografii nadkrytycznej - oznaczenie
może, i jest wykonywane w sposób dynamiczny, podczas przepływu eluatu z kolumny przez
przepływowe naczynie, głowicę, albo dzięki kontaktowi substancji zawartej w eluacie z

odpowiednim czułym czujnikiem pomiarowym detektora. Zawartość składników w eluacie, a
w konsekwencji - w próbce - jest obliczana na podstawie wysokości, albo powierzchni piku,
praktycznie jednocześnie z ich rozdzieleniem. W przypadku chromatografii planarnej, tzn.,
cienkowarstwowej i tzw. nadciśnieniowej chromatografii planarnej (OVP-TLC), oznaczanie
zawartości składników analitu jest wykonywane po zakończeniu rozdzielania i najczęściej po
odparowaniu eluentu - na podstawie intensywności „barwy” plamek, z zastosowaniem
skanera.
Fazę stacjonarną w kolumnie, albo w chromatografii planarnej, może stanowić
porowata powierzchnia adsorbentu o określonej polarności (najczęściej - układ faz
normalnych - NP), albo hydrofobowości (najczęściej - układ faz odwróconych - RP),
wymieniacza jonów o określonych oddziaływaniach jonowymiennych (ogólnie -
chromatografia jonowymienna, a ostatnio coraz częściej – chromatografia jonowa - IC),
warstewka fazy ciekłej o określonym, w chromatografii cieczowej – często generowanym
dynamicznie, składzie (chromatografia podziałowa gaz – ciecz – GLC), albo ciecz – ciecz -
LLC, lub ostatnio - LIHLC). Może nią być też powierzchnia „najeżona” określonymi
ligandami o określonym powinowactwie do konkretnych związków chemicznych
(chromatografia powinowactwa - AC), lub o zdolności wymiany ligandów
(chromatografia wymiany ligandów - LEC). Tylko wówczas, gdy fazą stacjonarną jest
spolimeryzowana struktura o zróżnicowaniu średnicy / wielkości porów, tak przygotowana,
aby unikać jakichkolwiek oddziaływań sorpcyjnych, jonowymiennych, powinowactwa, czy
między ligandami – mówimy o chromatografii wykluczania, albo żelowej (GPC, SEC).
Proces chromatograficzny można ogólnie zdefiniować jako zespół wzajemnych
„konkurencyjnych” oddziaływań cząsteczek związków chemicznych rozdzielanej mieszaniny,
a w przypadku chromatografii cieczowej, dodatkowo - składników fazy ruchomej (eluentu), z
fazą stacjonarną, który prowadzi do rozdzielenia i opuszczania układu w różnym czasie przez
poszczególne składniki rozdzielanej mieszaniny. W warunkach chromatografii cieczowej, a
także chromatografii nadkrytycznej z m wykorzystaniem polarnych modyfikatorów, należy
także uwzględniać także, wzajemne oddziaływania między cząsteczkami, lub jonami
rozdzielanej mieszaniny oraz cząsteczkami, lub jonami eluentu, co w znaczny sposób
komplikuje opis, ale najczęściej korzystnie wpływa na retencję i selektywność rozdzielania.
Innymi słowy - w zapewniających separację - układach chromatografii cieczowej,
nadkrytycznej i adsorpcyjnej chromatografii gazowej mają miejsce bardzo podobne, jednak -
nie identyczne - wartości energii swobodnej oddziaływań składników rozdzielanej mieszaniny
i składników eluentu z fazą stacjonarną. W warunkach chromatografii gaz - ciecz o
rozdzielaniu decyduje, przede wszystkim, zróżnicowanie lotności składników poddawanych
rozdzielaniu. Dodatkowe znaczenie ma zróżnicowanie rozpuszczalności w fazie stacjonarnej.
Gdy energie oddziaływań sorpcyjnych będą identyczne, nie może nastąpić rozdzielenie,
niezależnie od tego jak bardzo sprawny jest układ chromatograficzny. Jedynie, w przypadku
„czystej” chromatografii wykluczania (żelowej), rozdzielanie ma miejsce dzięki
zróżnicowaniu dróg dyfuzji składników rozdzielanej mieszaniny.
Bardziej ściśle i w zgodzie z zasadami fizykochemii – proces chromatograficzny
prowadzi do opuszczania kolumny przez poszczególne składniki mieszaniny rozdzielanych
substancji, z różnymi wartościami objętości elucji.
Zjawisko wolniejszej migracji składników rozdzielanej mieszaniny niż wynosi
prędkość przepływu eluentu nazywamy retencją (opisywany współczynnikiem retencji (k)).
Gdy każdy składnik mieszaniny wprowadzonej do układu chromatograficznego wykazuje
zróżnicowaną retencję, układ chromatograficzny jest selektywny wobec składników

rozdzielanej mieszaniny. Selektywność układu chromatograficznego jest opisywana z
zastosowaniem stosunku współczynników retencji sąsiednich stref rozdzielanych substancji o
większej i mniejszej retencji i nosi, obecnie, nazwę współczynnika rozdzielenia (α), dawniej
nazywanego współczynnikiem selektywności, albo współczynnikiem pojemnościowym.
Optymalne warunki rozdzielania i oznaczania w chromatografii
Szansa uzyskania rozdzielenia stref składników rozdzielanej mieszaniny ma miejsce
tylko pod warunkiem wyższych od jedności wartości ich współczynników rozdzielenia.
Jednocześnie konieczna jest wystarczająca sprawność rozdzielania, albo dostateczna
sprawności układu, tzn., wystarczająca sprawność kolumny, albo warstwy w
chromatografii planarnej, lub cienkowarstwowej (TLC). Jeżeli którekolwiek składniki
wykazują identyczną retencję w określonym układzie chromatograficznym i w określonych
warunkach rozdzielania, nie ma szans ich rozdzielenia, niezależnie od sprawności układu
chromatograficznego. Wówczas rozdzielczość pików (R, dawniej Rs) wynosi zero. Stąd
podstawowe znaczenie ma dobór selektywności rozdzielania, a nieco mniejsze – dobór
odpowiedniej sprawności.
Gdy warunki rozdzielania zostały dobrane w sposób optymalny, wówczas ma miejsce
rozdzielenie wszystkich składników „na styk” i rozdzielczość obliczona dla wszystkich pików
wynosi jeden. Dokonywanie rozdzielania z wartościami rozdzielczości wyższymi od 1-1.5 nie
jest celowe, powoduje, bowiem niepotrzebny wzrost czasu rozdzielania i zużycia eluentu.
Dobór odpowiedniego układu chromatograficznego, zadowalającej selektywności i
sprawności rozdzielania, to wybranie odpowiedniej fazy stacjonarnej (wypełnienia kolumny,
albo sorbentu w chromatografii cienkowarstwowej), odpowiedniego składu eluentu, albo
programu elucji oraz korzystnej sprawności rozdzielania, mierzonej liczbą półek
teoretycznych kolumny, albo płytki TLC - jest często niełatwym zadaniem, tym
trudniejszym, im bardziej zbliżone do siebie są właściwości fizykochemiczne składników
mieszaniny, które mają zostać rozdzielone.
Gdy stosujemy stałą temperaturę rozdzielania - mówimy o elucji izotermicznej.
Warunki elucji z zastosowaniem eluentu o składzie niezmiennym – o warunkach elucji
izokratycznej, a stosowanie stałej wartości ciśnienia płynu nadkrytycznego oznacza elucję
izobaryczną. Gdy w warunkach jakiejkolwiek techniki chromatograficznej stosujemy
programowanie warunków elucji (w celu optymalizacji rozdzielenia składników
mieszaniny) – mówimy o programowanych warunkach elucji, tzn., o elucji gradientowej,
albo / i programowaniu przepływu. W warunkach chromatografii cieczowej elucja
gradientowa polega, z reguły, na zmianie składu eluentu poprzez systematyczne zwiększanie
udziału składnika / składników o wyższej sile elucyjnej. W chromatografii gazowej
zwiększamy temperaturę podczas rozdzielania, a w chromatografii nadkrytycznej – ciśnienie,
a także często, jednocześnie – temperaturę. Programowanie warunków elucji może też
dotyczyć zmiany prędkości przepływu eluentu przez kolumnę, uzyskiwanej poprzez
programowanie objętościowego natężenia przepływu. Jednak, ma to drugorzędne znaczenie.
Wyniki rozdzielania w chromatografii i zakres możliwości ich wykorzystania
Wyniki rozdzielania zapisywane są w postaci zapisu, składającego się z pików
chromatograficznych, których kształt odpowiada rozkładowi stężenia w pasmach (plamkach)
substancji opuszczających kolumnę chromatograficzną, a zapis ten nosi nazwę
chromatogramu.
Chromatogram dostarcza dwojakiego typu informacji:
-- jakościowych - na podstawie miejsca piku na chromatogramie można m.in. wnioskować o
rodzaju rozdzielanych substancji i o strukturze molekularnej ich cząsteczek, a także o ich
właściwościach fizykochemicznych. Na podstawie liczby pików, o liczbie składników w
mieszaninie - pod warunkiem, że zastosowany układ chromatograficzny zapewnił
rozdzielenie wszystkich składników mieszaniny, a detektor jest czuły na wszystkie (wszystkie
je „widzi”);
-- ilościowych - wartość sygnału detektora, zmierzona jako wysokość, albo powierzchnia piku
chromatograficznego, jest funkcją stężenia bądź masy analitu w próbce dozowanej. Warto
pamiętać, że istnieją dwa różne typy przepływowych detektorów chromatograficznych o
ogólnie, przepływowych instrumentów pomiarowych – „stężeniowe”, albo „masowe”. W
przypadku detektora stężeniowego (np. detektora spektrofotometrycznego (UV-VIS),
zwanego też fotoabsorpcjometrycznym, refraktometrycznego (RID), fluorescencyjnego
(FLD), czy konduktometrycznego (CD) amplituda sygnału detektora jest proporcjonalna do
stężenia składnika w eluacie wypływającym z kolumny i w małym stopniu - zależnym tylko
od zmiany sprawności kolumny - zależy od natężenia przepływu eluatu przez naczynie
detektora. W przypadku, jednak, detektorów masowych, tzn., większości detektorów
stosowanych w gazowej chromatografii (np. detektora płomieniowo – jonizacyjnego (FID),
termo-konduktometrycznego (TCD), a także np. radiometrycznego w chromatografii
cieczowej), amplituda sygnału zależy od szybkości doprowadzania masy analitu do głowicy
detektora. Nie ma to znaczenia w warunkach zachowywania jednakowej wartości natężenia
przepływu eluentu podczas kalibracji i oznaczania. Jednak, nawet niewielkie zmiany
natężenia przepływu mają istotny wpływ na odpowiedź detektora masowego. Równocześnie
trzeba stosować inne zasady przeliczania parametrów kalibracyjnych na inne warunki
prędkości elucji dla detektora stężeniowego oraz inne dla detektora masowego.
Podstawowy opis mechanizmów oddziaływań międzycząsteczkowych i międzyfazowych
w chromatografii cieczowej
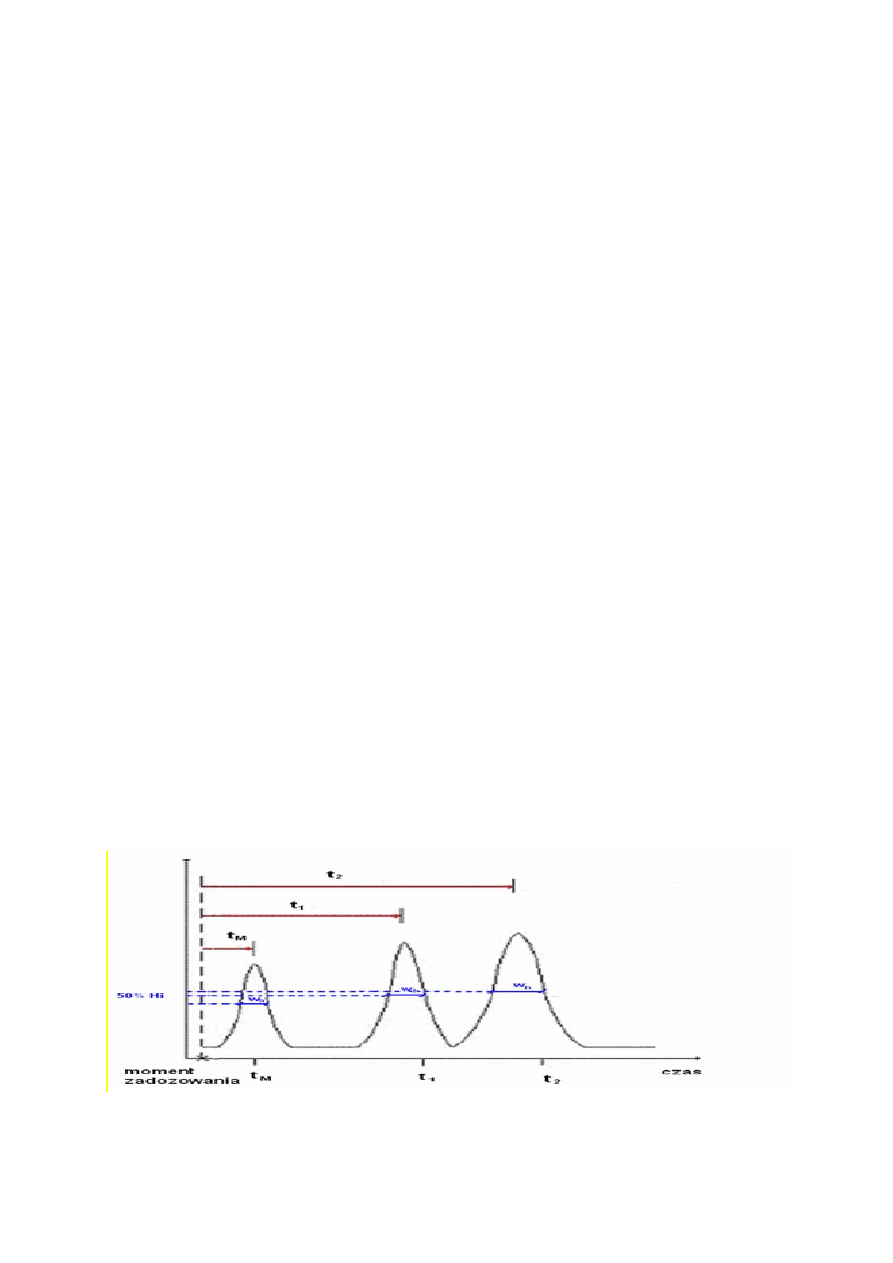
Na rysunku 1 przedstawiono schematycznie wynik rozdzielania substancji w kolumnie
z zastosowaniem przepływowego detektora, tzn., chromatogram.
Rysunek 1 Schematyczny obraz chromatogramu

Proces chromatograficzny to wielokrotna sorpcja i desorpcja substancji z fazy
ruchomej do stacjonarnej i odwrotnie, z fazy stacjonarnej do fazy ruchomej. W zależności od
„siły” (energii) oddziaływań z każdą z faz, składniki mieszaniny szybciej lub wolniej
przemieszczają się wzdłuż warstwy wypełnienia i opuszczają kolumnę w różnym czasie.
Jednocześnie pasma ulegają poszerzeniu (rozmyciu) na skutek procesów dyfuzyjnych i
dyspersyjnych oraz w rezultacie ograniczonej szybkości zjawisk sorpcji-desorpcji.
Warto też zapamiętać, że w warunkach chromatografii wykluczania (żelowej) oraz w
warunkach chromatografii powinowactwa, podstawowe zjawiska wykorzystywane do
rozdzielania substancji są inne, natomiast, zjawiska powodujące rozmycie pasm – te same.
Ze względu na różny mechanizm oddziaływań rozdzielanych substancji z fazą
ruchomą i stacjonarną układy chromatograficzne dzielimy na:
1. Układy faz normalnych
1.1. Adsorpcyjne warunki rozdzielania w układzie faz normalnych (NP) (czasem z
niewielkim stopniem udziału warunków podziałowych), mają miejsce wtedy, gdy
wykorzystuje się interakcje polarnych grup funkcyjnych rozdzielanych składników z
polarnymi centrami aktywnymi, obecnymi na powierzchni fazy stacjonarnej, albo z
polarnymi składnikami ciekłej, lub dynamicznie generowanej polarnej fazy stacjonarnej.
Ogólnie - im wyższa polarność eluentu, tym wyższa jego siła elucyjna w układzie faz
normalnych. Jednak, zmiana jednego składnika eluentu na inny może też powodować
zmianę selektywności rozdzielania. Przykłady tradycyjnych faz stacjonarnych
wykorzystywanych w układach faz normalnych, to żel krzemionkowy, tlenek glinu o
różnym stopniu zasadowości powierzchni, krzemian magnezu (Fluorisil), hydroksyapatyt
(wykazujący już, jednak, również oddziaływania jonowymienne) oraz porowaty ditlenek
tytanu, czy cyrkonu. Wadą tych faz stacjonarnych są wysokie energie adsorpcji wody i
silna zależność retencji substancji od zawartości wody w eluencie. Obecnie, stosuje się
coraz częściej, na ich miejsce wiele tzw. związanych faz stacjonarnych, otrzymanych na
drodze syntezy odpowiednich grup funkcyjnych, najczęściej do powierzchni żelu
krzemionkowego, ale także do tlenku glinu, di-tlenku tytanu, albo di-tlenku cyrkonu.
Przyłącza się w ten sposób grupy OH - w postaci alkilodiolu, CN – w postaci alkilo-
nitrylu, NH2 (wykazujący także bardzo słabe oddziaływania jonowymienne), grupy
arylo-, albo alklo-nitrowe (NO2), amid kwasu karboksylowego i inne. Skład fazy
ruchomej odpowiedniej do rozdzielania substancji w warunkach faz normalnych zależy
od polarności rozdzielanych składników. Typowe warunki chromatografii w układach faz
normalnych mają miejsce podczas rozdzielnia nisko- i średnio- polarnych związków
chemicznych. Stosuje się wtedy warunki niskiej, kontrolowanej zawartości wody w
eluencie, tzn., określone rozpuszczalniki organiczne najczęściej nie mieszające się z
wodą i ich mieszaniny, złożone z zupełnie nie polarnych składników, takich, jak n-heksan
i n- heptan, a nawet jeszcze mniej polarne fluoroalkany, poprzez kolejno – węglowodory
aromatyczne (szczególnie toluen), etery (szczególnie eter metylowo-, albo etylowo –
tertbutylowy), chloroalkany (szczególnie – dichlorometan), estry (szczególnie octan
metylu, albo etylu), ketony (szczególnie aceton i MEK), acetonitryl, alkohole
(szczególnie izopropanol, albo niewielki udział metanolu), kwasy hydroksylowe
(szczególnie bezwodny kwas octowy).
1.2.W przypadku rozdzielania w substancji polarnych w układach faz normalnych (polioli,
cukrów, aminokwasów, jonów organicznych, czy nieorganicznych itp.) można stosować
fazy ruchome zawierające znaczne zawartości wody, z dodatkiem acetonitrylu, metanolu,

pirydyny, kwasu octowego itp. polarnych i rozpuszczalnych w wodzie składników. Tego
typu układy chromatograficzne noszą nazwę układów oddziaływań hydrofilowo –
liofilowych i nie są to już warunki typowej chromatografii adsorpcyjnej, a warunki
chromatografii adsorpcyjno – podziałowej (HILC).
1.3. Podziałowe warunki rozdzielania w chromatografii cieczowej w układach faz
normalnych (NP-LLC) dawniej uzyskiwano poprzez naniesienie warstewki polarnej
cieczy (np. ciekłego glikolu polietylenowego) na powierzchnię szerokoporowatego
nośnika (jak w kolumnowej chromatografii gazowej) oraz z zastosowaniem nisko- i
średnio- polarnego eluentu, nasyconego fazą stacjonarną, w celu zapobiegania jej
„zdzierania” na drodze rozpuszczania w eluencie. W podobny sposób uzyskiwano
podziałowe warunki układu faz odwróconych (gdy fazą stacjonarną była np. ciekła
parafina, czy BB’ oxo-di-propionitryl alifatyczny, albo n-oktanol, a fazą ruchomą
mieszanina metanol – woda nasycona odpowiednimi składnikami fazy stacjonarnej).
Takie postępowanie ma już tylko historyczne znaczenie, ponieważ sprawność tego typu
kolumn była bardzo niska (bardzo szerokie – silnie asymetryczne piki), chociaż tzw.
właściwa pojemność sorpcyjna dosyć wysoka. Warunki chromatografii podziałowej w
układach faz normalnych można także uzyskać na drodze generowania w sposób
dynamiczny ciekłej polarnej fazy stacjonarnej, z zastosowaniem sorbentów, szczególnie
żelu krzemionkowego, o typowych porach 6 – 10 nm i eluentu stanowiącego mieszaninę
cieczy nie polarnej (np. CH2Cl2), z niewielkim dodatkiem polarnego składnika
organicznego (np. CH3OH) oraz wody o zawartości bliskiej nasycenia (jednak nieco
niższej, aby nie dopuścić do wydzielenia się wody w przypadku zmniejszenia się
temperatury eluentu). Przykładem może być układ złożony z żelu krzemionkowego o
porach o przeciętnej średnicy 6 nm - jako „nośnika” i eluentu chlorek metylenu – metanol
– woda 94:6:0.5 v/v. W tych warunkach można rozdzielać glikozydy, czy alkaloidy,
uzyskując bardzo dobrą selektywność, a szczególnie wysoką właściwą pojemność
sorpcyjną i tylko w małym stopniu asymetryczne piki. Są to warunki chromatografii
podziałowej z dynamicznie generowaną, bogatą w wodę i metanol, a ubogą w CH2Cl2 –
fazą stacjonarną
2. Przeciwnym do powyższych, jest układ faz odwróconych ( RP), gdy faza stacjonarna jest
nie polarna a faza ruchoma polarna, złożona z wody i modyfikatora / modyfikatorów
organicznych. Retencja i rozdzielanie substancji w warunkach układu faz odwróconych
jest zależne od stopnia hydrofobowości molekuł, albo odpowiednich ich fragmentów.
Typowe fazy stacjonarne, to związane z żelem porowatym krzemionkowym
(dopuszczalny zakres pH eluentu od ok. 2,0 do 8.5), albo tlenkiem glinu, ditlenkiem
tytanu, albo ditlenkiem cyrkonu (zakres pH od 1.5 do ok. 10), a także z kopolimerem
styren – diwinylobenzen, grupy C18 (n-oktadecylowa), C8 (n-oktylowa), fenylowa (Ph).
Warunki faz odwróconych można uzyskać także, gdy grupą funkcyjną na powierzchni
sorbentu jest alkilonitryl (CN), cholesterol, cyklodekstryny i inne. Faza ruchomą stanowi
mieszanina wody, albo bardzo rozcieńczonego roztworu buforu z dodatkiem
organicznego modyfikatora, rozpuszczalnego w wodzie, takich, jak: metanol (MeOH),
acetonitryl (AcCN), Czterowodorofuran (THF), dioksan (D). Im wyższa zawartość
organicznego modyfikatora w eluencie (mniejsza zawartość wody, albo wodnego
roztworu buforu), tym eluent charakteryzuje się wyższą siłą elucyjną. W przypadku
rozdzielania organicznych kwasów i zasad bardzo ważne jest stosowanie takiego pH
eluentu, aby nastąpiło zjawisko cofania dysocjacji elektrolitycznej molekuł rozdzielanych
substancji, co powoduje wzrost ich ogólnej hydrofobowości i wzrost retencji.

2.1. Do tej grupy należy też zaliczyć tzw. chromatografię oddziaływań hydrofobowych
(HIC), gdy do rozdzielania wykorzystuje się hydrofobowe oddziaływania makromolekuł
z hydrofobową powierzchnią fazy stacjonarnej, w szczególny sposób wzmacniane przy
wysokich stężeniach soli w eluencie, tzn. gdy stężenie soli jest zbliżone do tzw. stężenia
wysalania.
2.2.Chromatografię par jonowych (IPC) – alternatywa dla chromatografii jonowymiennej
zalicza się do chromatografii w warunkach faz odwróconych. Wówczas, jonowe, albo
bardzo silnie polarne, fragmenty cząsteczek substancji rozdzielanych są „maskowane”
odpowiednim organicznym „przeciw-jonem” i powstają pary jonowe, które zachowują
się w układzie chromatograficznym (najczęściej w układzie faz odwróconych) podobnie
jak substancja neutralna. Warunki chromatografii par jonowych nie są już, jednak tak
jednoznaczne, jak warunki chromatografii w układach faz odwróconych i im tworzące
pary jonowe są „podatne” na dysocjacją elektrolityczną, w tym większym stopniu
warunki zbliżają się do chromatografii jonowymiennej.
2.3. Chromatografia wymiany ligandów może mieć miejsce w różnych układach faz, jednak,
najczęściej jest stosowana w układach faz odwróconych. Ligandy mające zdolność do
kompleksowania rozdzielanych substancji są dodawane do eluentu w bardzo niewielkim
stężeniu. Powinny mieć jednocześnie powinowactwo sorpcyjne do fazy stacjonarnej. Są
one wymieniane z ligandami kompleksującymi rozdzielane substancje, zawarte w próbce
wprowadzonej do kolumny i mającymi podobne powinowactwo do fazy stacjonarnej.
2.4. Chromatografia micelarna też jest stosowana tylko w układach faz odwróconych. Ma
miejsce, gdy w eluencie płynącym przez kolumnę są obecne micelle bogate w niektóre
składniki rozdzielanej próbki. Rozdzielaniu podlegają albo te że micelle, albo ma miejsce
wymiana składników analitu między powierzchnią micelli i powierzchnią fazy
stacjonarnej.
3. Jonowymienne układy chromatograficzne (zwane, w ich nowoczesnej realizacji –
jonowymi (IC)) mają miejsce, gdy rozdzielanie jest oparte na odwracalnej wymianie
jonów z fazą stacjonarną. Do tej grupy należy też zaliczać tzw. chromatografię
wykluczania jonowego (IEC), gdy mechanizm rozdzielania nie jest ściśle jonowymienny,
a spowodowany istnieniem tzw. membrany Donana.
4. Chromatografię wykluczania, zwaną do niedawna żelową, albo nieco dawniej
chromatografią wykluczania sterycznego (SEC, albo GPC), stosuje się do rozdzielania
substancji o różnej masie molowej (w zakresie do ok. 10 milionów Da), a w istocie o
różnych wymiarach tzw. średnicy, albo promienia hydrodynamicznego rozdzielanych
molekuł. Jest też wykorzystywana do przygotowania próbki w celu rozdzielania frakcji
składników nisko-molekularnych (np. wielopierścieniowych węglowodorów
aromatycznych, pestycydów w próbkach gleb, tłuszczów, węglowodorów
wysokowrzących od ogromnej ilości wyżej-molekularnych składników „matrycy”), a
także w warunkach hydrofilowych do odsalania białek i innych biomolekuł.
Wykorzystuje się mechanizm tzw. „sita molekularnego”, czy tzw. „wykluczania
sterycznego”, tzn. zróżnicowanie dróg penetracji porów wewnątrz-ziarnowych o różnych
średnicach przez cząsteczki o różnych wartościach średnicy hydrodynamicznej,
wykorzystując zróżnicowanie czasu ich dyfuzji wewnątrz porów wypełnienia i
eliminując, zjawiska sorpcji. W warunkach chromatografii wykluczania (żelowej)

zróżnicowanie energii sorpcji (adsorpcji, absorpcji, podziału), gdy ma dodatkowo
miejsce, może wpływać korzystnie, albo przeszkadzać rozdzielaniu.
5. Chromatografię powinowactwa (Affinity Chromatography) – stosuje się w biochemii i w
biotechnologii. Wykorzystuje się wysoce specyficzne oddziaływania (np. oddziaływanie
enzym – koenzym, czy wiązanie do powierzchni chityny itp.), albo innego typu specyficzne
oddziaływania między fazą stacjonarną a substancjami rozdzielanymi (np. tzw.
chromatografia „metalopowinowactwa” - oddziaływania Ni...S). Zjawiska powinowactwa
można też wykorzystywać bez kolumny, wykonując rozdzielenie (dokonując w istocie,
specyficznej sorpcji określonego składnika) w naczyniu laboratoryjnym, albo bezpośrednio w
bioreaktorze. Mimo nazwy - „chromatografia powinowactwa”, te techniki rozdzielania
należałoby zaliczać raczej do technik selektywnej adsorpcji, niż chromatografii.
Opis liczbowy układów chromatograficznych
Układy chromatograficzne można opisać liczbowo. Opis taki powinien być odrębny
dla chromatografii kolumnowej i dla chromatografii cienkowarstwowej. W przypadku
chromatografii kolumnowej dotyczy on, głównie:
A - parametrów fizycznych kolumny,
B – retencji i selektywności układu chromatograficznego,
C - sprawności układu chromatograficznego,
A – Główne fizyczne parametry kolumny to długość (L
c
) i średnica wypełnienia kolumny
(d
c
), liniowa (u) i objętościowa prędkość przepływu fazy ruchomej (w) oraz średnia wielkość
ziaren wypełnienia (d
p
). Niekiedy, podawany jest, dodatkowo, zakres wielkości ziaren
wypełnienia (najczęściej od 10% do 90% udziału masowego na krzywej rozkładu
granulometrycznego). Ważne znaczenie ma też średnia wielkość porów wypełnienia
kolumny, powierzchnia sorpcyjna, charakteryzowana w formie tzw. powierzchni właściwej
sorbentu. Parametrami kolumny są też: objętość martwa (V
0
) i związany z nią - czas martwy
kolumny (t
0
). Objętość martwa kolumny zależy od wymiarów wypełnienia kolumny oraz od
rodzaju i stopnia upakowania wypełnienia (tzn., od porowatości całkowitej, a stąd, od
porowatości między-ziarnowej i wewnątrz-ziarnowej wypełnienia kolumny - w przypadku
tzw. kolumn pakowanych oraz od porowatości makro- i mezo-porów oraz mikroporów - w
przypadku tzw. kolumn „monolitycznych), ale „w pierwszym przybliżeniu” nie zależy od
natężenia przepływu eluentu. Objętość martwą można uważać za sumę objętością cieczy,
która jest „uwięziona” (unieruchomiona w porach oraz tej, która znajduje się między ziarnami
wypełnienia). Analogicznym parametrem do objętości martwej kolumny jest czas martwy (t
0
),
który definiuje się jako czas od momentu wprowadzenia do kolumny substancji nie ulegającej
sorpcji, jednak wnikającej do wszystkich porów wewnątrz ziaren wypełnienia, do chwili
pojawienia się maksimum piku tej substancji na wylocie z kolumny. Czas martwy kolumny
zależy od objętości martwej kolumny i od objętościowej prędkości przepływu fazy ruchomej
(od natężenia przepływu fazy ruchomej (w)). Wzajemną zależność tych parametrów wyraża
równanie:
V
0
t
0
= ----
(1)
w
W przybliżeniu: V
0
= 0,6 d
c
2
.L
c
(2)

gdzie: L
c
- długość kolumny, d
c
- średnica wewnętrzna kolumny.
Równanie (2) jest słuszne, gdy całkowita porowatość wypełnienia wynosi około 0.76, tzn.
mamy do czynienia ze stosunkowo zwartym wypełnieniem kolumny upakowanej techniką
zawiesinową na mokro.
Wyznaczenie objętości martwej kolumny nie jest wcale proste. Dane literaturowe
wskazują, że różnice oznaczonych eksperymentalnie wartości, sięgającą +/-20 % i otrzymana
wartość zależy od warunków wyznaczania tego ważnego parametru kolumny, a przy bardzo
dokładnej obserwacji, także od natężenia przepływu eluentu.
Najczęściej czas martwy (objętość martwą kolumny) w układach faz normalnych
(NP), wyznacza się, stosując skwalan, albo fluoroalkany, jako substancję wzorcową, a fazą
ruchomą jest rozpuszczalnik o średniej sile elucyjnej np. octan etylu. W układach faz
odwróconych stosuje się często uracil lub D
2
O lub stężony roztwór azotanu potasu (detekcję
przy długości fali λ=205-280 nm), jako substancję testową, a fazą ruchomą może być metanol
albo acetonitryl.
B – Retencja i selektywność układu chromatograficznego dotyczy łącznie - kolumny
(sorbentu) i fazy ruchomej (eluentu). Retencja eluowanych substancji jest często opisywana
wartością czasu retencji piku na chromatografie (tr), tzn. liczoną w jednostkach czasu
odległością maksimum piku od punktu dozowania. Czas retencji ma sens termodynamiczny,
tylko pod warunkiem stałej wartości natężenia przepływu eluentu (u=const). Bardziej zgodne
z zasadami termodynamiki jest określanie objętości retencji (Vr). Najlepszą miarą retencji
określonej substancji w określonym układzie chromatograficznym jest współczynnik retencji
(k)
Selektywność układu chromatograficznego dotyczy określonych dwóch substancji
rozdzielanych w określonym układzie chromatograficznym. Można ją opisać odległością
między maksimum pików. Odległość między poszczególnymi maksimami pasm
stężeniowych składników mieszaniny daje pogląd o oddziaływaniach tych substancji z fazą
stacjonarną i fazą ruchomą. Selektywność układu chromatograficznego jest miarą
oddziaływań międzycząsteczkowych i jest przede wszystkim zależna od budowy chemicznej
składników rozdzielanej mieszaniny, charakterystyki powierzchni sorpcyjnej i charakteru
oddziaływań międzyfazowych i międzycząsteczkowych w układzie chromatograficznym.
Miarą selektywności jest współczynnik rozdzielenia (α) wyrażający stosunek wartości
współczynników retencji (k) substancji stanowiących najczęściej sąsiednie piki
chromatograficzne.
Wyrażanie retencji i kolejno, selektywności za pomocą objętości, a szczególnie, za
pomocą czasu retencji, utrudnia porównanie poszczególnych układów chromatograficznych
(różne wymiary kolumny, różna prędkość przepływu fazy ruchomej powoduje uzyskanie
różnych wartości czasu, a także objętości retencji). Obiektywnym parametrem pozwalającym
porównać selektywność różnych układów chromatograficznych jest bezwymiarowy
współczynnik retencji k, który wiąże parametry retencji i parametry fazy stacjonarnej
kolumny.
k = K ( V
s
/ V
m
) = C
s
V
s
/ C
m
V
m
( 3 )
gdzie: K – stała podziału (jak w równaniu Nernsta), V
s
- objętość fazy stacjonarnej, V
m
-
objętość fazy ruchomej, C
m
- stężenie substancji w fazie ruchomej, C
s
- stężenie substancji w
fazie stacjonarnej.

Należy pamiętać, że nie jest to proste przeniesienie równania Nernsta, gdzie założono,
że stosunek objętości fazy organicznej do objętości fazy nieorganicznej jest bliski 1:1.
W praktyce współczynnik retencji k wyznacza się z chromatogramu korzystając z poniższej
zależności (4), zwanej równaniem elucji.
V
R
= V
0
( 1 + k ) lub dla u=const: t
R
= t
0
( 1 + k )
(4)
gdzie: V
R
– objętośc retencji określonej substancji, pozostałe zmienne j.w.
Parametrem,
opisującym selektywność kolumny jest
α, tzn. - współczynnik
rozdzielenia (nazywany dawniej, współczynnikiem selektywności, bądź retencją względną):
α = k
2
/ k
1
(5)
przy czym, cyfra „2” oznacza pik substancji później eluowanej, a cyfra „1” – eluowanej
wcześniej
C – sprawność układu chromatograficznego jest wyrażana liczbą półek teoretycznych (N)
bądź tzw. wartością wysokości równoważnej półce teoretycznej, potocznie: „wysokości
półki teoretycznej” (H). Poglądowo wysokość półki teoretycznej można zdefiniować jako
teoretyczną wysokość wypełnienia kolumny, w zakresie której, ustala się stan równowagi
stężenia substancji w fazie stacjonarnej i w fazie ruchomej. W praktyce, ze względu na
określoną dynamikę rozdzielania, do stanu równowagi nigdy nie dochodzi.
W publikacjach i podręcznikach można znaleźć szereg teorii i zależności, wg których
można teoretycznie określić sprawność kolumny chromatograficznej, uwzględniając wielkość
ziaren, strukturę wypełnienia, kinetykę dyfuzji, opory przenoszenia masy, prędkość i profil
przepływu cieczy, kinetykę zjawisk sorpcji – desorpcji itp. W praktyce, dla pików o kształcie
bardzo zbliżonym do krzywej Gaussa, liczbę półek teoretycznych można łatwo obliczyć na
podstawie chromatogramu, korzystając z zależności (6):
N
=
5.545
(l
R
/w
1/2
)
2
(6)
gdzie: l
R
, - odległość maksimum piku od punktu dozowania (obliczona na podstawie
chromatogramu); w
1./2
– szerokość piku w połowie wysokości. Obliczenia wykonane na
podstawie chromatogramu z zastosowaniem zależności (6) oraz innych, uwzględniających
szerokość pików i ich odległość od punktu dozowania, są teoretycznie poprawne, tylko wtedy,
gdy kształtu piku jest gaussowski. Otrzymana wartość (N) jest różna dla substancji o różnych
współczynnikach retencji. Na ogół przyjmuje się, że dopuszczalne są różnice o około 15%.
Większe różnice są spowodowane nadmiernym wpływem tzw. „poza-kolumnowych efektów
rozmycia stref substancji”, nieregularnym profilem przepływu cieczy w kolumnie, albo
wyraźnie nieliniowymi zjawiskami sorpcji w kolumnie.
W przypadku pików niesymetrycznych, do obliczania sprawności kolumny stosuje się
równanie Dorsey-Foley’a, wyrażone zależnością (7)
41,7 ( l
R
/w
0,1
)
2
N = ----------------- (7)
(B/A)
+
1,25

gdzie: w
0,1
– szerokość piku na wysokości 10 % powyżej podstawy (linii bazowej) piku, B/A
- stosunek szerokości prawej / lewej (zstępującej do wstępującej) strony piku, wyznaczony na
poziomie 10% wysokości piku, inaczej współczynnik asymetrii (As
0.1
). W praktyce pik uważa
się za symetryczny, gdy współczynnik As
0.1
ma wartość 0.95 do 1.1.
Ocenę sprawności i selektywności kolumny dokonuje się najczęściej z zastosowaniem
systemu komputerowego. Kupując kolumnę otrzymuje się certyfikat jakości kolumny, w
którym m. in. podane są liczby półek teoretycznych, wyznaczone dla kilku substancji
mieszaniny testowej.
Końcowy efekt procesu chromatograficznego jest opisany rozdzielczością pików (R)
(dawniej nazywaną stopniem, albo współczynnikiem rozdzielenia (Rs) - dwóch sąsiadujących
na chromatogramie, substancji „i+1” oraz „i”. R można obliczyć na podstawie
chromatogramu mierząc w tych samych jednostkach odległość między maksimami pików
oraz szerokości pików przy podstawie. W przypadku pików nie rozdzielonych do linii
podstawy należy mierzyć szerokości połówkowe pików przy podstawie, odpowiednio: po
stronie wstępującej piku poprzedniego i po stronie zstępującej piku następnego oraz obliczyć
wartość R (Rs)wyrażoną równaniem (8):
R = (tr
(i+1)
- tr
(i)
) / ½ (S
(i+1)
+ S
(i)
) = 2 (tr
(i+1)
- tr
(i)
) / (S
(i+1)
+ S
(i)
) (8)
Podstawowe znaczenie w chromatografii ma równanie (9), które uzależnia stopień
rozdzielenia substancji od sprawności i selektywności układu chromatograficznego i
umożliwia sformułowanie ważnych wniosków dotyczących optymalizacji warunków
rozdzielania substancji z zastosowaniem eluentu o stałym składzie (warunki izokratyczne), a
także umożliwia ich „pół-ilościowe” uogólnienie dla warunków elucji gradientowej:
√ N α - 1 k
2
R
s
= ----- ------- -------- ( 9 )
4 α 1 + k
2
gdzie: k
2
- współczynniki retencji substancji później eluowanej (charakteryzuje retencję),
N – liczba półek teoretycznych kolumny (charakteryzuje sprawność kolumny),.
α - współczynnik rozdzielenia (charakteryzuje selektywność układu
chromatograficznego)
Każdy z czynników równania (8) jest niezależny od drugiego. Istotne jest
stwierdzenie, że im wyższa sprawność kolumny, tym niższa jest wymagana selektywność
układu, natomiast, warunkiem koniecznym uzyskania rozdzielenia jest α > 1.0. Im wartość α
jest bliższa 1.0, tym nieproporcjonalnie wyższa musi być sprawność kolumny. Jednocześnie z
równania (8) widać, że nie jest celowe zwiększanie współczynnika podziału powyżej wartości
k = ok. 10. W przeciwnym razie wzrasta czas rozdzielania, spada granica oznaczalności, z
powodu spadku wysokości pików, a praktycznie nie wzrasta już rozdzielczość pików
substancji (np. dla k=10, ostatni czynnik w równaniu (8) wynosi 10/11, a dla k=20 to 20/21,
co praktycznie nie różni się od 10/11).
Przyjmuje się, że w celu wykonywania oznaczeń ilościowych rozdzielczość pików R
może mieć wartość ok. 0,9 do 1,0. Zwiększanie R ponad wartość 1 jest działaniem

nieefektywnym w warunkach chromatografii analitycznej, ponieważ prowadzi do zwiększania
czasu rozdzielania, nie wpływając, praktycznie, na dokładność wyników oznaczania.
Niektóre inne, powszechnie stosowane w chromatografii, określenia to
Pojemność względem pików – określa liczbą substancji, które mogą być rozdzielone w danej
kolumnie (w warunkach elucji izokratycznej). Każda kolumna chromatograficzna ma
określoną długość i określoną sprawność, a więc w zakresie k=0 do k=10, jest w stanie
„pomieścić” określoną liczbę rozdzielanych substancji. Im mniej rozmyte pasma stężeniowe
(większa sprawność kolumny), tym większa pojemność względem pików.
Impedancja separacji (E) – parametr charakteryzujący ciśnienie konieczne dla uzyskania
jednej półki teoretycznej w kolumnie w jednostce czasu, a więc opisujący przepuszczalność
kolumny w odniesieniu do tzw. efektywnej sprawności kolumny. Szczególnie korzystnymi,
bardzo niskimi wartościami impedancji separacji charakteryzują się, wprowadzone niedawno,
tzw. kolumny monolityczne, które nie są wypełnione ziarnistym sorbentem, ale wypełnienie
stanowi otrzymany syntetycznie „monolityczny” sorbent, tzn., warstwa wypełnienia,
porowata w całej objętości kolumny, złożona z tzw. makro-porów, mezo-porów i mikro-
porów. Te ostatnie decydują o powierzchni sorpcyjnej monolitycznego wypełnienia kolumny,
natomiast w przestrzeni makro – porów i mezoporów przepływa eluent, przenoszący
cząsteczki rozdzielanych substancji. Impedancja rozdzielania jest ważnym parametrem
opisującym efektywność kolumny chromatograficznej, wyrażona jest ona zależnością (9):
t
o
ΔP
E = -----------
(9)
N
2
η
Porowatość między-ziarnowa wypełnienia – udział objętości przestrzeni między ziarnami
fazy stacjonarnej w kolumnie w całej objętości wypełnienia kolumny. W przypadku kolumny
monolitycznej, funkcję przestrzeni między-ziarnowej pełni objętość makro – porów i mezo –
porów.
Porowatość wewnątrz-ziarnowa wypełnienia– udział objętości dostępnej dla cząsteczek
eluentu i analitu wewnątrz ziaren wypełnienia kolumny (a w przypadku kolumny
monolitycznej łącznej objętości mikro – porów), odniesiony do łącznej objętości ziaren.
Ziarna fazy stacjonarnej mogą być całkowicie porowate lub tylko porowate w warstwie
powierzchniowej. Pory wewnątrz ziarna maja różne średnice, długości, są dwustronnie lub
jednostronnie otwarte.
Porowatość całkowita wypełnienia – łączny udział objętości między-ziarnowej i wewnątrz-
ziarnowej, odniesiony do objętości wypełnienia kolumny.
Podstawowe parametry i wymagania wobec fazy stacjonarnej i eluentu. najważniejsze
zasady postępowania warunkujące efektywne stosowanie chromatografii cieczowej
- Warto zwrócić uwagę, że w warunkach chromatografii cieczowej hydrodynamiczny
przepływ eluentu ma miejsce tylko w przestrzeni między-ziarnowej (a w przypadku tzw.
kolumn monolitycznych – tylko w przestrzeni makroporów i w bardzo niewielkim stopniu

także w przestrzeni mezoporów). Natomiast w przestrzeni wewnątrz-ziarnowej, która pod
względem powierzchni sorpcyjnej zdecydowanie dominuje, migracja molekuł odbywa się
tylko na drodze dyfuzji molekularnej. Jednocześnie, główną przyczyną wymiany masy jest
zawsze różnica stężeń (różnica potencjałów termodynamicznych) między określonymi
punktami w przestrzeni kolumny oraz na powierzchni fazy stacjonarnej.
Parametry charakteryzujące fazę stacjonarną (sorbent)
Najważniejsze, to:
- Właściwości powierzchni sorpcyjnej, tzn., rodzaj grup funkcyjnych oraz rodzaj i zawartość
zanieczyszczeń (np. jonów metali) oraz centrów o szczególnie wysokiej energii na
powierzchni sorpcyjnej;
- Powierzchnia właściwa sorbentu wyznaczana najczęściej metodą BET (ilość adsorbowanego
azotu). Np., żel krzemionkowy o wielkości porów 60 A, może mieć powierzchnię właściwą
nawet do 750 m
2
/g. Wysoka wartość powierzchni właściwej jest często pożądaną cechą
sorbentu (czasem może być niekorzystna);
- Stopień obsadzenia powierzchni sorpcyjnej grupami aktywnymi, tzn., grupami funkcyjnymi,
biorącymi udział w oddziaływaniach sorpcyjnych, wyrażony w mMol/g, albo w % (np. węgla
alifatycznego typu C18). Wysoka wartość stopnia obsadzenia powierzchni sorpcyjnej jest
pożądaną cechą sorbentu (niekiedy, może być niekorzystna);
Im większa powierzchnia sorpcyjna, a także im większy stopień obsadzenia grupami
funkcyjnymi tej powierzchni, tym większa retencja, a także większa pojemność sorpcyjna, a
więc lepsza przydatność sorbentu dla preparatywnego wykorzystania kolumny i najczęściej,
także do zastosowań analitycznych. Niekiedy, jednak, sorbenty o bardzo wysokiej wartości
powierzchni właściwej i o wysokim stopniu obsadzenia grupami aktywnymi na jednostkę
powierzchni, charakteryzują się nieliniowością izotermy sorpcji i piki chromatograficzne,
szczególnie substancji wykazujących wyższą retencję, są poszerzone i asymetryczne po stronie
zstępującej. W warunkach chromatografii analitycznej są to niepożądane cechy. Pożądane są,
więc, optymalne wartości w/w parametrów sorbentu, stosowanego jako wypełnienie kolumny.
- Wielkość porów (w istocie, chodzi o średnią wielkość i zakres wielkości porów). Średnie
wielkości porów sorbentów do HPLC mogą wynosić 50, 60, 80, 100, 120, 150, 200, 250, 300,
500, 1000, 2500, 5000, aż do 10 000 A (1A = 0.1nm). Wielkość porów powinna być
dostosowana do wielkości cząsteczek rozdzielanych substancji, tak, aby mogły one wnikać
wewnątrz porów i wykorzystywać powierzchnię sorpcyjną do rozdzielania. Szczególne, pod
tym względem wymagania, dotyczą chromatografii żelowej. Trzeba mieć świadomośc, że im
większe pory wypełnienia kolumny, tym mniejsza powierzchnia właściwa sorbentu (a, więc,
tym mniejsza retencja) oraz tym mniejsza odporność mechaniczna wypełnienia na
mechaniczne oddziaływanie ciśnienia. Kolumny o wysokich wartościach wielkości porów
mogą być wykorzystywane tylko przy ograniczonych ciśnieniach ! Jednocześnie, jednak, im
większe molekuły, albo cząstki podlegają rozdzielaniu, tym niższe są wartości ich
współczynników dyfuzji w eluencie, i tym niższe optymalne wartości prędkości przepływu
eluentu w kolumnie. W konsekwencji rozdzielanie substancji makromolekularnych wiąże się
szybkim spadkiem sprawności rozdzielania ze wzrostem prędkości przepływu eluentu.
Wówczas jest też szczególnie celowe podwyższanie temperatury podczas rozdzielnia (jeżeli
makromolekuły są odporne na podwyższoną temperaturę).

- Średnia wielkość ziaren wypełnienia i rozkład wielkości ziaren. Im mniejsza wielkość ziaren
wypełnienia kolumny i niewielka szerokość frakcji ziarnowej, tym sprawniejsza jest
poprawnie wypełniona kolumna. Typowa wartość wielkości ziaren wypełnień analitycznych
kolumn HPLC wynosi 5 mikrometrów. Stosowane są też kolumny wypełnione sorbentami o
wielkości ziaren 7, 10, albo 3 mikrometry. W zastosowaniu dla proteomiki wykorzystuje się
nawet wypełnienia o wielkości ziaren 1 mikrometr. Szczególnie niekorzystny jest nawet
niewielki udział procentowy ziaren bardzo małych (dużo mniejszych od średniej wielkości
ziaren wypełnienia kolumny). Powoduje znaczny wzrost oporów przepływu cieczy, obniżając
jednocześnie sprawność kolumny.
- Znaczenie praktyczne może mieć też kształt ziaren, gęstość materiału wypełnienia kolumny
i jego podatność na elektryzowanie, zwilżalność, gęstość materiału wypełnienia. Ziarna
kuliste dają wypełnienie o nieco lepszej sprawności niż ziarna nieregularne o tej samej
średniej wielkości. Te właściwości materiału wypełnienia mają przede wszystkim znaczenie
dla doboru warunków wypełniania kolumny. Niektóre mogą mieć znaczenie dla
wykonywania przeliczeń, np. w celu powiększania skali rozdzielania.
Temperatura rozdzielania w chromatografii cieczowej, wymagania wobec eluentu i
składników eluentu
W warunkach chromatografii elucyjnej w warunkach RP, NP, itd., z wyjątkiem
chromatografii wykluczania, najczęściej retencja substancji spada ze wzrostem temperatury, a
także pogarsza się selektywność rozdzielania. Wzrasta, natomiast sprawność układu. W
konsekwencji, niekiedy jest celowe dobranie optymalnej temperatury rozdzielania.
Eluent powinien być komponowany przede wszystkim z tych składników, które
zapewniają wystarczającą selektywność układu chromatograficznego. Powinno się też przy
wyborze eluentu uwzględniać też następujące, inne przesłanki:
- Składniki eluentu muszą być wzajemnie mieszalne. Nie mogą chemicznie reagować ani
wzajemnie z sobą, ani z fazą stacjonarną, ani z substancjami rozdzielanymi, wyłączając
tworzenie par jonowych i inne zamierzone działania, wpływające na selektywność
rozdzielania. Nie powinny też reagować z tymi materiałami konstrukcji aparatu
chromatograficznego, które mają kontakt z eluentem.
- Eluent powinien charakteryzować się możliwie niską lepkością, co wpływa na obniżenie
ciśnienia pracy aparatu i zwiększenie okresu miedzy-naprawczego pompy oraz umożliwia
stosowanie dłuższej kolumny, albo wypełnienia o mniejszych ziarnach. Jest też korzystne dla
uzyskania wysokiej sprawności rozdzielania. Ze wzrostem lepkości eluentu, spadają też
wartości współczynników dyfuzji, a stąd pogarsza się kinetyka wymiany masy w kolumnie i
sprawność rozdzielania.
- Szczególnie w warunkach preparatywnego wykorzystania chromatografii cieczowej, ale
także w przypadku stosowania niektórych rodzajów detektorów (np. MS, albo LLSD, LC-
FID), ważne znaczenie ma niskie ciepło parowania eluentu, niska temperatura wrzenia i
nieobecność nielotnych substancji.
- W przypadku wykorzystywania detektorów spektrofotometrycznych eluent nie powinien
absorbować światła w tych zakresach długości fali, które będą wykorzystywane do detekcji.

Dotyczy to też innych cech eluentu, które mogą przeszkadzać w przypadku stosowania innego
typu detektorów, np. niskiego przewodnictwa eluentu, w przypadku detektora
konduktometrycznego, wysokiego potencjału red-ox składników eluentu w przypadku
detektora elektrochemicznego.
- Do eluentu dodaje się często różne dodatki, nierzadko w bardzo niskich stężeniach, aby w
ten sposób zapewnić: tworzenie par jonowych, cofnięcie dysocjacji rozdzielanych substancji,
redukcję „zdzierania” fazy stacjonarnej z kolumny, kompleksowanie jonów metali, które
mogłyby bez tego wchodzić w reakcję ze składnikami analitu, obniżyć ryzyko denaturacji
biopolimerów, albo sprzyjać ich renaturacji, czy też, umożliwić stosowanie tzw. odwróconej
detekcji, albo do innych - rzadziej wykorzystywanych - celów.
- W ostatnich latach zaczyna być wprowadzana tzw. chromatografia „podkrytyczna” w
układach faz odwróconych, z zastosowaniem, jako eluentu - wody pod wysokim ciśnieniem i
w wysokiej temperaturze, ponieważ odkryto, że woda wykazuje tym silniejsze właściwości
lipofilowe im jej temperatura bardziej jest zbliżona do temperatury krytycznej. Umożliwia to
rozdzielanie nisko-molekularnych organicznych analitów bardzo trwałych termicznie, z
wykorzystaniem warunków układu faz odwróconych i detektora płomieniowo jonizacyjnego
do chromatografii gazowej (GC-FID). Należy jednak mieć świadomość, że warunki
chromatografii podkrytycznej są niezwykle niebezpieczne i zachowywać szczególną
ostrożność w stosowaniu tego typu chromatografii.
Inne zasady, mające znaczenie dla efektywnego stosowania chromatografii cieczowej
- Nie powinno się dopuszczać do wyschnięcia kolumny. Może wówczas nastąpić „pęknięcie”
wypełnienia nawet dobrze upakowanej kolumny (tak, jak pęka powierzchnia wysuszonego
mułu), co zdecydowanie pogarsza sprawność rozdzielania i bez ponownego napełnienia
kolumny problemu, najczęściej, nie daje się usunąć.
- Kolumny nie powinno się poddawać mechanicznym udarom, ani w sposób gwałtowny
obniżać ciśnienia eluentu. W przeciwnym razie może nastąpić osiadanie wypełnienia
kolumny, pogorszenie profilu przepływu cieczy i obniżenie sprawności rozdzielania.
- Próbka zawierająca zanieczyszczenia mechaniczne powinna przed dozowaniem do kolumny
zostać przefiltrowana przez „inertny” filtr membranowy (np. 0.45 mikrometra). Nie powinna
też ona zawierać substancji trwale sorbowanych na powierzchni wypełnienia kolumny.
Stosowanie tzw. „kolumn ochronnych - prekolumn” w celu przeciwdziałania skutkom tego
typu zanieczyszczeń jest dość mało skuteczne. Gdy próbka zawiera zanieczyszczenia
mechaniczne kolumny ochronne trzeba bardzo często wymieniać. Gdy zawiera
zanieczyszczenia trwale sorbowane na wypełnieniu - nie wiadomo, w którym momencie
pojemność powierzchni sorpcyjnej kolumny ochronnej została przekroczona (kolumna
ochronna została „przebita”) i następuje już „uszkadzanie” powierzchni sorpcyjnej właściwej
kolumny rozdzielczej. Obecność substancji trwale sorbowanych powoduje najczęściej
systematyczny spadek retencji oznaczanych składników próbki (czasem wzrost retencji
niektórych substancji), tym szybszy, im zawartość zanieczyszczeń w próbce jest wyższa.
- Najkorzystniejszym rozpuszczalnikiem substancji dozowanych do kolumny HPLC jest
eluent, albo ciecz o składzie odpowiadającym początkowemu składowi eluentu w warunkach
elucji gradientowej. Stosowanie rozpuszczalnika o mniejszej sile elucyjnej, jest korzystne w
warunkach analizy śladowej. Dozuje się wtedy dużą objętość próbki i wykorzystuje efekt

zwężenia pasma analitu na wlocie do kolumny. Dozowanie próbki rozpuszczonej w cieczy o
wyższej sile elucyjnej od eluentu jest niekorzystne, szczególnie, gdy objętość dozowanej
próbki jest względnie wysoka. Powoduje to zmniejszenie retencji, rozdzielanych substancji,
szczególnie tych, które są słabo sorbowane oraz inne problemy. Stosowanie cieczy o znacznie
wyższej sile elucyjnej od eluentu w roli rozpuszczalnika próbki, jest uzasadnione tylko
wówczas, gdy analizowane substancje nie rozpuszczają się w eluencie. Należy, jednak,
dozować jak najmniejszą objętość jak najbardziej rozcieńczonej próbki.
- Należy przestrzegać zaleceń producenta kolumny, zarówno, co do granicznych wartości pH
eluentu, jaki i co do składników eluentu, których nie należy stosować w przypadku
określonego typu wypełnienia kolumny. W przeciwnym razie można trwale uszkodzić
kolumnę (np. spowodować hydrolizę chemicznie związanej fazy stacjonarnej i jej „zdjęcie” z
powierzchni „nośnika”, albo np. trwałe skurczenie się ziaren wypełnienia, albo trwałe ich
spęcznienie, czy też rozpuszczenie w eluencie). Najczęściej w takich przypadkach kolumna
jest już nieprzydatna i konieczna jest jej wymiana na nową.
Document Outline
- Niektóre inne, powszechnie stosowane w chromatografii, określenia to
- Pojemność względem pików – określa liczbą substancji, które mogą być rozdzielone w danej kolumnie (w warunkach elucji izokratycznej). Każda kolumna chromatograficzna ma określoną długość i określoną sprawność, a więc w zakresie k=0 do k=10, jest w stanie „pomieścić” określoną liczbę rozdzielanych substancji. Im mniej rozmyte pasma stężeniowe (większa sprawność kolumny), tym większa pojemność względem pików.
- Porowatość między-ziarnowa wypełnienia – udział objętości przestrzeni między ziarnami fazy stacjonarnej w kolumnie w całej objętości wypełnienia kolumny. W przypadku kolumny monolitycznej, funkcję przestrzeni między-ziarnowej pełni objętość makro – porów i mezo – porów.
Wyszukiwarka
Podobne podstrony:
MK Chromatogram UV DAD Chlorofile Cerotenoidy
Podstawy chromatografii preparatywnej kurs W1
Podstawy chromatografii preparatywnej kurs W2
sciezki mk, Teoretyczne podstawy kształcenia
Montaż zimnej katody jako podświetlania zegarów w VW (na podstawie Golfa MK II), MOTORYZACJA, elektr
chromatografia cienkowarstwowa TLC, podstawy chemii organicznej
Podstawy teoretyczne chromatografii cieczowej, aparatura (2) ppt
Podstawy chromatografii Z Witkiewicz
Podstawy chromatografii Z Witkiewicz
chromatografia TLC podstawy
MK Chromatogram UV DAD Chlorofile Cerotenoidy
Podstawowe zasady udzielania pomocy przedlekarskiej rany i krwotoki
Farmakologia pokazy, Podstawy Farmakologii Ogólnej (W1)
więcej podobnych podstron