ĆWICZENIE 2 – WYKRYWANIE GRUP FUNKCYJNYCH
I.
GRUPA FENOLOWA
Właściwości związków fenolowych:
§
rozpuszczalność:
§
fenole jednowodorotlenowe łatwo rozpuszczają się w alkoholu i eterze
§
fenole wielowodorotlenowe łatwo rozpuszcza się w wodzie (większa ilość grup
hydroksylowych zwiększa hydrofilowość danego związku)
§
fenole nie rozpuszczają się w roztworach kwaśnych węglanów (wyjątki: kwas pikrynowy,
trójbromofenol, 2,4-dwunitrofenol)
§
posiadają kwaśny charakter:
§
rozpuszczalne w roztworach wodorotlenków
§
tworzą fenolany rozpuszczalne w wodzie
§
dwutlenek węgla rozkłada fenolany: wydziela się wolny fenol i tworzy węglan sodowy
(odróżnienie fenolu od kwasu)
§
różnice w rozpuszczalności fenolu i kwasu salicylowego:
§
w zasadowym środowisku wobec węglanu sodowego tworzy się salicylan sodowy i wolny
fenol – po wykłóceniu roztworu wodnego eterem fenol przejdzie do eteru, natomiast w
wodnym roztworze pozostanie salicylan sodowy
§
po zakwaszeniu roztworu wodnego kwasem solnym wydzieli się kwas salicylowy, który po
wykłóceniu eterem przejdzie do rozpuszczalnika organicznego
§
kwas salicylowy jest silniejszym kwasem – dwutlenek węgla nie rozkłada jego soli w
przeciwieństwie do fenolu
§
rozróżnienie fenolu i kwasu salicylowego:
§
różnice w rozpuszczalności
§
kwas salicylowy jest silniejszym kwasem – dwutlenek węgla nie rozkłada jego soli w
przeciwieństwie do fenolu
§
po odparowaniu eteru można stwierdzić obecność kwasu salicylowego i fenolu za pomocą
chlorku żelazawego
§
w lecznictwie stosowane są związki fenolowe o bardzo zróżnicowanej budowie
§
przykłady związków fenolowych:
pirokatechina rezorcyna hydrochinon pirogalol oksyhydrochinon floroglucyna
Reakcje charakterystyczne dla grupy fenolowej:
Próba
Podstawa chemiczna
Warianty
oznaczenia
Wykonanie
Efekt
Powstawanie
fenolanów
żelazowych
Związki fenolowe w reakcji
jonami żelazowymi tworzą
związki kompleksowe o
różnym zabarwieniu w
zależności od pH i
zastosowanego fenolu
Kwas
salicylowy
Ok.0,5g substancji wytrząsać z
5ml wody i przesączyć. Do
przesączu dodać 10ml wody oraz
niewielką ilość
świeżo
przygotowanego 1% r-ru chlorku
żelazowego
Powstaje fioletowe zabarwienie
od tworzącego się kompleksu
chelatowego (ugrupowanie
fenolowe i karboksylowe kwasy
salicylowego)
Salicylan
sodu
Niewielką ilość substancji
rozpuścić w wodzie, dodać
roztwór chlorku żelazowego
Powstaje fioletowe zabarwienie
Rezorcyna
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
OH
O
H
OH
Sprzęganie z
solami
dwuazoniowymi
Fenole ulegają reakcji
sprzęgana z solami
dwuazoniowymi. Reakcja
zachodzi w środowisku
słabo zasadowym
Do oziębionego roztworu
substancji w 15%NaOH dodać
taką samą objętość zimnego
roztworu soli dwuazoniowej.
Wkraplać przy jednoczesnym
wytrząsaniu do uzyskania
niebieskiej barwy papierka
jodoskrobiowego
W zależności od badanego
związku powstaje osad żółty,
pomarańczowy lub czerwony,
często z odcieniem brunatnym
lub fioletowym
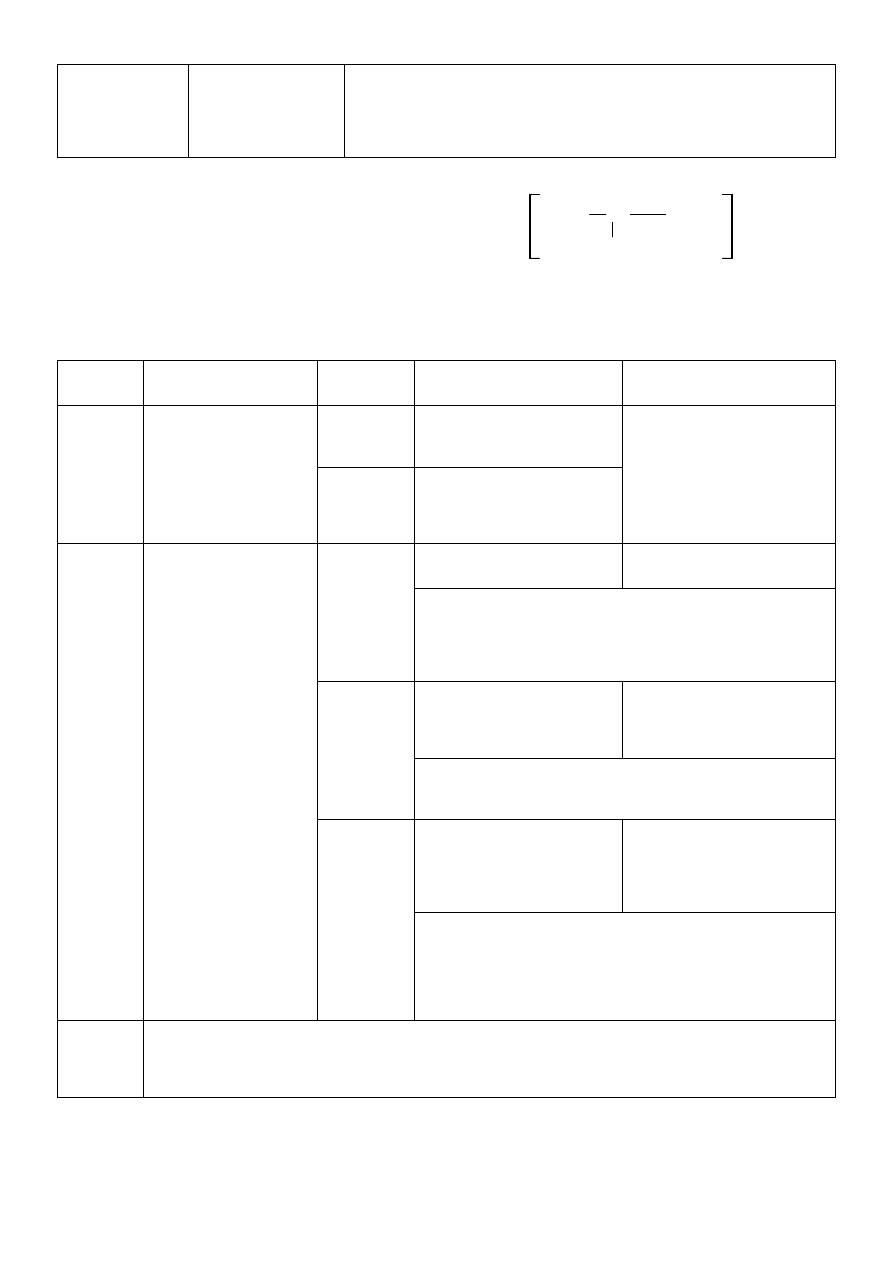
Sprzęganie fenoli z solami diazoniowymi:
Sprzęganie soli dwuazoniowych z fenolami zachodzi w środowisku słabo zasadowym. W tym celu I-rzędową aminę
aromatyczną przeprowadza się w odpowiedni chlorek arylodwuazoniowy za pomocą kwasu azotowego (III) w
środowisku kwaśnym, a następnie sprzęga z wybranym fenolem w środowisku alkalicznym.
Fenole jako słabe kwasy występują w środowisku zasadowym jako aniony, przy czym jony fenolanowi wykazują
większą aktywność w reakcji sprzęgania z chlorkiem arylodwuazoniowym niż wolne fenole. Sprzęganie najlepiej
zachodzi w położeniu C4. Obecność w tej pozycji grup karboksylowej lub sulfonowej nie przeszkadza, gdyż na skutek
ataku jonu dwuazoniowego zostają one wyeliminowane. Przy trwałym podstawieniu wodorów w pozycji C4
pierścienia aromatycznego (grupy alkilowe, amonowe, amidowe) sprzęganie zachodzi w pozycji C2
Nitrozowanie
W środowisku kwaśnym
dochodzi do podstawienia
w pozycji para- lub orto-
związku fenolowego grupą
nitrozową
Podstawienie
w pozycji
para-
Otrzymaną substancję zmieszać z
kilkoma kryształkami azotanu
(III) sodu oraz kilkoma kroplami
stężonego kwasu siarkowego
(VI) – podstawienie zachodzi w
bezwodnym środowisku kwasy
nitrozylosiarkowego
Reakcja Libermanna:
Nadmiar fenolu ulega kondensacji
z utworzoną pochodną p-
nitrozową, dając zieloną barwę
indofenolu
Reakcja chemiczna:
Podstawienie
w pozycji
orto-
Do substancji dodać niewielką
ilość odczynnika: w równych
objętościach zmieszane
2%
NaNO
2
i 10% HgSO
4
w 30%
H
2
SO
4
Podstawienie w obecności jonów
rtęciowych zachodzi w pozycji
orto- co objawia się pojawieniem
czerwonej barwy
Reakcja chemiczna:
Reakcje z
aldehydami
W środowisku stężonego
kwasu siarkowego (VI)
fenole ulegają kondensacji
z aldehydami
Do oznaczanej substancji dodać
odczynnik Marquisa (1 kropla
30% r-ru formaldehydu w 2ml
stęż.H
2
SO
4
). Można również
podwarstwić roztwór wodny
substancji obserwując barwę
utworzoną na granicy warstw
Pod wpływem kwasu siarkowego
(VI( powstaje fioletowy lub
czerwony rodnik
Reakcja chemiczna:
Reakcja fenoli z aldehydami:
Reakcja fenoli z odczynnikiem Marquisa jest szczególnie przydatna do identyfikacji grupy monofenolowej lub
eterowej łatwo rozszczepialnej do fenolowej.
W pierwszym etapie reakcji następuje addycja fenolu do czynnej pozycja para (w przypadku jej podstawienia –
pozycja orto) do grupy karbonylowej formaldehydu. Powstający odpowiedni alkohol o- lub p-hydroksybenzylowy
ulega kondensacji z drugą cząsteczką fenolu do pochodnej 4,4’-dihydroksydifenylometanu. Pod wpływem
utleniającego działania stężonego kwasu siarkowego tworzy się fioletowy lub czerwony rodnik.
Reakcję tę wykorzystuje się również do identyfikacji związków, które ogrzewane z 50% kwasem siarkowym
wydzielają formaldehyd, reagujący z dodanym związkiem fenolowym.
Reakcja z odczynnikiem Marquisa jest ujemna dla estrów kwasów: 4-hydroksybenzoesowego, 4-aminosalicylowego
oraz salicylamidu
Najważniejsze związki:
1. Acidum salicylicum
§
kwas salicylowy, kwas 2-hydroksybenzoesowy
§
łatwo rozpuszcza się w etanolu i eterze etylowym
§
dobrze rozpuszcza się w wodzie wrzącej, trudno natomiast w wodzie zimnej
§
substancja ostrożnie ogrzewana sublimuje
Najważniejsze reakcje kwasu salicylowego:
Próba
Podstawa chemiczna
Substancje w
oznaczeniu
Wykonanie
Efekt
Reakcja z
FeCl
3
Związki zawierające
ugrupowania fenolowe w
reakcji z chlorkiem żelaza
tworzą kompleksy
Salicylan sodu
Woda
FeCl
3
Niewielką ilość substancji
wytrząsnąć z kilkoma ml wody i
przesączyć. Do przesączu dodać
ponownie wody oraz chlorku
żelaza (III)
Powstaje fioletowe zabarwienie od
powstającego związku
kompleksowego
Reakcja z
CaO
Związek w reakcji z CaO
ulega dekarboksylacji
Salicylan sodu
Cao
Niewielką ilość substancji
ogrzewać z 0,5g tlenku wapnia
Wydziela się charakterystyczny
zapach fenolu
Estryfikacja
Grupa karboksylowa
salicylanu reaguje w
alkoholem w środowisku
kwaśnym wytwarzając ester
Salicylan sodu
Etanol
stęż. H
2
SO
4
Substancję ogrzewać z etanolem
oraz kilkoma kroplami stężonego
kwasu siarkowego (VI)
Wydziela się charakterystyczny
estrowy zapach
II. GRUPA KARBOKSYLOWA
Właściwości związków karboksylowych:
§
grupa karboksylowa charakterystyczna jest dla kwasów karboksylowych
§
w roztworze wodnym kwasy karboksylowe dysocjują na jony wodorowe
§
zabarwiają papierek lakmusowy na kolor niebieski
§
z roztworów węglanu wydzielają dwutlenek węgla
Reakcje charakterystyczne dla grupy karboksylowej:
Próba
Podstawa chemiczna
Substancje w
oznaczeniu
Wykonanie
Efekt
Próba z
papierkiem
lakmusowym
Związki z grupą
karboksylową w efekcie
dysocjacji odłączają jony
wodorowe – obniża się
pH
Próby ze
wskaźnikami pH
Kryształek substancji
zawierającej grupę
karboksylową nanieść na
zwilżony wodą
niebieski
papierek lakmusowy
Papierek lakmusowy od
kryształka substancji, bądź
kropli roztworu zabarwia się
na czerwono
Próba z
fenoloftaleiną
Do alkoholowego roztworu
fenoloftaleiny zabarwionego
na różowo (od 1kropli 1M
NaOH) dodać kilka
kryształków kwasu
Roztwór wskaźnika odbarwia
się (fenoloftaleina jest
bezbarwna w środowisku
obojętnym i kwaśnym)
Próba na
rozpuszczalność
kwasów i ich soli
Kwasy organiczne
tworzą z zasadami sole.
W miarę wzrostu ciężaru
cząsteczkowego kwasów
monokarboksylowych
maleje ich
rozpuszczalność w
wodzie
Roztwór
wodorotlenku
Do wyższego kwasu
karboksylowego dodać roztwór
wodorotlenku. Obserwować
różnice w rozpuszczalności
Wyższy kwas karboksylowy jest
nierozpuszczalny w wodzie – po
reakcji z wodorotlenkiem
powstaje dobrze rozpuszczalna
sól
Roztwór
substancji
kwasowej
Do roztworu dobrze
rozpuszczalnej soli dodać
roztwór substancji kwasowej
Po zakwaszeniu z roztworu
wodnego wydziela się w postaci
krystalicznej kwas
karboksylowy
Eter
Zakwaszony roztwór wykłócić
eterem
Wyższy kwas przechodzi do
warstwy eterowej
O
OH
OH
Reakcja z
węglanami
Kwasy organiczne
wydzielają z węglanów
dwutlenek węgla
(w przeciwieństwie do
węglanów)
Roztwór
węglanu
Do roztworu związku
zawierającego jony węglanowe
dodać roztworu kwasu
karboksylowego
Obserwuje się perlenie –
wydzielanie dwutlenku węgla
Tworzenie estrów
Grupa karboksylowa po
reakcji z alkoholami
wytwarza związki
estrowe
Kwas
Alkohol
Stęż. H
2
SO
4
Do probówki z kwasem
karboksylowym dodać
niewielką ilość alkoholu oraz
nadmiar kwasu siarkowego.
Ogrzać
Wydziela się przyjemny zapach
powstającego estru
Estryfikacja:
Po zmieszaniu niższego kwasu karboksylowego z alkoholem i nadmiarem środka odwadniającego (np. kwas
siarkowy) powstaje charakterystyczny zapach związku estrowego. Kwasy wyższe o dużej cząsteczce tworzą etsry
bezwonne w postaci oleistej cieczy.
Próba estrowa dla niektórych kwasów jest niecharakterystyczna- np. kwas winowy zwęgla się przy ogrzewaniu,
natomiast kwas szczawiowy rozkłada się podczas ogrzewania z kwasem siarkowym
Próba z solami
żelazowymi
kwasów
hydroksamowych
Związki karboksylowe
można przeprowadzić w
sole żelazowe przy
wykorzystaniu
odpowiednich chlorków
oraz roztworów
alkalicznych
Chlorek tionylu
Chlorowodorek
hydroksyloaminy
Wodorotlenek
potasu
Kwas solny
FeCl
3
Parę kryształów substancji
ogrzać z 2 kroplami chlorku
tionylu i odparować do sucha.
Następnie dodać 0,5ml
alkoholowego roztworu
chlorowodorku
hydroksyloaminy i
zalkalizować alkoholowym
roztworem KOH. Zawartość
tygla ogrzać, słab o zakwasić
HCl i dodać 1% FeCl
3
Występuje brunatnoczerowne
zabarwienie lub fioletowe
Reakcja chemiczna:
Fenole i enole dają zabarwienie z chlorkiem żelazowym bezpośrednio. Bezwodniki kwasów karboksylowych i
estry również dają powyższą reakcję dodatnią. Reakcję tę można wykonać nie dodając chlorku tionylu, jeśli kwas
wcześniej zestryfikuje się
Próba na kwasy
jednokarboksylowe
Roztwór soli sodowych
kwasów karboksylowych
daje zabarwienie, bądź
osady z roztworem
chlorku żelazowego
Mrówczany,
octany
i
propioniany
Czerwone zabarwienie z roztworem chlorku żelaza (III)
Sole kwasu
masłowego,
walerianowego i
kapronowego
Ceglaste osady w reakcji z chlorkiem żelaza (III)
Kwas glikonowy,
glicerol-
fosforowy
Hydroksykwasy ze śladami roztworu chlorku żelazowego dają
żółte zabarwienie
Niektóre hydroksykwasy podczas ogrzewania rozkładają się
aldehyd i kwas
Próba na kwasy
nienasycone
Kwasy nienasycone o
podwójnych i potrójnych
wiązaniach z nasyconym
roztworem
chloroformowym chlorku
antymonawego dają
zaarwienia lub osady
Kwasy
nienasycone
Zabarwienia lub osady o kolorze: żółtym, brunatnym lub
czerwonym
Cholesterol,
witamina D
Witamina A
Zabarwienie fioletowoczerwone szybko znikające
Kwasy di
karboksylowe
Stapiane z rezorcyną tworzą barwniki, których zasadowe
roztwory wykazują fluorescencję
Reakcja
fenolokwasów z
FeCl
3
Fenolokwasy posiadają
ugrupowanie fenolowe
reagujące podobnie jak
wolne fenole
Roztwór FeCl
3
Powstaje fioletowe zabarwienie od powstającego związku
kompleksowego.
W reakcji przeszkadzają kwasy nieorganiczne oraz zasady
Próba z
papierkiem Kongo
Odróżnienie kwasów
karboksylowych od
nieorganicznych
Kwasy nieorganiczne zmieniają zabarwienie papierka Kongo na niebiesko, zaś
kwasy organiczne nie zmieniają bądź zabarwiają na szaro fioletowy, który po
wyschnięciu papierka znika.
Kwas szczawiowy zabarwia papierek Kongo podobnie jak kwasy
nieorganiczne!
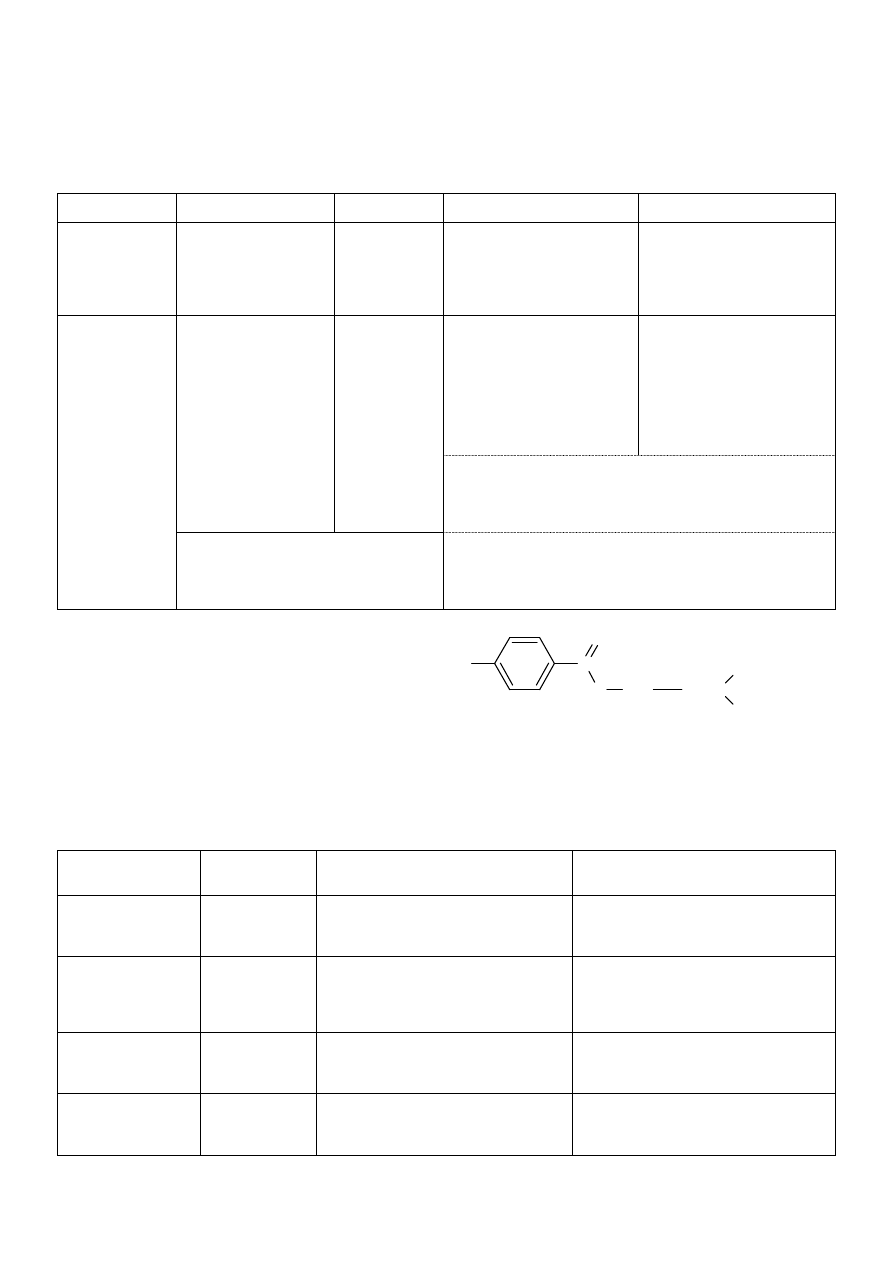
Najważniejsze substancje:
1. Calcium Lacticum
§
mleczan wapnia
§
postać: biały proszę, bez zapachu lub o słabym
charakterystycznym zapachu
§
wietrzeje na powietrzu
§
substancja rozpuszcza się w wodzie, łatwo rozpuszcza się w gorącej wodzie, gorzej w etanolu
§
pH bliskie obojętnemu
Reakcje charakterystyczne dla mleczanu wapniowego:
Próba
Podstawa chemiczna
Substancje w
oznaczeniu
Wykonanie
Efekt
Próba na
jony
wapniowe
Jony wapniowe w reakcji ze
szczawianem amoniowym
wytrącają się z roztworu
Szczawian
amonu
Niewielką ilość substancji
rozpuścić w wodzie. Dodać
roztwór szczawianu amonu
Wytrąca się biały osad szczawianu
wapnia
16% kwas
siarkowy
Substancję rozpuścić w wodzie,
całość zakwasić 16% H
2
SO
4
aż do
całkowitego strącenia jonów
wapniowych
Utlenianie
kwasu
mlekowego
Kwas mlekowy (α-
hydroksykwas) można
utlenić nadmanganianem
potasowym do aldehydu
octowego, który można z
kolei wykryć w reakcji
jodoformowej lub
kondensacji z fenolami
0,1M KMnO
4
Do 2ml przesączu dodać 5ml
nadmanganianu potasu. Ogrzać
Wydziela się zapach aldehydu
octowego
Reakcja chemiczna:
15% NaOH
J
2
w KJ
Do przesączu dodać 1ml 15%
wodorotlenku oraz kroplami J
2
w
KJ.
Roztwór
ogrzać
do
temperatury 600
O
. Ochłodzić
Wydziela się żółty osad jodoformu
o charakterystycznym zapachu
Reakcja chemiczna:
Rezorcynol
96% H
2
SO
4
Do 0,5ml przesączu dodać
rezorcynol oraz kroplę kwasu
siarkowego
Powstaje czerwone zabarwienie –
w reakcji z 2 cząsteczkami fenolu
powstają produkty utlenienia o
barwie od czerwonej do
fioletowej
Reakcja chemiczna:
Ogrzewanie
z
roztworem
KMnO
4
Mleczan wapnia ogrzewany do wrzenia z roztworem nadmanganianu potasu daje kwas pirogronowy (CH
3
COCOOH),
który pod wpływem roztworu 2,4-dwunitrofenylohydrazyny przechodzi w 2,4-dwunitrofenylohydrazon
III. GRUPA ESTROWA
Właściwości związków estrowych:
§
posiadają bardzo przyjemny zapach
§
estry alifatyczne są zazwyczaj ciekłe
CH
C
H
3
COO
-
OH
Ca
2+
x 5H
2
O
§
mają zdolność do hydrolizy – wydziela się kwas oraz alkohol lub fenol
§
kwas i alkohol po zmydleniu, jeśli są nielotne, można wyługiwać eterem lub innym rozpuszczalnikiem
§
jeżeli kwas i alkohol są lotne, należy po zmydleniu oddestylować alkohol a następnie z pozostałości po
zakwaszeniu kwasem fosforowy oddestylować kwas i zidentyfikować każdy destylat oddzielnie
Reakcje potwierdzające obecność estru:
Próba
Podstawa chemiczna
Substancje
Wykonanie
Efekt
Próba z
wykorzystaniem
fenoloftaleiny
Po zmniejszeniu ilości
wykorzystywanego
wodorotlenku obniża się
pH, więc zabarwienie
fenoloftaleiny zanika
Wodorotlenek
potasowy
Fenoloftaleina
Do 1ml próbki należy dodać 4
krople 0,5M alkoholowego
roztworu wodorotlenku
potasowego
oraz
fenoloftaleinę. Ogrzać
Czerwono-malinowe
zabarwienie zanika wobec estru
Reakcja z
hydroksyloaminą
oraz roztworem
FeCl
3
Reakcja polega na
powstawaniu kwasu
hydroksyamowego, który
daje z roztworem chlorku
żelazowego sól
kompleksową
Chlorowodorek
hydroksyloaminy
Wodorotlenek
potas
Kwas solny
FeCl
3
1 kroplę estru ogrzać z 0,5ml
nasyconego roztworu
chlorowodorku
hydroksyloaminy oraz 2ml
0,5M alkoholowego roztworu
wodorotlenku potasowego.
Zakwasić HCl i dodać kilka
kropli FeCl
3
Występuje zabarwienie
brunatnoczerwone do
fioletowego
Reakcja chemiczna:
Pozytywną reakcję dają również
wodorotlenki
Najważniejsze związki:
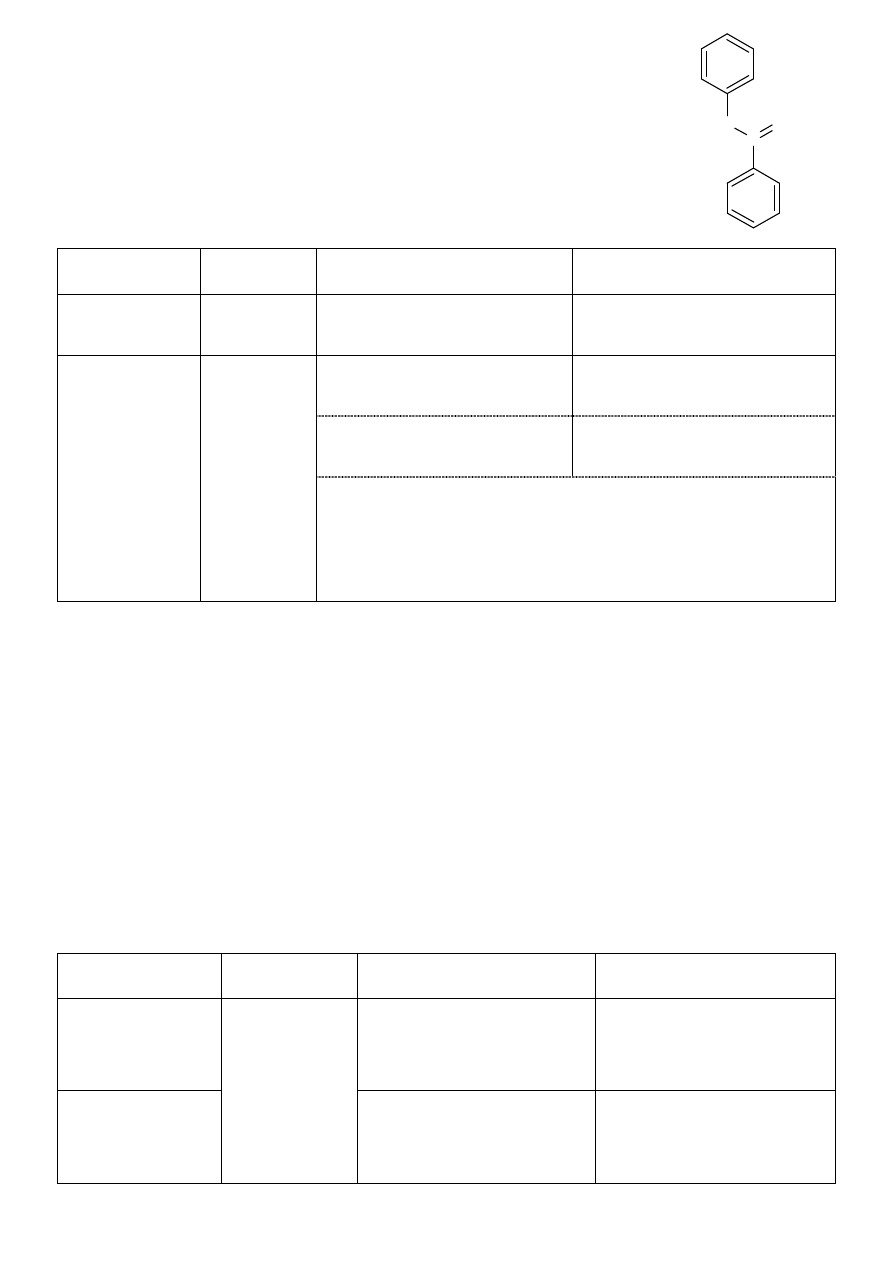
1. Procainum Hydrochloricum
(chlorowodorek prokainy)
§
chlorowodorek estru 2-dietyloaminoetylowego
kwasu 4-aminobenzoesowego
§
postać bezbarwnych kryształów lub biały krystaliczny proszek
§
pH roztworu lekko kwaśne, bliskie obojętnemu
§
substancja bardzo łatwo rozpuszcza się w wodzie, łatwo w etanolu, praktycznie nie rozpuszcza się w
eterze etylowym
§
lek o działaniu miejscowo znieczulającym
Najważniejsze reakcje chlorowodorku prokainy:
Próba
Substancje w
oznaczeniu
Wykonanie
Efekt
Reakcja
diazoniowania i
sprzęgania
Reakcja z furfurolem
Furfurol w kwasie
octowym
Stężony kwas
siarkowy
Do niewielkiej ilości badanej substancji
dodać mieszaniny 5% roztworu furfurolu
w kwasie octowym oraz stężonego kwasu
siarkowego w stosunku 1:3
Powstaje czerwone zabarwienie
Reakcje z
wodorotlenkiem
sodowym
NaOH
Do 1ml 10% roztworu chlorowodorku
prokainy dodać kilka kropli
15%
roztworu wodorotlenku sodowego
Powstają bezbarwne, oleiste krople, które
po pewnym czasie krystalizują
Reakcja z KMnO
4
KMnO
4
16% H
2
SO
4
Niewielką ilość badanej substancji
rozpuścić w 5ml wody, dodać kilka kropli
16% H
2
SO
4
oraz 0,3% roztwór KMnO
4
Pojawia się fioletowe zabarwienie szybko
znikające
N
H
2
C
O
O
CH
2
CH
2
N
C
2
H
5
C
2
H
5
x H
2
O
2. Phenylum Salicylicum
§
salicylan fenylu, ester fenylowy kwasu salicylowego
§
substancja bardzo łatwo rozpuszcza się w eterze etanolowym
§
łatwo rozpuszcza się w etanolu, 2% NaOH (w większych ilościach tworzy trudno
rozpuszczalny fenolan sodowy)
§
bardzo trudno rozpuszcza się w wodzie
Najważniejsze reakcje salicylanu fenylu:
Próba
Substancje w
oznaczeniu
Wykonanie
Efekt
Reakcja z FeCl
3
FeCl
3
Etanol
25mg substancji rozpuścić w 5ml etanolu i
dodać niewielką ilość roztworu chlorku
żelaza (III)
Powstaje fioletowe zabarwienie
Hydroliza zasadowa
15% NaOH
10% HCl
Roztwór jodu
NaOH
Wodny roztwór substancji wodne
ogrzewać przez 5min z 3ml 15% NaOH, a
następnie zakwasić 10% kwasem solnym
Po oziębieniu wydziela się osad kwasu p-
hydroksybenzoesowego oraz zapach fenolu
Przesącz z poprzedniej próby dodać do
roztworu jodu z kilkoma kroplami NaOH
(do odbarwienia). Lekko ogrzać
Wydziela się zapach jodoformu (z
wytrąceniem żółtego osadu)
Reakcja chemiczna:
IV. GRUPA AMINOWA
Właściwości związków z grupą aminową:
§
aminy otrzymuje się poprzez zastąpienie 1,2 lub 3 atomów wodoru w cząsteczce amoniaku odpowiednimi
rodnikami
§
związki te mają charakter zasadowy z wyjątkiem niektórych pochodnych aromatycznych
Aminy alifatyczne:
§
aminy alifatyczne występują w postaci gazowej lub ciekłej i mają charakter zasadowy
§
sole amin alifatycznych mają odczyn obojętny lub słabo kwaśny
Aminy aromatyczne:
§
aminy aromatyczne zawierające grupę aminową w pierścieniu, są związkami o charakterze słabych zasad
§
aminy aromatyczne są słabo rozpuszczalne w wodzie
Sole amin:
§
sole amin aromatycznych rozpuszczają się w wodzie, niektóre sole dwumian są trudniej rozpuszczalne
§
przez wprowadzenie grup NO
2
oraz SO
2
OH tracą charakter zasadowy i nie tworzą soli z kwasami
§
roztwory soli amin dają często osady z jodem w jodku potasowym, wodą bromową, kwasem pikrynowym
§
dwumiany aromatyczne mają zdolność redukowania amoniakalnego roztworu azotanu srebra
Wykrywanie zasadowego charakteru amin:
Próba
Substancje w
oznaczeniu
Wykonanie
Efekt
Próba z papierkiem
Kongo
Próby wskaźnikowe
Na papierek Kongo dodać 1 kroplę
0,1M kwasu solnego oraz kroplę
badanej substancji
Papierek Kongo po dodaniu 1 kropki
kwasu solnego zabarwia się na
niebiesko. Po wysuszeniu i dodaniu
kropli badanej substancji – na
czerwono
Próba z oranżem
metylowym
Do parowniczki porcelanowej dodać 2
krople kwasu solnego, 1 kroplę
alkoholowego roztworu oranżu
metylowego oraz 2 krople badanej
substancji
Zmiana zabarwienia czerwonego na
żółte wskazuje na obecność aminy
C
O
O
Rozróżnienie rzędowości amin:
Próba
Rodzaj amin
Efekt
Próba z kwasem
azotowym (III)
Aminy I-rzędowe
Środowisko reakcji zakwasza się kwasem solny. Stosuje się oziębiony kwas
azotowy (III). Całość podgrzewa się w łaźni wodnej i obserwuje wydzielanie się
pęcherzyków azotu
Aminy II-rzędowe
aromatyczne np. anilina
Anilina reaguje z kwasem azotowym (III) w temperaturze ok. 0 stopni i
przy zakwaszonym, kwasem solnym, środowisku. Ulega reakcji
diazowania – przechodzi w chlorek benzenodiazoniowy. Środowisko musi
być odpowiednio zakwaszone, gdyż do reakcji używa się azotanu (III)
sodu. Do stwierdzenia obecności kwasu azotowego (III) stosuje się
papierek jednoskrobiowy – zabarwia się na niebiesko pod wpływem jodu.
Chlorek benzenodiazoniowy ulega reakcji sprzęgania z
b
-naftolem
(wytwarza się barwnik azowy)
Aminy III-rzędowe np.
N,N-dietyloanilina
Pod wpływem kwasu azotowego przechodzi w chlorek p-nitrozo-N,N-
dietyloaniliny . Po zalkalizowaniu przechodzi w wolną aminę p-nitrozo-
N,N-dietyloanilinę. Sam chlorek ma zabarwienie żółte. W końcowym etapie
reakcji powstaje oliwkowy lub zielonkawy osad pochodzący od wolnej
aminy
Reakcja z ninhydryną
na bibule
chromatograficznej
Aminy o różnej
rzędowości
Aminy o różnej rzędowości bada się na bibule chromatograficznej
Whatman-1. Przed nałożeniem ninhydryny należy wysuszyć całość w
strumieniu ciepłego powietrza. Stosuje się 0,5% r-r ninhydryny w acetonie.
W miejscu naniesienia aminy I-rzędowej pojawia się fioletowa plama.
Barwna plama pojawia się również w miejscu naniesienia aminy o innej
rzędowości, ale dopiero po osuszeniu w ciepłym strumieniu powietrza
Rozróżnienie amin alifatycznych i aromatycznych:
Próba
Rodzaj amin
Wykonanie
Efekt
Reakcja
nihydrynowa
Aminy
alifatyczne
Do badanej substancji dodać kilka
kropli
0,2% etanolowego
roztworu ninhydryny i ogrzać
do pojawienia się barwy.
W przypadku soli należy wodny
roztwór zobojętnić Na
2
CO
3
Aminy alifatyczne I- i II-rzędowe oraz ich sole ulegają reakcji
ninhydrynowej. Ninhydryna degraduje aminy z równoczesnym
wydzieleniem niezbędnego dla tej reakcji amoniaku.
Ninhydryna redukuje się w tych procesach do 1,3-
diketoindanolu który reaguje swą formą tautomeryczną z
amoniakiem i nieprzereagowaną resztą ninhydryny tworząc
produkt kondensacji, najczęściej o zabarwieniu niebieskim
lub fioletowym
Reakcja Chen-
Kao
Aminoetanole
Badaną substancje rozpuścić w
niewielkiej ilości wody, dodać 2%
roztwór CuSO
4
oraz 1ml NaOH.
Do barwnego roztworu dodać
eteru etylowego i wytrząsnąć
W środowisku zasadowym w reakcji z jonami miedziowymi
tworzy si barwy, rozpuszczalny w eterze związek chylatowy.
W reakcji tworzy się fioletowe zabarwienie. Po dodaniu
etery etylowego warstwa etylowa zabarwia się na
ciemnoczerwono, a wodna na niebiesko
Oksydacja
benzaldehydu
Efedryna
(amina
alifatyczna)
Do 5% roztworu substancji dodać
15% NaOH
oraz
5%
K
3
[Fe(CN)
6
]. Ogrzać
Podczas ogrzewania wydziela się zapach gorzkich migdałów
(benzaldehyd) oraz pary amin barwiące papierek lakmusowy
na niebiesko
Najważniejsze aminy:
1. Ephedrinum hydrochloricum (chlorowodorek efedryny)
§
(1R, 2S) – 2-metyloamino-1-fenylopropan-1-ol
§
charakterystyczną reakcją dla efedryny jest oksydacja
benzaldehydu, w środowisku zasadowym w obecności
żelazicyjanku potasowego
2. Phenacetinum (fenacetyna)
§
4-etoksyacetanilid
§
substancja rozpuszcza się w etanolu, dość trudno we
wrzącej wodzie, bardzo trudno w eterze etylowym
§
po hydrolizie kwasowej daje reakcję barwną na grupę aminową fenetydyny (czerwień fenetydynowa)
§
wykonanie: niewielką ilość substancji ogrzewać przez 3 minuty z 15% kwasem solnym, dodać 10ml
wody, ochłodzić i przesączyć. Do przesączu dodać 0,1ml K
2
Cr
2
O
7
§
efekt: powstaje fioletowe zabarwienie, szybko przechodzące w ciemnoczerwone
CH
CH CH
3
N
H
OH
CH
3
x HCl
O
CH
2
C
H
3
NH C
CH
3
O
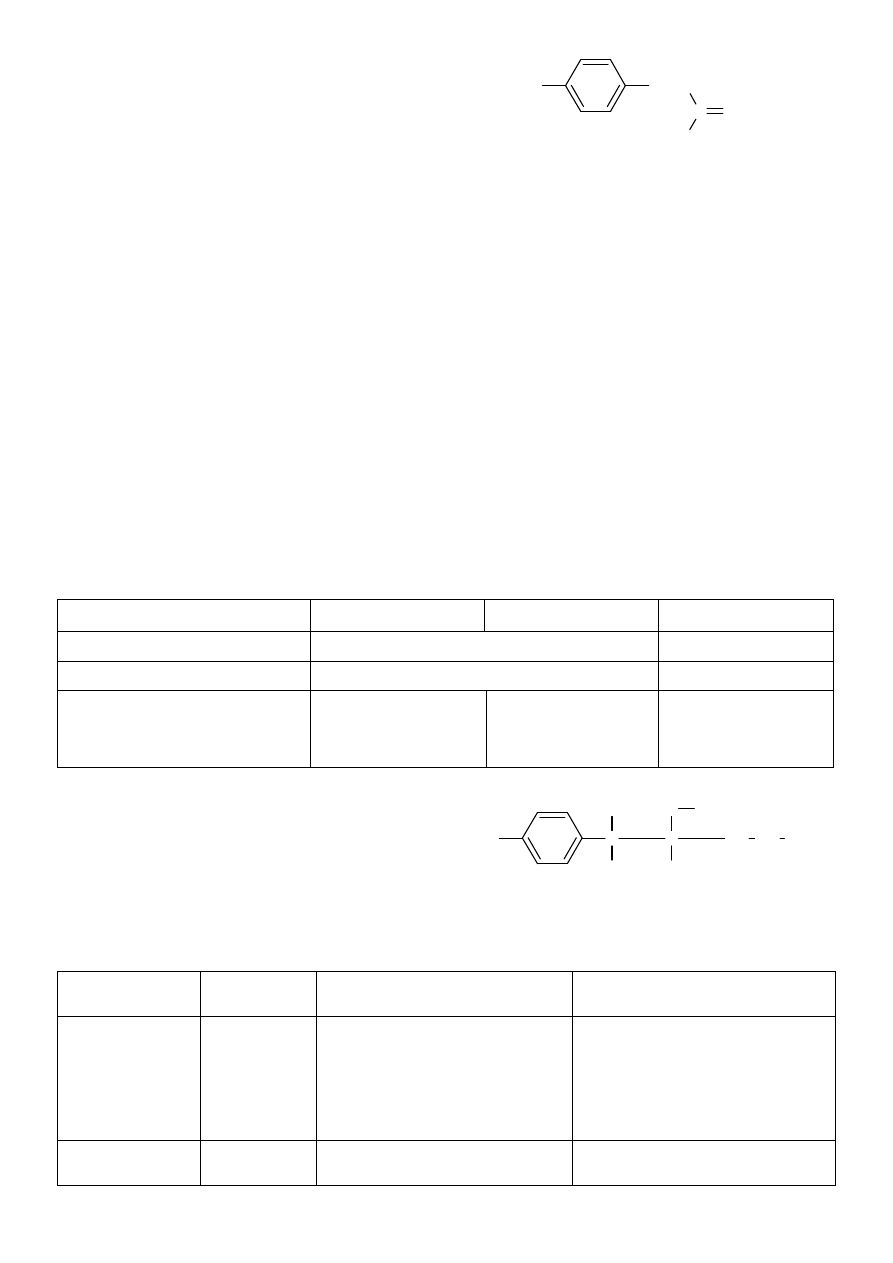
3. Sulfacetamidum natrium (sulfacetamid sodu)
§
biały lub żółtawo-biały proszek, bez zapachu, o słabo
gorzkim smaku
§
działanie bakteriostatyczne
§
reakcje charakterystyczne:
§
roztwór substancji w mieszaninie wody z buforem fosforanowym o pH=7,0 wykazuje maximum
absorpcji przy 255nm
§
substancja ogrzewana w suchej probówce burzy się i zabarwia na żółto, następnie brunatnieje i
wydziela się zapach kwasu octowego
§
preparat ogrzewany z etanolem i kilkoma kroplami kwasu siarkowego wydziela zapach estrowy
§
reakcje charakterystyczne dla jonów sodowych
V. GRUPA NITROWA
Właściwości związków z grupą nitrową:
§
związki nitrowe alifatyczne występują jako związki I-, II- oraz III-rzędowe
§
większość związków nitrowych jest cieczami
Reakcje charakterystyczne:
§
związki nitrowe łatwo ulegają redukcji do amin
§
wskutek działania roztworu wodorotlenków na te związki następuje rozkład z wydzieleniem tlenków azotu
§
redukują się w środowisku obojętnym do hydroksyloaminy, hydrazyny lub aminofenolu (związki te redukują
amoniakalny roztwór azotanu srebra do metalicznego srebra)
§
wykonanie: 0,5ml badanego roztworu rozpuścić w 10ml 50% alkoholu, dodać chlorku amonowego oraz
pyłu cynkowego , ogrzewać 2min i zostawić do ostygnięcia na 5min. Przesączyć. Do przesączu dodać
odczynnika Tollensa
§
efekt: wydziela się metaliczne srebro:
R-NO
2
+ 4H
+
= R-NH-OH + H
2
O
R-NH-OH + Ag
2
O = R-NO + 2Ag + H
2
O
Porównanie związków nitrowych o różnej rzędowości:
Reakcja charakterystyczna
I-rzędowe
II-rzędowe
III-rzędowe
Połączenia z roztworem wodorotlenków
Tworzą
Nie tworzą
Reakcja z kwasem azotawym
Reagują
Nie reagują
Reakcja z wodorotlenkiem sodowym i 5%
roztworem azotynu sodowego po
zakwaszeniu kwasem siarkowym
Dają sól sodową kwasu
nitrolowego o barwie
czerwonej, która zanika po
całkowitym zakwaszeniu
Dają zabarwienie niebieskie
od utworzonego
pseudonitrolu
Nie dają zabarwienia
Najważniejsze związki nitrowe:
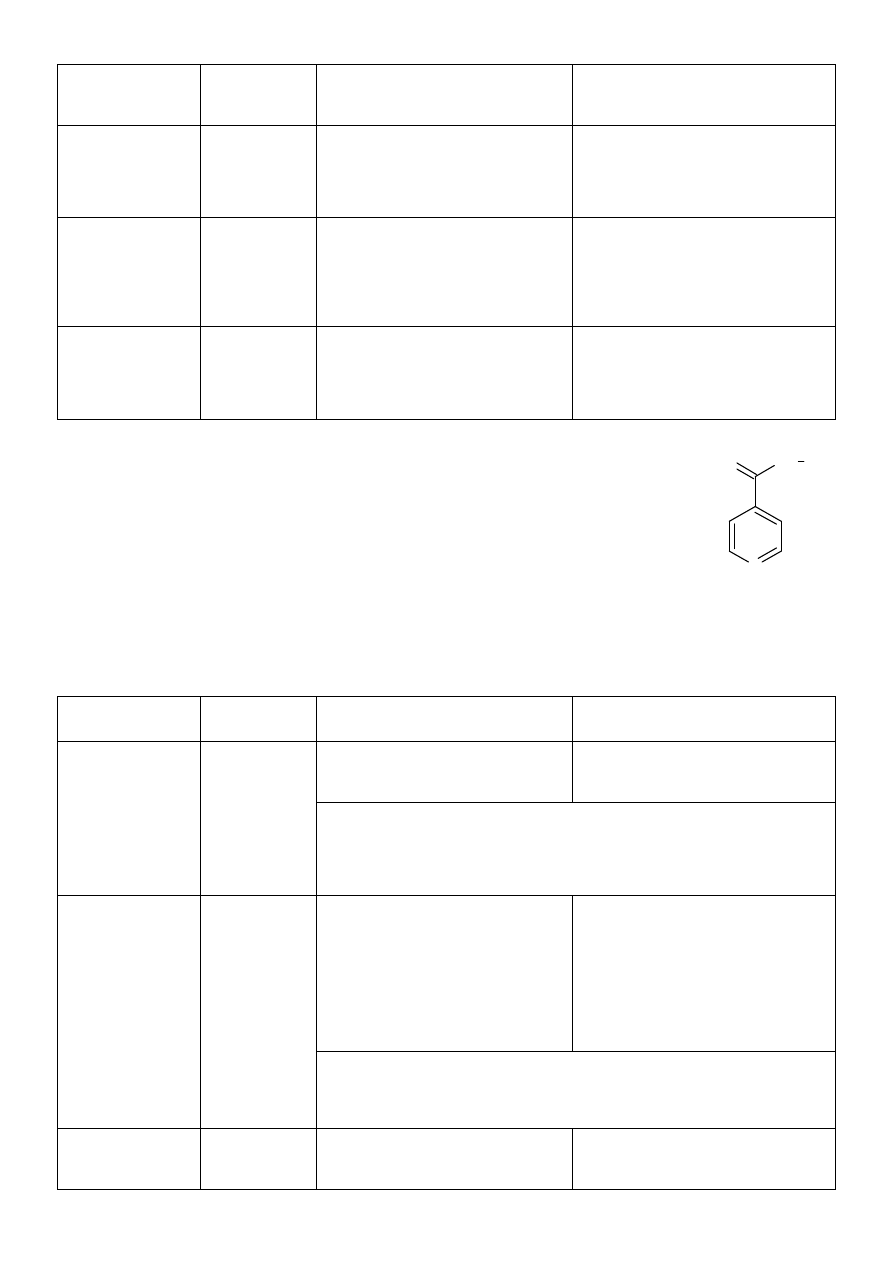
1. Chloramphenicolum (chloramfenikol)
§
inaczej chloromycetin, detreomycin, chlorocid
§
nazwa chemiczna: D/-/treo-1-/4-nitrofenylo/2-
dichloroacetamidopropano-diol-1,3
§
jest jednym z nielicznych związków naturalnych zawierających grupę nitrową
§
podstawowym fragmentem struktury jest propandiol-1,3 który w położeniu 1 zawiera ugrupowanie p-
nitrofenolowe, a położeniu 2 – dichloroacetyloaminowe
Najważniejsze reakcje chloramfenikolu:
Próba
Substancje w
oznaczeniu
Wykonanie
Efekt
Redukcja grupy NO
2
do NH
2
Etanol, woda, pył
cynkowy, 10%
HCl
Niewielką ilość substancji rozpuścić w 3ml
etanolu, dodać 7ml wody oraz 0,2 pyłu
cynkowego. Ogrzewać na łaźni wodnej pod
chłodnicą 10minut.
W przesączu zakwaszonym kilkoma
kroplami 10% HCl wykonać reakcję na
grupę NH
2
Zamiana atomowo
związanego chloru w
KOH, stęż. HNO
3
i
5% AgNO
3
Niewielką ilość substancji zmieszać z 0,5M
etanolowym KOH i ogrzewać na łaźni
Po dodaniu kwasu azotowego i azotanu (V)
srebra wytrąca się biały osad chlorku
N
H
2
SO
2
N
-
C
O
C
H
3
x Na
+
x H
2
O
O
2
N
C
C
NH
H
H
OH
H
2
C
OH
CO CHCl
2
postać jonową
wodnej pod chłodnicą przez 15minut.
Dodać kilka kropel stęż.HNO
3
i 5%AgNO
3
srebra, rozpuszczalny w amoniaku
-COCHCl
2
(+2OH-) = HOOC-CH(OH)
2
+ 2Cl
-
Reakcja
hydroksamowania
grupy amidowej
20% NaOH,
chlorowodorek
hydroksylaminy,
10% HCl, 10%
FeCl
3
Substancję rozpuścić w 20%NaOH, dodać
2ml wody oraz 0,1g chlorowodorku
hydroksylaminy. Odstawić na 1-minut.
Zakwasić roztwór 10% kwasem solnym i
dodać 0,5ml FeCl
3
Wytwarza się kwas dichloroaceto-
hydroksamowy, który daje brunatno-
czerwony kompleks chylatowy z jonami
żelazowymi
-COCHCl
2
+ 2OH
-
= HOOC-CH(OH)
2
+ 2Cl
-
Reakcja na
rozszczepienie C1-C2
50% NaOH
Reakcję wykonać z kilkoma kryształkami
substancji ogrzanej do wrzenia w 2ml 50%
NaOH
W tych warunkach z utworzonym 4-
nitrobenzaldehydem zachodzi reakcja
Cannizaro (dysproporcjonowania) tj.
redukcji grupy nitrowej i utleniania
aldehydowej. Powstaje sól kwau azobenzo-
4,4-dikarboksylowego o barwie żółtej
Reakcja na
kompleksotwórczą
właściwość
ugrupowania
enanoloaminowego
CuSO
4
15% NaOH
Eter
Do 2ml 5% roztworu substancji dodać
0,1ml CuSO
4
, 1ml 15% NaOH oraz
fioletową mieszaniną wytrząsnąć 2ml
eteru
Warstwa eterowa zabarwia się na
czerwono
VI. GRUPA HYDRAZYNOWA
Najważniejsze związki:
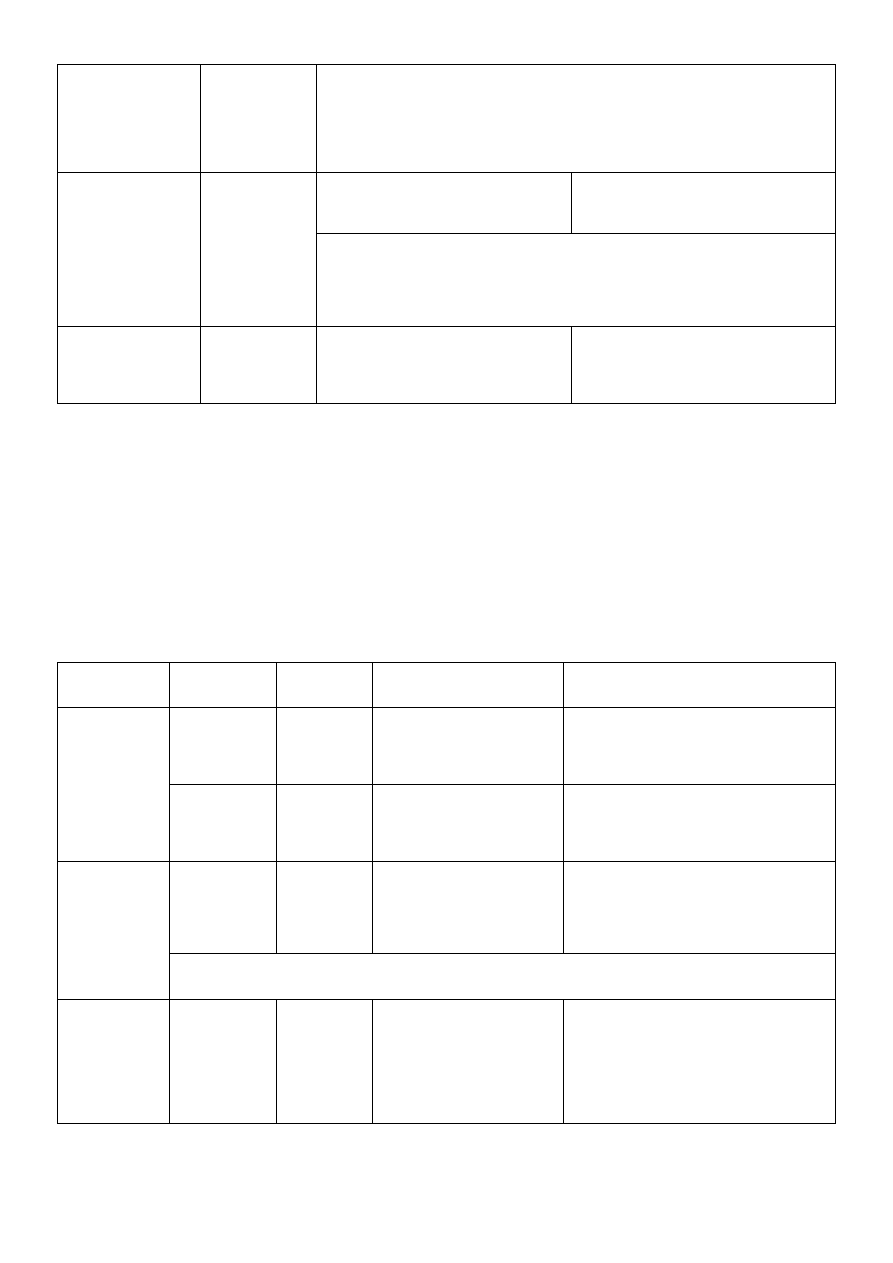
Isoniazidum
§
inaczej INH, hydrazyd kwasu izonikotynowego
§
związek łatwo rozpuszczalny w wodzie
Właściwości chemiczne
§
tworzy osad z taniną i zakwaszonym odczynnikiem Mayera
§
przy prażeniu z bezwodnym Na
2
CO
3
+ KNO
3
wydziela nieprzyjemny zapach pirydyny
§
podobnie jak inne glikozydy reaguje z kationami metali np.Cu
2+
swoją enolową formą tautomeryczną z
utworzeniem barwnej soli kompleksowej
§
obecność grupy hydrazynowej można potwierdzić reakcją z utleniaczami
§
obecność grupy aminowej można potwierdzić reakcją Schiffa (kondensacja z aldehydami)
Najważniejsze reakcje izoniazydu (potwierdzenie tożsamości):
Próba
Substancje w
oznaczeniu
Wykonanie
Efekt
Reakcja z
siarczanem (VI)
miedzi
10% CuSO
4
Do stężonego
wodnego
roztworu
izoniazydu dodać kilka kropli siarczanu
(VI) miedzi
Powstaje zielony osad soli chylatowej
Reakcja chemiczna:
Reakcja z wodą
bromową
Woda bromowa,
octan sodu, octan
miedzi
Do stężonego wodnego roztworu
izoniazydu dodać wody bromowej, aż do
uzyskania trwałej, jasnożółtej barwy.
Ogrzać roztwór aż do odbarwienia, dodać
octan sodu (w celu przeprowadzenia
utworzonego kwasu izonikotynowego
rozpuszczalną sól sodową). Odsączyć
nierozpuszczalny nadmiar kwasu i dodać
kilka kropli octanu miedzi
Po chwili wytrąca się niebieski osad soli
miedziowej
Reakcja chemiczna:
Reakcja z
odczynnikiem
Fehlinga
Odczynnik
Fehlinga
Do stężonego wodnego roztworu
izoniazydu dodać kilka kropli odczynnika
Fehliga
Wytrąca się czerwony osad tlenku miedzi
(I) – Cu
2
O
N
O
NH NH
2
Reakcja chemiczna:
Reakcja z
odczynnikiem
Tollensa
Odczynnik
Tollensa
Do stężonego wodnego roztworu
izoniazydu dodać kilka kropli odczynnika
Tollensa
Powstaje koloidalny, szary osad srebra
Reakcja chemiczna:
Reakcja z
odczynnikiem
Ehrlicha
Odczynnik
Ehrlicha (4-
dimetyloamino-
benzaldehyd)
Do stężonego wodnego roztworu
izoniazydu dodać kilka kropli odczynnik
Ehrlicha
Powstaje żółty roztwór zasady
hydrazometinowej tj. 4-
dimetyloaminobenzylidenohydrazydu
izonikotynowego
VII. REAKCJE GRUPOWE NA ALKALOIDY
Właściwości ogólne alkaloidów:
§
alkaloidy są w większości III-rzędowymi zasadami heterocyklicznymi (wyjątek stanowi II-rzędowa
alifatyczna efedryna)
§
łatwo rozpuszczalne w wodzie są ich sole (wyjątek stanowią sole alkaloidów chinowych, zwłaszcza siarczany
i chlorowodorek papaweryny)
§
soli nie tworzą alkaloidy purynowe będące słabymi kwasami (teofilina, teobromina) lub słabą zasadą
(kofeina)
§
bardziej czułe i specyficzne są dla alkaloidów reakcje barwne i osadowe – ponieważ nie są one specyficzne
dla poszczególnych alkaloidów należy wykonać przynajmniej kilka reakcji potwierdzających tożsamość
związku
Najważniejsze reakcje alkaloidów:
Próba
Oznaczana
substancja
Odczynniki
Wykonanie
Efekt
Reakcja z
odczynnikiem
Marguisa
(40% r-r
formaldehydu)
Morfini
Hydrochloricum
96% H
2
SO
4
Odczynnik
Marguisa
Około 3mg substancji rozpuścić
w 2ml 96% kwasu siarkowego.
Dodać kroplę odczynnika
Marguisa
Powstaje czerwone zabarwienie szybko
przechodzące w fioletowe
Papaverini
hydrochloricum
Odczynnik
Marguisa
Parę kryształków substancji
rozpuścić 1ml
wody,
podwarstwić odczynnikiem
Marguisa i lekko ogrzać
Pojawia się różowa obrączka
dwucząsteczkowego produktu rodnikowego
Reakcja
talejochinowa
Chinini
hydrochloricum
Woda
bromowa
10% amoniak
Do roztworu substancji lub
przesączu uzyskanego z jej
kilkuminutowego wytrząsania
dodać 2 krople wody bromowej
oraz 0,5ml 10% amoniaku
Powstaje zielone zabarwienie roztworu
Reakcja talejochinowa jest reakcją specyficzną dla chininy oraz chinidyny. Maskują ją fena zon, aminofenazon oraz
kofeina!
Próba Vitaliego
Atropinum
sulfuricum
Stężony HNO
3
Etanolowy
roztwór KOH
Aceton
10mg badanej substancji
rozpuścić w 0,25ml stężonego
HNO
3
i odparować do sucha na
łaźni wodnej. Do pozostałości
dodać 3% etanolowy roztwór
KOH oraz 2ml acetonu
Powstaje fioletowo-czerwone zabarwienie

Jest to próba charakterystyczna dla atropiny i alkaloidów tropanowych. Początkowo po dodaniu do badanej
substancji stężonego HNO
3
następuje nitrowanie pierścienia aromatycznego kwasu tropowego i równoczesna
estryfikacja grupy alkoholowej. W wyniku wewnątrzcząsteczkowego przekształcenia w obecności nukleofilowej
komponenty (alkoholowy r-r KOH) tworzy się mezostabilny anion o przejściowej barwie fioletowo-czerwonej
Reakcja
mureksydowa
Coffeinum
Purum
H
2
O
2
Stęż. HCl
10% NH
3
Substancję zmieszać w
parowniczce z kilkoma
kroplami nadtlenku wodoru i 5
kroplami stężonego kwasu
solnego.
Odparować do sucha na łaźni
wodnej. Pomarańczową
pozostałość zwilżyć 10%
amoniakiem
Powstaje czerwono-fioletowa barwa
Wyszukiwarka
Podobne podstrony:
STARSZEŃSTWO GRUP FUNKCYJNYCH
GRAWIMETRIA CW1 grupa 1a, gik, semestr 8, sem 8, Grawimetria, kolokwium 1, Cwiczenia wszystkich grup
Ćwiczenia różnych grup mm, kosmetologia, rehabilitacja
Ćwiczenia różnych grup mm OKLŁADKA, kosmetologia, rehabilitacja
Wprowadzanie grup funkcyjnych do białek
Chemia żywnosci Cwiczenie 3 Reakcje nieemzymatycznego brunatnienia zywnosci
ćwiczenie14 500 grup
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
reakcje ułożenia ćwiczenia z kinezy
Cwiczenie nr 05 Wybrane metody anlizy jakosciowej Reakcje anlityczne wybranych kationow
CWICZENIE NR 5 Reakcje polikondensacji Otrzym
Podział cukrów biochemia ćwiczenia cukry reakcje?rwne
cwiczenie 4 inwertaza kinetyka reakcji enzymatycznych 05 05 2014
Ćwiczenie 10.Kinetyka reakcji, I rok, chemia
cwiczenie 2 hydrolazy czynniki wplywajace na szybkosc reakcji enzymatycznych 15 05 2014
10.Reakcje zobojętniania, Chemia ogólna ćwiczenia
6c. Teoria grup odniesienia, Ćwiczenia - dr K
więcej podobnych podstron