V. ELEKTRONOWA STRUKTURA ATOMU
Atom i jego budowa wg teorii mechaniki klasycznej sformułowanej przez Newtona (XVII w.)
promieniowanie katodowe - wykrycie elektronu
promieniowanie kanalikowe (anodowe)
promieniowanie α, β i γ
atom wg Rutherforda (1913 r.) - co już było wiadomo o budowie atomu
model atomu Bohra - 1913 r. - planetarny model atomu - Bohr wprowadził do budowy atomu zasady teorii kwantowej Plancka
teoria i doświadczenie w nauce
Teoria to system pojęć, definicji i twierdzeń dot. relacji pomiędzy pojęciami i aksjomatami, tworzący spójny system pojęciowy
Teoria naukowa to uporządkowany zbiór zdań orzekających o badanej przez naukę dziedzinie rzeczywistości
Teoria nie dowiedziona faktami lub dowodami matematycznymi to hipoteza
Teorię trzeba dowieść w praktyce, np. poprzez doświadczenie. Teoria mówi jak jest w praktyce.
2. Teorie dotyczące natury światła
Huyghens (XVII w.) - teoria falowa światła,
Newton (XVIII w.) - teoria korpuskularna,
Hertz (XIX w.) - światło jest falą elektromagnetyczną.
Ciało doskonale czarne (c.d.cz.) - pochłania wszystkie rodzaje promieniowania elektromagnetycznego. Właściwości zbliżone do c.d.cz. posiada sadza. C.d.cz. emituje też promieniowanie elektromagnetyczne - ilość energii wysyłanej wzrasta z temperaturą.
Rozkład energii w widmie c.d.cz.:
- Planck (1900 r.) - światło jest pochłaniane i emitowane) przez c.d.cz. porcjami, a ściślej kwantami energii:
![]()
Teoria kwantowa wyjaśnia m.in. efekt fotoelektryczny, tj. emitowanie elektronów przez powierzchnię metalu, na które pada promieniowanie elektromagnetyczne.
Podstawę do przypisania fotonowi określonej masy daje teoria względności Einsteina:
![]()
3. Dwoista natura światła i elektronów
De Broglie (1924r.): Dualizm korpuskularno - falowy
Jeżeli fale elektromagnetyczne mają właściwości korpuskularne to z kolei cząstka materii jaką jest elektron ma właściwości falowe. Wyprowadźmy równanie na długość fali fotonu (fali elektromagnetycznej):
De Broglie wysunął hipotezę, że elektron poruszający się z szybkością V posiada długość fali:
Przyjmując masę elektronu m = 9,1⋅10-28 g można obliczyć długości fali przy różnych prędkościach. Np:
V = 5,9⋅105 m/s λ = 1,20 nm
V = 5,9⋅106 m/s λ = 0,12 nm
4. Zasada nieoznaczoności Heisenberga
Mechanika klasyczna - ciała makroskopowe → opis materii
Mechanika kwantowa - cząsteczki elementarne → opis mikroświata w postaci równań matematycznych:
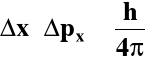
Δx - niepewność położenia elektronu
Δpx - niepewność określenia pędu elektronu
W przypadku elektronu w ruchu nie jest możliwe równoczesne i dokładne określenie jego położenia i pędu. Tym samym nie jest możliwe jednoznaczne rozstrzygnięcie dualizmu falowo - korpuskularnego. |
Mechanika kwantowa, zamiast określać ostro położenie cząstki, zakłada jedynie istnienie określonego prawdopodobieństwa napotkania cząstki w danym miejscu.
Prawdopodobieństwo napotkania cząstki w objętości dV:
ρ - gęstość prawdopodobieństwa:
ρ = ρ(x, y, z)
Całka prawdopodobieństwa:
5. Równanie Schrödingera
Opisuje zachowanie się elektronu w atomie; jest to równanie różniczkowe:
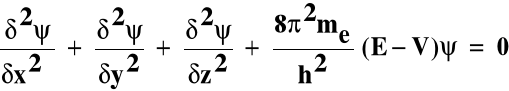
gdzie:
Ψ - funkcja falowa - amplituda prawdopodobieństwa
w dowolnym punkcie o współrzędnych x, y, z
E - energia całkowita elektronu
V - energia potencjalna elektronu
me - masa elektronu
A - amplituda maksymalna
λ - długość fali
Kwadrat amplitudy określa gęstość prawdopodobieństwa:
Atom wodoru: zawiera tylko 1 elektron w atomie
Tylko niektóre funkcje, będące rozwiązaniem równania Schrödingera wyrażają prawdopodobieństwo napotkania elektronu w atomie wodoru. Są to tzw. funkcje porządne.
Muszą być spełnione 3 warunki aby funkcja była funkcją porządną |
1o Energia elektronu (E):
me - masa elektronu,
e - ładunek elektronu,
ε0 - przenikalność dielektryczna,
n = 1, 2, 3,.... główna liczba kwantowa
główna liczba kwantowa 1 2 3 4 5 6 7
symbol powłoki (literowy) K L M N O P Q
2o Orbitalny moment pędu elektronu:
l = poboczna (orbitalna) liczba kwantowa,
l = 0, 1, 2, ...., n - 1
symbol orbitalu
l = 0 s (sharp)
l = 1 p (principle)
l = 2 d (diffuse)
l = 3 f (fundamental)
3o Składowa z-etowa orbitalnego momentu pędu elektronu:
m - magnetyczna liczba kwantowa: - l ≤ m ≤ + l
w sumie m przyjmuje 2l + 1 wartości |
np. dla l = 2: m = -2, -1, 0, +1, +2
l = 3: m = -3, -2, -1, 0, =1, +2, +3
Każdej kombinacji 3 liczb kwantowych, tj. n, l, m odpowiada jedna porządna funkcja falowa spełniająca równanie Schrödingera.
Funkcje te nazywamy orbitalami (podpowłokami) |
Dana powłoka n składa się z n2 podpowłok (orbitali):
Wartości n |
Wartości l |
Wartości |
Podpowłoka (orbital) |
Liczba orbitali |
Liczba orbitali na powłoce |
1 |
0 |
0
|
1s |
1 |
1 |
2 |
0 1 |
0 -1, 0, +1
|
2s 2p |
1 3 |
4 |
3 |
0 1 2 |
0 -1, 0, +1 -2, -1, 0, +1, +2
|
3s 3p 3d |
1 3 5 |
9 |
4 |
0 1 2 3 |
0 -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1 +2, +3 |
4s 4p 4d 4f |
1 3 5 7 |
16 |
Diagramy trójwymiarowe orbitali typu s, p oraz d przedstawiono poniżej:
6. Widma emisyjne (i absorpcyjne) wodoru
Gazy pobudzone do świecenia wskutek ogrzania emitują światło zawierające tylko niektóre długości fal. Światło takie obserwowane w spektrometrze daje widmo złożone z pojedynczych linii, które z kolei układają się w serie. Dla wodoru stwierdzono istnienie następujących serii:
- Lymana - w nadfiolecie
- Balmera - w zakresie widzialnym i bliskim nadfiolecie
- Paschena, Bracketta, Pfunda i Humphreysa - w
podczerwieni i dalekiej podczerwieni
Seria Balmera linii widmowych wodoru:
Balmer (1855 r.) podał wzór empiryczny: 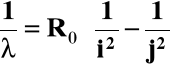
7. Spin elektronowy
DIRAC → spinowy moment pędu elektronu:
s - spinowa liczba kwantowa = 1/2
Składowa zetowa spinowego momentu pędu elektronu:
ms - spinowa magnetyczna liczba kwantowa
-s < ms < s
ms może przyjąć dwie wartości, tj.: -1/2, +1/2
Są elektrony o spinie dodatnim (ms = +1/2) i o spinie ujemnym (ms = -1/2) |
Pełen opis zachowania się danego elektronu w atomie to potrzeba uwzględnienia 4 liczb kwantowych: n, l, m, ms
Liczba elektronów o danym n → 2n2 |
8. Orbitale w atomach wieloelektronowych
Funkcja falowa: ψ(x1, y1, z1, x2, y2, z2,....xn, yn, zn) rozwiązania przybliżone → funkcja falowa jest iloczynem orbitali jednoelektronowych
Istotna różnica - o energii decyduje tak n jak i l (a nie tylko n jak dla wodoru)
Liczby orbitali typu |
s - 1 p - 3 d - 5
f - 7 |
krotność zdegenerowania
|
Schemat poziomów energetycznych:
9. Zasady zapełniania orbitali przez elektrony
1o Zakaz Pauliego
W atomie nie mogą występować elektrony które nie różnią się conajmniej jedną liczbą kwantową. Oznacza to, że jeden orbital o liczbie kwantowej n, l, m może opisać zachowanie się 2 elektronów.
2o Orbitale zapełniane są wg wzrastającej energii
3o Reguła Hunda (reguła maksymalnej różnorodności)
Kolejność zapełnienia orbitali elektronowych:
9. Zasady zapełniania orbitali przez elektrony
1o Zakaz Pauliego
W atomie nie mogą występować elektrony które nie różnią się conajmniej jedną liczbą kwantową. Oznacza to, że jeden orbital o liczbie kwantowej n, l, m może opisać zachowanie się 2 elektronów.
2o Orbitale zapełniane są wg wzrastającej energii
3o Reguła Hunda (reguła maksymalnej różnorodności)
Elektrony wypełniają poszczególne typy orbitali
w taki sposób, aby liczba niesparowanych elektronów była w stanie podstawowym atomu możliwie najwyższa.
Przykład ⇒ dwa elektrony na orbitalach typu p:
↑↓ |
|
|
← źle |
↑ |
↑ |
|
← dobrze |
Koniec rozdz. V -go
Władysław Walkowiak - Chemia Ogólna, kurs WPC 1002w
1 / 25
Rozdział V. Elektronowa struktura atomu
Rozkład gęstości elektronowej dla orbitali p: :orbitali p:
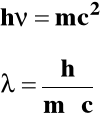
Ro = 1,0973⋅107 m-1; stała Rydberga j oraz i - liczby naturalne, j > i
Dla serii Lymana: i = 1; j = 2, 3,...
Dla serii Balmera: i = 2; j = 3, 4,....
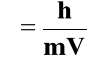
stąd:
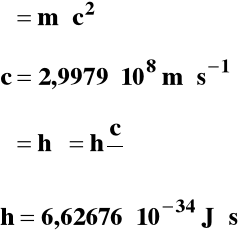
równanie Einsteina
prędkość światła
równanie fali
stała Plancka
Rozkład gęstość elektronowej dla orbitali d: d:
zakres widzialny
nadfiolet
↑
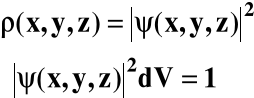
![]()
Rozkład gęstości elektronowej orbitalu s: s: stypu p:
Rozkład gęstości elektronowej dla orbitalu typu s:
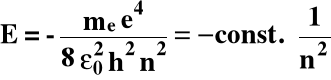
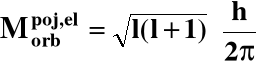
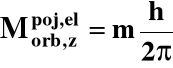
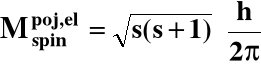
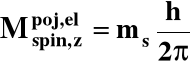
Wyszukiwarka
Podobne podstrony:
Wykład 11b. Elektrolity - cd., chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 11a. Elektrolity - kwasy, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 2. Roztwory i stężenia, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 10.Równowaga chemiczna. Prawo działania mas, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DO
Wykład 1. Wstępne pojęcia chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 4. Reakcje utleniajaco-redukcyjne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 12. Reakcje jadrowe, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 7. Okresowosc wlasciwosci pierw. chemicznych, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) D
Wykład 9. Szybkosc reakcji chemicznych, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
WYKŁAD 5. Elektronowa struktura atomu, chomikowe, WYKŁADY z Chemii
Chemia Ogólna - PROGRAM WPC1002w (Walkowiak), Biotechnologia PWR, Semestr 1, Chemia ogólna, Chemia o
chemia wyklady2ok, Studia, Mibm, semestr I, Chemia Ogólna
Chemia - wykłady, Dietetyka CM UMK, Chemia ogólna i żywności
Wyklad 11a. Elektrolity, pwr biotechnologia(I stopień), I semestr, Chemia ogólna
Wyklad 11b. Elektrolity - cd., pwr biotechnologia(I stopień), I semestr, Chemia ogólna
więcej podobnych podstron