XIa. RÓWNOWAGI W ROZTWORACH WODNYCH ELEKTROLITÓW. KWASY, ZASADY i SOLE.
1. Elektrolity
Elektrolitem nazywamy substancję, która rozpuszczając się w wodzie lub innym rozpuszczalniku polarnym ulega dysocjacji elektrolitycznej czyli rozpadowi na jony, tj. kationy i aniony |
Roztwory wodne elektrolitów (chlorek sodu, kwas solny, wodorotlenek sodu) - przewodzą prąd elektryczny
Roztwory wodne nieelektrolitów (cukier, alkohol etylowy) - nie przewodzą prądu elektrycznego
Dysocjację elektrolityczną charakteryzuje ilościowo stopień dysocjacji, α:
O ≤ α ≤ 1 O ≤ α ≤ 100%
Jeżeli w roztworze wodnym stężenie elektrolitu c ≈ 0,1 M:
mocne α = 1
Elektrolity
słabe α << 1
Mocnymi elektrolitami są:
sole (np. CaCl2, KNO3, Na2SO4)
niektóre kwasy (np. HCl, HNO3, H2SO4, HClO4)
niektóre wodorotlenki (np. NaOH, KOH, Ca(OH)2)
Związki chemiczne, które są mocnymi kwasami lub wodorotlenkami, posiadają wiązania chemiczne pomiędzy wodorem lub grupą wodorotlenową a resztą cząsteczki o przeważającym jonowym charakterze.
W przypadku soli wiązania pomiędzy kationem i anionem są w przeważającej części w 100% jonowe.
2. Woda jako rozpuszczalnik
Woda jest przykładem rozpuszczalnika polarnego.
Budowa cząsteczki H2O:
O
163 pm
H H
Sposoby przedstawiania cząsteczki H2O:
Cząsteczka wody ma charakter dipola elektrycznego!
Proces rozpuszczania w wodzie substancji o budowie jonowej
na przykładzie chlorku sodu (NaCl):
cząsteczka wody
Każdy jon uwolniony z sieci krystalicznej otaczany jest przez kilka cząsteczek wody - zjawisko to nosi nazwę hydratacji.
Silna hydratacja dla jonów o dużej wartości potencjału jonowego, tj. Zi / ri,
(Zi - ładunek jonu, ri - promień jonu)
np. Cr3+ → [Cr(H2O)6]3+
Słaba hydratacja anionów, np. Cl -, NO3-,
Hydratacja jonu wodorowego (H+):
H+ + H2O = H3O+
H+ + 4H2O = [H9O4]+
Hydratacja jonu wodorotlenowego (OH- ):
OH- + 3H2O = [H7O4]-
Budowa [H9O4]+ Budowa [H7O4]-
3. Równowagi w roztworach wodnych słabych elektrolitów
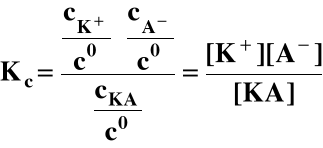
KA ⇔ K+ + A-
gdzie : Kc - stężeniowa stała równowagi (stała
dysocjacji), jest const. dla danej temperatury,
cK+, cA-, cKA - równowagowe stężenia molowe.
Tak jest dla słabych elektrolitów, tj. takich dla których:
< 10-3 mol/dm3
Ale dla elektrolitów średniej mocy, tj. takich dla których
cK+, cA- > 0,01 mol/dm3 wartość stałej Kc nie jest stała
Stała, która jest w każdych warunkach stała, to stała aktywnościowa, tj. wyrażona przy pomocy aktywności:
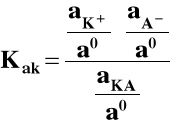
gdzie: Kak - stała aktywnościowa,
aK+, aA-, aKA - aktywności K+, A- i KA,
ao ≡ 1 mol/dm3 (aktywność standardowa).
Definicja aktywności:
ai = yi × ci
gdzie: yi - współczynnik aktywności; 0 < yi < 1
ci - stężenie molowe (mol/dm3)
Od czego zależy współczynnik aktywności (yi):
yi = f (stężenia i ładunków wszystkich jonów obecnych w roztworze) czyli: yi = f(I)
I - siła jonowa roztworu:
gdzie: ci - stężenie i-tego jonu,
Zi - ładunek i-tego jonu,
n - sumowanie wszystkich jonów obecnych w roztworze.
Siła jonowa ma wymiar stężenia!
gdzie: A, B - stałe,
a - promień jonu.
Gdy I rośnie to yi → 0
Gdy I maleje to yi → 1, tak więc dla roztworów rozcieńczonych: ai ≈ ci gdyż yi ≈ 1.
Przekształćmy wyrażenie na Kak
Ale yKA ≡1
Jeśli I = const. to K = const. Jest to tzw. stała równowagi elektrolitu przy stałej sile jonowej |
4. Dysocjacja słabych kwasów i zasad wg. teorii Arrheniusa
Słaby kwas:
a - kwas (acid)
Jeśli w roztworze nie ma innych elektrolitów poza HA:
gdzie:
![]()
- stężenie początkowe (analityczne) kwasu,
cH+ - stężenie jonów H+ w stanie równowagi.
Wprowadźmy stopień dysocjacji (α):
Stąd :
Stężenie poszczególnych form jonowych wynoszą:
|
HA |
H+ |
A- |
na początku |
|
0 |
0 |
przereagowało |
|
|
|
w stanie równowagi |
|
|
|
Jeżeli α << 1:
1
α
0
1/c
Jest to prawo rozcieńczeń Ostwalda
W roztworach słabych elektrolitów wraz z rozcieńczaniem roztworu wartość stopnia dysocjacji zbliża się (asymptotycznie) do jedności.
Słaba zasada:
BOH ⇔ B+ + OH-
b - zasada (base)
5. Dysocjacja wody
Woda ulega również dysocjacji elektrolitycznej:
H2O ⇔ H+ + OH-
W zwykłych warunkach ciśnienia i temperatury stopień dysocjacji wody jest bardzo niski.
Stała równowagi:
Ale [H2O] w wodzie jest stałe i w temperaturze 298 K wynosi:
[H2O] = 55,4 M
Wówczas:
Kw - iloczyn jonowy wody
Po zlogarytmowaniu:
log Kw = log[H+] + log[OH-]
- log Kw = - log[H+] - log[OH-]
Zdefiniujmy:
pH = - log[H+] pOH = -log[OH-]
pKw = - logKw
Stąd:
pH + pOH = pKw
pKw (Kw) zależy tylko od temperatury i siły jonowej roztworu.
Roztwory obojętne pH = pOH = ½pKw, [H+] = [OH-]
kwaśne pH < ½pKw czyli [H+] > [OH-]
zasadowe pH > ½pKw czyli [H+] < [OH-]
Iloczyn jonowy wody dla I = 0 w temp. 25 0C wynosi 1,00⋅10-14, czyli pKw = 14,00
W tych warunkach:
roztwory kwaśne pH < 7,0
roztwory zasadowe pH > 7,0
roztwory obojętne pH = 7,0
Wartości pH wybranych roztworów wodnych:
14
pH
0
Władysław Walkowiak - Chemia Ogólna. WPC1002w
17 / 39
Rozdział 11a. Równowagi w roztworach wodnych elektrolitów. Kwasy. Zasady. Sole.
H H
O
101 pm
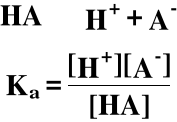
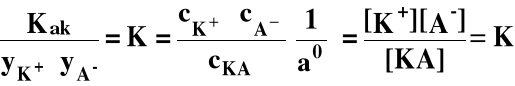
+
+
Na+
Cl-
Na+
Na+
Cl-
Cl-
Cl-
Na+
Cl-
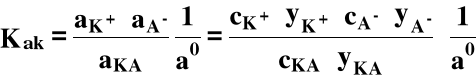
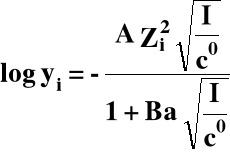
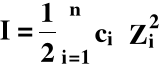
![]()
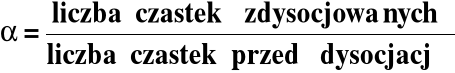
Na+
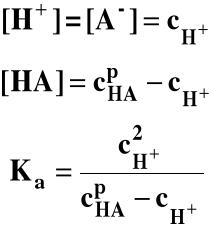
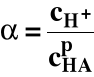
![]()
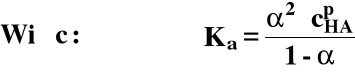
![]()
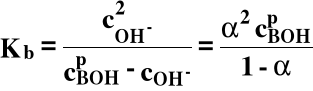
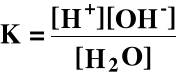
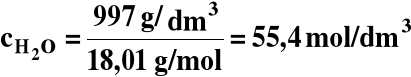
![]()
Wyszukiwarka
Podobne podstrony:
Wykład 5. Elektronowa struktura atomu, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 11b. Elektrolity - cd., chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 2. Roztwory i stężenia, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 10.Równowaga chemiczna. Prawo działania mas, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DO
Wykład 1. Wstępne pojęcia chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 4. Reakcje utleniajaco-redukcyjne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 12. Reakcje jadrowe, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 7. Okresowosc wlasciwosci pierw. chemicznych, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) D
Wykład 9. Szybkosc reakcji chemicznych, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wyklad 11a. Elektrolity, pwr biotechnologia(I stopień), I semestr, Chemia ogólna
Chemia Ogólna - PROGRAM WPC1002w (Walkowiak), Biotechnologia PWR, Semestr 1, Chemia ogólna, Chemia o
chemia wyklady2ok, Studia, Mibm, semestr I, Chemia Ogólna
Chemia - wykłady, Dietetyka CM UMK, Chemia ogólna i żywności
Wyklad 11b. Elektrolity - cd., pwr biotechnologia(I stopień), I semestr, Chemia ogólna
Elektrody, CHEMIA, semestr 1, chemia ogólna, wykłady
więcej podobnych podstron