IV. Reakcje utleniająco-redukcyjne
1. Stopnie utlenienia
Rzeczywisty stopień utlenienia |
Stopień utlenienia jest to liczba elektronów, jaką by dany pierwiastek przyjął (lub oddał) gdyby utworzone wiązanie miało charakter jonowy. Jest to wielkość umowna |
Stopnie utlenienia
tlenu -2 (z wyjątkiem nadtlenków H2O2, Na2O2),
ponadtlenków (KO2) i fluorku tlenu (OF2)
wodoru +1 (z wyjątkiem wodorków metali → -1 st. utl.)
w stanie wolnym pierwiastka 0
suma stopni utlenienia wszystkich atomów tworzących
cząsteczkę wynosi 0
cząsteczka: H2SO4
siarka: 2(+1) + x + 4(-2) = 0 x = +6
anion: Cr2O72-
chrom: 2x + 7(-2) = -2 x = +6
kation: VO2 +
wanad: x + 2(-2) = +1 x = +5
Formalny stopień utlenienia |
np. ołów w Pb3O4
tlen 4(-2) = - 8
3 atomy Pb +8
1 atom Pb +8/3
Jest to tzw. formalny stopień utlenienia. Jak to wyjaśnić?
|
|
|
|
|
|
|
|
Pb(+2) |
|
|
|
O |
|
|
Formalny stopień utlenienia nie musi być liczbą całkowitą. Tutaj wynosi on +8/3.
2. Reakcje utleniająco - redukcyjne - dobieranie współczynników
a. Metoda uproszczona
Cu + H+ + NO3- = Cu2+ + NO + H2O
redukcja
N(+5) + 3e N(+2)
utleniacz
utlenienie
Cu(0) Cu(+2) + 2e
reduktor
Uzgadniamy współczynniki dla miedzi i azotu:
3Cu + H+ + 2NO3- = 3Cu2+ + 2NO + H2O
Następnie uzgadniamy współczynniki dla H+:
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO + H2O
Na końcu uzgadniamy wsp. Dla wody:
3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO + 4H2O
b. Metoda równań połówkowych
1o Fe2+ + MnO4- + H+ = Fe3+ + Mn2+ + H2O
5x Fe2+ = Fe3+ + e utlenianie
1x MnO4- + 8H+ + 5e = Mn2+ + 4H2O redukcja
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O
2o CrO4 2- + H2O2 + ....... = CrO8 3- + .......
H2O2 w roli utleniacza (elektrony po lewej stronie)
H2O2 + 2H+ + 2e = 2H2O
3o MnO4- + H2O2 + ......... = Mn2+ + O2 + .....
H2O2 w roli reduktora (elektrony po prawej stronie):
H2O2 = 2H+ + O2 + 2e
4o Cu2S + NO3 - + ...... = Cu2+ + SO4 2-+ NO + ……
c. Reakcje dysproporcjonowania:
chlor jest jednocześnie utleniaczem i reduktorem!
Cl(+6) + e Ⴎ Cl(+5) redukcja
Cl(+6) Ⴎ Cl(+7) + e utlenianie
Cl2O6 + 2OH- = ClO3- + ClO4 - + H2O
2.2. Reakcje połówkowe - półogniwa (elektrody)
Każdą reakcję utleniająco-redukcyjną można zapisać w postaci 2 reakcji połówkowych, czyli reakcji utleniania i redukcji.
Np. w reakcji:
Fe 2+ + MnO4- + H+= Fe3+ + Mn2+ + H2O
Wyróżnić można:
redukcję: MnO4- + 8H+ + 5e → Mn2+ + 4H2O
utlenienie: Fe2+→ Fe3+ + 1e
Każda z tych połówkowych reakcji stanowić może tzw. półogniwo (elektrodę).
Utl + ne → Red
2.3. Wzór Nernsta
Każde półogniwo (elektroda) ma określoną wartość potencjału utleniająco - redukcyjnego. Wartość tego potencjału określa wzór Nernsta:
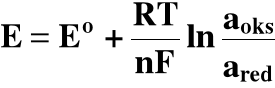
R - stała gazowa; 8,314 J/molთK
T - temperatura, K
F - stała Faradaya; 96480 C/mol
n - liczba elektronów
a - aktywności (mol/dm3) formy utlenionej (oks) i zredukowanej (red)
W roztworze w którym aoks = ared:
E = Eo : potencjał standardowy
Dla elektrody metalicznej:
Men+ + ne = Me
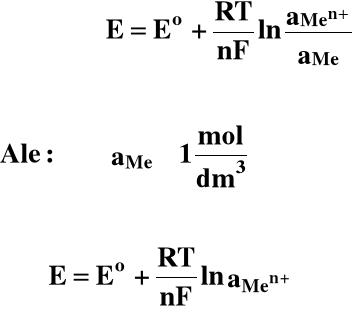
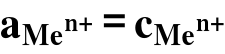
W roztworach rozcieńczonych współczynniki aktywności są równe 1,00, więc:
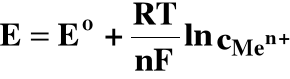
czyli:
Wzór Nernsta dla wybranych elektrod (półogniw):
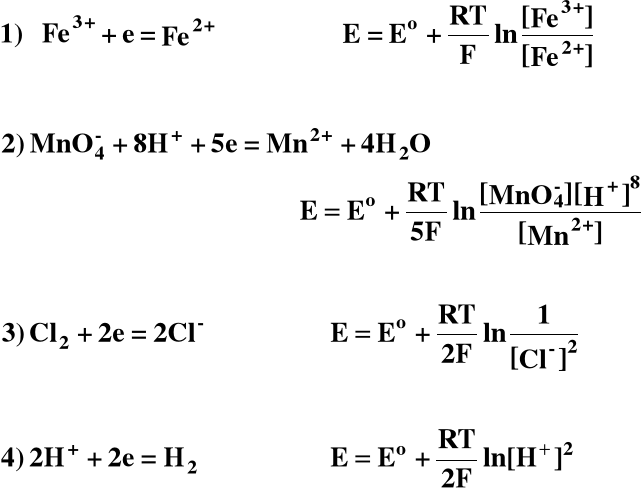
Szereg napięciowy dla wybranych metali:
silne reduktory
|
|
|
Eo , V |
metale nieszlachetne |
Na+ /Na Mg2+ /Mg Al3+/ Al Zn2+/ Zn Fe2+/ Fe Co2+/ Co Ni2+/ Ni |
Na+ + e = Na Mg2+ + 2e = Mg Al3+ + 3e = Al Zn2+ + 2e = Zn Fe2+ + 2e = Fe Co2+ + 2e = Co Ni2+ + 2e = Ni |
-2,72 -2,36 -1,66 -0,76 -0,74 -0,28 -0,25 |
|
H+/ H2 |
2H+ + 2e = H2 |
0,00 |
metale szlachetne
|
Cu2+/ Cu Ag+/ Ag Au3+/ Au |
Cu2+ + 2e = Cu Ag+ + e = Ag Au3+ + 3e = Au |
+0,34 +0,80 +1,38 |
(jony metalu) |
|
|
|
Potencjały standardowe wybranych półogniw niemetalicznych:
|
Eo, V |
NO3- + 4H+ + 3e = NO + 2H2O O2 + 2H2O + 4e = 4OH- Cl2 + 2e = 2Cl- MnO4- + 8H+ + 5e = Mn2+ + 4H2O Co3+ + e = Co2+ F2 + 2e = 2F- |
+0,96 +1,23 +1,36 +1,51 +1,84 +2,87 |
2.4. Wnioski praktyczne
Metal o niższym potencjale elektrochemiczny wypiera z roztworu metal o wyższym potencjale.
Zajdzie więc reakcja:
Fe + 2Ag+ = Fe2+ + 2Ag
Jest to tzw. proces cementacji - jony metalu bardziej szlachetnego redukujemy do postaci metalicznej za pomocą metalu mniej szlachetnego.
Nie zajdzie natomiast reakcja:
Cu + Zn2+ = Cu2+ + Zn
2) Wodór może być wydzielany z roztworu przez metale o niższym potencjale a więc metale nieszlachetne:
Al + 3H+ = Al3+ + 3/2H2
Natomiast nie zajdzie reakcja:
Cu + 2H+ = Cu2+ + H2
3) Metale szlachetne roztwarzają się dopiero przy użyciu silnych utleniaczy, np. kwasów utleniających (HNO3, stężony gorący H2SO4)
![]()
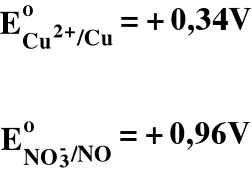
Dobrać współczynniki do tej reakcji!
4) Utleniacz z pary utl/red o wyższym potencjale utleni reduktor z pary utl/red o niższym potencjale :
Cl2 + 2Br- = 2Cl- + Br2 TAK
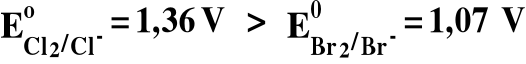
Koniec rozdz. IV-tego
Władysław Walkowiak - Chemia Ogólna, kurs WPC 1002w
15 / 15
Rozdział IV Reakcje utleniająco-redukcyjne
3e x 2
2e x 3
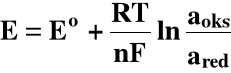
![]()
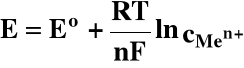
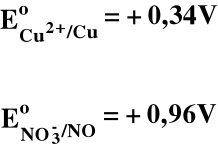
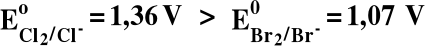
Wyszukiwarka
Podobne podstrony:
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 12. Reakcje jadrowe, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 9. Szybkosc reakcji chemicznych, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 5. Elektronowa struktura atomu, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 2. Roztwory i stężenia, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 10.Równowaga chemiczna. Prawo działania mas, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DO
Wykład 1. Wstępne pojęcia chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 11b. Elektrolity - cd., chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 11a. Elektrolity - kwasy, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 7. Okresowosc wlasciwosci pierw. chemicznych, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) D
Wyklad 4. Reakcje utleniajaco-redukcyjne, pwr biotechnologia(I stopień), I semestr, Chemia ogó
W15S-Reakcje utlenienia-redukcji, chemia, szkolka
Walkowiak, Chemia ogólna, Reakcje utleniająco redukcyjne
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
Laboratorium 4 Reakcje utleniania i redukcji, Studia - Inżynieria materiałowa, Chemia ogólna i nieor
instrukcja - REAKCJE UTLENIANIA I REDUKCJI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, l
Ćw. 10 i 11 - reakcje utleniania i redukcji - sprawko, Chemia ogólna i nieorganiczna
więcej podobnych podstron