II. ROZTWORY i STĘŻENIA
Roztwór a mieszanina.
Rozpuszczalnik, substancja rozpuszczona,
masa i gęstość roztworu.
Zmieszanie dwóch lub więcej składników daje mieszaninę. Wyróżniamy mieszaniny homo- i heterogeniczne.
Przykłady mieszanin heterogenicznych - skały, mleko. Tutaj składniki można zidentyfikować gołym okiem lub za pomocą mikroskopu.
Przykłady mieszanin homogenicznych - syrop (mieszanina cukru i wody), sól kamienna rozpuszczona w wodzie. Tutaj w żaden sposób nie można odróżnić składników mieszaniny. Mieszaniny homogeniczne noszą nazwę roztworów.
Składnik roztworu występujący w większej ilości (b. często woda) to rozpuszczalnik. Pozostałe składniki roztworu to substancje rozpuszczone. Najczęściej mamy do czynienia z roztworami wodnymi.
2. Masa i objętość i gęstość roztworu
m - masa roztworu w kg (g, Mg)
V - objętość roztworu w dm3 (cm3, m3)
d - gęstość roztworu w g/cm3 (kg/dm3, Mg/m3)
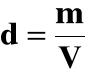
Do obliczeń i przeliczeń stężeń potrzebne są następujące definicje:
a) gęstość roztworu:
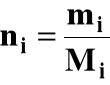
Jednostki: 1g/cm3 ≡ 1mg/dm3
b) liczność i-tego składnika roztworu w molach:
mi = masa i-tego składnika (g)
Mi = masa molowa i-tego składnika (g/mol)
Uwaga
Indeks i oznacza i-ty składnik roztworu
Wielkość bez indeksu odnosi się do całego roztworu
3. Jednostki stężeń
3.1. Ułamek wagowy (masowy). Procent wagowy (wagowy)
Ułamkiem wagowym (masowym) (wi) i-tego składnika nazywamy stosunek masy (mi) tego składnika do masy całego roztworu (m) :
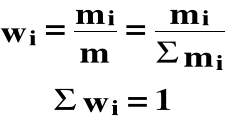
pi(wag) = wi ⋅ 100%
Procent wagowy (masowy) jest równy liczbie gramów danego składnika w 100g roztworu
UWAGA : wagowy = masowy
3.2. Stężenie molowe
Stężenie molowe (ci) i-tego składnika w danym roztworze jest to stosunek liczności (ni) tego składnika do objętości (V) całego roztworu:
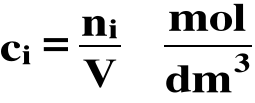
1M ≡ 1kmol/m3 ≡ 1mol/dm3 ≡ 1 mmol/cm3 ≡ roztwór 1-molowy ≡ roztwór w którym stężenie danej substancji wynosi 1 mol/dm3
3.3. Ułamek molowy. Procent molowy
Ułamek molowy (xi) jest to stosunek liczności (ni) danego składnika do sumy liczności wszystkich składników roztworu:
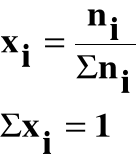
procent molowy : pi(mol) = xi ⋅ 100%
3.4. Procent objętościowy (dla gazów)
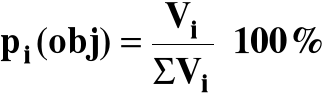
dla gazów idealnych: V = ΣVi
pi(obj) = pi(mol)
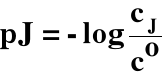
3.5. pJ (pH)
cJ → stężenie molowe jonu J
co → stężenie standardowe = 1 mol/dm3
Dla jonów H+ i OH-:
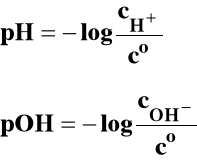
3.6. ppm* i ppb**
ppm i ppb odnoszą się tak do masy jak i objętości. W przypadku masy:
1 ppm = 1 część na milion czyli 1 mg substancji w 1 kg roztworu (mieszaniny)
1 ppb = 1 część na miliard czyli 1 μg substancji w 1 kg roztworu (mieszaniny)
1 ppm = 1000 ppb
*ppm ≡ parts per million
**ppb ≡ parts per billion
billion w j. ang. oznacza w j. pol. miliard
4. Zadania ze stężeń
Zadanie 1 - Stężenie molowe
1,50 g stopu zawierającego 60,0 % aluminium roztworzono w nadmiarze wodorotlenku sodu otrzymując 250 cm3 roztworu. Oblicz stężenie molowe glinianu sodu w tym roztworze.
Rozwiązanie:
Aluminium jako metal amfoteryczny roztwarza się w roztworach wodnych mocnych wodorotlenków:
Al + OH- + 3H2O = Al(OH)4- + 3/2 H2
Z tej reakcji wynika, że:
1 Al → 1 Al (OH)4-
1 mol Al → 1 mol glinianu
nAl = nAl(OH)4
Masa aluminium w stopie:
mAl = 1,50 g · 60,0 g / 100 % = 0,9000 g
Liczność aluminium:
nAl = 0,9000 g / 26,98 g/mol = 0,03336 mola
Jest to także liczność glinianu!
Stężenie molowe glinianu:
c = 0,03336 mol / 0,250 dm3 = 0,1334 mol/dm3
= 0,133 M
Zadanie 2 - rozcieńczanie roztworu stężonego
Do 200 cm3 22,4% -go roztworu HNO3 o gęstości 1,135 g/cm3 dodano 1,00 dm3 wody, otrzymując roztwór o gęstości 1,025 g/cm3. Jakie jest pH?
Rozwiązanie
Obliczamy liczność początkową HNO3 :
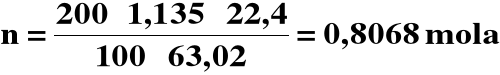
2) Obliczamy objętość końcową roztworu :
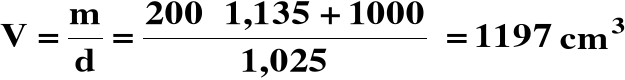
3) Obliczamy stężenie końcowe HNO3 :
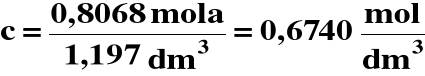
4) Obliczamy pH :
pH = -log[H+] = -log 0,6740 ⋅ 0,1713 = 0,171
Zadanie 3 - mieszanie roztworów
Zmieszano 100 cm3 2,00M roztworu H2SO4 o gęstości 1,18 g/cm3 z 200 cm3 kwasu siarkowego o xH2SO4 = 0,025 i gęstości 1,12 g/cm3.
Oblicz stężenie molowe jonów wodorowych w roztworze po zmieszaniu (d = 1,15 g/cm3).
Rozwiązanie
1) Obliczamy liczność H2SO4 w pierwszym roztworze :
n = c ⋅ V = 0,100 ⋅ 2,00 = 0,200 mola
2) Obliczamy masę drugiego roztworu :
m = 200 ⋅ 1,129 = 225,8 g
Obliczamy masę H2SO4 w drugim roztworze:
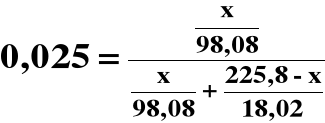
0,01020x = 2,549⋅10-4x + 0,3133 - 1,387⋅10-3x
0,01133x = 0,3133
x = 27,65 g
Obliczamy liczność H2SO4 w drugim roztworze:
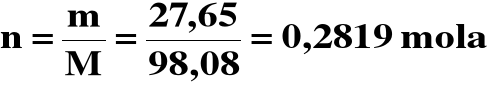
5) Liczność sumaryczna H2SO4:
n = 0,2000 + 0,2819 = 0,4819mola
Obliczamy objętość roztworu końcowego:
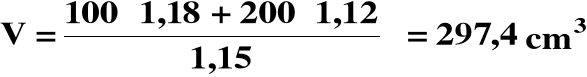
Stężenie końcowe H2SO4:
8) Stężenie końcowe H+:
Zakładamy, że kwas siarkowy ulega całkowitej dysocjacji dwustopniowej:
c = 2 × 1,620 ⋅ 3,240 = 3,24 mol/dm3
Koniec rozdz. II-go
Władysław Walkowiak - Chemia Ogólna WPC 1002w
15 / 15
.
Rozdz. II. Roztwory i stężenia
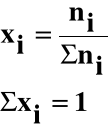
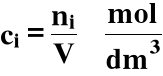
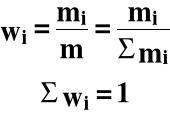
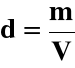
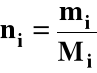
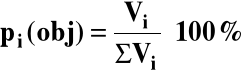
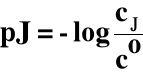
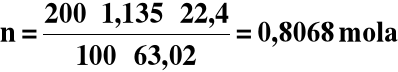
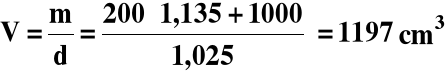
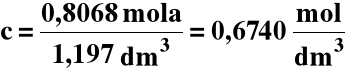
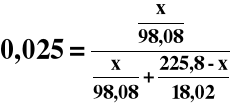
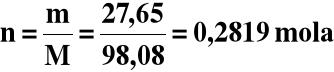
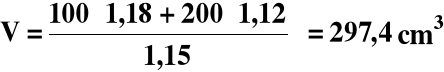
Wyszukiwarka
Podobne podstrony:
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 5. Elektronowa struktura atomu, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 10.Równowaga chemiczna. Prawo działania mas, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DO
Wykład 1. Wstępne pojęcia chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 11b. Elektrolity - cd., chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 11a. Elektrolity - kwasy, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 4. Reakcje utleniajaco-redukcyjne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 12. Reakcje jadrowe, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 7. Okresowosc wlasciwosci pierw. chemicznych, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) D
Wykład 9. Szybkosc reakcji chemicznych, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wykład 3. Reakcje chemiczne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Wyklad 2. Roztwory i stezenia, Inżynieria środowiska, inż, Semestr I, Chemia ogólna
Chemia Ogólna - PROGRAM WPC1002w (Walkowiak), Biotechnologia PWR, Semestr 1, Chemia ogólna, Chemia o
wyklad 11, Studia, Chemia Ogólna, Chemia Ogólna - notatki z wykładów, wykłady
Wyklad 2 Roztwory i stężenia
Roztwory, CHEMIA, semestr 1, chemia ogólna, wykłady
pH roztworów wodnych, CHEMIA, semestr 1, chemia ogólna, wykłady
więcej podobnych podstron