POCHODNE WĘGLOWODOROW
Przykładowe zadania sprawdzające:
1. Zapisz równania następujących reakcji oraz podaj nazwy systematyczne produktów organicznych:
a/ pentan-2-ol ![]()
b/ 3-chloro-2-metylopentan + KOH ![]()
c/ propen + woda ![]()
2. Używając wzorów strukturalnych, napisz równania reakcji przedstawione schematami:
a/ propan → 2-bromopropan → propan-2-ol
b/ but-1-en → 2-bromobutan → butan-2-ol → but-2-en
c/ propan → 1-chloropropan → propan-1-ol → propan-1-olan potasu
d/ but-2-yn → but-2-en → butan-2-ol
3. Ułożyć równania kolejnych reakcji, jakie należy przeprowadzić, aby otrzymać:
a/ glikol, mając do dyspozycji etan i dowolne odczynniki nieorganiczne,
b/ etanolan potasu, mając do dyspozycji etan i dowolne odczynniki nieorganiczne,
c/ glikol, mając do dyspozycji etanol i dowolne odczynniki nieorganiczne,
d/ metanolan sodu, mając do dyspozycji metan i dowolne odczynniki nieorganiczne,
e/ butan-2-ol, mając do dyspozycji etan i dowolne odczynniki nieorganiczne.
4. Narysuj wzory strukturalne i podaj nazwy wszystkich możliwych alkoholi o wzorze sumarycznym C4H8(OH)2.
5. Za pomocą wzorów półstrukturalnych podaj 5 przykładów alkoholi III-rzędowych oraz ich nazwy, będącymi względem siebie izomerami o wzorze sumarycznym C9H19OH.
6. Przemysłowe otrzymywanie metanolu i etanolu oraz ich zastosowanie.
7. W reakcji z litem przereagowało całkowicie 2,2 g n-alkanolu i otrzymano 280 cm3 wodoru (warunki normalne). Ustal masę molową i wzór tego alkanolu.
8. Spalono 2,2 g alkanolu o masie molowej 88 g/mol i otrzymano 5,5 g CO2 i 2,7 g H2O. Ustal wzór sumaryczny tego alkanolu.
9. Metanol uzyskany w reakcji wodoru z 560 m3 tlenku węgla(II) odmierzonego w warunkach normalnych wprowadzono do 2400 m3 wody. Oblicz stężenie procentowe otrzymanego roztworu.
10. Oblicz, ile kg spirytusu, będącego 95% wodnym roztworem etanolu, można wyprodukować z 56 m3 etylenu (warunki normalne).
11. Napisz równania reakcji na schemacie:
a/ skrobia → glukoza → etanol
12. Oblicz masę etanolu, którą można teoretycznie otrzymać z 1 t ziemniaków zawierających do 24,3% skrobi. Przyjmij 100-procentową wydajność wszystkich procesów.
13. Ustal wzory strukturalne oraz nazwy wszystkich alkanali o wzorze sumarycznym C5H10O.
14. Oblicz, ile srebra powstanie podczas utleniania tlenkiem srebra 10 g formaliny (30% roztworu metanalu), przyjmując, że cała ilość metanalu zawartego w formalinie uległa utlenieniu.
15. Uzupełnij równania następujących reakcji:
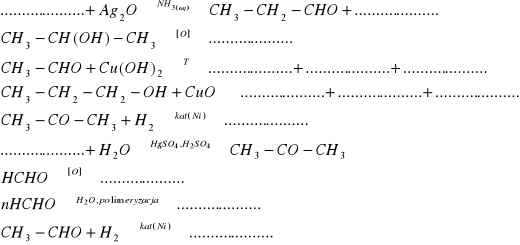
16. Wykonano dwa doświadczenia, biorąc metanol jako substrat każdego z nich oraz różne substancje o charakterze utleniającym. W I doświadczeniu otrzymano związek ciekły o masie molowej 46g/mol, w drugim - związek gazowy o gęstości 1,34 g/dm3 (w przeliczeniu na warunki normalne). Ustal wzory strukturalne produktów pierwszej i drugiej reakcji. W której z nich zastosowano silniejszy utleniacz.
17. Aceton (propanon) zmieszany z roztworem jodu i zasady sodowej ulega reakcji jodoformowej, charakterystycznej dla związków chemicznych zawierających ugrupowanie CH3CO-. Produktami reakcji są jodoform (trijodometan), substancja stała barwy żółtej stosowana jako środek dezynfekcyjny, oraz octan sodu CH3COONa, woda i jodek sodu. Napisz równanie tej reakcji.
18. Podaj wzory półstrukturalne oraz nazwy trzech alkanonów zawierających 7 atomów węgla w cząsteczce.
19. W jakim stosunku objętościowym należy zmieszać pary acetonu z powietrzem, aby po zainicjowaniu reakcji spalania przebiegła ona całkowicie.
20. Aceton reaguje z bromem w reakcji podstawienia, tworząc bromopropanon, lotną ciecz, której pary są środkiem drażniącym, powodującym silne łzawienie. Ile bromopropanonu można otrzymać, mieszając 5 cm3 acetonu (gęstość 0,78 g/cm3) z 4 cm3 bromu (gęstość 3,13 g/cm3)?
21. Poddano utlenianiu dwa związki organiczne według następujących schematów:
a) ![]()
b) ![]()
Podaj wzory półstrukturalne i nazwy związków A i B.
Zaprojektuj doświadczenie, które pozwoli Ci odróżnić związki A i B.
Przedstaw: substraty potrzebne do przeprowadzenia wybranego doświadczenia oraz warunki przebiegu reakcji, schematyczny rysunek, przewidywane spostrzeżenia, równania reakcji.
22. Które z właściwości alkoholi wzrastają zgodnie z pokazanym kierunkiem?
rozpuszczalność w wodzie
gęstość
temperatura wrzenia
23. Podaj wzory półstrukturalne związków o następujących nazwach:
2-metylopentanal; pentan-1-ol; 2-chloropropanal; kwas propenowy; kwas 2-metylobutanowy; kwas n-pentanowy; 4-metyloheksan-2-on; aceton; palmitynian metylu; octan etylu; tristearynian gliceryny; maślan izopropylu; trioleinian gliceryny.
24. Dokończ podane równania reakcji lub napisz, że reakcje nie zachodzą:
CH3COONa + HCOOH →
(CH3COO)2Ba + Na2SO4 →
(HCOO)2Cu + NaOH →
C2H5OH + CuO →
CH3OH + KOH →
CH3COOC2H5 + KOH →
CH3CH2OH + Na →
HCOOH + Mg(OH)2→
CH3CHO + Cu(OH)2 →
C2H5COOC2H5 + H2O →
CH3-CH2-CH2-Cl + KOH(r-r wodny) →
C6H5OH + HNO3 →
C6H5-CH3 + Cl2(św) →
CH3-CHO + Ag2O →
CH3-CH2-CHO + H2 →
CH3-CH(OH)-CH2-CH3 + Na →
CH3OH + HBr →
25. Uzupełnij brakujące reagenty i dobierz współczynniki stechiometryczne:
CH3-COOH + .................. → CH3-COOCH2CH3 + ………………
CH3-COOH → ……………... + …………………
![]()
…………………. + ………………… → C3H7COOCH3 + …………………
26. Podaj właściwości fizyczne: metanolu, etanolu, fenolu, metanalu, kwasu mrówkowego, kwasu octowego, kwasu stearynowego, tłuszczów, estrów, itd.
27. Napisz równania reakcji wyjaśniające powstawanie osadu podczas używania mydła w twardej wodzie.
28. Które z wymienionych substancji poddane działaniu NaOH tworzą mydło:
łój, stearyna, parafina
Napisz równania odpowiednich reakcji.
29. Które z właściwości kwasów wzrastają zgodnie z pokazanym kierunkiem?
gęstość
rozpuszczalność w wodzie
moc tych kwasów
30. Ułóż równania reakcji kwasu octowego z: magnezem, tlenkiem sodu, wodorotlenkiem potasu.
31. Ustal wzór alkanalu, wiedząc, że w wyniku reakcji 1,45 g tego związku z amoniakalnym roztworem tlenku srebra powstaje 5,4 g srebra.
32. W reakcji estryfikacji, zachodzącej z udziałem kwasu masłowego, otrzymano ester o masie molowej 130 g/mol. Podaj wzór sumaryczny alkanolu, który został użyty w tej reakcji.
33. Zapisz równania kolejnych reakcji jakie należy przeprowadzić, aby otrzymać:
octan etylu, mając do dyspozycji etan i dowolne odczynniki nieorganiczne
mrówczan potasu, mając do dyspozycji metan i dowolne substancje nieorganiczne
chlorotoluen, mając do dyspozycji acetylen i dowolne odczynniki nieorganiczne
Ciąg przemian zapisz za pomocą schematu i podaj nazwy związków organicznych powstających w tych reakcjach.
34. Hydroliza estrów. Zapisz równania hydrolizy zasadowej i kwasowej wybranego przez siebie estru. Jakie produkty powstają w wyniku tych reakcji?
35. Ustal masę molową i wzór n-alkanolu, wiedząc, że w reakcji 9 g tego związku z sodem wydziela się 1,68 dm3 wodoru (warunki normalne).
36. Ustal wzór strukturalny kwasu z szeregu kwasu mrówkowego, wiedząc, że w 250 cm3 roztworu o stężeniu 0,1 mol/dm3 znajduje się 2,55 g tego kwasu.
37. Zapisz równania reakcji na schemacie:
węglowodór nienasycony → alkohol → aldehyd → kwas karboksylowy → octan metylu
↓ ↓
monochlorowcopochodna sól wapniowa
węglowodoru
38. Oblicz, jaka objętość wodoru (warunki normalne) jest potrzebna do całkowitego uwodornienia 10 kg trioleinianu glicerolu.
39. Podaj przykład tłuszczu stałego i ciekłego. Dlaczego tłuszcze ciekłe można utwardzać oraz dlaczego odbarwiają wodę bromową? Zapisz równania odpowiednich reakcji.
40. Co to jest reakcja zmydlania tłuszczów. Zapisz równanie reakcji zmydlania tripalmitynianu gliceryny.
Ile mydła sodowego można otrzymać w tej reakcji z 1 kg tripalmitynianu gliceryny.
41. Zalewę octową do marynat sporządza się z 4% octu. Oblicz:
a/ ile wody i ile 10% octu potrzeba do otrzymania 1 dm3 zalewy octowej,
a/ ile wody trzeba dodać do 0,5 dm3 6% octu, aby otrzymać zalewę octową o odpowiednim stężeniu. Przyjmij, że gęstość roztworów octu i wody wynosi około 1 g/cm3.
42. Ustal wzór strukturalny kwasu z szeregu kwasu mrówkowego, wiedząc, że w 250 cm3 roztworu o stężeniu 0,1 mol/dm3 znajduje się 2,55 g tego kwasu.
43. Zapisz równania następujących reakcji:
kwas octowy + wapń
kwas masłowy + potas
kwas palmitynowy + wodorotlenek sodu
kwas mrówkowy + tlenek miedzi(II)
otrzymywania kwasu octowego w reakcji fermentacji octowej
kwasu propionowy + etanol
kwasu mrókowy + propan-1-ol (alkohol izopropylowy)
gliceryna + kwas stearynowy
hydrolizy kwasowej octanu etylu
kwasu propionowy + fenol
kwas benzoesowy + wodorotlenek baru
hydrolizy zasadowej maślanu izopropylu
zmydlania tristearynianu gliceryny
utwardzania trioleinianu gliceryny
prażenia stałego octanu sodu ze stałym NaOH w obecności tlenku wapnia
44. Zapisz równania kolejnych reakcji, jakie należy przeprowadzić, aby otrzymać:
mrówczan metylu, mając do dyspozycji metan i dowolne odczynniki nieorganiczne,
kwas octowy, mając do dyspozycji acetylen i dowolne odczynniki nieorganiczne.
45. W wyniku chlorowania propanu otrzymano mieszaninę monochlorowcopochodnych,
z których, działając roztworem NaOH, otrzymano mieszaninę alkoholi. Na produkty powstałe w wyniku utlenienia 3,0 g tej mieszaniny podziałano na gorąco wodorotlenkiem miedzi(II), otrzymując 5,4 g tlenku miedzi (I). Podaj skład procentowy mieszaniny chlorowcopochodnych powstałych w wyniku chlorowania propanu. Przyjmij, że w wyniku utlenienia mieszaniny alkoholi powstają dwa związki chemiczne.
46. W celu zobojętnienia 6,6 g pewnego kwasu alkanowego zużyto 75 cm3 roztworu KOH o stężeniu 1 mol/dm3. Ustal skład grupy węglowodorowej w tym kwasie.
47. Stopień dysocjacji w roztworze kwasu mrówkowego, o stężeniu 0,2 mol/dm3 wynosi 5%. Oblicz pH tego roztworu.
48. Ogrzewając z roztworem zasady sodowej 2,20 g estru, nie odbarwiającego wody bromowej, otrzymano 2,05 g soli i 1,15 g alkoholu. Oblicz masę molową estru i określ jego wzór strukturalny oraz nazwę.
49. W reakcji estryfikacji, zachodzącej z udziałem kwasu masłowego, otrzymano ester o masie molowej 130 g/mol. Podaj wzór sumaryczny alkanolu, który został użyty w tej reakcji.
50. Z 1 mola toluenu w wyniku utlenienia dwuchromianem (VI) potasu w środowisku kwaśnym otrzymano 91,5 g kwasu benzoesowego. Oblicz, ile procent toluenu uległo reakcji.
Do przeprowadzenia, w takich samych warunkach, redukcji wodorotlenku miedzi(II) do tlenku miedzi(I) użyto w jednym doświadczeniu 10cm3 1-molowego roztworu glukozy, w drugim 10 cm3 1-molowego roztworu metanalu. Oblicz masę powstałego tlenku w każdym z doświadczeń, jeżeli glukoza i metanal przereagowały całkowicie. Czy szybkość przebiegu reakcji w obu doświadczeniach była taka sama? Odpowiedź uzasadnij.
51. Oblicz masę glukozy, która uległa fermentacji do etanolu, jeżeli otrzymano 460 kg 96,5% roztworu tego związku.
52. Określ liczbę stereoizomerów: rybozy, deoksyrybozy występujących w formie łańcuchowej i w formie cyklicznej.
53. Przeciętna zawartość cukru w burakach wynosi 16,0%, a z 1 tony buraków produkuje się około 123 kg cukru. Jaki procent cukru zostaje wyodrębniony z buraków?
54. Szacunkowo obliczono, że w wyniku procesu fotosyntezy rośliny zielone na Ziemi dostarczają rocznie około 270 miliardów ton tlenu. Przyjmując, że substratami fotosyntezy są dwutlenek węgla i woda, a produktami glukoza i tlen, oblicz masę glukozy, jaką produkują rośliny, oraz objętość pochłanianego przez nie dwutlenku węgla.
55. W wyniku częściowego przebiegu reakcji hydrolizy 68,4 g sacharozy otrzymano 70,2 g mieszaniny sacharozy, glukozy i fruktozy. Oblicz skład tej mieszaniny w procentach masowych.
56. Oblicz masę etanolu, którą można teoretycznie otrzymać z 1 tony ziemniaków zawierających do 24,3% skrobi. Przyjmij 100% wydajność wszystkich procesów.
57. Oblicz masę kwasu, który powstał z glukozy podczas wykonywania próby Trommera, jeśli otrzymano równocześnie 3,6 g tlenku miedzi(I).
58. Cukier (sacharozę) otrzymuje się z wydajnością 85% z trzciny cukrowej i z buraków cukrowych, które zawierają przeciętnie 16% cukru. Oblicz, ile buraków i trzciny trzeba było przerobić, aby otrzymać 60 milionów ton cukru - roczną produkcję światową tego związku chemicznego.
59. Formy cykliczne glukozy, fruktozy, sacharozy, maltozy, celobiozy. Budowa a właściwości redukujące węglowodanów. Skrobia i celuloza.
CH3OH, C2H5OH, C3H7OH, C4H9OH, C5H11OH
CH3COOH, C2H5COOH, C3H7COOH, C4H9COOH
Wyszukiwarka
Podobne podstrony:
2009 nowy program organiczna, Szkoła Rolnictwo studia, Szkoła, Materiały studia, materialy - biotech
sciaga bialaka, Szkoła Rolnictwo studia, Szkoła, Materiały studia, materialy - biotechnologia, Chemi
ccukry, Szkoła Rolnictwo studia, Szkoła, Materiały studia, materialy - biotechnologia, Chemia organi
Chemia organiczna - office 2003, Szkoła Rolnictwo studia, Szkoła, Materiały studia, materialy - biot
mol, Szkoła Rolnictwo studia, Szkoła, Materiały studia, materialy - biotechnologia, Chemia nieorgani
iloczynjonowywody, Szkoła Rolnictwo studia, Szkoła, Materiały studia, materialy - biotechnologia, Ch
Chemia org. - Izomeria optyczna 2, Studia - materiały, semestr 2, Chemia, Organiczna
Zestaw treningowe nr 2 do sprawdzianu S2, WNOŻCiK (moje studia), Semestr II, Chemia organiczna
dibenzylidenoaceton, studia, bio, 2rok, chemia organiczna, laborki
Barwniki azotowe, Materiały, Chemiczne, Chemia organiczna
Krystalizacja, Materiały, Chemiczne, Chemia organiczna
AMIDY-KWASOWE, Materiały, Chemiczne, Chemia organiczna
więcej podobnych podstron