POLAROGRAFIA
84. Podaj definicję konduktometrii, opisz budowę i zasadę działania aparatury. Omów przypadki miareczkowania konduktometrycznego, podaj przykłady praktycznych zastosowań.
Konduktometria jest metodą analityczną polegającą na pomiarze przewodnictwa r-ru między dwoma elektrodami obojętnymi. Ma ona ograniczone możliwości analityczne, gdyż można ją stosować jedynie w przypadku pomiaru stężenia elektrolitów prostych. Oporność: R=ρl/s[Ω], oporność właściwa: ρ=Rs/l [Ωcm], przewodnictwo właściwe:Χ=1/F [Ω-1cm-1], przewodnictwo równoważnikowe: λ=X/c[Ω-1cm2gR-1]; λ=λK++λA-. Pomiaru przewodnictwa dokonuje się w specjalnych naczyńkach pomiarowych, wktórych dwie elektrody umieszczone są w stałej odległości od siebie. Naczyńko pomiarowe można scharakteryzować jego oporem (wzór wyżej), gdzie l/s=k, k - stała naczyńka konduktometrycznego. Wyznacza się ją mierząc opór r-ru wzorcowego o określonym stężeniu i znanym przewodnictwie właściwym. Do pomiarów przewodnictwa stosuje się układy oparte na zasadzie Kohlorauscha. Zastosowanie: strąceniowe oznaczanie siarczków w wodzie, halogenków w wodzie, potasu, kompleksometryczne oznaczanie: Ca2+, Mg2+, Ba2+, Cu2+, za pomocą EDTA.
Napięcie oscylatora 1 przyłożone jest do elektrod 2 znajdujących się w naczyńku konduktometrycznym i połączonym z nimi szeregowo opornika pomiarowego 3. Przez zmianę oporu pomiarowego ustala się zakres pomiarowy przyrządu. Napięcie z opornika pomiarowego dochodzi przez wzmacniacz 4 i prostownik 5 do rejestratora 6. Wartość przewodnictwa odczytuje się na skali; zawarte są w granicach 1,5*10-6÷1*10-1. Aparat wyposażony jest w elektrodę dzwonową.
Konduktometria bezkontaktowa - w zależności od częstotliwości stosowanego prądu można ją podzielić na:
Konduktometria bezkontaktowa o małej częstotliwości (100 Hz),
O wysokiej częstotliwości - oscylometria
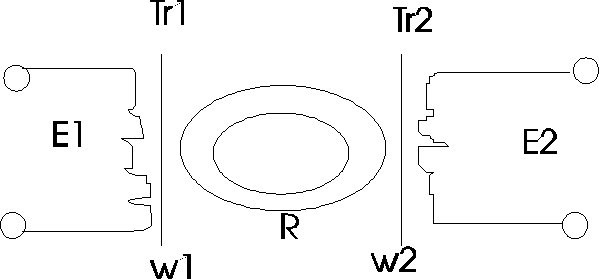
Wykonana z dielektryka rura, tworząca zamknięty obwód jest wypełniona badanym roztworem elektrolitu. W dwóch miejscach rury umieszczone są cewki transformatorów - wzbudzającego Tr1 i pomiarowego Tr2. Wskutek powstającego w transformatorze Tr1 pola elektromagnetycznego w rurze wypełnionej cieczą indukuje się siła elektromotoryczna e1 i prąd I1; I1=E1/R, gdzie R - opór cieczy wypełniającej rurę. e1=k1*E1 stąd I1=k1(E1/R). Konduktometry te pozwalają mierzyć wartość przewodnictwa r-ru elektrolitów w przypadku, gdy nie jest wskazane zetknięcie się roztworu badanego z elektrodami.
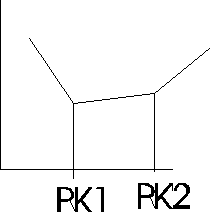
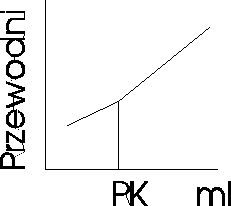
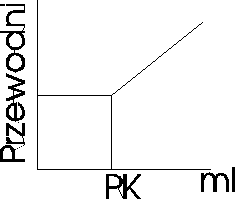
Miareczkowanie konduktometryczne: polega na obserwacji zmian przewodnictwa r-ru miareczkowanego. Zmiany te wynikają ze zmian stężenia jonów badanych oraz zmiany jonów o określonej ruchliwości na jony o ruchliwości innej niż jony pierwotne obecne w r-rze. Miareczkowanie strąceniowe A++B-+C++D-↔AD+C++D-, w którym kation A+ soli AB zostaje strącony anionem D-soli CD.
Miareczkowanie kwas - zasada
Mocny kwas - mocna zasada lub odwrotnie
H++X-+M++OH-=H2O+M++X-
Słaba zasada i słaby kwas lub odwrotnie
CH3COOH+NH4OH=NH4++CH3COO-+H2O
Słaby kwas i mocna zasada lub odwrotnie
CH3COOH+Na++OH-=CH3COO-+Na++H2O
Mieszaniny kwasów lub zasad różniących się stałą dysocjacji
79. Zasada metod woltamperometrycznych, zasady doboru elektrod wskaźnikowych.
Woltamperometria to metody elektrochemiczne stosowane w analizie chemicznej, oparte na zjawiskach zachodzących w ukł., w którym jedna z elektrod ulega polaryzacji. Zjawiska takie bada się w oparciu o krzywe zależności natężenia prądu od przyłożonego napięcia. Jedną z tych metod jest polarografia.
Wybór elektrody wskaxnikowe zależy od badanego zakresu potencjałów. W zakresie potencjałów dodatnich stosuje się elek. platynową (+0,65V÷-0,45V), w zakresie potencjałów ujemnych stosowana jest rtęciowa (+0,25V÷-2,6V).
82. Wymień zalety oraz wady kroplowej elektrody rtęciowej.
KER składa się z kapilary połączonej elastycznym wężem ze zbiornikiem rtęci. Zalety:
Powierzchnia kropli jest odnawiana ciągle, a produkty usuwane są z kroplą,
Mała powierzchnia elektrody powoduje, że natężenie prądu płynącego przez r-r jest bardzo małe, dlatego tylko niewielka ilość jonów ulega elektrolizie i skład r-ru nie ulega zmianie.
Rtęć jako metal szlachetny nie reaguje z większością r-rów,
KER zanurzona w r-rze wodnym umożliwia badanie w zakresie potencjałów względem NEK od +0,4 do -2,6V w r-rach obojętnych i zasadowych (rozpoczyna się elektroliza wody), zastosowanie rozpuszczalników organicznych pozwala na pracę do potencjału -3V.
Wady:
Małe ilości r-ru wodnego mają tendencję do przenikania do wnętrza kapilary między ścianką a słupkiem Hg, powoduje to wahania natężenia prądu,
Wskutek spadania kropli rtęci następuje pulsowanie natężenia prądu.
83. W jaki sposób można rozsunąć fale polarograficzne badanego roztworu.
Gdy skład r-ru próbki powoduje wzajemny wpływ poszczególnych jonów na przebieg fal polarograficznych konieczne jest wstępne rozdzielenie chemiczne oznaczanych składników. Przeprowadza się to wtedy, gdy oba składniki oznaczane zawarte w próbce są w ilościach znacznie różniących się między sobą oraz kiedy potencjały półfal składników są bliskie. Poza tym czynniki kompleksujące dodane do elektrolitu podstawowego wpływają na zwiększenie odległości między odpowiednimi falami na polarogramie.
80. Podaj interpretacje polarogramu katodowego, anodowego, oraz katodowo-anodowego, w jakich warunkach powstają.
Jeżeli badany składnik r-ru ulega redukcji na KER, która jest katodą, to otrzymujemy polarogram katodowy. Doświadczenie można przeprowadzać także ze składnikami r-ru ulegającymi utlenieniu, jeżeli KER podłączy się w obwodzie jako anodę, otrzymujemy wtedy falę anodową. Fala katodowa występuje na polarogramie w obszarze dodatnich natężeń prądu (od 0 wzwyż), natomiast fala anodowa znajduje się w obszarze ujemnych natężeń prądu (do 0). Można wykonywać także doświadczenia jeśli obie postacie utleniona i zredukowana danego składnika obecne są w r-rze w jednakowych stężeniach. Otrzymana w ten sposób fala przebiega od wartości ujemnych do dodatnich natężenia prądu. Jest to fala katodowo-anodowa.
81. podaj zasady doboru elektrolitu podstawowego.
Najczęściej stosowanymi elektrolitami są sole sodu i potasu, bufory amonowe oraz wodorotlenki czteroalkiloamoniowe. Zawiera ponadto czynniki tłumiące maksima tj żelatynę oraz substancje redukujące tlen np.: siarczyn sodu, metale. Dodaje się także czynniki kompleksujące wpływające na zwiększenie odległości między odpowiednimi falami na polarogramie.
UV-VIS
26. Zdefiniuj metodę spektroskopii absorpcyjnej w zakresie UV-VIS i objaśnij mechanizm powstawania elektronowego widma absorpcyjnego. Wymień zalety i ograniczenia spektroskopii w zakresie UV-VIS.
Spektroskopia absorpcyjna polega na pomiarze względnej ilości światła przepuszczonego przez próbkę jako funkcje długości fali stosowanego promieniowania. Zalety:
Niedroga i dostępna aparatura,
Czułość oznaczeń>10-6mol/dm3,
Dokładność oznaczeń około 2%
Dobra powtarzalność pomiarów,
Nieskomplikowana i szybka analiza,
Nieniszcząca metoda badań,
Krótki czas szkolenia obsługi.
Ograniczenia:
Zastosowanie ograniczone do substancji absorbujących UV i VIS,
Kłopotliwa analiza mieszanin,
Próbka musi być homogeniczna,
Materiały optyczne muszą być przepuszczalne dla promieniowania UV.
Prawdopodobieństwo przejść między stanami określa reguła wyboru:
Aby nastąpiła absorpcja promieniowania muszą istnieć takie dwa stany kwantowe ψm i ψn, których różnica odpowiada energiipromieniowania padającego.
Absorpcja promieniowania jest związana ze zmianą momentu dipolowego cząsteczki Rnm=∫ψnψmdτ. W zw. org. absorpcja jest związana z przejściem elektronów walencyjnych σ i Π oraz wolnych par elektronowych. W kompl. metali d elektronowych powłoka d posiada 5 orbitali o jednakowej energii. W wyniku oddziaływania kationu z ligandem wówczas zdegenerowane orbitale d rozszczepiają się na grupy o różnych energiach, a przejścia są uwarunkowane absorpcją lub emisją promieniowania.
27. Przedstaw podział aparatury do analizy absorpcyjnej w UV-VIS i scharakteryzuj poszczególne grupy przyrządów.
W zależności od budowy absorpcjometry można podzielić na 3 grupy: absorpcjometry wizualne - kolorymetry; absorpcjometry fotoelektryczne - fotokolorymetry; spektrofotometry. Metody stosujące odpowiednie przyrządy przyjęto określać mianem kolorymetrii, fotokolorymetrii i spektrofotometrii. Poszczególne grupy przyrządów różnią się szczegółami budowy ale wszystkie mają zasadnicze elementy budowy:
źródło promieniowania,
regulacja natężenia promieniowania,
regulacja długości światła padającego (monochromator),
pomieszczenie dla substancji badanej,
detektor,
wskaźnik lub rejestrator.
W fotometrii używamy: kolorymetrów VIS i fotokolorymetrów VIS. W spektrofotometrii używamy spektrofotometrów punktowych (jednowiązkowych) i spektrofotometrów samorejestrujących (dwu wiązkowych). W przyrządach jednowiązkowych prąd fotoelektryczny powstały w detektorze (fotokomórka lub fotopowielacz), ma wysokoomowy opornik, na którym powstaje spadek napięcia. Spadek napięcia kompensuje się napięciem z potencjometru. Jako przyrząd zerowy stosuje się jednokierunkowy zasilacz z miliamperomierzem. Potencjometr pomiarowy jest kalibrowany w procentach przepuszczalności lub absorbancji. W przyrządach dwuwiązkowych promieniowanie ze źródła dzieli się na dwie wiązki równoległe. Źródło promieniowania musi pokryc cały zakres UV VIS. Stosujemy lampy deuterowe, wolframowo-halogenowe, wysokociśnieniowe łukowe lampy ksenonowe. Monochromator ma wybrać z emitowanego przez źródło promieniowania wąskie pasmo o żądanej długości fali. Składa się ze szczeliny wejściowej kolimatora, elementu rozszczepiającego promieniowanie i szczeliny wyjściowej. Funkcje kolimatora pełnią zwierciadła aby uzyskać wiązkę równoległą. Elementem rozszczepiającym jest siatka dyfrakcyjna. Absorpcję bada się w kiuwetach. Powinna ona: zapewnić dokładną grubość warstwy absorbującej, wykazywać odporność na działanie substancji chemicznych, zapewniać w max stopniu transmisję. Detektory - przetwarzają energię promieniowania elektromagnetycznego na energie elektryczną. Fotokomórki - detektory oparte na zjawisku fotoelektrycznym zewnętrznym. Fotopowielacze - wykorzystują zjawisko wtórnej emisji elektronów.
28. Wymień i podaj główne charakterystyki źródeł światła stosowanych w aparatach do spektroskopii UV, VIS oraz omów techniki pomiarowe intensywności światła stosowane w aparatach do badania absorpcji promieniowania elektromagnetycznego.
W kolorymetrach źródłem światła jest zazwyczaj żarówka lub światło słoneczne. W fotokolorymetrach stosuje się lampy wolframowe i rtęciowe. W spektrofotometrach używa się lampy wolframowej (zakres widzialny i bliska podczerwień). Emituje ona promieniowanie ciągłe w zakresie od 380 do 2500 nm. W zakresie nadfioletu od 180 do 380 nm źródłem promieniowania ciągłego są lampy deuterowe. Źródłem promieniowania dla dla zakresu widzialnego i nadfioletu jest wysokociśnieniowa lampa ksenonowa. Używa się także: lampę rtęciową UV, argonową UV-VIS, żarową VIS.
Pomiary fotometryczne można wykonywać kilkoma sposobami, a mianowicie:
Metodą wychyleniową (różnica w absorpcji rozpuszczalnika i badanej substancji przejawia się wychyleniem odpowiedniego urządzenia - galwanometru).
Metodą kompensacyjną (różnicę w absorbancji kompensuje się elektrycznie - potencjometrem albo optycznie - przesłoną. Absorbancję i stężenie określa się na podstawie wartości przesuwu potencjometru lub przesłony).
Metodą podstawiania (można stosować przy pomiarze na przyrządach jednowiązkowych i dwuwiązkowych. Nastawia się największą przepuszczalność na czysty rozpuszczalnik, a następnie układa się próbke i rejestruje wychylenie galwanometru. Po ponownej wymianie próbki na czysty rozpuszczalnik wsuwa się kalibrowany klin do strumienia świetlnego tak aby osiągnąć to samo wychylenie galwanometru. Ze skali odczytuje się odpowiadającą wartość %T lub A.
29. Zdefiniuj zasadnicze różnice między kolorymetrem, fotometrem, spektrofotometrem.
W kolorymetrach stosujemy jako źródło światła żarówkę. W fotokolorymetrach najczęściej używane są lampy wolframowe i rtęciowe. W spektrofotometrach używa się lampy wolframowej. Następną cechą, którą różnią się te urządzenia jest sposób regulacji długości światła padającego. W kolorymetrach używamy filtrów barwnych i interferencyjnych a w spektrofotometrach monochromatory (pryzmaty i siatki dyfrakcyjne). Jest to główny czynnik odróżniający spektrofotometry od pozostałych absorpcjometrów. W kolorymetrach detektorem jest oko ludzkie, fotokolorymetrach - fotoogniwo, fotokomórki, fotopowielacze.
30. Scharakteryzuj najważniejsze rozpuszczalniki stosowane w analizach UV VIS.
Wybór odpowiedniego rozpuszczalnika odgrywa pierwszoplanową rolę. Rozpuszczalniki muszą być bardzo czyste, ponieważ już ślady zanieczyszczeń wykazują absorpcję w niektórych zakresach. Przy wyborze rozpuszczalnika należy uważać na to, aby w zakresie pomiaru był przepuszczalny, ponadto nie może reagowac z badaną substancją. Gdy substancja niepolarna jest rozpuszczona w rozpuszczalniku niepolarnym, wpływ tego ostatniego na widmo jest niewielki. W tym przypadku (heksan, heptan) maksima absorpcji są najostrzejsze. Większy wpływ ma polarny rozpuszczalnik na substancję niepolarną. Największy wpływ ma rozpuszczalnik polarny na substancję polarną. W zakresie VIS najczęściej stosowana jest woda, zaś w UV węglowodory i alkohole (pentan, heksan, metanol, etanol).
33. Omów problematykę oznaczania wielu składników obok siebie.
Widmo absorpcji w nadfiolecie i części widzialnej powstaje w wyniku przejścia cząsteczek ze stanu elektronowego podstawowego, do jednego ze stanów wzbudzonych informując o różnicy energii elektronowej obu tych stanów. Zachodzą tutaj również zmiany oscylacyjne i rotacyjne. Elektrony mają różną energię i dlatego wzbudzane są promieniowaniem o różnych długościach fali. Ze względu na charakterystyczną absorpcję promieniowania w UV związki organiczne można podzielic na:
Związki zawierające jedynie elektrony σ - przeźroczyste w bliskim nadfiolecie, energia σ→σ* około 185kcal/mol.
Związki nasycone zawierające elektrony n - zw. nasycone posiadające heteroatomy (O, N, S) obok przejść σ→σ* mają przejścia n→σ* o mniejszej energii, mogą być używane jako rozpuszczalniki.
Związki nienasycone zawierające elektrony Π (chromofory) - intensywne pasmo absorpcyjne Π→Π* w obszarze 165 - 200nm
Podstawniki alkilowe i heteroatomy przy węglach etylenowych wywołują przesunięcie Π→Π* w stronę fal dłuższych. Sprzężenie wiązań podwójnych prowadzi do przesunięcia pasm absorpcyjnych w strone fal dłuższych i wzrost natężenia. Pasma charakterystyczne dla chromoforów:
C=C 165 nm; C=O 166-279nm
O=C-NH2 178; O=C-OR 211nm
O=C-Cl 220nm; -CN 167nm
-N=N- 340nm; NO2 201,270nm
-ONO 350nm.
Absorpcja związków organicznych w obszarze 200÷800nm może mieć wysokie natężenie co pozwala na badanie r-rów silnie rozcieńczonych (stężenie 10-3÷10-5M).
32. Na czym polegają metody analizy różnicowej.
W metodzie fotometrii różnicowej (metoda stosunku transmisji)r-rem odniesienia jest r-r zawierający badaną substancję o stężeniu C0. Ustawienie przyrządu na 100% transmisji przeprowadza się gdy promieniowanie przechodzi poprzez r-r odniesienia o stężeniu C0.
Modyfikacją tej metody jest tzw pełna fotometria różnicowa. R-rem odniesienia jest r-r zawierający subst. Badaną o stężeniu C0. Ustawienie przyrządu na 0% transmisji przeprowadza się tak jak poprzednio. Różnica polega na tym, że w stosunku do r-ru odniesienia o stężeniu C0 można zmierzyć r-ry zarówno o stężeniu większym jak i mniejszym od stężenia r-ru odniesienia. Dla umożliwienia tych pomiarów ustawia się przyrząd na 1005 transmisji, gdy promieniowanie przechodzi przez r-r odniesienia, w przypadku gdy Cx>C0 , lub przez r-r badany gdy Cx<C0
Metody spektrofotometrii różnicowej określane są mianem spektrofotometrii precyzyjnej. Główne zalety tych metod to większa precyzja oznaczeń niż w metodzie fotometriii bezpośredniej, a także stworzenie możliwości ilościowych oznaczeń substancji o dużych stężeniach (np. oznaczanie głównego składnika w stopach).
31. Metody oznaczeń ilościowych w spektoskopii absorpcyjnej UV-VIS.
Jest to dział metod optycznych, wykorzystujących absorpcję promieniowania elektromagnetycznego w zakresie widzialnym. Metody te powszechnie stosuje się do analizy jakościowej i ilościowej związków organicznych i nieorganicznych. Metody:
Algebraiczna - wykorzystuje bezpośrednio prawo Lamberta-Bourgiera, zakładając, że A=f(C) jest liniowa. Natężenie Cx oznaczanego składnika można obliczyć bezpośrednio
Cx= A/ε*C, gdzie ε- współ. absorpcji, wyznaczamy go mierząc przy danej długości fali λmax, absorbancję kilku roztworów wzorcowych i obliczamy εśr........
Inny sposób oznaczania Cx polega na porównaniu absorbancji roztworu badanego i roztworu wzorcowego o znanym stężeniu substancji oznaczanej, absorbancji rozpraszającej o tej samej długości fali w naczyniach o tej samej grubości warstwy:
Ax= ελ*Cx*lx oraz Awz= ελ*Cwz*lwz , przy czym: lx = lwz , ελ= const.
![]()
Pewniejsze wyniki przy zastosowaniu dwóch roztworów wzorcowych C1 i C2:
A1<Ax<A2 ![]()
Dodatku wzorca - jeżeli prawo L-b jest spełnione, to stężenie substancji badanej Cx można wyznaczyć, dodając tej samej substancji w różnym stężeniu Cs i mierząc As.
![]()
Krzywej wzorcowej - polega na sporządzeniu kilku roztworów wzorcowych oznaczanej substancji, o różnych stężeniach, zmierzeniu absorbancji tych roztworów, przy danej długości fali i wykreśleniu krzywej wzorcowej A= f(C). Jest to linia prosta, o ile roztwory spełniają prawa absorpcji. Dla określenia stężenia Cx badanej substancji należy w tych samych warunkach oznaczyć jej absorbancję Ax i z krzywej analitycznej odczytać szukane stężenie Cx. Roztworem odniesienia może być rozpuszczalnik albo wzorcowy roztwór substancji badanej.
wyk.
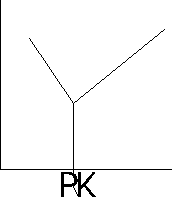
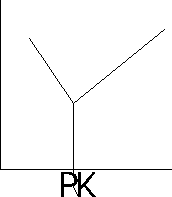
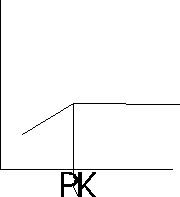
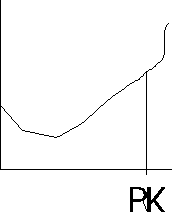
Miareczkowanie spektrofotometryczne - stosuje się w celu ustalenia punktu końcowego miareczkowania, gdy zmiana barwy towarzysząca temu punktowi nie jest wyrażna, aby ją zaobserwować, lub przebiega stoniowo, w miarę dodawania odczynnika miareczkującego. Pomiar polega na mierzeniu absorbancji, zmniejszającej się podczas miareczkowania roztworu badanego. Proces ten przedstawia się graficznie w układzie: A= f(V), gdzie V- objętość roztworu miareczkującego. Miareczkowanie można prowadzić z indykatorem lub bez.
Miareczkowanie bez indykatora:
oznaczana substancja A i produkt AB nie absorbują światła, a odczynnik miareczkujący B absorbuje światło.
produkt miareczkowania AB absorbuje światło, natomiast substancje A i B nie.
substancja A pochłania światło, natomiast B i AB nie pochłaniają światła.
A i B pochłaniają światło, natomiast produkt AB nie pochłania światła.
wyk.
Jeżeli żaden ze składników reakcji A, B, AB nie pochłania promieniowania, to często stosuje się indykator, który pozwala uchwycić PK.
A
C
A=f(c)
C0
A
C
A=f(c)
C0
-A
Wyszukiwarka
Podobne podstrony:
se, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
saa, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
analiza odp cz2 chyba, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
zwiazkow, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
nmr, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
ir, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
test 2009 1, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
1(1), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
sprawozdanie1 cw.4, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
Cw9, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
CWGC, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
ćw 5, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
Chromatografia #2, Technologia chemiczna, 5 semestr, analiza instrumentalna, notatki
1(2), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
cw 2(1), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
cw 1, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
więcej podobnych podstron