SE
9. Zdefiniuj metody spektralnej analizy emisyjnej. Wyjaśnij mechanizm powstawania widm emisyjnych . zdefiniuj potencjał wzbudzenia, linie rezonansowe i ostatnie.
Spektralna analiza emisyjna polega na badaniu promieniowania elektromagnetycznego powstającego w rezultacie tzw. optycznych przejść elektronowych, wzbudzonych atomów i jonów. Analiza emisyjna promieniowania elektromag. daje nam widmo emisyjne:
-ciągłe (od ciał stałych )
-pasmowe (od cząsteczek związków )
-liniowe (wolne atomy i jony )
Do metod należą: fotometria płomieniowa - gdzie pierwiastki wzbudzane są w płomieniu palnika do którego doprowadza się gaz, powstające widmo nosi nazwę widma emisyjnego. W warunkach normalnych atomy znajdują się w stanie nie wzbudzonym. Dostarczenie atomowi kwantu energii powoduje przeniesienie jednego z jego elektronów na wyższy poziom energetyczny (stan wzbudzony ). Powrót elektronu na poziom niższy powoduje emisję energii w postaci promieniowania elektromagn. hν= Ep-Ek=ΔE. Długość fali, która odpowiada tej energii oblicza się ze wzoru ν=1/λ=ν/c*R(1/n-1/m) R - stała Rydbergera n, m - główne liczby kwantowe, c - prędkość światła
Widmo atomu wodoru:
n=1 m=2,3,4 seria Lymana n=2 m=3,4,5 seria Balmera n=3 seria Paschena n=4 seria Brocketa n=5 seria Pfunda n=6 n=7 (nowa seria).
Widma elektronów złożonych:
Stan elektronów charakteryzują liczby kwantowe: n - główna liczba kwantowa n = 1,2,3,4 l= poboczna 0,1,2,3 m=magnety. (m =-l do l) ms= spinowa (1/2,-1/2). Ponadto wewnętrzny moment pędu elektronu j. Uwaga: możliwe są przejścia dla Δn dowolne, Δl=+-1 , Δj=+-1; wskutek oddziaływania orbitalnego i spinowego momentu magnet. następuje rozszczepienie poziomów energetycznych wskutek czego powstają multiplety linii spektralnych w liczbie 2s+1
Potencjał wzbudzenia - energia niezbędna do przeskoku elektronu na wyższy poziom energetyczny
Linie rezonansowe - linie spektralne odpowiadające przejściom elektronów z poziomów wzbudzonych, najbliższych podstawowemu
Linie ostatnie - linie które znikają jako ostatnie przy zanikającym stężeniu pierwiastka
10. Zdefiniuj metodę emisyjnej fotometrii płomieniowej, zalety i ograniczenia.
Metoda ta wchodzi w zakres emisyjnej analizy spektralnej, w której roztwór próbki wprowadza się do płomienia w postaci aerozolu. Roztwór wprowadzony do płomienia palnika odparowuje, cząsteczki dysocjują, część powstałych atomów ulega wzbudzeniu i emituje charakterystyczne promieniowanie. Metoda ta jest stosowana do analizy ilościowej. Płomień jest energetycznie uboższy od elektrycznych źródeł wzbudzania, dlatego powstają uboższe widma zawierające tylko niektóre najintensywniejsze linie. Fotometria znalazła zastosowanie do oznaczania pierwiastków o stosunkowo niskim potencjale wzbudzenia. W fotometrii stosowane są głównie próbki ciekłe. Dlatego substancje stałe należy przed analizą przeprowadzić do roztworu. Roztwór próbki rozpyla się i w postaci aerozolu wprowadza do płomienia palnika. Roztwór musi być bardzo dokładnie rozpylony aby rozmiar kropli nie był większy od 10 μm. Ilościowe oznaczanie tą metodą opiera się na krzywej wzorcowej sporządzonej z szeregu roztworów wzorcowych. Aby otrzymać prawidłowe wyniki przy oznaczaniu należy jako wzorzec stosować takie roztwory, które swoim składem odpowiadają składowi analizowanej próbki. Poza wpływem pierwiastków tzw. trzecich w fotometrii szczególnie wyraźnie występują następujące czynniki: samoabsorbancja i jonizacja, które naruszają zależność prostoliniową między intensywnością promieniowania i stężeniem pierwiastka w roztworze.
Fotometrię płomieniową stosuje się do oznaczania litowców i wapniowców ze względu na ich łatwe wzbudzenie w płomieniu. Ich widma są stosunkowo proste, dlatego można je oznaczać w mieszaninach.
Zalety - szybka metoda, tania aparatura
Wady - dokładność ~ 10%(3%), metoda niszcząca próbkę, substancja badana musi być w roztworze, podatność na zakłócenia pomiarowe.
11. Wyjaśnij zasadę działania fotometru płomieniowego, omów metody oznaczeń ilościowych z wykorzystaniem EFP.
Rys.
Fotometry płomieniowe można podzielić na przyrządy z filtrami i z monochromatorami. Gaz palny i tlen doprowadzane są z butli. Mieszanina palna spala się u wylotu palnika. Płomień palnika, w którym są wzbudzane oznaczane pierwiastki, stanowi źródło promieniowania w odpowiednim układzie optycznym. W przypadku fotometru Zeissa (rys.) układ ten składa się ze zwierciadła wklęsłego, układu soczewek, przesłony, filtru, detektora (fotoogniwa selenowego). W rozpylaczu rozpylany jest roztwór badany, który potem miesza się z gazem palnym.
Analiza ilościowa
metoda wzorców modelowych: krzywe wzorcowe sporządzane na podstawie pomiarów serii roztworów z dodatkiem substancji zakłócających
metoda dodatku wzorca zakłada prostolinijny przebieg krzywej
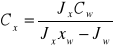
metoda stand. wewnętrz. Cx - określane jest z krzywej J/Js=f(c)
12. Zdefiniuj metodę spektroskopii emisyjnej (SE), wymień i scharakteryzuj źródła wzbudzenia próbki stosowane w tej metodzie.
Jest to metoda, w której widmo substancji wzbudzonej w łuku elektr. lub przy zastosowaniu iskry, rozszczepione w układzie optycznym (pryzmaty, siatka dyfrakcyjna) jest rejestrowane na kliszy fotograficznej lub za pomocą fotopowielaczy. W przypadku kliszy po jej wywołaniu otrzymuje się szereg linii zaczernionych, których położenie (ustalone za pomocą spektroprojektora) pozwala na jakościową analizę, zaś stopień zaczernienia (zmierzony za pomocą mikrifotometra) na ilościową ocenę stężenia danego pierwiastka w próbce. Najistotniejszymi częściami aparatury są: źródło wzbudzenia z elektrodami, układ optyczny i układ rejestrujący.
Rejestracja widma - płyta fotograficzna transmisyjna, fotopowielacze ( T=J/Jo, S=lg1/T - gęstość optyczna ). Przyrządy pomocnicze - spektroprojektor, mikrofotometr
Rys.
Źródła wzbudzenia:
- łuk prądu stałego (4000-7000 K). Pozwala osiągać dużą wykrywalność pierwiastków, dlatego stosowany jest w analizie śladowej. Jednak w łuku prądu stałego mogą zachodzić procesy w wyniku, których otrzymane widmo ma zaczerniony obraz co zmniejsza dokładność wyników. Jest to wywołane silnym rozgrzewaniem się elektrod, co powoduje wysyłanie promieniowania przez nie i produkty ich utlenienia.
- łuk prądu zmiennego (7000-10000 K) ma w porównaniu z łukiem prądu stałego, lepszą stabilność, wymaga jednak specjalnego układu zapalającego, gdyż każda zmiana kierunku prądu wywołuje gaśnięcie.
Oba te źródła charakteryzuje: dobra wykrywalność (10-3%), mała trwałość elektrod, mała stabilność, zmiana przerwy analitycznej, zacieniony obszar widmowy.
- iskra elektryczna ( 10-15 tyś. K)
- palniki plazmowe (10-15 tyś. K).
W plazmotronie z elektrodą zewnętrzną (rys. I) zapala się łuk prądu stałego między elektrodami, z których jedna (anoda) znajduje się w komorze, a druga (katoda) jest na zewnątrz. Do komory doprowadza się gaz roboczy stycznie do jej ścianek. Próbkę badaną podaje się w postaci aerozolu w dodatkowym strumieniu gazu przez otwór w anodzie.
Rys. I rys. II
W plazmotronie Kranza (rys.II) obie elektrody są zamknięte w komorze. Po zapaleniu łuku wprowadza się aerozol próbki wraz z gazem przez dolny otwór w komorze. Plazma wyprowadzana jest górą.
- laser
Ostatnie 3 źródła cechuje: dobra powtarzalność warunków wzbudzenia, mała erozja próbki
Wymień i objaśnij metody oznaczeń ilościowych z wykorzystaniem SE.
Metody te oparte są liniowej zależności: lgJ=blgC+lga. Jeśli badany jest stopień zaczernienia płyty (S): S = lg Jom/Jm ; S=f(lgC) .
Metoda slandaidu wewnętrznego
Slandaid wewn. - pierwiastek występujący w analizowanej próbce w stałym stężeniu. Do badanej próbki dodaje się znaną ilość pierwiastka (slandaidu wewn.) - niekiedy jest nim jeden z pierwiastków występujących w badanej próbce w stałych ilościach. We wszystkich badanych próbkach linie slandaidu powinny
14. Podaj podstawowe równanie definiujące zależność intensywności źródła promieniowania od stężenia analizowanego pierwiastka. Metodyka oznaczeń ilościowych z wykorzystaniem spektroskopii emisyjnej i kwantometru.
W analizie ilościowej wykorzystujemy zależność między stężeniem badanego pierwiastka w źródle wzbudzenia, a natężeniem promieniowania jakie emituje. Zależność tą opisuje równanie Łomanina, Scheibego: J = acb gdzie a - wielkość charakteryzująca warunki wzbudzenia, b - przy małych stężeniach przyjmuje wartość 1 (dla ilości śladowych), a przy większych wartość jego maleje.
Metodyka oznaczeń oparta jest liniowej zależności: lgJ = blgc + lga (równanie Scheibego w postaci lg) : J = f(c) - tzw. krzywa analityczna, bywa przedstawiana w logarytmicznym układzie współrzędnych i powinna być linią prostą. Gdy b=1 wykres zależności J od c jest linią prostą, także w zwykłym układzie współrzędnych., a tangens kąta nachylenia tej prostej do osi odciętych jest miarą parametru a.
6. Przedstaw podział spektralnych metod analizy z punktu widzenia zmiany energii (ΔE) badanego układu.
Z punktu widzenia zmiany energii (ΔE) badanego układu, układy makroskopowe mogą zmieniać swą energię w sposób dowolny. Sytuacja jest odmienna w mikro świecie atomów i cząsteczek. Forma energii cząsteczki(atomu) zmieniają się w sposób nieciągły (skokowy) dana cząsteczka może oddać swą energię tylko określonymi porcjami (kwantami). To samo dotyczy pobierania przez cząsteczkę energii z otoczenia. Mówimy, że w mikro świecie energia jest skwantowana. Zmiany energetyczne cząsteczek (atomów) towarzyszące pochłanianiu lub oddawaniu energii promienistej opisuje równanie Bohra: ΔE=Ek-Ep=hν ΔE - zmiana energii cząsteczki Ek, Ep - energia cząsteczki w stanie końcowym i początkowym. Jeżeli energia stanu początkowego (Ek>Ep) to zmiana energii jest dodatnia ( ΔE>0) i promieniowanie jest pochłanianie przez układ (atom). Jeżeli natomiast energia stanu końcowego jest niższa (Ek<Ep), to zmiana energii jest ujemna (ΔE<0), promieniowanie jest emitowane przez układ. W pierwszym przypadku mamy do czynienia ze spektroskopią absorpcyjną a w drugim z emisyjną. Rodzaje spektroskopii można podzielić na kilka działów biorąc pod uwagę następujące kryteria: wielkość energii fotonów promieniowania elektromagnetycznego ( zakres promieniowania elekromagnetycznego) formy energii występujące w układach materialnych. Podział spektroskopii według form energii występujących w układach materialnych związany jest z istniejącymi w tych układach skwantowanych atomów energetycznych. Spektroskopia rotacyjna, spektroskopia elektronowego rezonansu paramagnetycznego (EPR), spektroskopia jądrowego rezonansu magnetycznego (URJ). W układach materialnych można wyróżnić następujące rodzaje stanów energetycznych:
a) poziomy energetyczne - energia przejść między poziomami wewnętrznych powłok elektronowych są rzędu dziesiątków tysięcy elektronowoltów, a powstające w wyniku tych przejść widmo jest widmem rentgenowskim. Energia wynikająca z przejść między poziomami zewnętrznych powłok elektronowych jest rzędu kilku elektronowoltów powstające widmo optyczne przypada na zakres widzialny i ultrafiolet,
b) poziomy oscylacyjne związane z oscylacyjnym ruchem jąder w czasie zmiany położeń równowagi. Energia tych drgań wynosi 0,01-0,5eV, a odpowiednie przejście między poziomami oscylacyjnymi przypadają w zakresie podczerwieni,
c) poziomy rotacyjne - związane są z obrotowym ruchem cząsteczki jako całości wokół własnej osi. Zmiany energii związane z odpowiednimi przejściami energetycznymi są rzędu 0,005-0,025 eV. Wartości energii rotacyjnej oscylacyjnej elektronowej mają się do siebie jak Erot:Eosc:Eele=1:10:1000,
d) poziomy struktury subtelnej, energie tych przejść są rzędu 4*10-5eV i związane są z obecnością spinu elektronowego .Przejście to bada się metodami radiospektroskopii
e) poziomy struktury nadsubtelnej - związane z obecnością spinu jądrowego. Zmiany energii są rzędu 2*10-8 eV, przejście to bada się metodą rezonansu magnetycznego.
7. Rodzaje energii cząsteczek. Omów podziały optycznych metod analizy według zakresu długości fali promieniowania elektromagnetycznego.
W zależności od długości fali promieniowania elektromagnetycznego spektroskopie optyczną dzielimy:
- nadfiolet UV i światło widzialne VIS (100-800 nm)
- podczerwień IR (0,8-300μm )
UV-VIS - zmiana energii elektromagnetycznej w wyniku przejść cząsteczki ze stanu elektronowego podstawowego do jednego ze stanów wzbudzonych .Zmiana energii oscylacyjnej i rotacyjnej, ponieważ energię pochłaniana w UV i VIS jest skwantowana, widmo absorpcji wywołane przejściem elektronów powinno składać się z pojedynczych linii. Widma liniowego nie uzyskuje się ,ponieważ absorpcja elektronowa nakłada się na poziomy oscylacyjne i radiacyjne.
IR - zmiany energii oscylacyjnej i rotacyjnej. Poziomy rotacyjne leżą przeważnie blisko siebie co prowadzi do wywołania zmiany energii rotacyjnej. Widma oscylacyjne występują częściej w postaci pasm nie linii, ponieważ każdej zmianie energii oscylacyjnej towarzyszy zmiana energii rotacyjnej. Zatem widma występujące w tym zakresie to widma oscylacyjno-rotacyjne.
8. Wymień i opisz monochrom. wykorzystywane w aparatach do optycznej analizy instrumentalnej (budowa i najważniejsze parametry ).
Układ monochromatora:
- szczelina wstępowa
- zespół dyspersyjny, szczelina wyjściowa
- filtr barwny - przepuszcza promieniowanie elektromagnetyczne tylko w pewnym zakresie szerokość spektralna s=λ2-λ1
-filtr interferencyjny: dwie płytki szklane, między nimi warstwa barwna. Na zewnętrzną stronę płytek nanosi się warstwę srebra
Rys.
Max. transmitancji λ/nα=2d/m gdzie m - rząd interferencji nα - współcz. załamania światła
-pryzmat: dyspersja kątowa - D = do/dλ rozdzielczość R = λ/Δλ
rys
lustra: Cornu Littrowa Wadswortha Abbego Ferryego
Dla większych długości fali jest mniejszy współczynnik załamania światła, dzięki czemu następuje dyspersja
- siatka dyspersyjna, interferencyjna, refleksyjna, koło Rolanda
rys koło Rowlanda
rys
układ Eberta(zwierciadło kolimacyjne)
Wyszukiwarka
Podobne podstrony:
saa, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
polar i uv-vis, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
analiza odp cz2 chyba, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
zwiazkow, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
nmr, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
ir, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
test 2009 1, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
1(1), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
sprawozdanie1 cw.4, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
Cw9, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
CWGC, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
ćw 5, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
Chromatografia #2, Technologia chemiczna, 5 semestr, analiza instrumentalna, notatki
1(2), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
cw 2(1), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
cw 1, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
1(3), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
więcej podobnych podstron