. Metody eliminacji zakłóceń absorbancji, dokładność metody, zastosowanie SAA.
Metoda roztworów buforowych kiedy skład matrycy dokładnie nie jest znany, albo skład ten jest bardzo zmienny, polega na tym, że do wzorców roztworów próbek dodaje się roztwory eliminujące roztwory buforowe.
Metoda wzorców modelowych w przypadku gdy znamy skład próbki (matryca), stosuje się do otrzymania krzywej analitycznej modelowe wzorce o takim składzie jak próbka.
Metoda dodatku wzorca
Dokładność oznaczania zależy od:
fluktuacji intensywności źródła światła
szumów powielacza
fluktuacji płomienia
szumów elektroniki przyrządów
niedokładności wskazań odczytu
błędów systematycznych, przypadkowych
interferencji atomowych
Zastosowanie SAA
Analizy agrochemii: gleby, roślin zielonych (zaw. Fe, Mg, Sn, Cu), analizy kliniczne i biochemiczne osocze krwi (Ca, K, Na, Li, Cu, Zn, ), krew (Fe, Pb), metalurgiczne- stopy (H, Mg, Cu, Zn, Fe), petrochemia paliwa (V, Ni, Cu, Zn, Fe, Mn, Ba), smary (Ba, Ca, Zn, Mg, Sb)
metodę spektroskopii absorpcyjnej atomowej SAA. Jakie prawa rządzą badanym w tej metodzie zjawiskiem.
SAA polega na pomiarze absorpcji promieniowania elektromagnetycznego przez wolne atomy pierwiastków o specyficznej dla tych pierwiastków długości fali. Podstawą zjawisk jest prawo Kirchoffa, które brzmi: stosunek zdolności absorpcyjnej nie zależy od rodzaju ciała i jest równy zdolności emisyjnej ciała doskonale czarnego. A więc im silniej ciało absorbuje promieniowanie tym silniej emituje promieniowanie o tej samej długości fali. Gdy promieniowanie przechodzi przez środowisko, w którym znajdują się atomy jakiegoś pierwiastka, to zachodzi absorpcja promieniowania w wyniku zderzeń fotonów promieniowania z tymi atomami. Jeżeli foton promieniowania o częstości γ spotka atom obojętny znajdujący się na podstawowym poziomie energetycznym Ep, to w przypadku absorpcji tego fotonu poziom energetyczny atomu wzrośnie i wyniesie Ep+hγ. Nowy stan odpowiada stanowi wzbudzonemu atomu o energii Ek. (Ek=Ep+hγ). Absorpcja jest proporcjonalna do stężenia oznaczanych atomów i może być opisana I=Io/e-kl⇒A=log Io/I
(prawo Lamberta-Beera) A=kl
k - współczynnik absorpcji k=ac
l - długość warstwy absorbującej
![]()
Środowisko absorpcyjne powinno zapewniać jak największe stężenie wolnych atomów i utrzymać podczas analizy proporcjonalność między ich ilością, a stężeniem analizowanego pierwiastka w analizowanej próbce.
Np - liczba atomów w stanie podstawowym
f- moc oscylatora
l- długość drogi absorpcji
a - współczynnik charakteryzujący linię emisyjną
![]()
Wzajemny stosunek obsadzeń poziomów obrazuje wzór Boltzmana:
Nw- liczba atomów wzbudzonych
Np- liczba atomów w stanie podstawowym
gw, gp- wagowe współczynniki statyczne poziomów
k- stała Boltzmana
T- temp w [K]
Ep, Ew- energie poziomów [eV]
Dlaczego czułość i granica oznaczalności w SAA są wielokrotnie wyższe niż w metodach emisyjnych
Do oznaczania pierwiastków z niskim potencjałem jonizacyjnym stosuje się płomienie o niższych temperaturach, ponieważ w wyższych temperaturach wskutek jonizacji czułość oznaczenia maleje oraz występują zakłócające wpływy jonizacyjne. Przeciwnie dla pierwiastków, które tworzą w płomieniu stosunkowo trwale tlenki, konieczne jest stosowanie płomienia o wysokiej temperaturze. Wyższość absorpcyjnej spektrofotometrii atomowej w porównaniu z metodą emisyjną polega na tym że z ogromnej liczby atomów w płomieniu tylko ok. 1% jest w stanie wzbudzonym, a więc w stanie zdolnym do emitowania promieniowania, reszta 99% ma potencjalną możliwość absorpcji. Z tego wynika, że metoda SAA w porównaniu z metodą emisyjną jest czulsza.
Czułość- ilość oznaczanego pierwiastka w badanym roztworze w ppm lub mg/dm3 wywołująca zmianę absorpcji 0,00436 tj. 1% absorpcję przechodzącego promieniowania
Granica czułości-stężenie pierwiastka w ppm lub mg/dm3 wywołującą zmianę absorbancji równą dwukrotnej czułości odchylenia standardowego sygnału.
Np. Zn- 0,002 ppm.
budowę i zasadę działania spektroskopu SAA.
SAA- polega na pomiarze absorpcji promieniowania elektromagnetycznego przez wolne atomy pierwiastków i specyficznej dla tych pierwiastków długości fali.
Aparatura składa się z:
- źródła promieniowania liniowego, które powinno emitować stabilne, bardzo intensywne promieniowanie o długości fali odpowiadającej jak najwyższej linii rezonansowej oznaczanego pierwiastka .
atomizera (palnik gazowy, kiuwety grafitowe)
monochromatora
detektora (fotopowielacza)
rejestratora.
Atomizacja może być:
płomieniowa (w płomieniu palnika)
Atomizacja badanej substancji zachodzi w płomieniu palnika do którego doprowadza się gaz utleniający, gaz palny i roztwór analizowany. W celu przedłużenia drogi absorpcji stosuje się palniki płaskie o długiej i wąskiej szczelinie wylotowej. Podstawową reakcją dostarczającą wolnych atomów, zdolnych do absorpcji promieniowania jest reakcja dysocjacji termicznej.
elektrotermiczna
Polega na podgrzaniu próbki(stałej): 100-2000C odparowanie rozpuszczalnika, 200-10000C mineralizacja badanej próbki, 1000-30000C atomizacja, 30000C wygrzewanie w celu oczyszczenia kiuwet
rys
1-źródło promieniowania; 2- atomizer; 3- monochromator: 4- detektor; 5- wzmacniacz; 6- rejestrator.
Źródła światła w SAA, budowa i ich działanie.
Lampa z katodą wnękową.
Lampa z katodą wnękową jest to hermetyczna rurka szklana z okienkiem kwarcowym, wypełniona gazem obojętnym pod zmniejszonym ciśnieniem. Anoda jest wykonana z wolframu, a katoda z metalu którego promieniowanie o charakterystycznych liniach lampa emituje. Dodatnie jony gazu wypełniającego lampę bombardują katodę i wybijają z niej atomy metalu. Wybite atomy metalu w stanie gazowym ulegają wzbudzeniu i emitują promieniowanie.
Promieniowanie to przechodzi przez środowisko absorpcyjne atomizera. Środowisko absorpcyjne w metodzie SAA musi zawierać wolne atomy oznaczanego pierwiastka, w stanie gazowym. Sól oznaczanego pierwiastka poddawana jest dysocjacji termicznej. Przejście substancji od roztworu do gazu atomowego składa się z dwóch etapów: nebulizacji i atomizacji. Pierwszy etap polega na rozproszeniu analizowanego roztworu w delikatną mgłę i doprowadzeniu jej w sposób jednorodny do płomienia. Następnie w płomieniu następuje atomizacja.
Lampa z wyładowaniem bezelektrodowym.
Jest to rura zawierająca Ar (Ne) pod zmniejszonym ciśnieniem i niewielką ilość oznaczanego pierwiastka (1-2 mg), którego promieniowanie winno być emitowane. Pobudzenie do promieniowania następuje przez działanie pola elektromagnetycznego o dużej częstotliwości (10-100 MHz). Stosowane są do oznaczania: Sb, As, Bi, Cd, Mg, P, Se, Tl, Sn, Zn, Hg, Rb, Cs, Ge.
Lampy łukowe.
Wysyłają promieniowanie o dużo większej intensywności, niż lampy z katodą wnękową, jednak linie są szersze. Wypełnione rozrzedzonym Ar i parami oznaczanego pierwiastka, np.: Hg, Cd, Zn, Na, K, Cs, Rb. Stosuje się je zwłaszcza dla metali alkalicznych.
sposoby rejestracji widm absorpcyjnych (krzywe).
Transmitacja: T= f(λ)
Absorbancja: A= f(λ) oznaczenie ilościowe
Log. absorbancji: lg A= f(λ)
lg A= lgε + lgL + lgC
Absorbancja różnicowa: A - A0 = f(λ)
Molowy współczynnik absorpcji: ε = f(λ)
Log. z mol. współ. absorpcji: lg = f(λ) oznaczenie jakościowe
24. Omów główne przyczyny błędów oznaczeń ilościowych metodami spektroskopii absorpcyjnej.
Błędy ogólnoanalityczne - są to błędy wynikające z niedokładności ważenia, pomiaru objętości itp.
Błędy specyficzne - zależą od badanego układu, związanego stopniem przereagowania, trwałości związku.
Błędy pomiarów fotometrycznych - względny błąd pomiaru stężeń ΔC/C = ΔA/A ,gdzie: C- wielkość oznaczana, A- wielkośc mierzona.
wyk.
Najmniejszy błąd względny pomiarów fotometrycznych jest przy A= 0,3-0,7. Ma to wpływ na: dobór pasma do oznaczeń, dobór zakresu stężeń przy sporządzaniu krzywej wzorcowej.
Optymalne warunki oznaczenia ilościowego są w zakresie w którym przepuszczalność nośną mierzy się z najmniejszym błędem. Zgodnie z prawem Lamberta-Beera względny błąd określany jako funkcja transmitacji wynosi 2,7%. Błąd względny dla zakresu 20-60% T, niewiele się zmienia. W zakresie tym pomiar jest niedokładny. Jeżeli pracuje się metodą różnicową błąd można zmniejszyć do 50%.
Wpływ absorpcji tła. Jeżeli prosta kalibracyjna odcina na osi absorbancji odcinek A0 to występuje tło. W tym przypadku krzywa kalibracyjna jest definiowana zależnością: A= A0 + εd . Krzywą kalibracyjną można transformować od początku jeżeli wartości się różnią A- A0 = f(C). Rzeczywiste odchylenie występuje wtedy, jeżeli w roztworze badanym występuje równowaga chemiczna. W wyniku zmiany stężeń substratów mogą zachodzić oddziaływania jonowe i międzyjonowe, reakcja dysocjacji, polimeryzacji, itp. Pozorne odchylenia są spowodowane niedostateczną monochromatycznością promieniowania. Ma to miejsce przy użyciu barwnych filtrów.
Prawa absorpcji promieniowania
I Wiązka światła monochromatycznego przechodząc przez środowisko absorpcyjne o grubości b ulega osłabieniu wg. wzoru:
![]()
I=Ioe-kb gdzie k- współczynnik absorpcyjny
Absorbancja:
II. W przypadku gdy współczynnik absorpcji rozpuszczalnika jest równy 0, to wiązka promieniowania monochromatycznego, przy przechodzeniu przez jednorodny roztwór o stężeniu c ulega osłabieniu wg wzoru:
![]()
I=Ioe-kbc
III. Absorbancja roztworu jest sumą absorbancji poszczególnych składników
A=A1+A2+.......+A3
A=acb A=εcb
a -właściwy współ. absorpcji [g/ml] ε- molowy współczynnik absorpcji [mol/l]
ZDEFINIUJ CZUŁOŚĆ OZNACZEŃ I GRANICĘ WYKRYWANIA W METODZIE SPEKTROSKOPII ABSORPCYJNEJ.
Czułość - pod tym pojęciem należy rozumieć najmniejsze oznaczalne stężenie pierwiastków, które można określić za pomocą danej metody. Obiektywnym liczbowym wykładnikiem czułości metod spektrofotometrycznych jest molowy współczynnik absorpcji ε odpowiadający max. danego roztworu. Wartości współ. absorpcji ε metod czułych wynoszą poniżej 100000, a współczynnik ε o wartości poniżej 1000 odpowiednim metodom małoczułym. Do określenia metod czułości spektroskopowych stosowany jest też współczynnik wy.. Wyraża on stężenie pierwiastka lub substancji przy której uzyskuje się absorbancję równą 0,05 gdy grubość warstwy absorbującej l=1cm.
Zdefiniuj metody optyczne analizy instrumentalnej. Promieniowanie elektromagnetyczne i możliwe oddziaływanie z badaną próbką.
Układy optyczne stosowane są w analizie chemicznej są częścią składową teoretyczno-doświadczalnej nauki zwanej spektroskopią. Spektroskopia zajmuje się oddziaływaniem promieniowania elektromagnetycznego z materią. Obejmuje wszystkie zjawiska zachodzące w atomach i cząsteczkach oraz w samej fali elektromagnetycznej, gdy kwanty promieniowania i cząsteczki materiałów są w odległości umożliwiającej to oddziaływanie .
Promieniowanie elektromagnetyczne jest to forma energii występująca w formie fal elektromagnetycznych, które rozchodzą się z prędkością 3*108 m/s periodycznych zmian, pola elektrycznego i magnetycznego. Zakres fal elektromagnetycznych jest bardzo szeroki, gdyż sięga od bardzo krótkich fal promieniowania wynoszącego (10-14m) do najdłuższych fal radiowych (106m). Cechami jakościowymi promieniowania elektromagnetycznego jest długość fali λ [μm, nm], częstość drgań ν i częstość drgań na centymetr czyli liczba falowa ν [cm-1] ν=c/λ [s-1] ν=1/λ [cm-1] c - prędkość światła
Wielkość energii pojedynczego kwantu promieniowania, zwanego fotonem wyraża wzór Planca: E = hν. Zależność ta łączy falową (ν) i korpuskularną (E) naturę promieniowania. Cechą ilościową promieniowania elektromagnetycznego jest intensywność promieniowania, określająca ilość energii promienistej oddziaływującej materiałem. Intensywność promieniowania I jest to energia przechodząca w ciągu jednej [s] przez 1[cm2] powierzchni prostopadłej do kierunku biegu promieniowania.
Metoda spektralna :
Schemat oddziaływań badanej próbki ze strumieniem padającego światła Io (λ)
Oddziaływania promieniowania elektromagnetycznego i korpuskularnego z cząsteczkami badanej próbki :
Sprężyste
Zjawiska związane z optyką, falowa zmiana kierunku fal lub cząsteczki stosowanych P ΔEk=P
P- wynik pomiarów najczęściej obraz
Niesprężyste
Wymiana energii między wiązką promieniowania, a próbką według zasad kwantowania ΔEk≠O

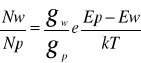
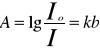
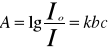
Wyszukiwarka
Podobne podstrony:
se, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
polar i uv-vis, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
analiza odp cz2 chyba, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
zwiazkow, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
nmr, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
ir, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
test 2009 1, Technologia chemiczna, 5 semestr, analiza instrumentalna, zaliczenia
1(1), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
sprawozdanie1 cw.4, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
Cw9, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
CWGC, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
ćw 5, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
Chromatografia #2, Technologia chemiczna, 5 semestr, analiza instrumentalna, notatki
1(2), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
cw 2(1), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
cw 1, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
1(3), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
więcej podobnych podstron