ELEKTROCHEMIA
z. 1.
W zlewce zawierającej roztwór siarczanu (VI) cynku o stężeniu 0,5 mol/dm3 zanurzono blaszkę cynkową. Podobnie w zlewce zawierającej roztwór siarczanu )VI) miedzi (II) o stężeniu 0,2 mol/dm3 zanurzono blaszkę miedzianą. Tak skonstruowane półogniwa połączono kluczem elektrolitycznym i zamknięto w obwód elektryczny. E0Zn/Zn2+ = -0,763 V; E0Cu/Cu2+ = 0,521 V.
a) Napisz schemat tego ogniwa
b) Zapisz reakcje zachodzące w półogniwach i reakcje sumaryczną
c) Za pomocą odpowiednich wzorów wyraź siłę elektromotoryczną tego ogniwa a następnie oblicz jej wartość.
d) Zapisz wyrażenia na potencjały obu półogniw i oblicz ich wartość.
e) Oblicz zmianę entalpii swobodnej w tym ogniwie, jeżeli przez obwód przepłynęło 0,1 mola elektronów.
Zauważamy, że potencjał standardowy półogniwa miedziowego jest zancznie większy od potencjału standardowego półogniwa cynkowego (w tym wypadku od razu to widać, bo jeden jest dodatni, a drugi ujemny). Miedź ulega więc redukcji, a cynk utlenieniu, czyli schemat tego ogniwa jest następujący:
-Zn|Zn2+ || Cu2+ | Cu+
W układzie zachodzą następujące reakcje:
Zn0 - 2e- → Zn2+
Cu2+ + 2e- →Cu0
A sumarycznie:
Zn0 + Cu2+ ↔ Zn2+ + Cu0
c) Ze wzoru Nernsta wiemy, że siła elektromotoryczna dana jest wzorem:
![]()
czyli:
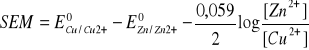
bo stała reakcji sumarycznej wynosi: K = [Zn2+]/[Cu2+] (tylko formy jonowe rozpuszczone w wodzie wchodzą do stałej).
SEM = 0,521 - (-0,763) - 0,059/2log(0,5/0,2) = 1,284 - 0,012 = 1,272 V
d) Potencjały półogniw
Uwaga: Trzeba uważać, żeby we wzorze Nernsta na potencjały półogniw mieć dobre znaki, tak, żeby później odjęcie potencjału lewego półogniwa od prawego dało dokładnie to samo wyrażenie, co zapisane powyżej na SEM. Ponadto w tym zadaniu można zacząć od tego podpunktu, wyliczyć wartości liczbowe potencjałów obu półogniw, a następnie w punkcie dotyczącym SEM napisać, że SEM = EP - EL i odjąć dwie, uprzednio wyliczone liczby.
Uwaga: Rozpatrujemy półogniwa niespięte, czyli takie, w których nie wiemy, czy będzie zachodziło utlenianie, czy redukcja, konwencja więc jest taka, żeby zawsze rozpatrywać równowagę redukcji:
W lewym półogniwie (cynkowym) mamy następującą równowagę:
Zn2+ + 2e- ↔ Zn0, czyli K = 1/[Zn2+] (bo Zn0 nie wchodzi do stałej)
EZn = E0Zn/Zn2+ - 0,059/2log(1/[Zn2+]) = -0,763V - (0,059/2)log(1/0,5) = -0,763 - 0,009 = - 0,772 V
W prawym półogniwie (miedzianym) mamy następującą równowagę:
Cu2+ + 2e- ↔ Cu0, a więc K = 1/[Cu2+] (bo Cu0 na górze nie piszemy)
ECu = E0Cu/Cu2+ - (0,059/2)log(1/0,2) = 0,521 - 0,021 = 0,500V
Sprawdzamy:
SEM = ECu - EZn = 0,500 V - (-0,772V) = 1,272 V
Uwaga: Ponieważ łatwo jest się pomylić w znakach, lepiej jednak jest robić to zadanie w takiej kolejności jak idą podpunkty, czyli najpierw SEM, a potem potencjały półogniw.
e) ΔG = - nFSEM
Uwaga: w tym wzorze n nie jest takie samo jak w powyższych punktach, czyli nie wynosi 2, bo w treści zadania napisane jest, że przepłynęło 0,1 mola elektronów:
ΔG = -0,1*96500*1,272V = -12275 J
z. 2.
Zbudowano ogniwo Daniela zestawiając półogniwa glinowe i żelazowe. Potencjały standardowe tych półogniw wynoszą odpowiednio E0(Al3+/Al.) = -1,662 V i E0(Fe3+/Fe) = -0,036V. Wiedząc, że stężenie jonów Al3+ wynosiło 0,12 mol/dm3, a jonów Fe3+ 0,24 mol/dm3:
a) Zapisz schemat tego ogniwa
b) Zapisz reakcje zachodzące w półogniwach i reakcje sumaryczną
c) Za pomocą odpowiednich wzorów wyraź siłę elektromotoryczną tego ogniwa, a następnie oblicz jej wartość.
d) Zapisz wyrażenia na potencjały obu półogniw i oblicz i wartość.
e) Oblicz zmianę entalpii swobodnej w tym ogniwie, jeżeli przez obwód przepłynęło 0,05 mola elektronów.
a) Widzimy, że potencjał standardowy w ogniwie żelazowym jest wyższy niż w glinowym, czyli żelazo się redukuje, a glin utlenia:
-Al|Al3+ || Fe3+ | Fe+
b) Al0 - 3e- → Al3+
Fe3+ + 3e- → Fe0
Al0 + Fe3+ ↔ Al3+ + Fe0
c) ![]()
widzimy, że K = [Al3+]/[Fe3+]
czyli: SEM = -0,036V - (-1,662V) - (0,059/3)log(0,12/0,24) = 1,626 + 0,006 = 1,632 V
d)
W lewym półogniwie (glinowym, rozłączonym) rozpatrujemy równowagę w kierunku redukcji:
Al3+ + 3e- ↔ Al0 ; K = 1/[Al3+]
EAl = E0Al/Al3+ - (0,059/3)log(1/[Al3+]) = -1,662V - 0,018 = -1,68 V
W prawym półogniwie (żelazowym, rozłączonym) rozpatrujemy równowagę w kierunku redukcji:
Fe3= + 3e- ↔ Fe0 ; K = 1/[Fe3+]
EFe = E0Fe/Fe3+ - (0,059/3)log(1/[Fe3+]) = -0,036V - 0,012 = - 0,048 V
Sprawdzamy: SEM = EFe - EAl = -0,048 - (-1,68) = 1,632 V
e)
ΔG = -nFSEM = 0,05*96500*1,632 = -7874 J
z. 3.
Zbudowano ogniwo Daniela zestawione z półogniwa kadmowego i półogniwa srebrowego. E0(Cd2+/Cd) = -0,403 V; E0(Ag+/Ag) = 0,799 V. Wiedząc, że stężenie jonów kadmu wynosiło 0,4 mol/dm3, a jonów srebra 0,3 mol/dm3:
a) Zapisz schemat tego ogniwa
b) Zapisz reakcje zachodzące w półogniwach i reakcje sumaryczną
c) Za pomocą odpowiednich wzorów wyraź siłę elektromotoryczną tego ogniwa, a następnie oblicz jej wartość.
d) Zapisz wyrażenia na potencjały obu półogniw i oblicz ich wartość
e) Oblicz zmianę entalpii swobodnej w tym ogniwie, jeżeli przez obwód przepłynęło 0,15 mola elektronów.
a) -Cd|Cd2+||Ag+|Ag+
b) Cd0 - 2e- → Cd2=
2Ag+ + 2e- → 2Ag0
Cd0 + 2Ag+ ↔ Cd2+ + 2Ag0
c)
![]()
K = [Cd2+]/[Ag+]2, czyli:
SEM = 0,799 - (-0,403) - (0,059/2)log(0,4/(0,3)2) = 1,202 - 0,019 = 1,183 V
d)
Piszemy równowagowo reakcje w półogniwach w kierunku redukcji:
Lewe: Cd2+ + 2e- ↔ Cd0; K = 1/[Cd2+]
Czyli: ECd = E0Cd/Cd2+ -(0,059/2)log(1/0,4) = -0,403 - 0,012 = - 0,415 V
Prawe: Ag+ + e- ↔ Ag0 K = 1/[Ag+]
Czyli: EAg = E0Ag+/Ag - 0,059log(1/0,3) = 0,799 - 0,031 = 0,768 V
SEM = EAg - ECd = 0,768 - (-0,415) = 1,183
Uwaga: przy rozpatrywaniu półogniwa pominąłem kwadrat przy stężeniu srebra, ale również współczynnik 2 przy 0,059, bo (0,059/2)log(1/0,3)2 = (0,059/2)*2log(1/0,3) (z praw o logarytmach.
e) ΔG = -nFSEM = -0,15*96500*1,183 = -17124
z. 4.
Zbudowano ogniwo redoksowe w następujący sposób: w roztworze o stężeniu 0,4 mol/dm3 względem jonów Sn4+ i 0,03 mol/dm3 względem jonów Sn2+ zanurzono elektrodę platynową. Podobnie w drugim roztworze o stężeniu 0,25 mol/dm3 względem jonów Fe3+ i 0,05mol/dm3 względem jonów Fe2+ zanurzono elektrodę platynową. Roztwory połączono kluczem elektrolitycznym i złączono obwód elektryczny. E0 (Sn4+/Sn2+) = 0,150 V; E0 (Fe3+/Fe2+) = 0,771V
a) Zapisz schemat tego ogniwa
b) Zapisz reakcje zachodzące w półogniwach i reakcje sumaryczną
c) Za pomocą odpowiednich wzorów wyraź siłę elektromotoryczną tego ogniwa, a następnie oblicz jej wartość.
d) Zapisz wyrażenia na potencjały obu półogniw i oblicz ich wartość
e) Oblicz zmianę entalpii swobodnej w tym ogniwie, jeżeli przez obwód przepłynęło 0,04 mola elektronów.
Z potencjałów standardowych wynika, że w układzie z żelazem będzie zachodziła redukcja, a w układzie z cyną utlenienie.
a)
-Pt | Sn2+, Sn4+ || Fe3+, Fe2+ | Pt+
Uwaga: W ogniwie redoksowym elektrodą jest metal szlachetny, np. drut platynowy, stąd symbol Pt w układzie.
b)
Sn2+ - 2e- → Sn4+
2Fe3+ + 2e- → 2Fe2+
Sn2+ + 2Fe3+ ↔ Sn4+ + 2 Fe2+
K = [Sn4+][Fe2+]2 / [Sn2+][Fe3+]2
c)
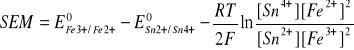
SEM = 0,771 - 0,150 - (0,059/2)log(0,4*0,052/0,03*0,252) = 0,621 + 0,008 = 0,629 V
d)
Reakcje w półogniwach zapisujemy również w kierunku redukcji:
Półogniwo cynowe:
Sn4+ + 2e- ↔ Sn2+; K = [Sn2+]/[Sn4+]
ESn = E0Sn4+/Sn2+ - (0,059/2)log(0,03/0,4) = 0,150 + 0,033 = 0,183 V
Półogniwo żelazowe:
Fe3+ + e- ↔ Fe2+; K = [Fe2+]/[Fe3+]
EFe = E0Fe3+?Fe2+ - 0,059log(0,05/0,25) = 0,771 + 0,041 = 0,812
SEM = EFe - ESn = 0,812 - 0,183 = 0,629
e) ΔG = -nFSEM = -0,04*96500*0,629 = -2428 J
z. 5.
Zbudowano ogniwo redoksowe w następujący sposób: W kwaśnym roztworze manganianu (VII), w którym jony MnO4- są w równowadze z jonami Mn2+ zanurzono elektrodę platynową. Stężenie jonów MnO4- wynosiło 0,06 mol/dm3, a jonów Mn2+ 0,02 mol/dm3. Podobnie w drugim półogniwie w roztworze zawierającym jony Cr3+ (0,5 mol/dm3) i Cr2+ (0,02 mol/dm3) zanurzono elektrodę platynową. Półogniwa złączono kluczem elektrolitycznym i spięto w obwód elektryczny. E0 (MnO4-/Mn2+) = 1,51 V; E0 (Cr3+/Cr2+) = -0,408 V
a) Zapisz schemat tego ogniwa
b) Zapisz reakcje zachodzące w półogniwach i reakcje sumaryczną
c) Za pomocą odpowiednich wzorów wyraź siłę elektromotoryczną tego ogniwa, a następnie oblicz jej wartość.
d) Zapisz wyrażenia na potencjały obu półogniw i oblicz ich wartość.
e) Oblicz zmianę entalpii swobodnej w tym ogniwie, jeżeli przez obwód przepłynęło 0,01 mola elektronów.
a)
-Pt | Cr2+, Cr3+ || MnO4-, Mn2+, H+| Pt+
b)
5Cr2+ + 5e- → 5Cr3+
MnO4- - 5e- + 8H+ → Mn2+ + 4 H2O
5Cr2+ + MnO4- + 8H+ ↔ Mn2+ + 5Cr3+ 4 H2O
K = [Mn2+][Cr3+]5/[Cr2+]5[MnO4-] (H+ pomijamy w wyrażeniu na stałą, zakładając, że jest go nadmiar i jego stężenie jest stałe)
Obliczmy sobie od razu stałą:
K = (0,02*0,55/0,025*0,06) = 0,000625/1,92*10-10 = 3,26*106
c)
![]()
SEM = 1,51 - (-0,408) - (0,059/5)log(3,26*106) = 1,918 - 0,077 = 1,841 V
d)
Znowu piszemy oba półogniwa w kierunku redukcji:
Cr3+ + e- ↔ Cr2+; K = [Cr2+]/[Cr3+]
ECr = E0Cr3+/Cr2+ - 0,059log(0,02/0,5) = -0,408 + 0,082 = -0,326 V
MnO4- + 5e- + 8H+ ↔ Mn2+ + 4H2O; K = [Mn2+]/[MnO4-]
EMn = E0MnO4-/Mn2+ - (0,059/5)log(0,02/0,06) = 1,51 + 0,006 = 1,516
SEM = EMn - ECr = 1,516 - (-0,326) = 1,842 V
e)
ΔG = -0,01*96500*1,842 = -1778 J
z.6
Zbudowano półogniwo manganowe zanurzając blaszke manganową w roztworze chlorku manganu o stężeniu 0,2 mol/dm3 oraz półogniwo wodorowe zanurzając blaszke platynową w roztworze kwasu solnego o stężeniu 0,5 mol/dm3. E0(Mn2+/Mn) = -1,18 V
a) Zapisz schemat tego ogniwa
b) Zapisz reakcje zachodzące w półogniwach i reakcje sumaryczną
c) Za pomocą odpowiednich wzorów wyraź siłę elektromotoryczną tego ogniwa, a następnie oblicz jej wartość.
d)Zapisz wyrażenia na potencjały obu półogniw i oblicz ich wartość.
e) Oblicz zmianę entalpii swobodnej w tym ogniwie, jeżeli przez obwód przepłynęło 0,05 mola elektronów.
a)
Uwaga: jedną z części ogniwa jest półogniwo wodorowe, nie jest to jednak normalna elektroda wodorowa, bo stężenie H+ = 0,5 , a nie 1. E0H+/H2 = 0
-Mn | Mn2+ || H+, H2 | Pt+
b)
Mn0 - 2e- → Mn2+
2H+ + 2e- → H2
Mn + 2H+ ↔ Mn2+ + H2;
K = [Mn2+]/[H+]2
c)
![]()
SEM = 0 - (-1,18) - (0,059/2)log(0,2/0,52) = 1,18 + 0,003 = 1,183 V
d)
lewe: Mn2+ + 2e- ↔ Mn0; K = 1/[Mn2+]
EMn= E0Mn2+/Mn -(0,059/2)log(1/0,2)= -1,18 - 0,021 = -1,201
prawe: H+ + e- ↔ 1/2H2; K = 1/[H+]
EH = 0 - 0,059log(1/0,5) = -0,018
SEM = EH - EMn = -0,018 - (-1,201) = 1,183
e)
ΔG = -nFSEM = -0,05*96500*1,183 = -5708 J
z. 7.
W nasyconym roztworze chlorku srebra zanurzono elektrodę chlorosrebrową i tak skonstruowane półogniwo połączono z normalną elektrodą wodorową. Wiedząc, że E0Ag/AgCl = 0,222 V, a zmierzona siła elektromotoryczna wynosiła 0,511 V:
a) zapisz schemat tego ogniwa
b) zapisz reakcje połówkowe i reakcję sumaryczną
c) wyznacz iloczyn rozpuszczalności chlorku srebra.
a)
Normalna elektroda wodorowa ma potencjał 0, czyli mniejszy niż E0Ag/AgCl, więc będzie zachodziło utlenianie wodoru i redukcja srebra.
-Pt | H+, H2 || Cl- |Ag/AgCl+
b)
1/2H2 - e- → H+
AgCl + e- → Ag + Cl-
1/2H2 + AgCl ↔ Ag + Cl- + H+
K = [Cl-][H+] (bo inne substancje są albo stałe albo gazowe)
c)
![]()
SEM = 0,222 - 0 - 0,059log[Cl-]*1
[Cl-] jest niewiadomą i mamy je wyliczyć, wiedząc, że zmierzone SEM wynosi 0,511V
0,511 = 0,222 - 0,059log[Cl-]
-0,059log[Cl-] = 0,289
log[Cl-] = -4,9
[Cl-] = 10-4,9
[Cl-] = 1,26*10-5
Piszemy równanie dysocjacji AgCl i wyrażenie na iloczyn rozpuszczalności:
AgCl ↔ Ag+ + Cl-; KSO = [Ag+][Cl-], czyli jest to iloczyn tylu x2
Kso = (1,26*10-5)2 = 1,58*10-10
z. 8.
W nasyconym roztworze siarczanu (VI) ołowiu zanurzono elektrodę zbudowaną z drutu ołowianego pokrytego cienka warstwą siarczanu (VI) ołowiu. Tak skonstruowane półogniwo połączono z normalna elektrodą wodorową. Wiedząc, że E0Pb/PbSO4 = -0,356 V, a zmierzona siła elektromotoryczna wyniosła 0,241 V:
a) zapisz schemat półogniwa
b) zapisz reakcje połówkowe i reakcję sumaryczną
c) wyznacz iloczyn rozpuszczalności siarczanu (VI) ołowiu.
a)
Potencjał elektrody drugiego rodzaju jest ujemny, czyli będzie ona półogniwem lewym, a normalna elektroda wodorowa półogniwem prawym:
-Pb/PbSO4 | SO42- || H+, H2 | Pt+
b)
Pb + SO42- - 2e- → PbSO4
2H+ - 2e- → H2
Pb + SO42- + 2H+ ↔ PbSO4 + H2
K = 1/[SO42-][H+]2
c)
![]()
SEM = 0 - (-0,356) - (0,059/2)log(1/[SO42-]*1)
Przy okazji: log(1/[SO42-] = - log[SO42-], więc:
SEM = 0,356 + (0,059/2)log[SO42-]
[SO42-] jest niewiadomą, SEM = 0,241V
0,241 = 0,356 + 0,0295log[SO42-]
0,0295log[SO42-] = - 0,115
log[SO42-] = -3,9
[SO42-] = 10-3,9
[SO42-] = 1,26*10-4
Piszemy równanie dysocjacji PBSO4 i wyrażenie na iloczyn rozpuszczalności:
PbSO4 ↔ Pb2+ + SO42- ; KSO = [Pb2+][SO42-]
Czyli jest to iloczyn typu x2
KSO = (1,26*10-4)2 = 1,6*10-8.
Wyszukiwarka
Podobne podstrony:
iloczynrozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
kol4v1rozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
kol3rozwiazane, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
kol3v2rozwiazane, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
iloczynrozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
konwers. II 2009, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna
Konwersatorium II, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna
Pomoc do mieszaniny końcowej, materialy farmacja, I rok, chemia nieorganiczna kolokwia
IV i V gr. kationów notatka + hydroliza, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia koń
KationyV, Farmacja, I rok, Chemia nieorganiczna
KationyIIB, Farmacja, I rok, Chemia nieorganiczna
ELEKTROLITY, Studia budownictwo pierwszy rok, Chemia budowlana, Chemia budowlana, Na Egzamin
nieorgany 9-16, Studia, II rok, Chemia nieorganiczna
Egzamin 4, Studia chemia UJ, II rok, Chemia nieorganiczna, Egzamin
Egzamin 5, Studia chemia UJ, II rok, Chemia nieorganiczna, Egzamin
kołokwium 4, Notatki Rolnictwo, III Rok, entomologia, IV kolokwium
nieorgany 49-56, Studia, II rok, Chemia nieorganiczna
KationyI, Farmacja, I rok, Chemia nieorganiczna
więcej podobnych podstron