z.1. Zmieszano 200cm3 0,15M roztworu amoniaku (K=1,77*10-5) i 100cm3 0,2M roztworu azotanu (V) amonu. Wykonaj poniższe polecenia:
a) oblicz pH powstałego roztworu.
b) Do 300 cm3 tak przygotowanego roztworu dodano 10 cm3 1M roztworu HCl. Jak zmieniło się pH?
c) Do 300 cm3 tak przygotowanego roztworu dodano 30 cm3 1M roztworu NaOH. Jak zmieniło się pH?
a)
Liczymy liczbę moli amoniaku i azotanu (V) amonu
0,15 - 1000 cm3; 0,2 - 1000 cm3
x - 200 cm3; x - 100 cm3
x = 0,03 mol (0,25p); x=0,02 mol (0,25p)
To jest bufor zasadowy, więc korzystamy ze wzoru:
pOH = pK + log(nS/nB)
pOH = -log(1,77*10-5) + log(0,02/0,03) = 4,75 - 0,18 = 4,57
pH = 14 - 4,57 = 9,43 (za te obliczenia, stwierdzenie, ze to jest bufor i zastosowanie właściwego wzoru 0,5p).
b) Zaczynamy od zapisania równania reakcji:
NH3 + HCl → NH4Cl (0,25p)
Liczymy liczbę moli HCl:
1mol - 1000 cm3
x - 10cm3; x = 0,01 mol (0,25p)
Amoniaku było przed reakcją 0,03 mol, więc po reakcji z 0,01 mol HCl zostanie go 0,2 mol, z kolei przybyło soli amonowej: 0,02 + 0,01 = 0,03 mol
(tu nie ma znaczenia, czy to jest NH4NO3, czy NH4Cl - przeciwjon jest bez znaczenia, liczy się jon NH4+.).
pOH = 4,75 + log(0,02+0,01)/(0,03-0,01) = 4,75 + log0,03/0,02 = 4,75 + 0,18 = 4,93
pH = 14 - 4,93 = 9,07
ΔpH = 9,07 - 9,43 = -0,36 (za obliczenia 0,5p)
c) NH4NO3 + NaOH → NH3 + NaNO3 + H2O (0,25p)
Liczymy liczbę moli dodanej zasady:
1mol - 1000 cm3
x - 30 cm3; x = 0,03 mol (0,25p)
W układzie było 0,02 mol soli (NH4NO3) a więc NaOH jest w nadmiarze i wynosi on 0,03 - 0,02 = 0,01 mol. W takim razie bufor przestał działać, a my liczymy pH roztworu NaOH, nie zapominając o przeliczeniu stężenia molowego: (za tą część 0,5p)
0,01mol - 330 cm3
x - 1000 cm3; x = 0,03
pOH = -log(0,03) = 1,52, pH = 12,48 (za tę część obliczeń 0,5p)
część a - 1p
część b - 1p
część c - 1,5p
całe zadanie 1 - 3,5p
Błędy
Typowym błędem było niezauważenie, że jest to bufor zasadowy, więc korzystamy ze wzoru na pOH, a nie pH, lub ze wzoru pH = 14 - pK + log(nB/ns). W części c część osób nie zauważąła, że NaOH jest w nadmiarze i liczyła ten punkt dalej ze wzoru na pH buforów.
z.2. Rozpuszczono 0,6g kwasu octowego (K=1,58*10-5) w 200 cm3 wody (przyjąć gęstość roztworu 1 g/cm3).
a) Obliczyć pH powstałego roztworu.
b) Do tego roztworu dodano 1,96g octanu potasu. Jak zmieniło się pH?
c) Do tego roztworu dodano 10 cm3 0,05M roztworu siarczanu(VI) potasu. Jak zmieniło się pH?
a)
Liczymy liczbę moli i stężenie kwasu octowego:
M (CH3COOH) = 60 g/mol;
1 mol - 60g
x - 0,6g
x = 0,01 mol (0,25p)
0,01 mol - 200 cm3
x - 1000 cm3
x = 0,05 mol/dm3 (0,25p)
Teraz zauważamy, że to jest kwas słaby!
α = ![]()
= 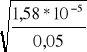
= 0,018 (0,25p)
[H+] = α*c = 0,018*0,05 = 0,0009 mol/dm3 (0,25p)
pH = -log(0,0009) = 3,05 (0,25p)
b) Dodano octan potasu, czyli mamy teraz w układzie słaby kwas i jego sól z mocną zasadą, czyli bufor kwaśny.
Liczymy liczbę moli octanu potasu:
M (CH3COOK) = 98 g/mol
1 mol - 98 g
x - 1,96g; x = 0,02 mol (0,25p)
pH = pK + log(nS/nA) = 4,8 + log(0,02/0,01) = 4,8 + 0,3 = 5,1 (za obliczenia 0,5p)
uwaga: nA = 0,01, bo interesuje nas liczba moli kwasu octowego w naczyniu, do którego dadano octan potasu, a nie stężenie molowe
c) należało napisać : pH nie zmieni się. Siarczan potasu nie ma żadnych wspólnych jonów z kwasem octowym. Poza tym jest to sól silnej zasady i mocnego kwasu, czyli nie hydrolizuje i w żaden sposób nie zmienia pH roztworu kwasu octowego:
Za zadanie 2 było 2,5p (a - 1p, b - 0,75p, c - 0,5p)
Błędy
Prawie wszyscy potraktowaliście kwas octowy jako kwas mocny. Ja zapowiadałem, że podpunkt o słabych kwasach/zasadach trafi się od nowa w kolokwium, bo w poprzednim takie zadanie poszło bardzo źle. Na prawdę wzór α=![]()
nie jest chyba jakoś strasznie skomplikowany.
Wiele osób mieszało punkt b z c, np. twierdziło, że octan potasu nie ma wspólnych jonów z kwasem octowym, za to twierdzili, że K2SO4 ma takie jony i tworzy bufor z kwasem octowym.
z.3. Ile gramów chlorku amonu należy dodać do 250cm3 0,3M roztworu amoniaku (K=1,77*10-5), aby otrzymać roztwór o pH 9,5?
Na początku obliczmy liczbę moli amoniaku:
0,3 mol - 1000 cm3
x - 250 cm3; x = 0,075 mol (0,25p)
Teraz podstawiamy to do wzoru na pOH buforu zasadowego (pOH = 14-9,5 = 4,5)
pOH = pK + log(nS/nB)
lub do bezpośredniego wzoru na pH: pH = 14 - pK + log(nB/nS)
Ale trzeba wybrać jeden z tych wzorów, ich nie można pomieszać!!!!
(nieprawdziwy jest wzór pH = pK + log(nS/nb) - bo opisuje on pH buforu kwaśnego, a nie zasadowego)
pOH = pK + log(nS/nB) (za napisanie odpowiedniego wzoru i podstawienie odpowiednich liczb - 0,5p)
4,5 = 4,75 + log(nS/0,075)
log(nS/0,075) = -0,25
nS/0,075 = 10-0,25
nS/0,075 = 0,56
nS = 0,075*0,56 = 0,042
M NH4Cl = 53,5 g/mol
1 mol - 53,5g
0,042 - x; x = 2,247g (za przeprowadzenie obliczeń 0,5p)
Za całe zadanie było 1,25p
Błędy
Typowym błędem było mieszanie wzorów na pH, próba liczenia tego wzorem na pH buforu kwaśnego.
z. 4. Do 100 cm3 0,1M roztworu HCl dodano:
a) 200 cm3 0,1M roztworu NaOH. Jak zmieniło się pH?
b) 200 cm3 0,1M roztworu amoniaku (K=1,77*10-5). Jak zmieniło się pH?
pH na początku wynosi 1 (pH = -log(0,1))
a) HCl + NaOH → NaCl + H2O (0,25p)
Liczymy liczbę moli obu składników:
0,1 - 1000 cm3; 0,1 mol - 1000cm3
x - 100 cm3; x - 200 cm3
x = 0,01 mol; x = 0,02 (za obliczenie liczby moli 0,25p)
Widzimy, że NaOH jest w nadmiarze i nadmiar ten wynosi 0,01 mol. Liczymy stężenie molowe NaOH:
0,01 - 300 cm3
x - 1000 cm3; x = 0,0333 mol/dm3
pOH =-log(0,0333)= 1,48; pH = 12,52 (za resztę obliczeń 0,5p)
ΔpH = 12,52 - 1 = 11,52
b) HCl + NH3 → NH4Cl (0,25p)
Znowu liczymy liczbę moli kwasu i zasady, proporcje jak wyżej
x= 0,1 mol; x = 0,02 mol (0,25p)
Mamy nadmiar amoniaku. Po reakcji mamy w zlewce 0,01 mol amoniaku i 0,01 mol chlorku amonu, czyli powstał bufor amonowy
pOH = pK + log(nS/nB) = 4,75 + log(0,01/0,01) = 4,75 , pH = 0,25(za resztę obliczeń 0,5p)
ΔpH = 9,25 - 1 = 8,25
Za zadanie 2 były 2p
Błędy
Znowu w części b niektórzy liczyli pH buforu zasadowego wzorem na pH buforu kwaśnego.
Punktacja i oceny
0 - 4,62 ndst (2,0)
> 4,62 - 5,55 dst (3,0)
>5,55 - <6,5 +dst (3,5)
6,5 - 7,4 db (4,0)
> 7,4 - < 8,25 +db (4,5)
=>8,25 bdb (5,0)
Wyszukiwarka
Podobne podstrony:
iloczynrozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
kol4v1rozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
kol3rozwiazane, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
elektrochemiarozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
iloczynrozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
konwers. II 2009, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna
Konwersatorium II, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna
Pomoc do mieszaniny końcowej, materialy farmacja, I rok, chemia nieorganiczna kolokwia
IV i V gr. kationów notatka + hydroliza, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia koń
KationyV, Farmacja, I rok, Chemia nieorganiczna
KationyIIB, Farmacja, I rok, Chemia nieorganiczna
nieorgany 9-16, Studia, II rok, Chemia nieorganiczna
Egzamin 4, Studia chemia UJ, II rok, Chemia nieorganiczna, Egzamin
Egzamin 5, Studia chemia UJ, II rok, Chemia nieorganiczna, Egzamin
kołokwium 4, Notatki Rolnictwo, III Rok, entomologia, IV kolokwium
nieorgany 49-56, Studia, II rok, Chemia nieorganiczna
KationyI, Farmacja, I rok, Chemia nieorganiczna
nieorgany 65-72, Studia, II rok, Chemia nieorganiczna
więcej podobnych podstron