z.1. Zmieszano 150 cm3 0,1M roztworu kwasu octowego (octowego=1,58*10-5) i 150 cm3 0,2M roztworu octanu sodu. Wykonaj poniższe polecenia:
a) Oblicz pH powstałego roztworu
b) Do 300 cm3 tak przygotowanego roztworu dodano 7,5 cm3 1M roztworu HCl. Jak zmieniło się pH?
c) Do 300 cm3 tak przygotowanego roztworu dodano 25 cm3 1M roztworu NaOH. Jak zmieniło się pH?
a)
Liczymy ilości moli kwasu octowego i octanu sodu:
0,1mol - 1000 cm3; 0,2mol - 1000 cm3
x - 159 cm3; x - 150 cm3
x = 0,015mol (0,25p) x = 0,03 mol (0,25p)
Zmieszanie słabego kwasu z jego solą z mocną zasadą daje roztwór buforowy:
pH = pK + log(nS/nA)
pH = -log(1,58*10-5) + log(0,03/0,015) = 4,8 + 0,3 = 5,1 (0,5p)
b) Zaczynamy od równania zachodzącej reakcji !
CH3COONa + HCl → CH3COOH + NaCl (0,25p)
W tej reakcji ubywa octanu sodu a przybywa kwasu octowego.
Pytamy jaką ilość moli HCl dodaliśmy:
1mol - 1000 cm3
x - 7,5cm3; x = 0,0075 mol (0,25p)
pH = pK + log(nS-x)/(nA+x) = 4,8 + log(0,03-0,0075)/(0,015+0,0075) = 4,8 + log(0,0225/0,0225) = 4,8 + log1 = 4,8 (za zapisanie odpowiedniego wyrażenia i obliczenie 0,5p)
ΔpH = 4,8-5,1 = -0,3
c) CH3COOH + NaOH → CH3COONa + H2O (0,25p)
Liczymy ilość moli zasady:
1mol - 1000 cm3
x - 25 cm3; x = 0,025mol (0,25p)
Zauważamy, że w całym roztworze kwasu octowego było 0,015 mol, a więc jest nadmiar NaOH, który wynosi 0,01 mol i bufor oczywiście przestał istnieć (za stwierdzenie tego 0,5p)
Liczymy pH dla zasady sodowej, pamiętając o tym, że pH liczy się dla stężeń molowych:
0,01 mol OH- - 330 cm3
x - 1000 cm3; x=0,031 mol
pOH = -log(0,031) = 1,51; pH = 14-1,51= 12,49
ΔpH = 12,49-5,1 = 7,39
(za ta część zadania 0,5p)
Punktacja w zadaniu 1
Część a - 1p
Część b - 1p
Część c - 1,5p
Całość 3,5p
Typowe błędy
Generalnie zadanie było dobrze rozwiązane, błędy były raczej przypadkowe. Często nie piszą Państwo równań reakcji, a ja te równania punktuje, więc tracicie na tym. Równanie powinno być zawsze zapisane, bo po pierwsze pokazuje stechiometrię, a po drugie w przypadku buforów pokazuje której formy ubyło, a której przybyło w reakcji z kwasem/zasadą.
W części c liczba moli zasady jest tak dobrana, żeby bufor przestał działać. Większość z Was wie, że wtedy liczymy pH z nadmiaru zasady, ale część z Państwa zapomina obliczyć stężenie molowe jonów OH-.
z.2. Rozpuszczono 0,85g gazowego amoniaku (K=1,77*10-5) w 400 cm3 wody (przyjąć gęstość roztworu 1 g/cm3)
a) Obliczyć pH powstałego roztworu
b) Do tego roztworu dodano 5,35g azotanu (V) amonu. Jak zmieniło się pH?
c) Do tego roztworu dodano 10 cm3 0,5M roztworu NaCl. Jak zmieniło się pH?
a)
MNH3 = 14+3 = 17g/mol
1mol - 14g
x - 0,85g; x = 0,05 mol (0,25p)
Obliczamy stężenie molowe amoniaku:
0,05mol - 400 cm3
x - 1000 cm3; x=0,125 mol/dm3 (0,25p)
TO JEST SŁABA ZASADA!!!
α = ![]()
= 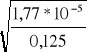
= 0,012 (0,25p)
[OH-] = α*c = 0,012*0,125 = 0,0015 mol/dm3 (0,25p)
pOH = -log(0,0015) = 2,82; pH = 11,18 (0,25p)
b) Dodano NH4NO3
To jest sól tej słabej zasady z mocnym kwasem, czyli powstaje roztwór buforowy:
Obliczamy liczbę moli NH4NO3:
M (NH4NO3) = 80 g/mol
1mol - 80g
x - 5,35g; x = 0,067mol (0,25p)
pOH = pK + log(nS/nB) = 4,75 + log(0,067/0,05) = 4,75 + 0,13 = 4,88
pH = 14-4,88 = 9,12; ΔpH = 9,12 - 11,18 = -2,06
(za te obliczenia 0,5p)
Uwaga: do wyrażenia na pOH buforu wpisujemy liczbę moli amoniaku w 400 cm3, bo do tej objętości dodano NH4NO3, a nie stężenie molowe amoniaku.
c) Należało napisać: pH nie zmieniło się (0,5p)
A nie zmieniło się, bo ta sól nie ma wspólnego jonu z amoniakiem, a poza tym jest solą silnego kwasu i silnej zasady, czyli nie hydrolizuje i w żaden sposób nie zmienia stosunku jonów H+/OH- w roztworze amoniaku
Za całe zadanie 2 było 2,5p.(część a 1p, część b 0,75p, część c 0,5p)
Typowe błędy:
Prawie wszyscy zrobili źle część a. Znowu potraktowaliście amoniak jak mocną zasadę. Ja mówiłem po drugim kolokwium, że znowu dam jakiś podpunkt o pH słabego kwasu/zasady, bo źle poszło to poprzednio, no i znowu poszło beznadziejnie. Przeciez to chyba nie jest trudny materiał ? chyba wzór α = ![]()
nie jest jakiś specjalnie skomplikowany. Trzeba sobie tylko o nim przypomnieć… Bufory są rozwinięciem tematyki dotyczącej pH słabych kwasów i zasad, wiec nie można tego szufladkować i rozdzielić. Proszę wreszcie się tego douczyć!!!
Niektórzy z Państwa przeprowadzali jakieś skomplikowane obliczenia w punkcie c - tam nic nie trzeba było liczyć.
z.3 Ile gramów octanu potasu należy dodać do 200 cm3 0,2M roztworu kwasu octowego (octowego=1,58*10-5), aby otrzymać roztwór o pH=5?
Liczymy liczbę moli kwasu octowego
0,2 mol - 1000 cm3
x - 200 cm3, x = 0,04 mol (0,25p)
Podstawiamy teraz do wzoru na pH buforu kwaśnego:
pH = pK + log(nS/nA)
5 = 4,8 + log(nS/0,04) (za właściwe zapisanie i podstawieni 0,5p)
log(nS/0,04) = 0,2
nS/0,04 = 100,2
nS/0,04 = 1,58
nS = 0,04*1,58 = 0,063mol
M(CH3COOK) = 98g/mol
1mol - 98g
0,063 mol - x; x=6,17g (za obliczenia 0,5p)
Za całe zadanie było 1,25p
Błędy
Większość z Państwa zrobiła to zadanie dobrze. Pojawiał się następujący dziwny błąd:
Pisaliście: log(nS/0,04) = 0,2, po czym
nS/0,04 = 10-0,2
Skąd ten minus? Jeżeli a=b, to 10a = 10b, ale nie 10-b
z.4 Do 100 cm3 0,1M roztworu NaOH dodano:
a) 200 cm3 0,1M roztworu HCl. Jak zmieniło się pH?
b) 200 cm3 0,1M roztworu CH3COOH (K=1,58*10-5). Jak zmieniło się pH?
pH przed dodaniem czegokolwiek wynosiło 13 (pOH = -log(0,1))
a) NaOH + HCl → NaCl + H2O (0,25p)
Liczymy liczbę moli zasady i kwasu:
0,1mol - 1000cm3; 0,1mol - 1000 cm3
x - 100 cm3; x - 200 cm3
x = 0,01 x = 0,02 (za obie liczby 0.,25p)
Kwasu jest 2 razy więcej niż zasady, czyli po reakcji zostanie 0,01 mol kwasu w 300 cm3
0,01 - 300 cm3
x - 1000 cm3; x = 0,033 mol/dm3
pH = -log(0,033) = 1,48
(za obliczenia 0,5p)
ΔpH = 1,48 - 13 = -11,52
b) NaOH + CH3COOH → CH3COONa + H2O (0,25p)
Liczymy liczbę moli zasady i kwasu, proporcje jak wyżej.
x = 0,01; x = 0,02 (za ilości moli 0,25p)
Dwukrotny nadmiar kwasu octowego. Po reakcji mamy w układzie 0,01 mol CH3COONa i 0,01mol CH3COOH, a więc mamy bufor octanowy
pH = pK + log(nS/nA) = 4,8 + log(0,01/0,01) = 4,8 (za obliczenia (0,5p)
ΔpH = 4,8 - 13= -8,2
Za całe zadanie były 2 punkty
Błędy
Raczej poszło dobrze
Czasem zapominaliście przeliczyć stężenie molowe w punkcie a
Punktacja i oceny
0 - <4,63 ndst (2,0)
4,63 - 5,55 dst (3,0)
>5,55 - <6,5 +dst (3,5)
6,5 - 7,4 db (4,0)
>7,4 - <8,25 +db (4,5)
=> 8,25 bdb (5,0)
Wyszukiwarka
Podobne podstrony:
iloczynrozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
kol4v1rozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
kol3v2rozwiazane, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
elektrochemiarozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
iloczynrozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
konwers. II 2009, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna
Konwersatorium II, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna
Pomoc do mieszaniny końcowej, materialy farmacja, I rok, chemia nieorganiczna kolokwia
IV i V gr. kationów notatka + hydroliza, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia koń
KationyV, Farmacja, I rok, Chemia nieorganiczna
KationyIIB, Farmacja, I rok, Chemia nieorganiczna
nieorgany 9-16, Studia, II rok, Chemia nieorganiczna
Egzamin 4, Studia chemia UJ, II rok, Chemia nieorganiczna, Egzamin
Egzamin 5, Studia chemia UJ, II rok, Chemia nieorganiczna, Egzamin
kołokwium 4, Notatki Rolnictwo, III Rok, entomologia, IV kolokwium
nieorgany 49-56, Studia, II rok, Chemia nieorganiczna
KationyI, Farmacja, I rok, Chemia nieorganiczna
nieorgany 65-72, Studia, II rok, Chemia nieorganiczna
więcej podobnych podstron