z1. Ile gramów Ca3(PO4)2 rozpuści się w 100g wody?. KSO Ca3(PO4)2 = 10-26
W takim zadaniu należy rozpisać dysocjację trudno rozpuszczalnej soli, napisać wyrażenie na iloczyn a następnie zastanowić się, jakiego typu jest to iloczyn:
Ca3(PO4)2 ↔ 3Ca2+ + 2PO43-
x 3x 2x
KSO = [Ca2+]3[PO43-]2 = (3x)3*(2x)2 = 108x5
O co chodzi z tym x:
Zakładamy, że dysocjuje x moli tej soli. Na skutek dysocjacji dostajemy 3x moli jonów Ca2+ i 2x moli jonów PO43-. Jeżeli te x wstawimy do odpowiednich nawiasów kwadratowych, to ostatecznie otrzymamy wyrażenie 108x5.
x = ![]()
= 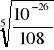
= 2,47*10-6 mola
Czyli w 1000 cm3 wody może się rozpuścić 2,47*10-6 mola Ca3(PO4)2, a więc w 100 cm3 (100g) wody 10 razy mniej czyli 2,47*10-7 mola.
M (Ca3(PO4)2 = 310 g/mol
A więc m = 2,47*10-6*310 = 7,66*10-4g
z. 2. Czy przy pH = 4 z 0,1M roztworu CuCl2 może się wytrącić wodorotlenek miedzi? KSO Cu(OH)2 = 2,5*10-19
Na początku trzeba zapisać dysocjację trudno rozpuszczalnego związku i wyrażenie na iloczyn:
Cu(OH)2 ↔ Cu2+ + 2OH-
KSO = [Cu2+][OH-]2
Nie ma sensu wpisywać tu jakichkolwiek x-sów i zastanawiać się jakiego typu to jest iloczyn. W takich zadaniach do formuły na iloczyn, czyli wzoru [Cu2+][OH-]2 należy wstawić stężenia obu jonów, wyliczyć wartość liczbową i porównać ją z tablicową wartością iloczynu rozpuszczalności. Jeżeli liczba, która nam wyszła jest większa od KSO, to osad się strąci, a jeżeli jest mniejsza od KSO, to osad się nie strąci.
W tym zadaniu znamy zarówno stężenie jonów Cu2+ - w treści zadania napisane jest, że CuCl2 jest 0,1M, jak i stężenie jonów OH-, bo znamy pH:
pH = 4; pOH = 10; [OH-] = 10-10
Podstawiamy do formuły na iloczyn:
[Cu2+][OH-]2 = 0,1*(10-10)2 = 10-21
Zauważamy, że liczba, która nam wyszła, 10-21 jest mniejsza od 2,5*10-19 (KSO), czyli wyciągamy wniosek, że osad się nie strąca.
z. 3. Zbudowano ogniwo Daniela zestawione z półogniwa glinowego i półogniwa talowego. E0(Al3+/Al0) = -1,66 V;
E0(Tl+/Tl0) = -0,336 V. Wiedząc, że stężenie jonów glinu wynosiło 0,4 mol/dm3, a jonów talu 0,02 mol/dm3:
a) Napisz schemat tego ogniwa
b) Zapisz reakcje zachodzące w półogniwach (po złączeniu ich w to konkretne ogniwo) i reakcje sumaryczną.
c) Oblicz stałą równowagi dla reakcji zachodzącej w ogniwie
d) Za pomocą odpowiednich wzorów wyraź siłę elektromotoryczną tego ogniwa a następnie oblicz jej wartość.
e) Zapisz wyrażenia na potencjały obu półogniw i oblicz ich wartość przy zadanych stężeniach jonów.
f) Oblicz zmianę entalpii swobodnej w tym ogniwie, jeżeli przez obwód przepłynęło 0,1 mola elektronów.
a) (A-) -Al| Al3+ || Tl+ |Tl+ (K+)
b) Al0. - 3e- → Al3+
Tl+ + e- → Tl0 |*3
Al. + 3Tl+ ↔ Al3+ + 3Tl
c) K = [Al3+]/[Tl+]3 = (0,4)/(0,02)3 = 50000
d) SEM = E0Tl+/Tl - E0Al3+/Al. - (0,059/3)logK = -0,336 - (-1,66) - 0,02log(50000) =
1,324 - 0,094 = 1,230 V
e) Pamiętamy, że rozpięte półogniwa rozpatruje się zawsze w kierunku redukcji:
Al3+ + 3e- ↔ Al0 ; K = 1/[Al3+]
E = E0Al3+/Al. - (0,059/3)logK = -1,66-0,008 = -1,668V
Tl+ + e- ↔ Tl0, K = 1/[Tl+]
E = E0Tl+/Tl - 0,059logK = -0,336 - 0,1 = -0,436V
f) ΔG = -nFSEM = -0,1*96500*1,23 = -11869 J
z. 4. Zbudowano dwa półogniwa: W roztworze zawierającym jony kobaltu (III) (stężenie 0,04M) i jony kobaltu (II) (stężenie 0,3M) zanurzono elektrodę platynową. Podobnie w drugim roztworze zawierającym jony cyny (IV) (stężenie 0,15M) i cyny (II) (stężenie 0,05M) zanurzono elektrodę platynową. Elektrody połączono drutem a roztwory kluczem elektrolitycznym łącząc te półogniwa w ogniwo prądu stałego. E0Co3+/Co2+ = 1,84V; E0Sn4+/Sn2+ = 0,15V. Wykonaj następujące polecenia:
a) Zapisz schemat tego ogniwa.
b) Zapisz reakcje zachodzące w półogniwach (po złączeniu ich w to konkretne ogniwo) i reakcję sumaryczną.
c) Oblicz stałą równowagi dla reakcji zachodzącej w ogniwie.
d) Za pomocą odpowiednich wzorów wyraź siłę elektromotoryczną tego ogniwa i oblicz jej wartość.
e) Zapisz wyrażenia na potencjały obu (separowanych) półogniw i oblicz ich wartość przy zadanych stężeniach jonów.
f) Oblicz zmianę entalpii swobodnej w tym ogniwie, jeżeli przez obwód przepłynęło 0,3 mola elektronów.
a) (A-) -Pt| Sn2+, Sn4+ || Co2+, Co3+ |Pt+ (K+)
Uwaga!! Zapis -Pt| Sn2+| Sn4+ || Co2+| Co3+|Pt+ jest zupełnie błędny - kreski pionowe oznaczają granicę faz, przecież jony Sn2+ i Sn4+ nie są niczym od siebie odseparowane i pływają razem w jednym roztworze, podobnie jony kobaltu. Tu muszą być przecinki! Nie ma natomiast znaczenia kolejność wymieniania jonów w roztworze, czyli Sn4+, Sn2+ albo Sn2+, Sn4+.
b)
Sn2+ - 2e- → Sn4+
Co3+ + e- → Co2+ |*2
Sn2+ + 2Co3+ ↔ Sn4+ + 2Co2+
c)
K = 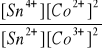
= 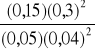
= 169
d)
SEM = E0Co3+/Co2+ - E0Sn4+/Sn2+ -(0,059/2)log(K) = 1,84 - 0,15 - 0,0295log(169) = 1,69 - 0,066 = 1,624V
e)
Sn4+ + 2e- ↔ Sn2+; K = [Sn2+]/[Sn4+]
E= E0Sn4+/Sn2+ - (0,059/2)logK = 0,15 - 0,0295log(0,333) = 0,15 + 0,014 = 0,164V
Co3+ + e- ↔ Co2+ K = [Co2+]/[Co3+]
E = E0Co3+/Co2+ - 0,059logK = 1,84 - 0,059log(7,5) = 1,84 - 0,05 = 1,79V
f) ΔG = -nFSEM = -0,3*96500*1,624 = 47015J
Wyszukiwarka
Podobne podstrony:
iloczynrozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
kol3rozwiazane, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
kol3v2rozwiazane, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
elektrochemiarozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
iloczynrozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
konwers. II 2009, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna
Konwersatorium II, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna
Pomoc do mieszaniny końcowej, materialy farmacja, I rok, chemia nieorganiczna kolokwia
IV i V gr. kationów notatka + hydroliza, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia koń
KationyV, Farmacja, I rok, Chemia nieorganiczna
KationyIIB, Farmacja, I rok, Chemia nieorganiczna
nieorgany 9-16, Studia, II rok, Chemia nieorganiczna
Egzamin 4, Studia chemia UJ, II rok, Chemia nieorganiczna, Egzamin
Egzamin 5, Studia chemia UJ, II rok, Chemia nieorganiczna, Egzamin
kołokwium 4, Notatki Rolnictwo, III Rok, entomologia, IV kolokwium
nieorgany 49-56, Studia, II rok, Chemia nieorganiczna
KationyI, Farmacja, I rok, Chemia nieorganiczna
nieorgany 65-72, Studia, II rok, Chemia nieorganiczna
więcej podobnych podstron