9. Omów budowę, właściwości i otrzymywanie kompleksów 1,3-diketonianowych metali przejściowych na przykładach - np. [Ru(acac)3], [Cu(acac)2], [Pd(acac)2]. Podaj ogólny wzór liganda 1,3-diketonianowego.
Właściwości:
-bardziej kowalencyjne niż triady Fe, Co, Ni
-nie tworzą hydratów
-rozpuszczają się w cieczach organicznych
- nierozp. w H2O
- bardzo trwałe
Synteza rac-[Ru(acac)3] - ogrzewanie RuCl3 x H2O z Hacac i HCl do wrzenia, w toluenie a potem mieszanie w środowisku K2CO3
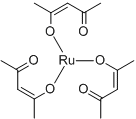
Jest to czerwony, paramagnetyczny, bardzo trwały termodynamicznie kompleks.
Struktura oktaedryczna
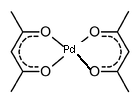
Synteza [Pd(acac)2] : reakcja Na2[PdCl4] z Hacac i zasadą NaOH w H2O
Żółto-pomarańczowy nierozp w wodzie, niezbyt trwały termicznie kompleks ( jednak w temp pokojowe jest praktycznie „wieczno- trwały”!) Płaski kwadrat
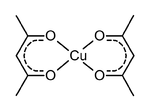
[Cu(acac)2]
Wzór ogólny:
[M(1,3-diket)2 lub3]
10. Przedstaw ogólną charakterystykę pierwiastków grup 8, 9 i 10: właściwości fizyczne samych metali, reaktywność chemiczną, stopnie utlenienia, chemię koordynacyjną i metaloorganiczną, itp.
Fe- bardzo czyste żelazo jest srebrzysto-białe, miękkie, ciągliwe występuje w 3 odmianach alotropowych, jest parą lub ferromagnetyczne - zależnie od warunków. Właściwości żelaza zależą od domieszek przede wszystkim od węgla . W suchym powietrzu nie ulega zmianom ( warstwa ochronna tlenku ); w wilgotnym powietrzu szybko się utlenia -rdza( korozja, uwodnione tlenki, węglany i inne sole) w zetknięciu z roz. elektrolitów ulega korozji, silnie rozdrobnione zapala się na powietrzu. Ulega roztworzeniu w kwasach nieutleniających -wydziela się wodór. W stężonym kwasie azotowym (V) ulega pasywacji, atakuje je stężony wodorotlenek sodu powstają oksoaniony i wodór. W podwyższonej temperaturze reaguje z parą wodną ,powstaje Fe3O4 i H2
Co, Ni- oba metale mają barwę białą, Ni z odcieniem żółtawym, niezbyt reaktywne, bardzo zbliżone, podobne właściwości do żelaza. Są bardziej odporne od żelaza a jednak
rozdrobnione są piroforyczne .Są ferromagnetyczne .Nie reagują z wilgotnym powietrzem zachowują połysk, roztwarzają się w kwasach nieutleniających ale wolniej niż żelazo, w stężonym HNO3 ulegają pasywacji. Nikiel silnie absorbuję wodór( jego siec przestrzenna rozszerza się) tworzy też zdefiniowany NiH2, oba metale reagują z parą wodną.
Wszystkie metale reagują ( w różnych temp niekiedy dopiero w temp czerwonego żaru)
z tlenowcami, fluorowcami, B, P, Si, As, Sb, CO NH3( Co i Ni- tworzą azotki z amoniakiem)
Wszystkie występują na II st. utlenienia na III Fe i Co. Tworzą też związki na formalnie ujemnych, zerowym (wszystkie); IV ( Fe, Co ,Ni) ;V (Fe, Co) VI (Fe) stopniach utlenienia. Maksymalny stopień utlenienia maleje od Fe do Ni.
Związki kompleksowe triady Fe, Co, Ni:
•Kompleksy z ditlenem:
a) akwajony [M(H20)6]2 lub 3+
b)kompleksy z amoniakiem lub innymi ligandami N-donorowymi: [M(NH3)6] 2 lub 3+
•Kompleksy anionowe:
a) [MX6] 3 lub 4- M= Fe, Co( II i III) X= CN, SCN, Cl, Br..
b) [MX4]2- M= Ni lub Co X= Cl, Br, I…
c) oksoaniony np. [FeO4]2-
•Kompleksy z ligandami 1,3- diketonianowymi. [M(acac)3] M= Fe, Co
•Kompleksy z N- i P- donorami ( Aminami, Fosfinami) np.: [Ni(PPh3)4]; [CoH(PPh3)4]
Ru, Rh Pd, Os, Pt- srebrzyste(wyjątek Os jest szaroniebieski) z różnymi odcieniami, lśniące , duża gęstość ,trudno topliwe. Są odporne i bierne chemicznie -zaliczane do metali szlachetnych (dość zróżnicowana reaktywność) . Iryd jest najbardziej odporny chemicznie, nie roztwarza się w wodzie królewskiej. Pd i Pt -są najbardziej reaktywne ze wszystkich platynowców ,roztwarzają się nawet w st. HCl, ale w obecności tlenu z powietrza Pt i Pd rozpuszczają wodór ( zimna fuzja). HNO3 atakuje tylko Pd i sproszkowany Os. Woda królewska rozpuszcza Pt, Pd .Os utlenia się łatwo tlenem z powietrza OsO4. Reszta metali ulega działaniu O2 w temp. ciemnego żaru. W podwyższonej temp platynowce reagują z F2, Cl2 ,S i P . Tworzą związki na stopniach utlenienia od 0 do VIII (VII i VIII jedynie Ru i Os) a nawet na formalnie ujemnych np: [M(CO)4]2- gdzie M= Ru, Os, Rh
Ruten występuje głównie jako Ru( 0, I, II ,III i IV); Os jako Os(0, I, II, III, VI i VIII)
Rod jest w związkach w formie Rh( 0, I, II, III); Ir( 0, I, II, III, IV); Pallad występuje jako Pd( 0,II) a Platyna jako Pt ( 0, II i IV).
Związki kompleksowe Ru, Rh, Ir, Pd, Os, Pt:
•Kompleksy anionowe
a) Jony [MX4lub6]2- M= Pd, Pt X= Cl, Br, CN, SCN ale nie F
b) Jony [MCl6]2 - M= Ru , Os
c) Jony [MCl6]3- M= Ru, Rh , Ir
•Kompleksy kationowe
a)[M(H2O)m]2+ M= Pd, Pt
b) [M(H2O)m]3+ lub 2+ M= Ru, Os, Rh, Ir
c)kompleksy z amoniakiem i aminami np: [Ru(NH3)6]2+, [Os(bpy)]3
•Oksoaniony np. [MO4]2- ,[MO4]- M= Ru, Os
•Kompleksy z fosfinami :
a)[M(CO)3(PPh3)2] M= Ru, Os
b) [MX(PPh3)3] M= Rh, Ir
c) [M X2(PPh3)2 M=Pd, Pt
•Kompleksy z ligandami 1,3- diketonianowymi. [M(acac)3] M= Ru, Rh ,Os, Ir
[M(acac)2] M= Pd, Pt
Związki metaloorganiczne: (8,9,10 gr.)
•Kompleksy σ- karbylowe :
a)Triada Fe, Co, Ni : tylko Fe tworzy trwałe homoleptyczne kompleksy σ- karbolowe np: [Fe(norbonyl)4] Pozostałe żelazowce( także Fe) tworzą heteroleptyczne np. typu [MXR(difosfina)] M= Ru, Os
b)Triada Co, Rh, Ir - tylko Co tworzy trwały [Co(norbonyl)4] pozostałe heteroleptyczne np: [MR(fosfina)3]gdzie M= Co, Rh, Ir a R= aryl, alkil
c)Triada Ni, Pd ,Pt typowe dla tej gr. są kompleksy kwadratowe [MR(X)(L2)] i [MR2L2] gdzie L= fosfina, difosfina, dien i inne . Najtrwalsze są kompleksy Pt
•Karbonylki:
a) Triada Fe, Ru, Os. Wszystkie tworzą kompleksy typu [M(CO)5]
b)Triada Co, Rh, Ir. [M2(CO)8]
c)Triada Ni, Pd, Pt. [M(CO)4]
•Hydrokarbonylki np: [Co H(CO)4], [IrClH2(CO)(PPh3)2]
•Kompleksy alkenowe:
a)Triada Fe, Ru, Os. [M(CO)4(alken)]nietrwałe i [MCl2(COD)x] b trwałe
b)Triada Co, Rh, Ir np.: [RhCl2(eten)4]
c)Triada Ni, Pd, Pt . np.: [Ni(COD)2] ,[PdCl2(COD)]
•Kompleksy karbonowe:
Są to kompleksy zawierające skoordynowany karben (ligand 2e).Szczególne znaczenie mają kompleksy karbonowe molibdenu, tytanu i rutenu ( kat. metatezy)
•Kompleksy allilowe : Znanych jest wiele typów tych kompleksów metali- mniej lub bardziej trwałych, homo lub heteroleptycznych, mono i wielordzeniowych. Na przykład homoleptyczne: [M(allil)2] M= Ni, Pd, Pt [M(allil)3] M= Fe, Ru ,Os ,Ir, Rh
•Kompleksy cyklopentadienylowe
a) Triada Fe, Ru, Os. [Mcp2] wyjątkowo trwałe ;18e
b)Triada Co, Rh, Ir [Mcp2] stosunkowo trwały tylko dla Co ;19e
c)Triada Ni, Pd, Pt. [Mcp2] 20e.
Pierwiastki Co, Rh, Ir, Ni, Pd, Pt tworzą także trwałe kompleksy cyklopentadienylowe zawierające także inne ligandy niż cp np.: Cl, Br, fosina, alkeny..
•Kompleksy arenowe:
a) Fe, Ru, Co [M(aren)2]
b)Fe, Os, Co, Rh [M(aren)2]+
c)Fe, Ru, Rh, Co, Ni, Os [M(aren)2]2+
11. Na jakich formalnych stopniach utlenienia platynowce występują w związkach chemicznych? Podaj po jednym przykładzie związków na dwóch stopniach utlenienia, dla każdego z platynowców.
Tworzą związki na stopniach utlenienia od 0 do VIII (VII i VIII jedynie Ru i Os) a nawet na formalnie ujemnych np: [M(CO)4]2- gdzie M= Ru, Os, Rh
Ruten występuje głównie jako Ru( 0, I, II ,III i IV); Os jako Os(0, I, II, III, VI i VIII)
Rod jest w związkach w formie Rh( 0, I, II, III); Ir( 0, I, II, III, IV); Pallad występuje jako Pd( 0,II) a Platyna jako Pt ( 0, II i IV)
• OsF6 i OsF7
• RuCl3 i RuO4
• PtCl4 i PtF6
• PdCl2 i H2[PdCl6]
• IrCl3 i [IrCl6]2-
• RhCl3 i Rh( bpy)2]2+
13.Jak zmienia się skłonność pierwiastków grup 8, 9 i 10 do tworzenia związków na wyższych stopniach utlenienia. Wyjaśnij te zależności.
W okresie: Wraz ze wzrostem liczby elektronów d maleje skłonność do tworzenia związków na wysokich stopniach utlenienia( maksymalny stopień utlenienia maleje od Fe do Ni; od Ru do Pd i od Os do Pt) - coraz trudniejsze staje oderwanie par elektronowych o przeciwnych spinach. Np: Pd i Pt maja 10e d i są one sparowane a Ru i Os maja 8e d w tym 2 są nie sparowane, które łatwiej oderwać.
W dół grupy 8,9 i 10 wraz ze wzrostem liczby atomowej rośnie trwałość połączeń na wyższym stopniu utlenienia. Rośnie promień atomowy, elektrony są coraz dalej od jądra ,są słabiej przyciągane a więc łatwiej je oderwać. Fe<Ru<Os ; Co<Rh<Ir ; Ni<Pd<Pt 14. Podaj przykłady trzech typów kompleksów anionowych platynowców, dla różnych metali tej grupy
[Pd(CN)4]2- , [ OsCl6]2-, [RhCl6]3-
15. Podaj przykłady kompleksów kationowych platynowców - trzech typów, dla różnych pierwiastków.
[Ru(H2O)6]2+,[Pt(NH3)4]2+ , [Os(bpy)3+]
16. Podaj przykłady kompleksów fosfinowych platynowców: dwóch różnych klas związków i różnych pierwiastków. Omów budowę wiązania metal-fosfina.
[Pd(PPh3)4], [Ru(CO)3(PPh3)2], [RhH(CO)(PPH3)3]
Wyszukiwarka
Podobne podstrony:
nieorgany 49-56, Studia, II rok, Chemia nieorganiczna
nieorgany 65-72, Studia, II rok, Chemia nieorganiczna
NIEOR 25-32, Studia, II rok, Chemia nieorganiczna
nieorgany 105-112, Studia, II rok, Chemia nieorganiczna
Egzamin 4, Studia chemia UJ, II rok, Chemia nieorganiczna, Egzamin
Egzamin 5, Studia chemia UJ, II rok, Chemia nieorganiczna, Egzamin
ściąga nieorganiczna, Studia, [xxx] Rok I, Chemia
Wybrane skl zywnosci, studia, Maja, Studia, II rok, III semestr, Chemia Żywnosci, Sciagi ChŻ
SCIAGA CHEMIA-zadania, Studia II rok, Studia, PD materialy donauki, PD materialy donauki
SCIAGA CHEMIA-POJECIA, Studia II rok, Studia, PD materialy donauki, PD materialy donauki
BIa-ka-chemia ¬ywnoÂci, Studia II rok, Studia, PD materialy donauki, PD materialy donauki
Rama nr 16, Studia, [xxx] Rok II, [xxx]Semestr 4, Wytrzymałość materiałów [x], ramy
DOSWIADCZENIA, studia, Maja, Studia, II rok, III semestr, Chemia Żywnosci, Sciagi ChŻ
pytania z CHEMII, Studia II rok, Studia, Teoria z fizyki do 57 ćw, Chemia Wykłady
MIKRO ŚCIĄGI Z WYKŁADU, studia, studia II rok, mikrobiologia, mikro egz, Ściągi RAZY 2
Przejawy niedost. społ. wśród uczniów klas gimnazjalnych, studia, II ROK, Resocjalizacja
zagadnienia chemia wody, Politechnika Wrocławska, Inżynieria Środowiska, II rok, Chemia wody
pediatria bad pacj, Pielęgniarstwo licencjat, licencjat, Studia II rok, pediatria
3 równania, Studia, II rok, Materiały Budowlane 2
więcej podobnych podstron