ANALIZA ILOŚCIOWA - miareczkowa
Analiza ilościowa prowadzi do poznania liczbowej wartości składu chemicznego materiałów, złożonych z mieszanin związków chemicznych, w odpowiednich jednostkach miary, (np. w gramach, molach). Analizę ilościową można wykonać różnymi metodami i przy zastosowaniu różnych technik. Wybór metody uzależniony jest od składu jakościowego materiału, ale też od dokładności wyników czy stopnia trudności i szybkości przeprowadzenia analizy.
Podstawowe kryterium klasyfikacji
W zależności od rodzaju metod pomiarowych, podobnie jak analizę jakościową, analizę ilościową dzieli się na chemiczną (klasyczną) i instrumentalną.
W nowoczesnych laboratoriach analitycznych XXI wieku powszechnie stosuje się instrumentalne metodyki analizy. Niemniej jednak nadal ważne miejsce pośród bardzo wyrafinowanej aparatury pomiarowo-badawczej zajmuje sprzęt z początków analityki chemicznej. Tendencja do obniżania poziomów oznaczalności składników badanych substancji kieruje wybór w stronę technik instrumentalnych, jednak w wielu przypadkach analityka instrumentalna nie jest w stanie poradzić sobie z problemami badań materiałów niekonwencjonalnych, w tym próbek środowiskowych. W praktyce metody chemiczne i instrumentalne uzupełniają się wzajemnie. Wzorce, niezbędne w analizie instrumentalnej analizuje się metodami chemicznymi.
1.1.Chemiczna analiza ilościowa
Klasyczna, chemiczna analiza ilościowa opiera się na metodach chemicznych, gdzie zachodzą reakcje wytrącania osadów, zobojętniania, utleniania i redukcji oraz kompleksowania.
Analiza klasyczna dzieli się na metody wagowe i miareczkowe a zadanie realizowane jest poprzez pomiar masy i objętości.
1.1.1. ANALIZA WAGOWA (inaczej: grawimetryczna)
Analiza wagowa opiera się na wydzieleniu z próbki substancji oznaczanej w formie związku chemicznego, posiadającego bardzo małą rozpuszczalność, lub oddzieleniu od cieczy, oznaczanych składników, poprzez sączenie albo odparowanie. W analizie wagowej sygnałem analitycznym jest masa otrzymanego osadu.
Oznaczenia w analizie wagowej polegają na dokładnym określeniu masy oznaczanego składnika, poprzez przeprowadzenie go za pomocą odpowiedniego odczynnika strącającego w trudno rozpuszczalny związek chemiczny, wysuszenie lub wyprażenie i zważenie. Wytrącony z roztworu osad powinien być praktycznie nierozpuszczalny w danym środowisku. W wyniku prażenia można osad przeprowadzić w inny związek o dokładnie określonym składzie chemicznym. Z masy osadu i zależności stechiometrycznych, oblicza się zawartość procentową danego składnika, w odważonej do analizy próbie.
Oprócz reakcji strącania, w analizie wagowej stosuje się również metody wykorzystujące lotność składnika wyłącznie pod wpływem temperatury lub z jednoczesnym przeprowadzeniem reakcji chemicznej. W budownictwie np. oznaczanie wody krystalicznej w solach (np. gipsach) lub CO2 w węglanach (wapieniach) a także oznaczanie krzemionki, poprzez przeprowadzenie jej w lotny związek z fluorem. W obu przypadkach masę oznaczanego składnika uzyskuje się w dwóch ważeniach. Określa się w ten sposób masę próbki i pozostałość.
Strącanie osadów (patrz rozdział…). jest podstawową czynnością w analizie wagowej. Wydzielanie pierwiastka chemicznego z analizowanej próbki można też osiągnąć w wyniku reakcji elektrodowej w procesie elektrolizy.
Oznaczenia wagowe stosuje się dla tzw. makroskładników, czyli składników występujących w próbce w większych ilościach. Metody te odznaczają się dużą dokładnością (<0,1 % błędu), natomiast ich wadą jest długi czas wykonywania poszczególnych operacji. Metody te mają charakter powszechny, można nimi oznaczyć praktycznie wszystkie kationy i aniony (metale i niemetale).
1.1.2. ANALIZA OBJĘTOŚCIOWA (inaczej: miareczkowa)
Analiza objętościowa polega na dokładnym dozowaniu odczynnika, w postaci roztworu, o znanym stężeniu, który reaguje z oznaczanym składnikiem w sposób stechiometryczny. Zawartość substancji oznaczanej oblicza się na podstawie zmierzonej objętości roztworu i jego stężenia. Sygnałem analitycznym jest więc objętość roztworu miareczkującego.
Analizę miareczkową wykonuje się po przeprowadzeniu próbki badanej substancji do roztworu wodnego ( patrz rozdział…). Podczas analizy zachodzą głównie reakcje jonowe, przebiegające z dużą szybkością.
Metody analizy miareczkowej polegają na oznaczeniu ilości substancji w roztworze (analitu) za pomocą odczynnika (titranta) o dokładnie oznaczonym stężeniu (roztworu mianowanego). Czynność dodawania niewielkich porcji roztworu odczynnika o znanym stężeniu z kalibrowanej biurety do naczynia z roztworem oznaczanym nazywa się miareczkowaniem.
W trakcie miareczkowania titrant reaguje z analitem, powodując zmiany określonych właściwości analitu. Może to być np.: zmiana barwy wskaźnika , zmiana przewodnictwa elektrycznego i wiele innych.
Pomiar objętości dodanego titranta, połączony z pomiarem lub obserwacją zmiany fizycznych właściwości analitu, umożliwia określenie dokładnego stężenia określonego związku chemicznego w analicie.
Reakcja stosowana przy miareczkowaniu powinna:
przebiegać szybko i stechiometrycznie, zgodnie z określoną, dobrze znanym równaniem reakcji chemicznej,
wprowadzany odczynnik nie może wchodzić w reakcję z innymi substancjami obecnymi w roztworze,
posiadać odpowiedni wskaźnik, umożliwiający określenie końca reakcji (wyczerpanie się reagentów) a tym samym miareczkowania.
Ilość oznaczanej substancji oblicza się na podstawie zmierzonej objętości zużytego na zmiareczkowanie roztworu mianowanego w tzw. punkcie równoważnikowym.
Punkt równoważnikowy PR reakcji jest to moment, w którym doprowadzona ilość odczynnika miareczkującego jest równoważna chemicznie ilości składnika oznaczanego.
Jeżeli w reakcji chemicznej A + B, reaguje nA moli substancji A (analitu) z nB molami substancji B (titranta), to:
nA : nB = VA . cA : VB . cB,
gdzie V - objętość roztworu, c - stężenie molowe roztworu
W PR nA = nB i VA . cA = VB . cB, stąd : cA = VB . cB /VA ,
Punkt równoważnikowy PR określa się przy zastosowaniu metod wizualnych i instrumentalnych. Metody wizualne polegają na obserwacji zmiany barwy wskaźników (tzw. indykatorów), w momencie zakończenia reakcji między analitem i titrantem (w PR).
W metodach instrumentalnych punkt równoważnikowy reakcji najczęściej określa się za pomocą dwóch technik:
potencjometrycznie - na podstawie pomiaru zmian różnicy potencjału elektrody wskaźnikowej w czasie miareczkowania,
konduktometrycznie - na podstawie pomiaru zmian przewodnictwa elektrycznego roztworu miareczkowanego.
1.1.3. RODZAJE MIARECZKOWANIA
Ze względu na rodzaj reakcji w roztworze, która stanowi podstawę oznaczenia:
Alkacymetria - czyli miareczkowanie oparte na reakcji zobojętniania; kwas ↔ zasada. Titrant reagując z analitem zmienia pH układu; zmiany pH można mierzyć za pomocą chemicznych wskaźników pH lub przy pomocy pH-metrów (pehametria). W czasie miareczkowania zmienia się również przewodnictwo elektryczne roztworu (konduktometria). Pomiarów przewodności roztworu dokonuje się za pomocą konduktometrów.
Redoksymetria - której podstawą jest reakcja redukcji i utlenienia, która powoduje zmianę barwy wskaźnika redox albo zmianę przewodnictwa elektrycznego.
Kompleksometria - oparta jest na reakcjach, w których powstają trwałe i rozpuszczalne związki kompleksowe. Do wyznaczenia PR stosuje się głównie wskaźniki kompleksometryczne.
Precypitometria ( strąceniowe) - oparte na reakcjach tworzenia trudno rozpuszczalnych osadów o ściśle określonym składzie.
Klasyfikacja wg sposobu prowadzenia miareczkowania:
Miareczkowanie bezpośrednie - wykorzystanie bezpośredniej reakcji między titrantem a oznaczanym związkiem chemicznym,
Miareczkowanie pośrednie - oznaczany związek nie reaguje bezpośrednio z titrantem, lecz pośrednio z inną substancją, a miareczkowany jest produkt tej reakcji,
Miareczkowanie odwrotne - do badanego roztworu dodaje się odmierzoną ilość roztworu mianowanego w nadmiarze, a następnie miareczkuje się odpowiednio dobranym titrantem.
Do zalet metod miareczkowych można zaliczyć:
Oznaczanie bezwzględnej zawartości składnika
Łatwość stosowania
Szybkość analizy
Wszechstronność
Uzyskiwanie dokładnych i powtarzalnych wyników.
KOMPLEKSOMETRIA
W oznaczaniu przeszkadzają: wysoka mętność wody, znaczne ilości substancji organicznych, wodorowęglany i węglany (tzw. zasadowość wody) w ilości powyżej 6 mval/dm3 oraz jony żelaza(II) i (III) po 20 mg/dm3. manganu do 10 mg/dm3, cynku, glinu, ołowiu, cyny do 5 mg/dm3, miedzi do 2 mg/dm3. Ortofosforany wytrącają wapń przy pH stosowanym podczas oznaczania, w postaci trudno rozpuszczalnego Ca3(PO4)2 . W oznaczaniu przeszkadzają stront i bar. Silnie mętne próbki wody należy przesączyć przed wykonaniem oznaczania. Wpływ jonów metali przeszkadzających usuwany jest przez dodanie do próbki wody badanej specjalnych odczynników, które maskują powstające związki kompleksowe tych metali z wersenianem sodu.
Analiza miareczkowa, zwana kompleksometrią opiera się reakcjach chemicznych, w wyniku których powstają związki kompleksowe. Innymi metodami opierającym się na powstawaniu kompleksów jest kolorymetria, omówiona w następnym rozdziale. Kompleksometria daje możliwość oznaczenia metodami bezpośrednimi i pośrednimi niemal wszystkich pierwiastków układu okresowego z wyjątkiem gazów szlachetnych i niektórych pierwiastków, jak azot, antymon, beryl, bor i krzem a także Se, Te i Po. Są to metody, w których używa się mianowanych roztworów kompleksów.
Podstawowym odczynnikiem w tej metodzie jest sól dwusodowa kwasu etylenodiaminotetraooctowego ( nazwa zwyczajowa wersenian dwusodowy), znana jako EDTA lub komplekson III o następującym wzorze:
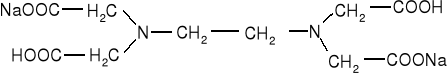
W kompleksometrii z użyciem EDTA stosuje się głównie miareczkowanie proste. Po wprowadzeniu do badanego roztworu odpowiednich środków maskujących i ustaleniu pH na właściwym poziomie dodaje się wskaźnika kompleksometrycznego i miareczkuje mianowanym roztworem EDTA do zmiany zabarwienia roztworu. Miareczkowanie odwrotne stosuje się w przypadku oznaczania metali, których kompleksy z EDTA tworzą się powoli, gdy nie można dobrać odpowiedniego wskaźnika do miareczkowania bezpośredniego lub gdy oznaczany metal mógłby strącać się przy pH wymaganym przy miareczkowaniu bezpośrednim.
Przykładem oznaczeń, wykorzystujących reakcje kompleksowania, jest oznaczenie sumarycznej zawartości jonów wapnia i magnezu w wodzie, zwane twardością ogólną, zgodna z obowiązującą normą PN-72/ C-04554 . Metodę można stosować do oznaczenia twardości ogólnej w wodzie i ściekach.
Związki wapnia i magnezu, znajdujące się w wodach naturalnych mają na ogół największy udział w zawartości soli mineralnych w przeliczeniu na kationy. Spowodowane jest to obfitością związków wapnia w przyrodzie, gdzie ten pierwiastek zajmuje piąte miejsce pod względem ilości. Związki wapnia, występujące w postaci kamienia wapiennego(CaCO3), dolomitów (CaMg(CO3)2) i gipsu (CaSO4.2H2O) w złożach naturalnych, warstwach wodonośnych ulegają rozpuszczaniu w stykającej się z nimi wodzie. Powstają rozpuszczalne wodorowęglany i siarczany, a stężenie jonów wapniowych w wodzie naturalnej może dochodzić do kilkuset mg/dm3. Związki te mogą pochodzić także z zanieczyszczeń w odpadach i ściekach przemysłowych. Nie zanieczyszczone wody wgłębne, zwłaszcza płytkie, zawierają na ogół więcej związków wapnia niż wody powierzchniowe.
Zawarty w wodzie wapń nie ma większego znaczenia higieniczno-epidemiologicznego. Dobowe zapotrzebowanie wapnia przez organizm ludzki wynosi 0,7 do 1,2 g Ca. Nawet najbardziej twarde wody używane do picia nie dostarczają takich ilości wapnia i organizm musi być dodatkowo zaopatrywany w wapń przez pokarmy stałe.
Niskie stężenia soli wapnia w wodzie przeciwdziałają korozji przewodów metalowych, gdyż tworzą na ich powierzchni warstwy ochronne. Natomiast większość soli wapnia występujących w wodzie ulega rozkładowi w podwyższonej temperaturze i tworzą one kamień w kotłach parowych, przewodach i naczyniach domowych do gotowania wody.
Twardość ogólną zgodnie z normą oznacza się kompleksometrycznie wobec czerni eriochromowej T jako wskaźnika. Do próbki badanej wody wprowadza się roztwór wersenianu dwusodowego, który ma właściwości kompleksometrycznego wiązania różnych jonów metali (kationów). Między innymi wersenian tworzy związki kompleksowe z kationami wapnia i magnezu.
Czerń eriochromowa T zachowuje się jak wskaźnik alkacymetryczny. Zależnie od wartości pH roztworu wskaźnik dysocjuje, występując w trzech zabarwionych postaciach.
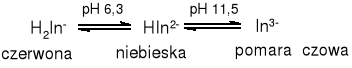
W roztworach kwaśnych wskaźnik ma barwę czerwoną, w roztworach silnie alkalicznych - pomarańczową a w zakresie pośrednim przy pH 7-11- niebieską.
Jony wapnia i magnezu w roztworze wodnym w pH około 10 zmieniają niebieskie zabarwienie czerni eriochromowej T tworząc z nią związek kompleksowy o czerwonym zabarwieniu. Kompleks ten jest mniej trwały niż z wersenianem dwusodowym. Przy miareczkowaniu, po związaniu wszystkich jonów wapnia i magnezu przez wersenian, wskaźnik zostaje uwolniony z uprzednio powstałych związków kompleksowych, co prowadzi do zmiany barwy roztworu z czerwonej na niebieską. Zmiana zabarwienia miareczkowanego roztworu jest wyraźna jedynie w obecności dostatecznej ilości jonów magnezowych.
Na wyrazistość końcowego punktu miareczkowania (PR) ma wpływ odczyn próbki, i wzrasta wraz ze wzrostem jej pH. Przy zbyt wysokim pH, może wystąpić wytrącanie węglanu wapnia lub wodorotlenku magnezu ( ponadto barwnik stosowany jako wskaźnik w bardzo alkalicznym pH zmienia swe zabarwienie). Przyjęty odczyn pH ok. 10,0 zapewnia wystarczająco dobry przebieg oznaczania. Samo miareczkowanie nie powinno trwać dłużej niż 5 min ze względu na możliwość wytrącania się węglanu wapnia.
Oznaczanie tylko zawartości wapnia w roztworze wodnym może być wykonane bezpośrednio za pomocą wersenianu, jeżeli jej próbka osiągnie odpowiednio wysokie pH, w granicach 12 ÷13. Wówczas występuje prawie całkowite wytrącenie magnezu pod postacią wodorotlenku. Jednocześnie używany jest wskaźnik, mureksyd lub kalceina, który reaguje tylko z jonami wapnia. Zmienia on swoje zabarwienie w momencie, gdy cała ilość jonów wapnia przechodzi w związek kompleksowy z wersenianem. Przeszkadzające związki żelaza maskuje się dodając roztwór trójetanoloaminy.
1
Wyszukiwarka
Podobne podstrony:
2. WODA W PRZYRODZIE - OCENA JAKOŚCI, Budownictwo, chemia, II semestr
6. POLIMERY - IDENTYFIKACJA TWORZYW SZTUCZNYCH, Budownictwo, chemia, II semestr
Sprawozdanie 7 - Analiza ilościowa (miareczkowanie), Studia, Chemia
3. WODA W TECHNICE - METODY UZDATNIANIA, Budownictwo, chemia, II semestr
5. ELEKTROLIZA - CYNKOWANIE, Budownictwo, chemia, II semestr
4. ELEKTROCHEMIA - pH- metria, Budownictwo, chemia, II semestr
instrukcja - ANALIZA ILOŚCIOWA-WAGOWA, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, labora
ANALIZA LEK. an.ilościowa, Farmacja studium 2 letnie, I II semestr, analiza
Pytania chemia, Budownictwo PŚK, II semestr, chemia, testy+materiały na zal
charakterystyka-badań-ilościowych-i-jakościowych, Pedagogika UŚ, II semestr, metodologia badań pedag
Materiały do definicji i podziału logicznego, ADMINISTRACJA, I rok II semestr, Podstawy logiki prakt
Sprawozdanie - Zaprawy 3, Studia Budownictwo polsl, II semestr, Materiały budowlane, Sprawko 7
Sprawozdanie nr 3 - zaprawa, Studia Budownictwo polsl, II semestr, Materiały budowlane, Sprawko 7
Sprawozdanie nr3 - zaprawa, Studia Budownictwo polsl, II semestr, Materiały budowlane, Sprawko 7
sprawozdanie nr 2 z kruszyw, Budownictwo UWM, II SEMESTR
TABELA MATERIAŁY - Kopia, Budownictwo UWM, II SEMESTR, Materiały budowlane
Analiza ilościowa (miareczkowa) Oznaczanie podstawowych kationów występujących w materiałach budowla
więcej podobnych podstron