Materiały do laboratorium z chemii
2011/2012
Ćwiczenie 3.
WODA W TECHNICE - METODY UZDATNIANIA
Zadanie doświadczalne:
OZNACZANIE TWARDOŚCI WODY. DEMINERALIZACJA
WODY NA JONITACH
Opracowała dr inż. Teresa Szymura
Literatura: Laboratorium chemiczne -oprac. zbiorowe pod redakcją D. Dziadko
Wykłady z chemii w semestrze zimowym
Materiały: Analiza miareczkowa
Materiały na laboratorium z chemii w roku Akad. 2009/2010.
Opracowała dr inż. Teresa Szymura
WODA W TECHNICE - METODY UZDATNIANIA
Woda jest czynnikiem życia, składnikiem świata zwierzęcego i roślinnego, a w życiu fizjologicznym i kulturalnym człowieka odgrywa wyjątkową rolę. Średnie zużycie wody do celów bytowych i sanitarnych na mieszkańca dużych miast polskich wynosi 0,3-0,4 m3 na dobę. Ogromne ilości wody zużywają przemysł i rolnictwo. Globalny pobór wody na potrzeby gospodarki w Polsce wynosił ponad 13 tys. km3.
Na naszym globie woda naturalna występuje jako powierzchniowa, opadowa i głębinowa. Wody powierzchniowe to źródła, rzeki, jeziora, zbiorniki retencyjne, morza i oceany. Miarą ilości wód powierzchniowych jest roczny odpływ rzek w przeliczeniu na jednego mieszkańca.
Wody powierzchniowe stanowią główne źródło zaopatrzenia w wodę użytkową. Ujęcia rzeczne są wygodne i niedrogie, lecz jakość tych wód zmienia się sezonowo wraz z cyklami rozwoju planktonu i jest zależna od ilości wprowadzanych ścieków. Oba czynniki mocno wpływają na koszt uzdatniania wody pochodzącej z tego źródła. Wody powierzchniowe, z wyjątkiem górskich, nie nadają się do bezpośredniego spożycia
Wody opadowe to skroplona para wodna, zawierająca rozpuszczone gazy -składniki atmosfery. W pobliżu okręgów przemysłowych wody te ulegają zanieczyszczeniu gazami, pyłami i dymami charakterystycznymi dla danego przemysłu. Na powierzchni ziemi ulegają dalszemu zanieczyszczeniu składnikami gleby też skażonej różnymi zanieczyszczeniami. W tak odmienionej postaci część ich wpływa do wód powierzchniowych lub infiltruje do głębszych warstw ziemi jeszcze bardziej zmieniając swój skład.
Wody podziemne zalegają pod warstwą gleby i ich skład zależy od rodzaju i grubości tej warstwy. Zalegające płytko pod powierzchnią ziemi (kilka metrów) wody zwane zaskórnymi lub podskórnymi, nie są dobrze chronione przed przenikaniem zanieczyszczeń i w stanie naturalnym nie nadają się do picia. Dobrej jakości są na ogół wody zalegające na znacznych głębokościach między nieprzepuszczalnymi warstwami. Cechuje je brak zawiesin i bakterii oraz stała temperatura w ciągu roku, a obecność w odpowiednim stężeniu niektórych związków chemicznych powoduje, że woda ma właściwości lecznicze (np. tzw. szczawy w Krynicy i Szczawnicy). Zastosowanie takich wód dla celów przemysłowych jest jednak kłopotliwe gdyż rozpuszczone w niej substancje należy całkowicie usunąć.
Światowe zasoby wodne przedstawiono w tabeli 1.
Tabela 1 Światowe zasoby wodne.
Zasoby wodne |
% |
km3 |
Wszystkie |
100 |
1 384 000 |
Woda słodka |
2,6 |
35 984 |
Woda głębinowa |
0,62 |
8 580 |
Słodka użytkowa |
0,24 |
3 321 |
Wszystkie opady |
0,03 |
415 |
Deszcze na kontynenty |
0,007 |
96 |
Słodka do picia |
0,0002 |
2 |
Polska pod względem zasobów wodnych zajmuje dalekie miejsce w Europie. Dyspozycyjne zasoby wody wynoszą 22 km3 (w tym 60% głębinowe), co odpowiada poniżej 5 m3 na jednego mieszkańca w ciągu doby, a deficyt wody notowany od lat porównywalny jest np. z sytuacją w Egipcie.
Tabela 2. Sposoby uzdatniania wody w zależności od jej przeznaczenia.
Lp |
Przeznaczenie wody |
Wymagana jakość |
Sposoby uzdatniania |
1 |
Woda do picia i gospodarstwa domowego |
Brak bakterii chorobotwórczych, dobre wskaźniki organoleptyczne |
Klarowanie, usuwanie związków żelaza i poprawianie smaku (filtrowanie), odkażanie (chlorowanie, ozonowanie) |
2 |
Przemysł spożywczy |
j.w., miękka |
jw., zmiękczanie, ew. destylacja |
3 |
Przemysł włókienniczy |
Klarowna, bezbarwna, miękka |
Klarowanie, filtrowanie, zmiękczanie. |
4 |
Przemysł budowlany |
Brak składników chemicznie agresywnych (kwasy organiczne i mineralne, CO2, H2S, SO4-2). Niedozwolone używanie wody morskiej, ścieków, wód bagiennych |
Używane są wody słodkie, w których zawartość siarczanów nie przekracza 250mgdm-3 |
5 |
Przemysł papierniczy |
Klarowna, bezbarwna, miękka, wolna od mikroorganizmów |
Klarowanie, filtrowanie, koagulacja, usuwanie zw. żelaza i manganu, zmiękczanie, chlorowanie. |
6 |
Woda chłodnicza |
Niska temperatura, brak zawiesin i mikroorganizmów, termo stabilna, niekorozyjna |
Odmulanie i uzdatnianie w obiegach zamkniętych, periodyczne usuwanie substancji organicznych. |
7 |
Woda do zasilania kotłów parowych |
Miękka lub całkowicie zdemineralizowana |
Filtrowanie, dekarbonizacja lub odsalanie. |
Przy ocenie przydatności wody posługujemy się wskaźnikami charakteryzującymi jej jakość. Wskaźniki te określają:
właściwości fizyczne (np. przezroczystość, barwa, zapach, smak);
właściwości chemiczne (np. twardość, zawartość chlorków, siarczanów, związków azotowych, arsenu ołowiu)
biologiczne - zawartość niepożądanych organizmów i ich wydzielin (np. miano coli).
Według norm obowiązujących w Polsce oznacza się ponad 30 wskaźników zanieczyszczenia wody.
W zależności od poziomu zanieczyszczeń i przeznaczenia, woda musi spełniać określone wymagania a jeżeli nie spełnia - należy ją odpowiednio uzdatnić.
Dla zaopatrzenia ludności najlepiej korzystać z wody głębinowej, ale w przypadku jej deficytu eksploatuje się również wody powierzchniowe. Należy je jednak odpowiednio uzdatnić, tak by spełniały warunki sanitarne i smakowe. Uzdatnianie wody do tych celów wymaga przede wszystkim klarowania, filtrowania i odkażania. Coraz częściej w procesach uzdatniania wody stosuje się zamiast chlorowania, ozonowanie, które skutecznie usuwa wiele typowych zanieczyszczeń oraz poprawia właściwości organoleptyczne wody.
Woda do celów energetycznych powinna być termo stabilna i nie może mieć właściwości korozyjnych. Niedotrzymanie tych warunków powoduje, że w podwyższonych temperaturach (np. w wymiennikach ciepła) zwiększa się szybkość korozji a na ściankach urządzeń wytrąca się osad (tzw. kamień kotłowy), który przy grubości np. 3mm obniża wydajność urządzeń o ok. 50%.
Wodę do zasilania kotłów parowych czyści się w specjalny sposób, usuwając częściowo lub całkowicie rozpuszczone sole, które w czasie ogrzewania i odparowywania wody zatężają się i wytrącają w postaci twardego kamienia kotłowego. Powstała w ten sposób izolacja powoduje nie tylko straty cieplne, ale może również doprowadzić do rozerwania kotła, gdy wskutek odpryśnięcia kamienia nastąpi miejscowe przegrzanie wody i gwałtownie wytworzy się duża ilość pary.
Składnikami kamienia są zwykle trudno rozpuszczalne związki wapnia, magnezu i żelaza a jego rodzaj zależy od wody zasilającej i warunków eksploatacyjnych urządzenia.
Rozróżnia się trzy podstawowe typy kamieni kotłowych:
kamień węglanowy, zawierający głównie CaCO3
kamień gipsowy, zawierający ok. 50% CaSO4·2H2O
kamień krzemianowy o zawartości ok. 25% kwasu krzemowego H2SiO3.
Szczególnie niebezpieczna jest obecność soli magnezu(II) w wodzie do zasilania kotłów. Oprócz wytrącania się kamienia może zachodzić (groźna z punktu widzenia korozji) reakcja hydrolizy termicznej, z wytworzeniem mocnego kwasu, zgodnie z reakcją:
MgCl2 + 2H2O ogrzewanie Mg(OH)2 + 2HCl
1. Twardość wody
Właściwość wody zwana twardością wywołana jest obecnością rozpuszczonych w niej soli wapnia i magnezu oraz innych śladowych kationów wielowartościowych.
Właściwość tę można rozpatrywać na kilka sposobów.
Twardość całkowitą (ogólną) wody klasyfikuje się wg kationów:
Tw. og = twardość wapniowa + twardość magnezowa. lub wg anionów:
Tw.og = twardość węglanowa + twardość niewęglanowa (stała).
Twardość wapniową powodują rozpuszczone w wodzie sole wapnia(II) i składa
się ona z twardości węglanowej tj. Ca(HCO3) 2 , CaCO3 , Ca(OH)2
i niewęglanowej, zwanej też twardością stałą np. CaCl2 , CaSO4 , CaSiO3
Twardość magnezową powodują analogicznie związki magnezu(II), które występują w wodzie naturalnej w mniejszych ilościach niż wapnia.
Twardość węglanowa zwana jest niekiedy jako przemijająca, ze względu na rozkład wodorowęglanów podczas ogrzewania wody:
Ca(HCO3)2 ogrzewanie CaCO3 + H2O + CO2
Mg(HCO3)2 ogrzewanie MgCO3 + H2O + CO2
MgCO3 + H2O ogrzewanie Mg(OH)2 + CO2
Powstałe w wyniku tych reakcji osady są głównymi składnikami kamienia kotłowego.
Do ilościowego oznaczania twardości wody (zgodnie z polskimi normami) powinno się stosować jednostkę mmol.dcm-3, tradycyjnie stosuje się tzw. stopnie milivalowe [mval∙dm-3]. Za jednostkę w tym przypadku przyjęto twardość wody, jaką nadaje połowa milimola jonów wapnia lub magnezu w ldm3 wody.
W Polsce bywają jeszcze używane tzw. stopnie niemieckie. 1° niemiecki =10 mg CaO w 1dm3 wody. (zawartość soli wapnia i magnezu przelicza się na tlenek wapnia).
W niektórych krajach używane są jeszcze inne jednostki twardości wody (patrz tabela 3).
Tabela nr 3. Zestawienie jednostek twardości wody.
Jednostka twardości |
Wielkość jednostek twardości wody |
||||||
|
|
Stopnie |
|||||
|
mval dm-3 |
mmoldm-3 |
niemiecki l0mg dm-3 CaO |
francuski l0mg dm-3 CaCO3 |
angielski l00mg∙galon-1 CaCO3 |
amerykański lmg dm-3 CaCO3 |
|
1 mval • dm-3 |
1,000 |
0,500 |
2,80 |
5,00 |
3,50 |
50,0 |
|
1 mmol • dm-3 |
2,000 |
1,000 |
1,40 |
2,50 |
1,75 |
25,0 |
|
niemiecka |
0,357 |
0,187 |
1,00 |
1,79 |
1,25 |
17.9 |
|
francuska |
0,200 |
0,100 |
0,56 |
1,00 |
0,70 |
10,0 |
|
angielska |
0,286 |
0,143 |
0,80 |
1,43 |
1,00 |
14,3 |
|
amerykańska |
0,020 |
0,010 |
0.056 |
0,10 |
0,07 |
1,00 |
|
Val - to ilość substancji, która w danej reakcji chemicznej wymienia 1 mol elektronów.
2. Oznaczanie twardości wody
Związki chemiczne, powodujące twardość wody reagują z mydłami sodowymi i potasowymi (np. stearynianem, palmitynianem) i tworzą nierozpuszczalne mydła wapniowe i magnezowe:
2 C17H35COONa + CaSO4 → ( Ci17H35COO )2Ca + Na2SO4
stearynian sodu stearynian wapnia
Dlatego woda twarda pieni się dopiero po dodaniu odpowiednio dużej ilości mydła. Zjawisko to wykorzystywane było dawniej do ilościowego oznaczania twardości wody. Miareczkowano wodę roztworem tzw. mydła Clarka do momentu utworzenia się piany.
Obecnie twardość wody oznacza się kompleksometrycznie, bardziej dokładną metodą wersenianową. Próbki wody miareczkuje się wersenianem disodu (EDTA) w obecności kompleksotwórczego wskaźnika (czerni eriochromowej T, metaloftaleiny, kalcesu lub mureksydu). Wskaźnik z jonami Ca2+ i Mg2+ tworzy nietrwałe związki kompleksowe o charakterystycznym zabarwieniu. W trakcie miareczkowania - EDTA wypiera wskaźnik ze związku i w końcowym punkcie miareczkowania następuje całkowite uwolnienie wskaźnika, ze zmianą barwy roztworu charakterystyczną dla danego wskaźnika.
3. Sposoby uzdatniania wody
Rozwój przemysłu spowodował gwałtowny wzrost zapotrzebowania na wodę uzdatnioną, którą dziś otrzymuje się stosując jeden lub kombinację kilku wymienionych procesów: zmiękczanie, dekarbonizacja połączona ze zmiękczaniem, dekationizacja, demineralizacja, oczyszczanie kondensatu.
Stosując określoną metodę oraz odpowiedni schemat technologiczny uzdatniania, można sprostać najbardziej zróżnicowanym wymaganiom jakościowym wody: od wody zmiękczonej do ultra czystej, praktycznie pozbawionej wszelkich zanieczyszczeń.
Zmiękczanie wody
Celem zmiękczania wody jest zabezpieczenie przed powstawaniem osadów. Metody zmiękczania wody można podzielić na chemiczne i fizyczne. Wybór metody zależy od rodzaju wody, warunków technicznych, objętości wodnej układu, możliwości finansowych .
3.1. Chemiczne metody usuwania twardości
Chemiczne metody polegają na usuwaniu z wody związków lub jonów, nadających wodzie twardość. W każdym przypadku zmienia się skład chemiczny wody. Usuwanie twardości realizuje się dozując związki chemiczne do wody przed wprowadzeniem jej do obiegu (uzdatnianie zewnętrzne) lub bezpośrednio do wody obiegowej (uzdatnianie wewnętrzne). Np. dla układów ciepłowniczych preferuje się obróbkę zewnętrzną.
Metoda termiczna polega na podgrzewaniu wody przez co naruszona zostaje równowaga węglanowa. Stosuje się ją do zmiękczania wody głównie o twardości węglanowej, przeznaczonej do zasilania kotłów o niskim i średnim ciśnieniu roboczym oraz jako metodę pomocniczą przy zmiękczaniu innymi metodami.
Metody strąceniowe polegają na dodaniu do wody odpowiednich substancji chemicznych. Następuje wytrącenie się trudno rozpuszczalnych związków, które usuwane są na drodze dekantacji lub filtracji. W zmiękczonej wodzie powstają łatwo rozpuszczalne sole sodowe, które nie powodują twardości. Substancje najczęściej stosowane w tej metodzie to: wodorotlenek wapniowy (wapno, mleko wapienne), węglan sodu (soda amoniakalna), wodorotlenek sodowy (soda kaustyczna) i fosforany.
a) Dekarbonizacja mlekiem wapiennym (wodna zawiesina Ca(OH)2).
To proces usuwania z wody twardości węglanowej przy użyciu mleka wapiennego:
Ca(HCO3)2 + Ca(OH)2 →2 CaCO3 + 2 H2O
Mg(HCO3)2 + 2 Ca(OH)2 →2 CaCO3 + Mg(OH)2 + 2 H2O
Mlekiem wapiennym można też usunąć twardość magnezową stałą:
MgSO4 + Ca(OH)2 → Mg(OH)2 + CaSO4.
b) Zmiękczanie sodą ( węglan sodu Na2CO3).
Metodą tą można usunąć zarówno twardość węglanową jak i stałą:
Ca(HCO3)2 +Na2CO3 → CaCO3 + 2NaHCO3
CaSO4 + Na2CO3 → CaCO3 + Na2SO4
Do niedawna najczęściej stosowano metodę "wapno-soda". Wapno usuwa twardość węglanową i sole magnezu, natomiast soda, twardość niewęglanową wapniową.
c) Zmiękczanie wody fosforanami (np. fosforanem(V) trisodu - Na3PO4) polega
na strącaniu trudno rozpuszczalnych fosforanów wapnia i magnezu, dzięki czemu pozostaje w wodzie bardzo mała twardość szczątkowa.
3 Ca(HCO3)2 + 2 Na3PO4 → Ca3(PO4)2 + 6 NaHCO3
3 MgCl2 + 2 Na3PO4 → Mg3(PO4)2 + 6 NaCl
Fosforan zapobiega też powstawaniu bardzo twardego kamienia krzemianowego. Wadą tej metody są duże koszty fosforanów, dlatego używa się jej do usuwania twardości szczątkowej, pozostałej po zmiękczeniu innymi metodami.
Do zmiękczania wody (proszki do prania) stosowany jest także polifosforan sodu (NaPO3)n, który wiąże jon Ca2+ tworząc związki kompleksowe.
3.2. Fizykochemiczne uzdatnianie wody - metody jonitowe
Do celów przemysłowych wodę odsala się za pomocą wymieniaczy jonowych (jonitów). Jonity są to żywice organiczne o skomplikowanej budowie, wykazujące zdolność do wymiany jonów, wchodzących w ich skład na jony znajdujące się w roztworze wodnym. Jonity wymieniające kationy nazywają się kationity, wymieniające zaś aniony - anionity. Jonity produkowane są w formie małych perełek lub włókien układanych w materiał podobny do filcu.
Większość obecnie stosowanych jonitów to syntetyczne zwiazki organiczne. Szkielety tych jonitów stanowią polimery styrenu i diwinylobenzenu (DVB), które charakteryzują się dużą odpornością mechaniczną i termiczną. Szkielet ten uzupełniają grupy funkcyjne, które decydują o właściwościach chemicznych jonitu.
Grupy funkcyjne o charakterze kwasowym lub zasadowym zdolne są do wymiany własnych jonów na jony z otaczającego je roztworu, w ilościach równoważnych.
Czasami do specjalnych celów, stosuje się jonity amfoteryczne, posiadające równocześnie oba rodzaje grup.
Jonity mogą występować w postaci zdysocjowanych związków; kationity w formie kwasu lub soli, a anionity - zasady lub soli.
Kationity mogą pracować w cyklu wodorowym lub sodowym, anionity w cyklu wodorotlenowym lub chlorkowym. W zależności od grupy funkcyjnej mogą wymieniać różne rodzaje jonów.
Tabela 4. Ogólny podział jonitów z uwzględnieniem grup funkcyjnych i cyklu pracy.
Jonity - polimery o zdolnościach wymiany jonów |
|||||||
Kationity (wymieniają kationy) |
Anionity (wymieniają aniony) |
||||||
Silnie kwasowe (wszystkie kationy)
|
Słabo kwasowe (kationy związane z resztami kwasowymi słabych kwasów) |
Silnie zasadowe ( wszystkie aniony) |
Słabo zasadowe
(aniony silnie zdysocjowanych |
||||
Kt-H |
Kt-Na |
Kt-H |
Kt-Na |
An-OH |
An-Cl |
An-OH |
An-Cl |
Przykładowe grupy funkcyjne |
|||||||
sulfonowa |
karboksylowa |
czwartorzędowa amoniowa |
2-go i 3-ciorzędowa aminowa |
||||
RSO3-H |
RSO3-Na |
RCOO-H |
RCOO-Na |
RN(CH3)3-OH |
RN(CH3)3-Cl |
RNH2 -OH |
RNH2 -Cl |
R - oznacza strukturalną , wielkocząsteczkową część jonitu.
3.2.1. Wymiana jonowa na kationicie
Jeżeli jonit, np. Kt-H umieści się w roztworze zawierającym jony wapnia, nastąpi szybka wymiana jonowa, którą można przedstawić następującym równaniem:
2 Kt-H + Ca2+ → Kt2-Ca + 2 H+
W czystej wodzie jony wodorowe w kationicie nie mogą się od niego oddalić ze względu na przyciąganie elektrostatyczne nieruchomych anionów struktury jonitowej. Jeżeli jednak w roztworze są obecne kationy, np. Ca2+, to zostaną związane przez anion kationitu, a na ich miejsce przejdą w głąb roztworu uwolnione jony wodorowe. W ten sposób kationit z formy kwasowej przechodzi w postać soli.
Siła wiązania różnych jonów przez grupy funkcyjne jonitu uzależniona jest od wielu czynników np:
jony o większym ładunku są wiązane silniej,
stężenie roztworu ma ogromny wpływ, zwłaszcza gdy w wymianie uczestniczą jony o różnych ładunkach.
Istotną cechą jonitów jest odwracalność procesu wymiany jonów. Wprowadzenie dużego stężenia jonów, nawet słabiej wiązanych, powoduje wyparcie z jonitu jonów wiązanych silniej. Proces wymiany, w którym jonit odzyskuje swoje pierwotne właściwości nazywa się regeneracją, a to ułatwia zastosowania w technice. Kationity wodorowe regenerowane są roztworem HCl, natomiast sodowe - NaCl. Do regeneracji anionitów są często stosowane NaOH, NH4OH i NaCl.
W technice do zmiękczania wody stosuje się głównie kationity silnie kwaśne, pracujące w cyklu sodowym przedstawionym na rysunku 5.
Proces przebiega zgodnie z reakcjami:
2 Kt-Na + Ca(HCO3)2 → Kt2-Ca + 2 NaHCO3
2Kt-Na + CaSO4 → Kt2-Ca + Na2SO4
Każde dwa kationy Na+ w jonicie zastępowane są jednym kationem dwuwartościowym Ca2+ .
Sole sodowe w roztworze wodnym są łatwo rozpuszczalne i nie tworzą kamienia kotłowego.
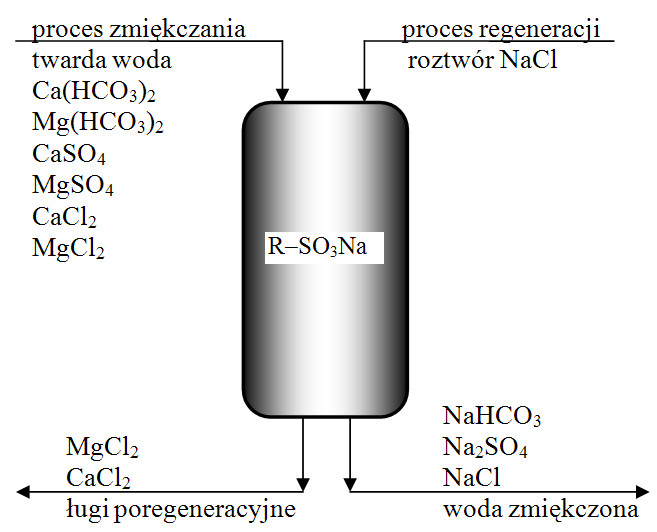
Rys. 3. Schemat procesu jednostopniowego zmiękczania wody na jonicie w cyklu sodowym.
Woda tak uzdatniona ma zastosowanie np. do zasilania kotłów niskoprężnych lub do obiegów chłodniczych. W procesie odwrotnym - podczas regeneracji przepuszcza się stężony (ok. 10)%) chlorek sodu w nadmiarze 2, 3 razy większym niż wymaga stechiometria.
Jednak odczyn alkaliczny (NaHCO3) i duża zawartość soli sodowych powoduje, że wody nie można zastosować w innych przypadkach, gdzie wymagania są wyższe.
W uzasadnionych przypadkach obok kationitu sodowego wprowadza się kolumnę wypełnioną kationitem wodorowym na którym zachodzi reakcja:
2 Kt-H + CaSO4 → Kt2-Ca + H2SO4
2 Kt-H + Ca(HCO3)2 → Kt2-Ca + 2 H2O + 2CO2
Wycieki z obu rodzajów kolumn są mieszane w odpowiedniej proporcji (zasadowy po jonicie sodowym i kwaśny po jonicie wodorowym), w wyniku czego następuje ich neutralizacja:
2NaHCO3 + H2SO4 → Na2SO4 + 2 H2O + 2 CO2
Sole sodowe w roztworze wodnym są łatwo rozpuszczalne i nie tworzą kamienia kotłowego.
3.2.2. Demineralizacja wody na jonitach
Do zasilania kotłów wysokoprężnych, do produkcji leków i odczynników chemicznych oraz w laboratoriach chemicznych wymagana jest woda najwyższej czystości, tzn. pozbawiona całkowicie wszystkich związków rozpuszczalnych. Taka woda nazywa się zdemineralizowaną, a odpowiedni proces oczyszczania demineralizacją lub całkowitym odsalaniem. Prostym i od dawna stosowanym sposobem odsalania wody jest proces destylacji. jest to sposób kosztowny i stosowany na niewielką skalę, który zastępują wymieniacze jonowe.
Podczas przepływu wody przez złoże jonitu zachodzi wymiana jonów, przy czym na kationicie kwasowym w cyklu wodorowym zachodzi wymiana wszystkich kationów zawartych w wodzie na jony wodorowe, np :
2Kt-H + Ca2+ → Kt2-Ca + 2 H+
Natomiast na anionicie zasadowym w cyklu wodorotlenowym zachodzi wymiana wszystkich anionów na jony wodorotlenowe wg reakcji:
2An-OH + SO42- → An2-SO4 + 2OH-
W ten sposób woda zostaje całkowicie pozbawiona zawartych w niej soli, przy czym wytwarza się równoważna liczba jonów H+ i OH- tworzących cząsteczki wody:
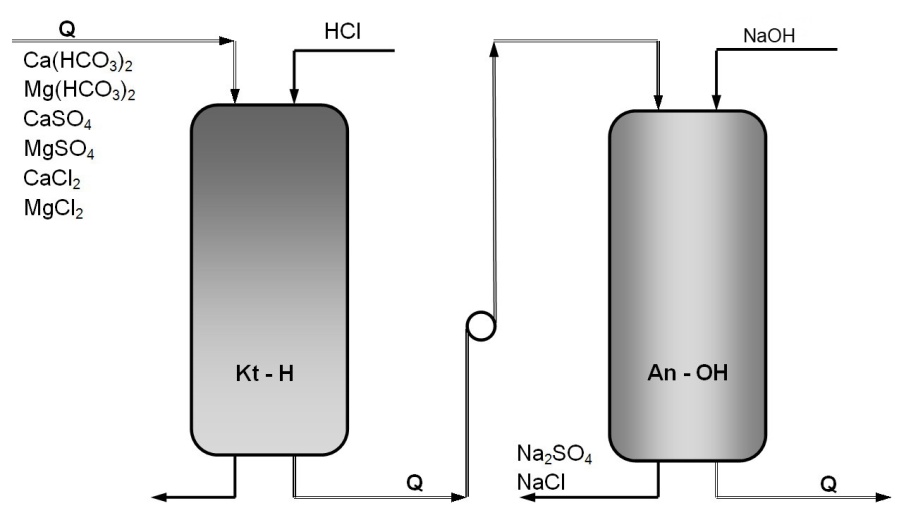
2 H+ + 2 OH+ = 2 H2O
Rys. 4. Schemat ideowy demineralizacji wody na kationicie silnie kwasowym w cyklu wodorowym i anionicie silnie zasadowym w cyklu wodorotlenowym
Po przejściu wody przez system wymieniaczy jonowych można otrzymać wodę o czystości podwójnie destylowanej.
W technice najlepsze efekty odsalania uzyskuje się za pomocą złóż mieszanych, złożonych z silnie kwaśnych kationitów i silnie zasadowych anionitów. Kwasy powstające przy ziarnach kationitu są natychmiast neutralizowane przez przylegające ziarna anionitu i odwrotnie co powoduje maksymalne odsolenie wody. Demineralizacja wody na złożach mieszanych jest tanią i prostą metodą, łatwą do kontroli i automatyzacji.
Podczas usuwania z wody, zawierajace np. siarczany i chlorki wapnia i magnezu na kolumnie kationitowej i amonitowej zachodzą reakcje:
- dysocjacja soli: CaSO4 → Ca2+ + SO42-
MgSO4 → Mg2+ + SO42-
Na kationicie wodorowym następuje wymiana wszystkich kationów na jon wodorowy (dekationizacja).
2 Kt-H + Ca2+ + SO42- = Kt2-Ca + 2 H+ + SO42-
2 Kt-H + Mg2+ + 2Cl- = Kt2-Ca + 2 H+ + SO42-
Po przejściu przez tę kolumnę aniony zostały w roztworze. Otrzymuje się zatem w wycieku mieszaninę kwasów.
Na drugiej kolumnie, zawierającej anionit, aniony z roztworu zostają wymienione na jony wodorotlenowe,
2 An-OH + SO42- + 2 H+ = An2-SO4 + 2 OH- + 2 H+
2 An-OH + 2Cl- + 2 H+ = 2An-Cl + 2 OH- + 2 H+
W wycieku po obu jonitach, jony wodorotlenowe łączą się z jonami wodorowymi na niezdysocjowane cząsteczki wody. W ten sposób otrzymuje się wodę pozbawioną wszelkich soli.
2 H+ + 2 OH+ = 2 H2O
Proces odwrotny, czyli regenerację prowadzi się po cyklu pracy jonitów. Regenerantem jest ok. 10% HCl podawany w dużym nadmiarze ( 2-3-krotny).
W technice najlepsze efekty odsalania uzyskuje się za pomocą złóż mieszanych, złożonych z silnie kwaśnych kationitów i silnie zasadowych anionitów. Kwasy powstające przy ziarnach kationitu są natychmiast neutralizowane przez przylegające ziarna anionitu i odwrotnie co powoduje maksymalne odsolenie wody. Demineralizacja wody na złożach mieszanych jest tanią i prostą metodą, łatwą do kontroli i automatyzacji.
Zadanie doświadczalne nr 1 .
OZNACZANIE TWARDOŚCI WODY. DEMINERALIZACJA
WODY NA JONITACH
Celem ćwiczenia jest poznanie cech wody naturalnej ważnych ze względu na zastosowania przemysłowe. Zdobycie praktycznych umiejętności w zakresie demineralizacji wody techniką jonitową.
Patrz rozdział „Woda w przyrodzie” i „Woda w przemyśle”
WYKONANIE ĆWICZENIA:
Demineralizację wody, zawierającej rozcieńczony siarczan wapnia, przeprowadzić na kolumnie z kationitem wodorowym i anionitem wodorotlenowym wg rys 1.
Siarczan wapnia, sól mocnego kwasu siarkowego i mocnej zasady wapniowej ulega całkowitej dysocjacji na jony wg reakcji: CaSO4 → Ca2+ + SO42-
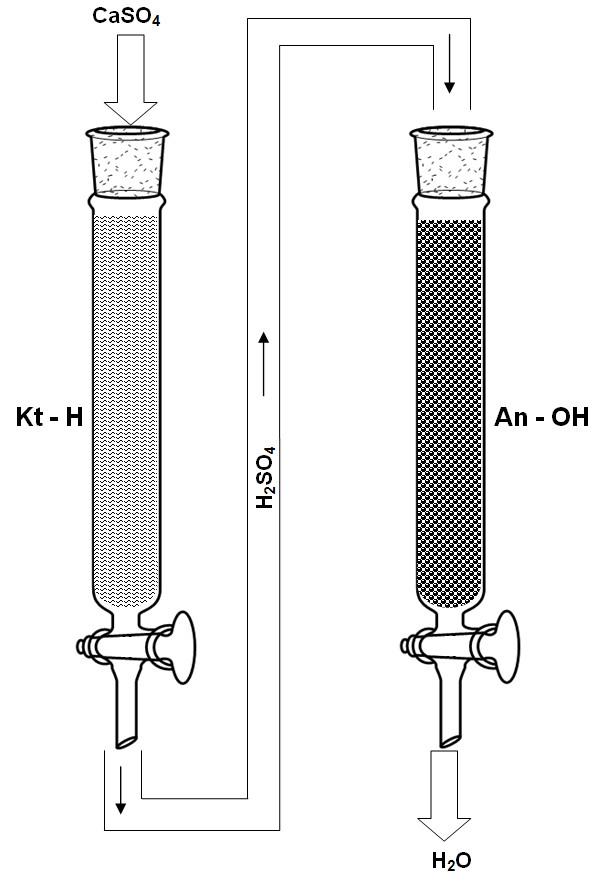
Rys. 5. Proces demineralizacji wody zawierającej siarczan wapnia na silnie kwaśnym kationicie wodorowym i silnie zasadowym anionicie wodorotlenowym.
Podczas usuwania z wody siarczanu wapnia na kolumnie kationitowej i amonitowej zachodzą reakcje:
Na kationicie wodorowym następuje wymiana wszystkich kationów na jon wodorowy.
2 Kt-H + Ca2+ + SO42- = Kt2-Ca + 2 H+ + SO42-
Po przejściu przez kolumnę z kationitem otrzymuje się w wodzie rozcieńczony kwas siarkowy.
Na drugiej kolumnie, zawierającej anionit wodorotlenowy, aniony z roztworu zostają wymienione na jony wodorotlenowe,
2 An-OH + SO42- + 2 H+ = An2SO4 + 2 OH- + 2 H+
W wycieku po przejściu wody przez oba jonity, jony wodorowe łączą się z jonami wodorotlenowymi na niezdysocjowane cząsteczki wody:
2 H+ + 2 OH+ = 2 H2O
W ten sposób otrzymuje się wodę pozbawioną wszelkich soli - wodę zdemineralizowaną.
Wykonanie zadania składa się z następujących etapów:
a) Przygotowanie jonitów do pracy.
b) Badanie wody twardej, otrzymanej do demineralizacji :
Pomiar pH,
Wykonanie analizy jakościowej na obecność jonów Ca2+
Wykonanie analizy jakościowej na obecność jonów SO42-.
Oznaczenie twardości,
a) Przeprowadzenie procesu dekationizacji wody na kationicie wodorowym.
b) Oznaczenie w wodzie wyciekającej z kationitu:
pH
Wykonanie analizy jakościowej na obecność jonów Ca2+
Wykonanie analizy jakościowej na obecność jonów SO42-.
a) Przeprowadzenie procesu wymiany anionów na kolumnie z anionitem.
b) Oznaczenie wody wyciekającej z anionitu:
Pomiar pH,
Wykonanie analizy jakościowej na obecność jonów Ca2+
Wykonanie analizy jakościowej na obecność jonów SO42-.
Oznaczenie twardości,
Zapisać wszystkie dane w odpowiednich rubrykach tabeli sprawozdawczej.
Obliczyć twardość wody twardej i w wycieku po anionicie w różnych jednostkach.
Obliczyć wydajność procesu demineralizacji na jonitach.
Etap I. Przygotowanie jonitów do pracy - płukanie złoża jonitowego
Pracę na stanowisku należy rozpocząć od płukania złóż kationitu i anionitu wodą destylowaną. W tym celu do obu kolumn wlewamy porcjami po około 450cm3 wody destylowanej aż do uzyskania odczynu obojętnego wody wyciekającej z kolumn. W trakcie pracy z kolumnami jonitowymi należy tak ustawiać przewody wylotowe, by utrzymywać w kolumnach poziom cieczy powyżej złoża jonitowego i nie dopuszczać do jego zapowietrzania.
Uwaga! W czasie płukania należy jednocześnie wykonywać analityczną część zadania.
OPIS ANALIZY CHEMICZNEJ PRÓBEK WODY
Badanie odczynu wody - pH
Pomiar pH polega na zanurzeniu (ok. 1 sekundy) paska papierka wskaźnikowego w próbce wody i porównaniu przed upływem 10 sekund zabarwienia ze skalą barw. Do pomiaru pH wystarczy pasek papierka o długości ok. 1 cm.
Badanie obecności jonów Ca2+
Wykonanie oznaczenia
Wlać do probówki (około 1/3) badaną wodę i dodać ok. 5 kropel roztworu szczawianu amonu. Jony szczawianowe tworzą z jonami wapnia biały, trudno rozpuszczalny osad szczawianu wapnia zgodnie z reakcją:
Ca2+ + (COO)22-→ Ca (COO)2
Zmętnienie badanej próbki wody (powstanie osadu) oznacza obecność w niej jonów Ca2+. Zmętnienie może nastąpić nawet po 5 min.
Badanie obecności jonów SO42-
Wykonanie oznaczenia
Wlać do probówki (około 1/3) badaną wodę i dodać ok. 5 kropel roztworu chlorku baru. Jony siarczanowe reagują z jonami barowymi tworząc trudno rozpuszczalny osad siarczanu barowego zgodnie z reakcją:
Ba2+ + SO42- → BaSO4
Obserwuje się próbkę czy nastąpiło zmętnienie. Zmętnienie oznacza obecność jonów SO42w badanej próbce wody -.
Oznaczenie twardości ogólnej wody metodą miareczkowania kompleksometrycznego (tylko do etapu I i III) (patrz rozdział Miareczkowanie kompleksometryczne)
Wykonanie oznaczenia
Do trzech kolb stożkowych odmierzyć pipetą jednomiarową po 20 cm3 badanej wody i rozcieńczyć próbki wodą destylowaną do objętości ok. 50 cm3. Do próbek dodać:
po 10 cm buforu amonowego o pH =10 (odmierzamy bufor cylindrem miarowym)
niewielką ilość (na koniec bagietki) wskaźnika czerni eriochromowej T.
- Po dokładnym wymieszaniu miareczkować kolejne próbki mianowanym roztworem wersenianu sodowego (0,01m/dcm3 EDTA) do zmiany barwy z czerwonej na niebieską.
Z ilości zużytego wersenianu obliczyć ogólną twardość wody (w mval dm-3 ) wg wzoru:
a - stężenie wersenianu sodowego - [mol/dcm3]
V1 - objętość wersenianu sodowego zużytego na zmiareczkowanie próbki
wody - [cm3]
Vwody - objętość próby wody użytej do miareczkowania - [cm3]
2 - przelicznik moli na vale,
1000 - przelicznik vale na mvale.
Etap II. Proces dekationizacji wody na kationicie wodorowym
Do wypłukanej kolumny z kationitem wlewać porcjami wodę twardą przeznaczoną do demineralizacji. Szybkość przepływu regulować tak, aby w ciągu 5-10 min wyciekało z kolumny 100 cm3 wody. Pierwsze porcje wycieku ok. 250 cm3 trzeba odrzucić (wylać), a następnie wyciekającą wodę zbierać do zlewki.
UWAGA: Do kolumny wypełnionej anionitem nie wolno wlewać wody twardej, przeznaczonej do demineralizacji. Złoże anionitu może być zasilane jedynie wodą przepuszczoną przez kationit.
W wycieku po kationicie wykonać następujące badania:
Zmierzyć pH (jak w pkt. 1),
sprawdzić obecność jonów Ca2+ (jak w pkt. 2)
sprawdzić obecność jonów SO42- (jak w pkt. 3).
Nie wykonywać oznaczenia twardości.
Etap III. Proces wymiany anionów na kolumnie z anionitem.
Wyciek z kationitu wlewać porcjami do kolumny z anionitem. Pierwsze porcje wycieku z anionitu ok. 250 cm3 - trzeba odrzucić (wylać), a następne porcje zbierać do zlewki.
W wycieku po anionicie wykonać następujące badania:
Zmierzyć pH (jak w pkt. 1),
sprawdzić obecność jonów Ca2+ (jak w pkt. 2)
sprawdzić obecność jonów SO42- (jak w pkt. 3).
Oznaczyć twardość ( jak w punkcie 4).
Etap IV. Zapisać wszystkie dane w odpowiednich rubrykach tabeli sprawozdawczej.
Otrzymane wyniki wpisać do tabeli sprawozdania (próby jakościowe w postaci liczb i znaków „+” lub „-”, próby ilościowe - wartości liczbowe) i przedstawić do akceptacji prowadzącemu ćwiczenia.
Etap V. Obliczyć twardość wody
twardej, otrzymanej do badań i w wycieku po anionicie, w różnych jednostkach pamiętając, że:
twardość 1mval/dcm3 = 0,5mmol/dcm3 = 2,8otwardości = 50mgCaCO3/dcm3.
Etap VI. Obliczyć wydajność procesu demineralizacji na jonitach.
Określenie skuteczności demineralizacji wody (wydajności procesu), wg wzoru:
Przykład obliczenia:
Podczas demineralizacji wody na jonitach, oznaczano twardość ogólną w wodzie twardej i po demineralizacji. Na zmiareczkowanie 20cm3 wody przed demineralizacją (1) zużyto średnio 5,4 cm3 0,01m/dcm3 EDTA, natomiast na zmiareczkowanie 20 cm3 wody z wycieku po anionicie (2) zużyto 0,1 cm3. Oblicz twardość wody twardej i zdemineralizowanej oraz skuteczność procesu demineralizacji.
Korzystano ze wzoru na obliczenie twardości wody w mval/dcm3:
Obliczanie twardości wody przed demineralizacją:
Tw1= 5,4 mval/dcm3 = 2,7mmol/dcm3 = 270mgCaCO3/dcm3
Obliczanie twardości wody po demineralizacji:
Tw2 = 0,10mval/dcm3 = 0,05mmol/dcm3 = 5mgCaCO3/l
Obliczenie skuteczności demineralizacji
2,70mmol/l - 0,05mmol/l
η = ---------------------------------------- x 100% = 98%.
2,70mmol/l
Wzór sprawozdania:
Demineralizacja wody na jonitach
Wyniki prób jakościowych
Rodzaj badania |
Woda twarda |
Wyciek z kationitu |
Wyciek z anionitu |
|
|
|
|
wapniowych (Ca2+ ) |
|
|
|
|
|
|
|
Wyniki prób ilościowych
Twardość wody |
Twardość wody przed demineralizacją (woda twarda) |
Twardość wody po demineralizacji (wyciek po anionicie) |
Objętość roztworu EDTA zużytego na zmiareczkowanie próbki |
V1 ………… V2 ……… V3 ……… Vśr ……… |
V1 ………… V2 ……… Vśr ……… |
Twardość wody
[mval . dm-3] [mmol . dm-3] [stopnie tw.] [mgCaCO3 . dm-3]
|
………………………………. ………………………………. ………………………………. ………………………………. |
………………………………. ………………………………. ………………………………. ………………………………. |
Skuteczność uzdatnienia wody η [%]
|
………………………………. |
|
2
Wyszukiwarka