
Podstawy analizy miareczkowej
Przykłady oznaczeń wolumetrycznych
oraz ich zasady
Analiza miareczkowa
Analiza miareczkowa (objętościowa, wolumetryczna)
polega na oznaczaniu zawartości składnika w
badanym roztworze za pomocą roztworu odczynnika
miareczkującego (titranta) o dokładnie znanym
stężeniu (mianie) i ściśle odmierzonej objętości;
W miareczkowaniu można wykorzystać reakcje
chemiczne, które:
przebiegają stechiometrycznie (ilościowo);
przebiegają dostatecznie szybko;
w których punkt równoważnikowy można
wyznaczyć z wystarczającą dokładnością;
w których biorą udział substancje trwałe w
roztworach w warunkach miareczkowania
Punkt równoważnikowy i punkt końcowy
Punkt równoważnikowy (PR) = punkt miareczkowania, w
którym wskaźnik oznaczany przereagował ilościowo z
dodawanym odczynnikiem (został dodany w równoważnej
ilości);
Punkt końcowy (PK) = wyznaczony doświadczalnie punkt, w
którym ilość dodanego odczynnika odpowiada dokładnie
zawartości składnika oznaczanego;
Jeśli PK=PR, to błąd oznaczenia jest minimalny;
PK oznacza się różnymi metodami na podstawie pomiaru
właściwości fizycznych roztworu;
Do najprostszych metod oznaczania PK należą metody
wizualne, polegające na dodawaniu do roztworu
odpowiedniego wskaźnika, zmieniającego barwę np. w
zalezności od pH lub potencjału redoksowego roztworu
Stężenia roztworu miareczkującego i oznaczanego
powinny być podobne, gdyż zwiększa to dokładność
uchwycenia punktu końcowego
Alkacymetria
Składa się z
alkalimetrii
(oznaczania kwasów przy
pomocy zasad) oraz
acidimetrii
(oznaczania zasad
przy pomocy kwasów)
Wskaźniki kwasowo-zasadowe
Punkt końcowy miareczkowania kwasu zasadą lub
zasady kwasem można określić potencjometrycznie,
mierząc pH roztworu przy pomocy elektrody
szklanej;
Najprostszym sposobem wyznaczania PK jest jego
wizualne określenie przy pomocy związków, których
zabarwienie zależy od pH;
Najczęściej są nimi słabe zasady lub kwasy
organiczne, w których zabarwienie formy
zdysocjowanej jest inne niż formy niezdysocjowanej;
Można też uważać te dwie formy za sprzężone pary
kwas-zasada (wg Brønsteda)
Wskaźniki kwasowo-zasadowe (2)
[HInd]
]
[Ind
]
O
[H
K
3
Ind
−
+
⋅
=
]
[Ind
[HInd]
log
]
[Ind
[HInd]
K
]
O
[H
Ind
3
−
−
+
−
=
=
Ind
pK
pH
−
+
+
↔
+
Ind
O
H
O
H
HInd
3
2
Zmiana barwy następuje, gdy pojawia się około 10 % inaczej
zabarwionych form wskaźnika; zakres zmiany barwy odbywa się więc w
przedziale od 1:10 do 10:1
Dla każdego wskaźnika zmiany zachodzą w innym zakresie pH, który
zależy od wartości K
Ind
Wskaźniki kwasowo-zasadowe (3)
Zakres zmiany barwy wskaźnika dwubarwnego wynosi
więc około pH = pK
Ind
±
1, a dla pH=pK
Ind
(czyli dla
[HInd]=[Ind
-
]) wskaźnik ma barwę pośrednią;
Należy dobrać wskaźniki tak, by ich zmiana barwy
przypadała w żądanym zakresie pH;
Stoduje się także mieszane wskaźniki, lub wskaźniki
uniwersalne, pozwalające na szybkie orientacyjne
określenie pH.
Wskaźniki kwasowo-zasadowe (4)
niebieskie
bezbarwne
9,3 – 10,5
Tymoloftaleina
czerwone
bezbarwne
8,3 -10,0
Fenoloftaleina
niebieskie
ż
ółte
6,2 – 7,6
Błękit
bromotymolowy
ż
ółte
czerwone
4,2 – 6,3
Czerwień metylowa
ż
ółte
czerwone
3,1 – 4,4
Oranż metylowy
ż
ółte
czerwone
1,2 – 2,8
Błękit tymolowy
Zabarwienie w
roztworze
alkalicznym
Zabarwienie w
roztworze
kwaśnym
Zakres pH
zmiany
barwy
Wskaźnik
Miareczkowanie mocnego kwasu
mocną zasadą
Oznaczenie opiera się na reakcji zobojętnienia:
O
H
MeA
MeOH
HA
2
+
→
+
Ponieważ zarówno mocny kwas jak i mocna zasada i ich sól są
elektrolitami mocnymi, to ich dysocjacja jest całkowita:
O
H
2
)
A
Me
(
OH
Me
A
O
H
2
-
-
-
3
+
+
→
+
+
+
+
+
+
Reakcja jest zatem reakcją pomiędzy jonami hydroniowymi a
hydroksylowymi. pH roztworu soli mocnego kwasu i mocnej
zasady wynosi 7, zatem sygnałem osiągnięcia punktu
równoważnikowgo jest taka właśnie wartość pH
Miareczkowanie mocnego kwasu
mocną zasadą (1)
pH mocnego kwasu przed miareczkowaniem wynosi
pH = - log c
HA
W czasie miareczkowania przed punktem równoważnikowym:
Z
Z
Z
KW
V
V
V
c
V
c
pH
+
⋅
−
⋅
−
=
0
0
log
W punkcie równowaznikowym
pH = 7
Z
KW
Z
Z
w
V
V
V
c
V
c
pk
pH
+
⋅
−
⋅
+
=
0
0
log
Po osiągnięciu punktu równoważnikowego:
Miareczkowanie mocnego kwasu
mocną zasadą (2)
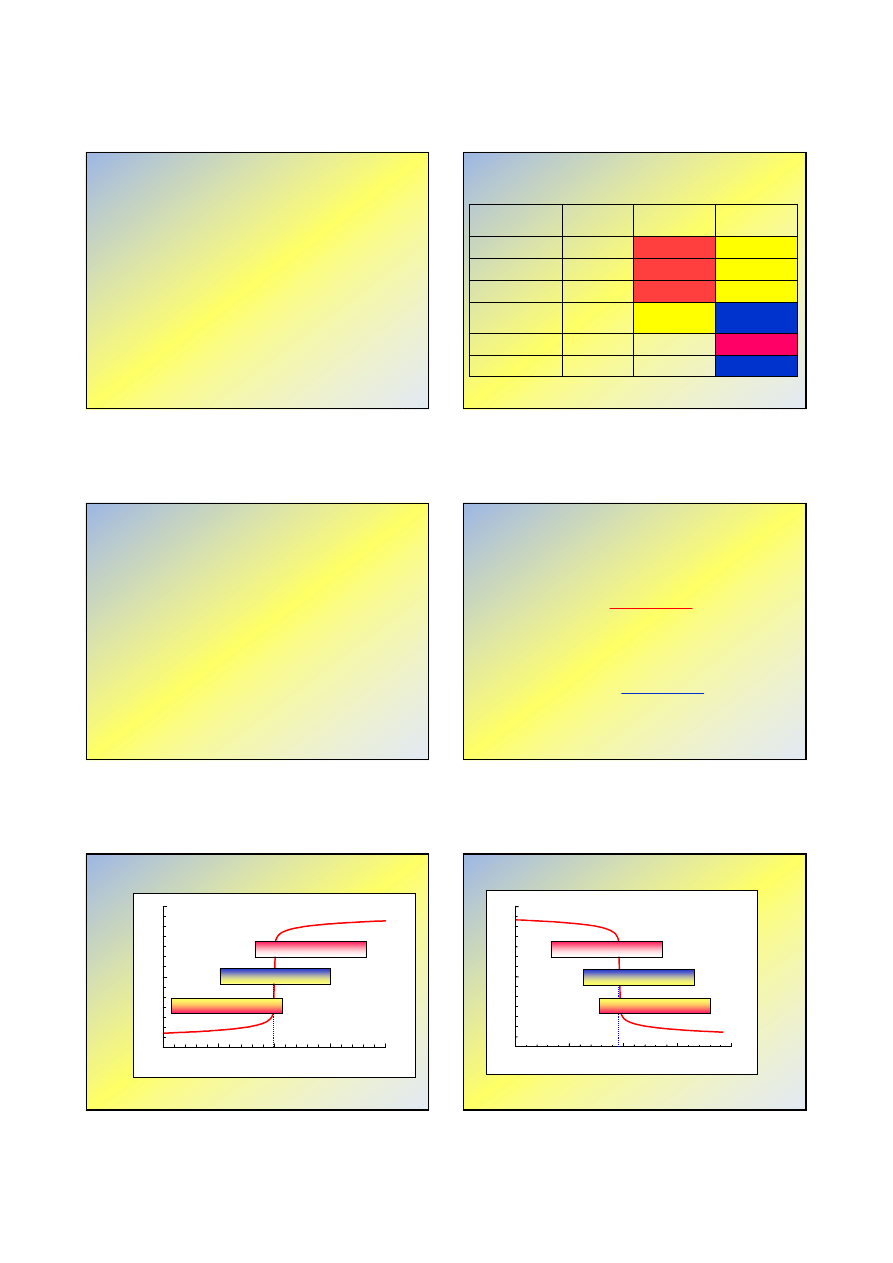
15
20
25
30
35
0
7
14
pH
MeOH, cm
3
oranż metylowy
błękit bromotymolowy
fenoloftaleina
Wszystkie trzy wskaźniki nadają się do określenia PK=PR
15
20
25
30
35
0
7
14
pH
HA, cm
3
Miareczkowanie mocnej zasady mocnym
kwasem
oranż metylowy
błękit bromotymolowy
fenoloftaleina
Wszystkie trzy wskaźniki nadają się również do określenia PK=PR
Miareczkowanie słabego kwasu
mocną zasadą
Oznaczenie opiera się na reakcji zobojętnienia:
O
H
MeA
MeOH
HA
2
s
s
+
→
+
Ponieważ zarówno mocny kwas i słaba zasada tworzą sól, która
wraz z nadmiarem słabego kwasu tworzy roztwór buforowy, to
początkowy, dość szybki wzrost pH ulega zahamowaniu:
-
s
2
-
s
OH
Me
HA
O
H
)
A
Me
(
+
+
→
+
+
+
+
Powstająca sól ulega hydrolizie, co powoduje, że punkt
równoważnikowy przypada powyżej pH = 7
pH przed miareczkowaniem
pH = ½ pK
kw
– ½ log (c
HA
)
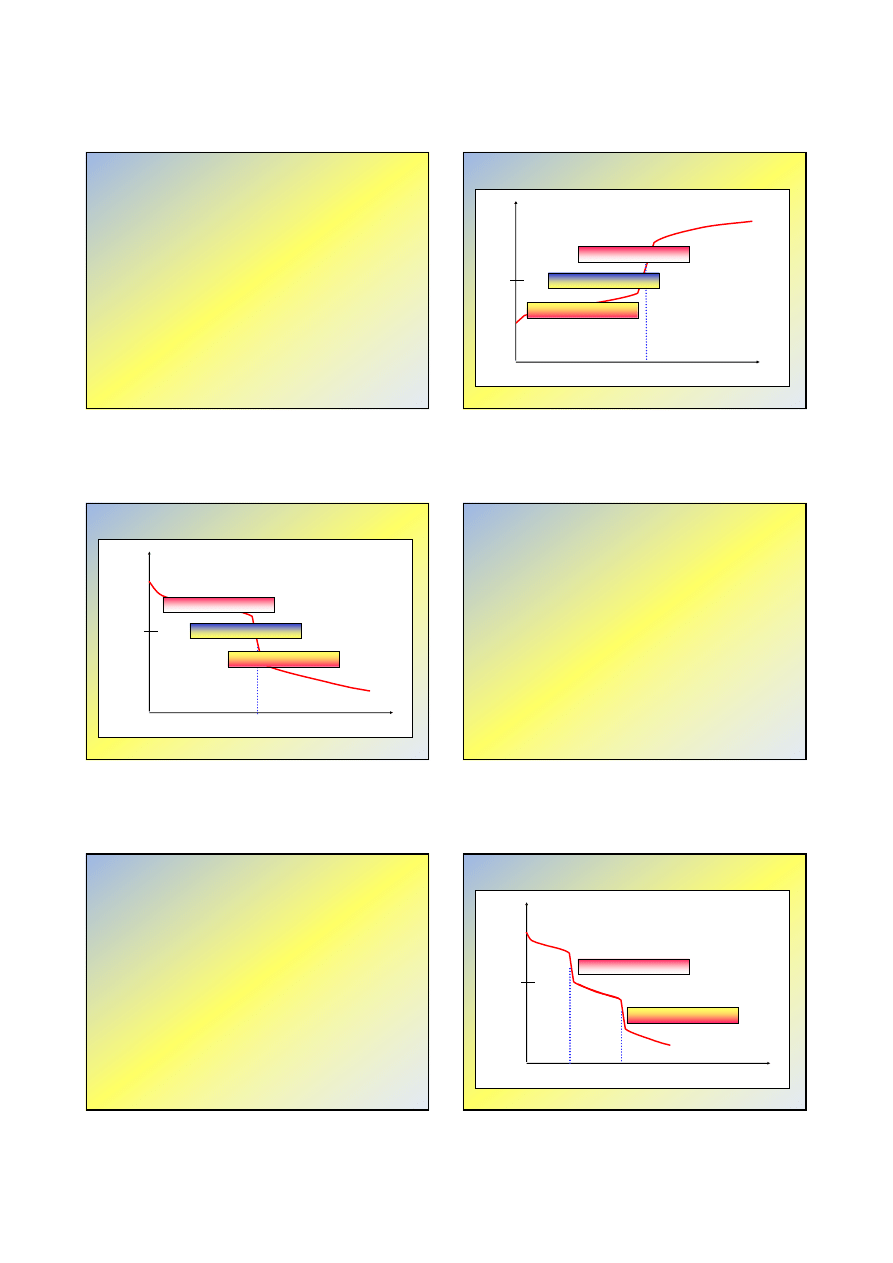
Miareczkowanie słabego kwasu
mocną zasadą (2)
pH
7
MeOH, cm
3
roztwór
buforowy
hydroliza
soli
fenoloftaleina
błękit bromotymolowy
oranż metylowy
Oranż metylowy – nie nadaje się
Miareczkowanie słabej zasady
mocnym kwasem
pH
7
HA, cm
3
roztwór
buforowy
hydroliza
soli
oranż metylowy
błękit bromotymolowy
fenoloftaleina
Fenoloftaleina – nie nadaje się
Jeszcze o alkacymetrii
W dotychczasowych rozważaniach opisano
miareczkowanie kwasu jednoprotonowego i
odpowiednich zasad;
Przy miareczkowaniu kwasu dwuprotonowego reakcja
będzie przebiegała dwuetapowo zgodnie z reakcjami:
Na krzywej miareczkowania pojawią się dwa punkty
przegięcia – każdy odpowiadający jednemu z punktów
równoważnikowych
O
H
A
Me
MeOH
MeHA
O
H
MeHA
MeOH
A
H
2
2
2
2
+
→
+
+
→
+
Miareczkowanie węglanów
Podobnie wygląda miareczkowanie węglanów, które
równiez przebiega dwuetapowo;
Węglan sodowy – ze wgzledu na hydrolizę –
zachowuje się jak dość słaba zasada:
Tworzący się w pierwszym etapie jon HCO
3
-
jest słabą
zasadą Brønsteda, a w drugim etapie tworzy się bardzo
słaby kwas węglowy;
Mieszanina jonów HCO
3
-
i H
2
CO
3
ma właściwości
buforujące;
O
2H
CO
O
H
CO
H
O
H
HCO
O
H
HCO
O
H
CO
2
2
2
3
2
3
3
2
3
3
2
3
+
→
+
→
+
+
→
+
+
−
−
+
−
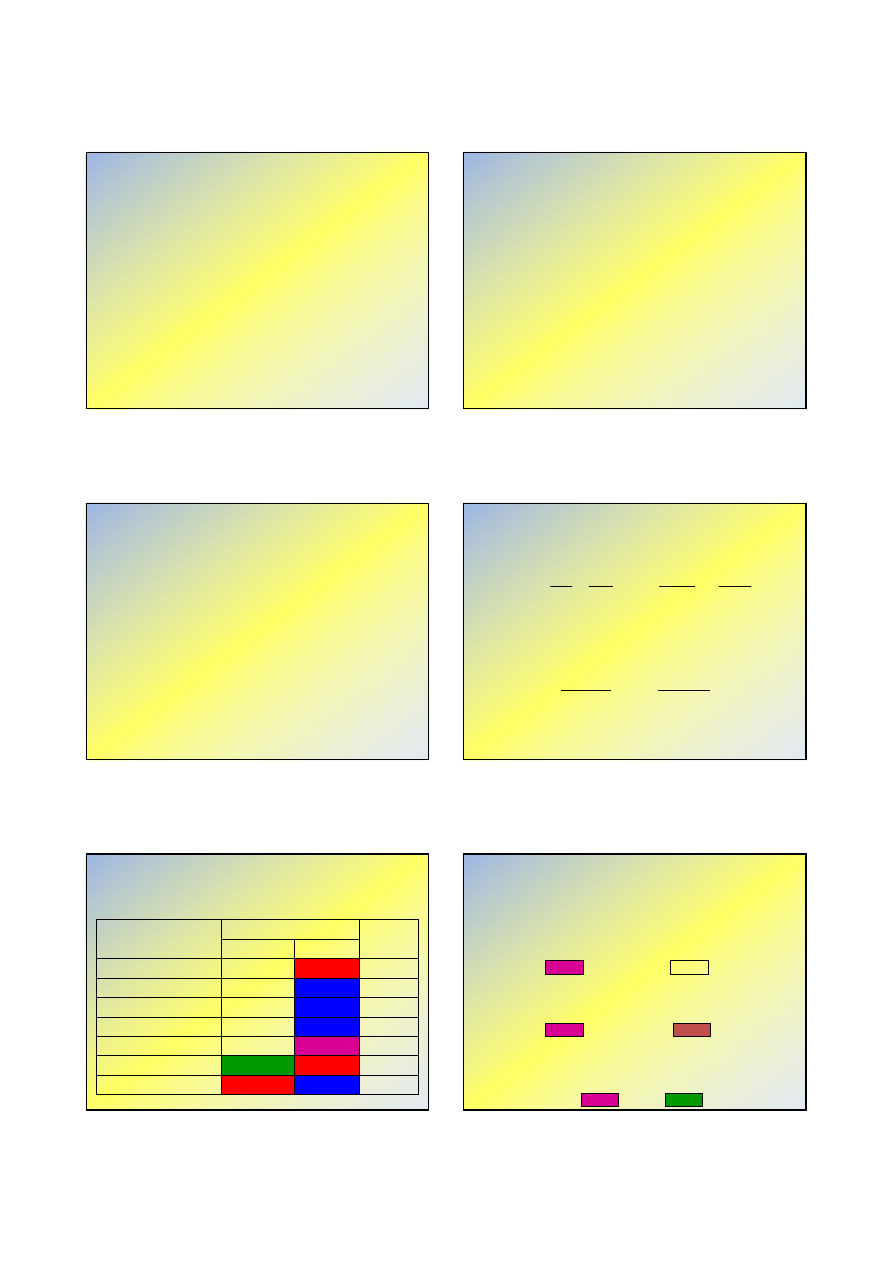
Miareczkowanie Na
2
CO
3
mocnym kwasem
pH
7
HA, cm
3
fenoloftaleina
O
H
HCO
O
H
CO
2
3
3
2
3
+
→
+
−
+
−
oranż metylowy
O
2H
CO
O
H
CO
H
O
H
HCO
2
2
2
3
2
3
3
+
→
+
→
+
+
−
Przykłady oznaczeń alkacymetrycznych
Oznaczanie zawartości NaOH przy pomocy HCl;
Oznaczanie zawartości HCl przy pomocy NaOH;
Oznaczanie zawartości CH
3
COOH przy pomocy
NaOH;
Oznaczanie zawartości NH
3
przy pomocy HCl;
Nie wykonuje się miareczkowań w układach słaby
kwas – słaba zasada;
Oznaczanie zawartości Na
2
CO
3
przy pomocy HCl;
Oznaczanie zawartości NaHCO
3
przy pomocy HCl;
Oznaczanie zawartości Na
2
CO
3
i
NaHCO
3
przy
pomocy HCl;
Każde z oznaczeń wymaga określonych warunków
Redoksometria
Składa się z
oksydymetrii
(oznaczania przy
pomocy substancji utleniających) oraz
reduktometrii
(oznaczania zasad przy pomocy
kwasów)
Redoksometria (1)
Przed miareczkowaniem trzeba przeprowadzić
substancję oznaczaną w formę zredukowaną (jeśli
odczynnik miareczkujący ma właściwości
utleniające) lub w formę utlenioną (jeśli odczynnik
miareczkujący ma właściwości redukujące);
Nadmiar stosowanego wstępnie reduktora lub
utleniacza trzeba usunąć z roztworu, by nie
przeszkadzał w oznaczeniu;
W czasie miareczkowania ulega zmianie różnica
potencjałów redoksowych ogniwa złożonego z
dwóch par
OX
/
RED
;
Potencjały zależą zarówno od pH roztworu, jak i od
jego siły jonowej
Redoksometria (2)
Dla każdej z dwóch par redoksowych (odczynnika
miareczkującego i substancji oznaczanej) potencjał
redoksowy wynosi:
Na początku miareczkowania wartość potencjału zależy
tylko od stężeń substancji oznaczanej, a w punkcie
równoważnikowym potencjał jest równy różnicy
potencjałów normalnych, czyli:
Na krzywej zależności różnicy potencjału od objętości
titranta zauważymy przegięcie
]
[
]
[
log
059
,
0
ln
0
0
red
utl
n
E
a
a
nF
RT
E
E
red
utl
+
=
+
=
PR
PR
PR
PR
red
utl
red
utl
]
[
]
[
log
]
[
]
[
log
2
2
1
1
−
=
Redoksometria - wskaźniki (3)
Wskaźniki redoksowe – substancje o innym zabarwieniu
formy utlenionej i zredukowanej:
Barwa formy
1,20
niebieskawa
czerwona
Ferroina
1,00
czerwona
zielona
Erioglucyna A
0,76
fioletowa
bezbarwna
Dwufenylamina
0,53
niebieska
bezbarwna
Błękit metylenowy
0,41
niebieska
bezbarwna
Błękit Nilu
0,36
niebieska
bezbarwna
Czterosulfonian indyga
0,24
czerwona
bezbarwna
Safranina T
E
0
[V]
utlenionej
zredukowanej
Wskaźnik
Manganometria (1)
Odczynnikiem miareczkującym (titrantem) jest manganian
(VII) potasu, KMnO
4
, którego potencjał utleniający dla
pH=0 wynosi 1,5 V i maleje ze wzrostem pH:
O
4H
Mn
5
8H
MnO
2
2
4
+
→
+
+
+
+
−
e
ś
rodowisko kwaśne
O
2H
MnO
3
4H
MnO
2
2
4
+
↓
→
+
+
+
−
e
ś
rodowisko słabo kwaśne lub słabo zasadowe
−
−
→
+
2
4
4
MnO
MnO
e
ś
rodowisko zasadowe
Mn
+VII
Mn
+II
Mn
+VII
Mn
+IV
Mn
+VII
Mn
+VI

Manganometria (2)
Miareczkowanie manganianem(VII) prowadzi się
w środowisku silnie kwaśnym), gdyż wtedy
potencjał utleniający jonów MnO
4
-
jest najwyższy;
Zaletą stosowania jonów MnO
4
-
jest ich
zabarwienie – wskaźnikiem PK jest nadmiar jonów
miareczkujących (bladoróżowe zabarwienie
roztworu);
Jony oznaczane, które ulegają w tych warunkach
utlenieniu, muszą wykazywać odpowiednie
potencjały redoksowe
Manganometryczne oznaczanie
szczawianów
Jony szczawianowe (zawarte w Na
2
C
2
O
4
, H
2
C
2
O
4
lub
H
2
C
2
O
4
⋅
2H
2
O) ulegają utlenieniu jonami manganiowymi
(VII) w środowisku silnie kwaśnym zgodnie z reakcją
sumaryczną:
Reakcję tę można wykorzystać również do pośredniego
oznaczania jonów Ca
2+
, wytrącając ilościowo osad
Ca
2
C
2
O
4
z roztworu, odsączając go i rozpuszczając go w
kwasie siarkowym i oznaczając odpowiadającą ilość
jonów szczawianowych:
O
8H
10CO
2Mn
6H
O
C
5H
2MnO
2
2
2
4
2
2
4
+
↑
+
→
+
+
+
+
−
+VII
+III
+II
+IV
O
8H
10CO
2Mn
6H
1
O
5C
2MnO
)
O
C
(2H
Ca
2H
O
CaC
O
CaC
O
C
Ca
2
2
2
-
2
4
2
4
-
2
4
2
2
4
2
4
2
-
2
4
2
2
+
↑
+
→
+
+
+
+
→
+
↓
→
+
+
+
−
+
+
+
+
Manganometryczne oznaczanie żelaza
o
Jony żelaza (II) w środowisku kwaśnym ulegają utlenieniu
jonami manganiowymi (VII) zgodnie z równaniem reakcji:
o
Przed przeprowadzeniem oznaczenia trzeba zawarte w
roztworze żelazo zredukować w całości do jonów żelaza
(II) i usunąć z roztworu nadmiar reduktora:
O
4H
5Fe
Mn
8H
5Fe
MnO
2
3
2
2
4
+
+
→
+
+
+
+
+
+
−
↓
+
→
+
+
+
→
+
+
−
+
+
+
+
+
+
2
2
4
2
2
2
4
2
2
3
Cl
Hg
Sn
2Cl
2Hg
Sn
Sn
2Fe
Sn
2Fe
:
Cl
nadmiar Sn
Inne oznaczenia manganometryczne
Zawartość H
2
O
2
w roztworze można oznaczyć
wykorzystując jego właściwości redukujące:
Jony manganianowe (VII) można również wykorzystać do
oznaczania arsenu (w tym przypadku trzeba obecny w
roztworze As(V) zredukować najpierw do As(V):
O
8H
5O
2Mn
6H
O
5H
2MnO
2
2
2
2
2
4
+
↑
+
→
+
+
+
+
−
+VII
-I
+II
0
O
3H
5AsO
2Mn
6H
5AsO
2MnO
2
4
3
2
3
3
4
+
+
→
+
+
−
+
+
−
−
Inne metody oksydymetryczne
Inną metodą oksydymetryczną jest chromianometria -
zastosowanie jako odczynnika miareczkującego roztworu
mianowanego dichromianu (VI) potasu:
Chromianometria może być m.in. stosowana do
oznaczania zawartości żelaza zgodnie z równaniem (w
ś
rodowisku kwaśnym, wkaźnik – dwufenyloamina):
O
H
7
2Cr
H
14
O
Cr
2
3
7
2
+
→
+
+
+
−
+VI
+III
O
H
7
6Fe
2Cr
14H
6Fe
O
Cr
2
3
3
3
-
2
7
2
+
+
→
+
+
+
+
+
+
Jodometria
Jodometria opiera się na wykorzystaniu utleniających
właściwości jodu – potencjał normalny I
2
/2I
-
wynosi
E
0
=0,535 V. Ze względu na niewielką trwałość
mianowanych roztworów jodu, najczęściej stosuje się
metody pośrednie, oznaczając wydzielony jod lub jego
nadmiar tiosiarczanem sodowym:
Jon tiosiarczanowy jest pochodną jonu siarczanowego, w
którym jeden z atomów tlenu zastąpiono siarką, a stopień
utlenienia siarki jest średnią ładunków dwóch atomów:
−
−
−
+
→
+
2I
O
S
I
O
2S
2
6
4
2
2
3
2
+II
0
+V/2 -I
S
O
O
H
H
O
S
S
O
O
O
H
H
O
S
O
O
H
O
S
O
O
S
S

Jodometria
Z bilansu elektronowego wynika, że dwa atomy siarki w
jonie tiosiarczanowym oddają tylko jeden elektron.
Roztwory tiosiarczanu sodowego, choć dość stabilne,
ulegają w wodzie powolnemu rozkładowi na jony
wodorosiarczanowe (IV) i siarkę:
Stężone roztwory jodu w wodzie mają kolor czerwony,
rozcieńczone – żółty. Wskaźnikiem w miareczkowaniu
jodu tiosiarczanem jest skrobia, która w obecności nawet
ś
ladowych ilości jodu barwi się na niebiesko.
S
HSO
H
O
S
3
2
3
2
+
→
+
−
+
−
Przykłady oznaczeń jodometrycznych
Zawartość nadtlenku wodoru w roztworze;
Nadtlenek wodoru reaguje w środowisku kwaśnym z
jonami jodkowymi, utleniając je do wolnego jodu
(oznaczenie pośrednie):
Do roztworu dodaje się nadmiar jodku potasu, a
wydzielony jod – odpowiadający zawartości H
2
O
2
w
roztworze – odmiareczkowuje się roztworem tiosiarczanu
sodowego, dodając pod koniec miareczkownia świeżo
przygotowanego roztworu skrobi.
O
2H
I
2H
2I
O
H
2
2
2
2
+
→
+
+
+
−
Przykłady oznaczeń jodometrycznych
Oznaczanie zawartości miedzi;
Jony miedziowe Cu
2+
reagują z jonami jodkowymi,
utleniając je do wolnego jodu, a równocześnie redukując
się do jonów Cu
+
(oznaczenie pośrednie):
Do roztworu dodaje się nadmiar jodku potasu, a
wydzielony jod – odpowiadający zawartości Cu
2+
w
roztworze – odmiareczkowuje się roztworem tiosiarczanu
sodowego, dodając pod koniec miareczkownia świeżo
przygotowanego roztworu skrobi. Ilość wolnego jodu
odpowiada stechiometrycznie zawartości miedzi w
badanym roztworze.
↓
+
→
+
−
+
2CuI
I
4I
2Cu
2
2
Kompleksometria
Kompleksometria polega na wykorzystaniu reakcji
tworzenia się trwałych kompleksów do oznaczania
zawartości badanych substancji w roztworze
Kompleksometria
Najczęściej stosowaną substancją jest kwas
etylenodiaminotetraoctowy (EDTA, komplekson II),
znany również jako kwas wersenowy, stosowany również
jako sól dwusodowa (komplekson III). Tworzą się trwałe
kompleksy chelatowe z większością jonów metali
wielowartościowych.
N—CH
2
—CH
2
—N
HOOC—H
2
C
HOOC—H
2
C
CH
2
—COOH
CH
2
—COOH
Oznaczając EDTA jako H
4
Y, możemy napisać reakcję
tworzenia sie kompleksu (kompleksowania):
+
+
−
−
+
+
→
+
2H
[MeY]
Y
H
Me
4)
(n
2
2
n
Kompleksometria
Punkt końcowy w miareczkowaniu
kompleksometrycznym jest podobny do PK w
alkacymetrii, tylko zamiast skoku pH, jest skok pMe
(ujemnego logarytmu za stężenia oznaczanego metalu),
reakcja kompleksowania przebiega wg schematu:
Powinny być spełnione podobne warunki, jak przy
miareczkowaniu alkacymetrycznym, czyli: podobne
stężenia, wysoka trwałość produktu reakcji (niska
dysocjacja)
O
2H
OH
O
H
MeL
L
Me
2
3
→
+
→
+
−
+

Wskaźniki kompleksometryczne
Są to substancje organiczne, będące często również
wskaźnikami alkacymetrycznymi, które tworzą z
oznaczanym metalem kompleks o trwałości znacznie
mniejszej niż jego kompleks z EDTA. Zabarwienie
kompleksu jest inne, niż zabarwienie cząsteczek
wskaźnika (zależne często również od pH!):
Czasem stosuje się również wskaźniki redoks (np. dla Fe
3+
),
gdyż wytworzenie kompleksu obniża potencjał utleniający;
Kompleksometria pozwala na oznaczanie zawartości
różnych kationów w mieszaninach poprzez maskowanie
obceności pozostałych kationów przez wytworzenie
trwalszych kompleksów lub ich wytrącenie
In
EDTA
-
Me
EDTA
In
-
Me
+
→
+
barwa I
barwa II
Przykłady oznaczeń kompleksometrycznych
Oznaczanie Mg – w roztworze o pH = 10 (bufor) i w
obecności czerni eriochromowej jako wskaźnika;
Zmiana zabarwienia roztworu z różowofiołkowego na
niebieskie;
Te sam sposób oznaczania można zastosować np. również
do oznaczania jonów Ca
2+
- w obecności innych jonów
należy silnie zalkalizować roztwór (pH=13), tak by
wytrącić pozostałe kationy.
W tych warunkach pH wskaźnikiem jest mureksyd lub
kalces.
Metoda nadaje się róznież do oznaczania zawartości
wapnia i magnezu łącznie (twardość wody!)
Metody strąceniowe
Metody strąceniowe
Oznaczanie przy pomocy metod strąceniowych polega na
wytworzeniu przez titrant trudnorozpuszczalnych osadów
z substancją oznaczaną;
Warunkiem jest tworzenie się osadu o ściśle określonej
stechiometrii o bardzo niskiej rozpuszczalności;
Podobnie jak w innych przypadkach, tak i w tym
wyznaczenie PK miareczkowania wymaga analizy
krzywej miareczkowania na wykresie zalezności
ujemnego logarytmu ze stężenia substancji oznaczanej w
funkcji objętosci dodawanego odczynnika;
Najbardziej znaną metodą strąceniową jest
argentometria, w której substancją miareczkującą jest
mianowany osad azotanu(V) srebra, tworzący
trudnorozpuszczalne osady z większością anionów
Argentometria - wskaźniki – oznaczanie Cl
-
Wskaźnikami w metodach strąceniowych są substancje
tworzące z nadmiarem odczynnika strącającego barwne
osady, bądź barwne rozpuszczalne związki kompleksowe.
Przykład – chromian (VI) potasu, stosowany jako wskaźnik
przy miareczkowaniu chlorków.
Argentometryczne oznaczanie chlorków opiera sie na
reakcji:
Wskaźnik równiez tworzy z jonami srebra
trudnorozpuszczalny osad:
-10
10
1,1
]
[Cl
]
[Ag
AgCl
Cl
Ag
⋅
=
⋅
↓
→
+
−
+
−
+
-12
2
4
2
4
2
2
4
10
2
]
[CrO
]
[Ag
CrO
Ag
CrO
2Ag
⋅
=
⋅
→
+
−
+
−
+
Oznaczanie chlorków metodą Mohra
Dwie sole trudno rozpuszczalne:
W roztworze znajduje się 0,001 mola chlorku potasu oraz 0,001 mola
chromianu (VI) potasu. Do roztworu dodawano kroplami 0,01 M
roztwór azotanu srebra. Jaki osad wytrąci się z tego roztworu ?
12
4
2
-
2
4
-10
-
10
2
L
CrO
Ag
CrO
2Ag
10
1
L
AgCl
Cl
Ag
−
+
+
⋅
=
↓
→
←
+
⋅
=
↓
→
←
+
Obliczamy przy jakim stężeniu jonów srebrowych będą się wytrącać
poszczególne osady:
5
3
12
2
4
CrO
Ag
4
2
7
3
10
10
5
,
4
10
10
2
]
[
]
[Ag
CrO
Ag
10
10
10
]
[
]
[Ag
AgCl
4
2
−
−
−
−
+
−
−
−
−
+
⋅
=
⋅
=
=
=
=
=
CrO
L
Cl
L
AgCl

Oznaczanie chlorków (2)
Stężenie jonów srebrowych pozostających w równowadze z
osadem:
]
[CrO
10
2
]
[CrO
L
]
[Cl
10
1,1
]
[Cl
L
]
[Ag
2
4
12
2
4
CrO
Ag
10
AgCl
4
2
−
−
−
−
−
−
+
⋅
=
=
⋅
=
=
stąd możemy określić początek strącania Ag
2
CrO
4
:
5
12
10
2
4
10
7,8
10
2
10
1,1
]
[CrO
]
[Cl
−
−
−
−
−
⋅
=
⋅
⋅
=
Początek wytrącania osadu Ag
2
CrO
4
zależy od stężenia
jonów chromianowych, które powinno być niewielkie
(ponadto ze względu na zabarwienie jonów
chromianowych (VI), ich nadmiar utrudnia określenie PK)
Na następnym wykładzie
Chemia nieorganiczna
Właściwości i reakcje
najważniejszych związków
Wyszukiwarka
Podobne podstrony:
chemia lato 12 07 08 id 112433 Nieznany
chemia lato 01 07 08
chemia lato 13 07 08
chemia lato 03 07 08
chemia lato 10 07 08
chemia lato 05 07 08 id 112417 Nieznany
chemia lato 09 07 08 id 112430 Nieznany
chemia lato 06 07 08
chemia lato 11 07 08
chemia lato 12 07 08 id 112433 Nieznany
chemia lato 10 07 08
chemia lato 09 07 08
chemia lato 04 09 10
więcej podobnych podstron