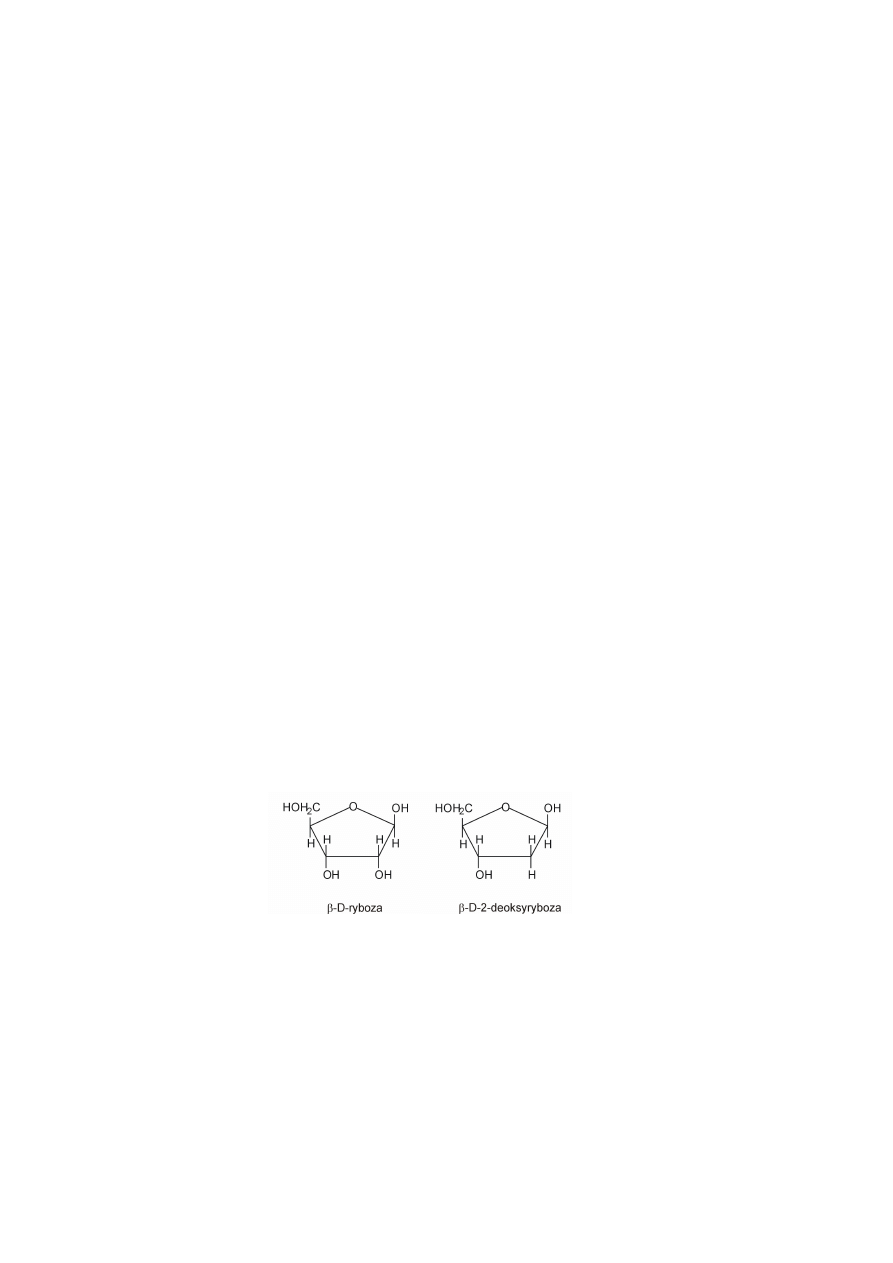
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
Badanie składników kwasów nukleinowych
Cel ćwiczenia
Ćwiczenie ma na celu poznanie niektórych reakcji barwnych charakterystycznych dla
kwasów nukleinowych. Na ćwiczeniu zostaną wykonane reakcje pozwalające na wykrycie:
pentozy (reakcja Biala), deoksyrybozy (reakcja Dischego), tyminy i reszty kwasu
fosforowego.
Wprowadzenie
Kwasy nukleinowe są podstawowymi składnikami komórek zwierzęcych, roślinnych i
drobnoustrojów. Występują one w jądrze komórkowym, chloroplastach, mitochondriach oraz
w cytoplazmie. Wśród kwasów nukleinowych wyróżnia się: kwas deoksyrybonukleinowy
(DNA), który stanowi informację genetyczną we wszystkich organizmach żywych (wyjątek
wirusy RNA) oraz kwasy rybonukleinowe (RNA), które uczestniczą między innymi w
ekspresji genów i biosyntezie białka.
Kwasy nukleinowe są biopolimerami składającymi się z monomerów, zwanych
nukleotydami. Nukleotyd, składa się z: cząsteczki cukru – pentozy, zasady azotowej, oraz
reszty kwasu fosforowego. Cukier wchodzący w skład nukleotydu to: ryboza (β-D-ryboza),
charakterystyczna dla nukleotydów budujących kwasy rybonukleotydowe (RNA) lub
deoksyryboza (β-D-2-deoksyryboza) występująca w cząsteczkach DNA. Obie cząsteczki
cukru występują w formie hemiacetalowego pierścienia. Deoksyryboza różni się od rybozy
tylko brakiem grupy hydroksylowej przy drugim atomie węgla w pierścieniu (rys 1).
Rysunek 1. Wzory cukrów występujących w kwasach nukleinowych
.
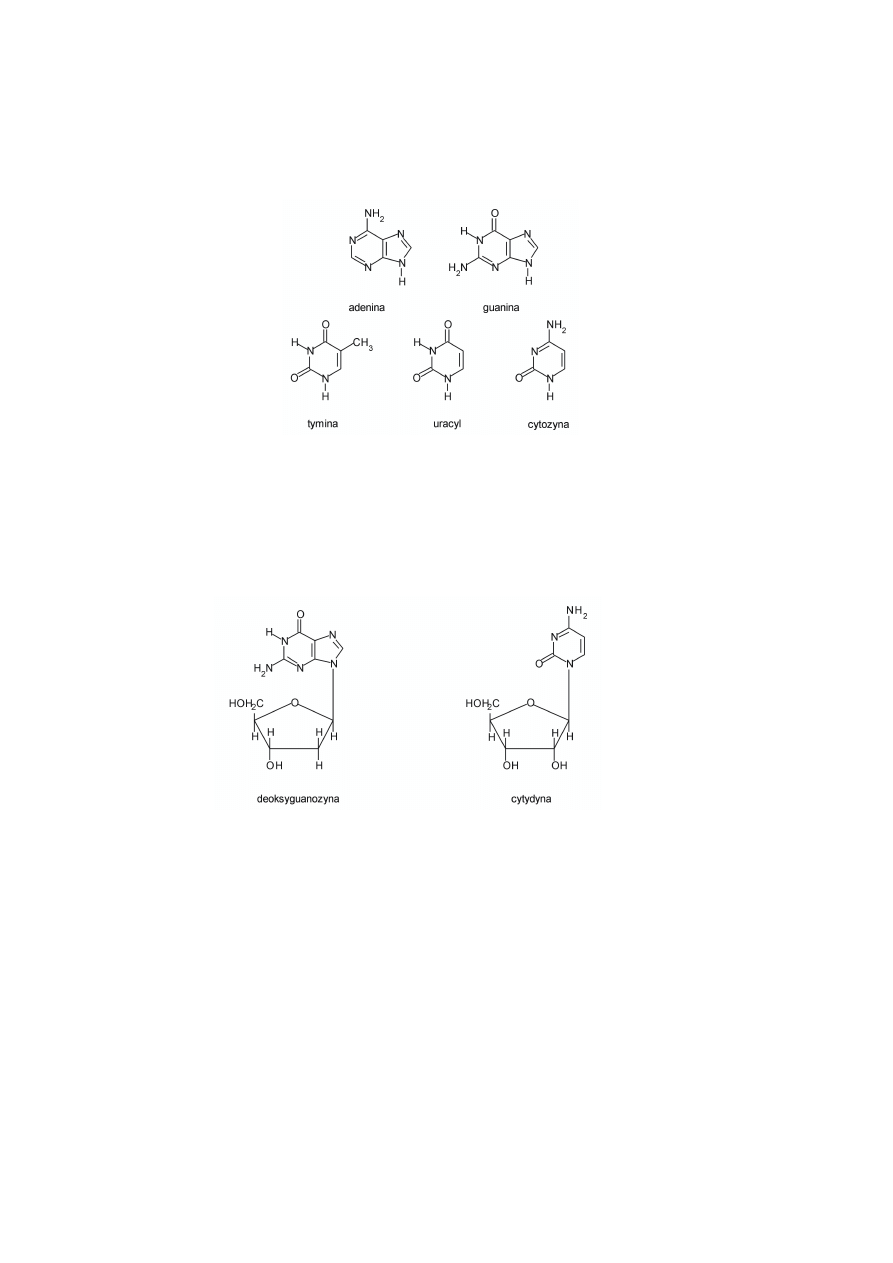
Zasady azotowe występujące w kwasach nukleinowych są związkami organicznymi,
heterocyklicznymi o charakterze aromatycznym. Zasady te to pochodne purynowe: adenina i
guanina oraz pirymidynowe: cytozyna, tymina i uracyl. Zarówno w DNA, jak i RNA
występują zasady purynowe – adenina (6-aminopuryna) i guanina (2-amino-6-
hydroksypuryna) oraz pochodna pirymidynowa –
cytozyna
(2-hydroksy-4-
1
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
aminopirymidyna). Poza tym w RNA występuje pochodna pirymidynowa – uracyl (2,4-
dihydroksypirymidyna), a w DNA pochodna pirymidynowa – tymina (2,4-dihydroksy-5-
metylopirymidyna). Wzory tych zasad są podane na rysunku 2.
Rysunek 2. Wzory zasad azotowych występujących w kwasach nukleinowych.
Zasada azotowa połączona z pentozą wiązaniem N-glikozydowym tworzy nukleozyd.
Wyróżniamy następujące nukleozydy: adenozyna, guanozyna, cytydyna, tymidyna i urydyna.
Na rysunku 3 pokazano przykładowe nukleozydy.
Rysunek 3. Wzory nukleozydów występujących w kwasach nukleinowych.
Nukleotydy należą do grupy estrów fosforanowych. Są to estry nukleozydów i kwasu
fosforowego. Typowym miejscem estryfikacji jest grupa hydroksylowa przy piątym (C-5)
atomie węgla pentozy. Ze względu na rodzaj pentozy wyróżniamy dwa typy nukleotydów:
rybonukleotydy zawierają β-D-rybozę, a deoksyrybonukleotydy - β-D-2-deoksyrybozę.
Natomiast w zależności od rodzaju zasady azotowej istnieje 5 typów nukleotydów:
adenozyno-5'-monofosforan, guanozyno-5'-monofosforan, cytydyno-5'-monofosforan,
tymidyno-5'-monofosforan, urydyno-5'monofosforan. Na rysunku 4 pokazano przykładowe
nukleotydy.
2

Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
Rysunek 4. Wzory nukleotydów występujących w kwasach nukleinowych.
Sąsiednie nukleotydy w łańcuchach kwasów nukleinowych połączone są ze sobą
wiązaniem 3’,5’-fosfodiestrowym. W wiązaniu tym fosforan jest podwójnie zestryfikowany
grupami hydroksylowymi cukru. Pierwsze wiązanie estrowe utworzone jest pomiędzy resztą
fosforanową, a grupą hydroksylową przy C-3’ pentozy jednego nukleotydu. Drugie wiązanie
estrowe łączy ten sam fosforan z grupą hydroksylową przy C-5’ pentozy następnego
nukleotydu. Jest to kowalencyjne wiązanie reszty fosforanowej między grupą 5’-
hydroksylową jednej rybozy i 3’ hydroksylową następnej.
Wyróżnia się dwa sposoby badania składników kwasów nukleinowych. Pierwszy z
nich wymaga wcześniejszej hydrolizy tych związków do składników podstawowych, tj. do
kwasu fosforowego, pentozy oraz zasady azotowej. Hydrolizę przeprowadza się z udziałem
odczynników chemicznych lub enzymatycznie. Degradacja chemiczna zachodzi pod
wpływem kwasów i zasad. DNA i oligodeoksyrybonukleotydy ulegają degradacji tylko w
środowisku kwaśnym, natomiast RNA i oligorybonukleotydy zarówno w środowisku
kwaśnym, jak i zasadowym. W przypadku środowiska alkalicznego, hydrolizie ulegają
jedynie wiązania 3’,5’-fosfodiestrowe między fosforanem, a grupą hydroksylową. Ponieważ
hydroliza ta wymaga wytworzenia wiązania estrowego między fosforanem, a grupą
hydroksylową w pozycji 2’ cukru, ulega jej tylko RNA i oligorybonukleotydy. Chemicznie
najczęściej wykonuje się hydrolizę traktując kwasy nukleinowe mocnymi kwasami
mineralnymi np. 60 % kwasem nadchlorowym w temperaturze 100°C przez 1 godzinę. W
takich warunkach w pierwszej kolejności hydrolizie ulega wiązanie N-glikozydowe miedzy
puryną a pentozą. Uwalniane są wolne puryny i tzw. kwas apurynowy. Dalsza hydroliza
prowadzi do rozpadu wiązania estrowego między pentozą, a resztą kwasu fosforowego w
efekcie, czego uwalniany jest cukier i fosforan. Następnie hydrolizie ulegają wiązania
fosfodiestrowe między nukleotydami zawierającymi zasady pirymidynowe. Pełna hydroliza
3

Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
prowadzi do rozpadu wiązań N-glikozydowych miedzy zasadami pirymidynowymi, a pentozą
i wiązań estrowych między tym cukrem a fosforanem.
Całkowitą hydrolizę kwasów nukleinowych można też przeprowadzić stosując
specyficzne enzymy. Nukleazy hydrolizują wiązanie 3’,5’-fosfodiestrowe uwalniając
pojedyncze nukleotydy, natomiast glikozydazy hydrolizują wiązania N-glikozydowe,
prowadząc do odłączenia zasad azotowych od szkieletu cukrowo-fosforanowego. Fosforan
może być uwolniony od reszty cukru przez działanie fosfataz, które hydrolizują wiązania
estrowe. Wspólne działanie wszystkich tych enzymów prowadzi do otrzymania mieszaniny
wolnych zasad azotowych (puryn i pirymidyn), fosforanu i cukru (β-D-rybozy lub β-D-2-
deoksyrybozy).
Reakcje barwne, wykonane na ćwiczeniach charakterystyczne dla hydrolizowanych
preparatów kwasów nukleinowych to reakcje pozwalające wykryć obecność fosforanów oraz
tyminy.
Drugi sposób badania składników kwasów nukleinowych związany jest z wykonaniem
reakcji barwnych bez konieczności ich hydrolizy. W niehydrolizowany preparacie kwasów
nukleinowych można wykryć pentozy dzięki reakcji Biala oraz obecność β-D-2-
deoksyrybozy wykonując reakcję Dischego.
Odczynniki
1.
Wodny roztwór kwasów nukleinowych.
2. 0,1 M NaOH
3.
60% w/o HClO
4
4. Odczynnik Biala
5. 1% w/o roztwór difenyloaminy
6.
10,6% w/o roztwór molibdenianu amonu
7. 5 M NaOH
8.
1,1% w/o Na
2
CO
3
9. Odczynnik diazowy
10. 3 M NaOH
11.
20% w/o roztwór hydroksyloaminy.
12.
96% w/o alkohol etylowy skażony 3% w/o acetonem.
4

Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
Wykonanie
Wszystkie barwne reakcje studenci wykonują na ćwiczeniach 4 godzinnych
indywidualnie, na ćwiczeniach 3 godzinnych wykonują parami. Natomiast wytrącanie
etanolem kwasów nukleinowych z roztworu wodnego oraz ich hydrolizę kwaśną w grupach
czteroosobowych.
1. Wytrącanie etanolem kwasów nukleinowych z roztworu wodnego.
Do cylindra o objętości 100 ml zawierającego 20 ml wodnego roztworu kwasów
nukleinowych (1) został wlany po bagietce alkohol etylowy (12). Wytrącony w tych
warunkach osad kwasów nukleinowych należy nawinąć na bagietkę, nadmiar alkoholu
usunąć, przyciskając bagietkę z nawiniętym osadem do ścianki cylindra. Delikatnie obracając
bagietkę rozpuścić preparat kwasów nukleinowych w 3 ml 0,1 M NaOH (2). Tak otrzymany
preparat kwasów nukleinowych podzielić na dwie części. Do szklanej probówki odpipetować
1 ml kwasów nukleinowych i dodać 4 ml 0,1 M NaOH (2). Otrzymany w ten sposób
rozcieńczony preparat zostanie wykorzystany do przeprowadzenia reakcji Biala i reakcji
Dischego. Pozostałą część preparatu wykorzystać do hydrolizy.
2. Hydroliza kwasów nukleinowych.
Do probówki zawierającej 2 ml roztworu kwasów nukleinowych w 0,1 M NaOH dodać 2 ml
HClO
4
(3) (hydrolizat, próba pełna). Do drugiej probówki odpipetować 2 ml 0,1 M NaOH (2)
i 2 ml HClO
4
(3) (próba odczynnikowa). Zawartość obu probówek dokładnie wymieszać.
Następnie obie probówki inkubować we wrzącej łaźni wodnej przez godzinę, do probówek
włożyć chłodniczki, które zapobiegają parowaniu zawartości probówek. Po zakończonej
hydrolizie do czystej probówki odpipetować 2 ml hydrolizatu, a do kolejnej probówki 2 ml
roztworu próby odczynnikowej, obie próby zobojętnić dodając 2 ml 5M NaOH (7). Zawartość
obu probówek dokładnie wymieszać. Otrzymane zobojętnione roztwory wykorzystać do
wykonywania reakcji na obecność tyminy. Do pozostałych niezobojętnionych 2 ml
hydrolizatu i 2 ml próby odczynnikowej dodać po 4 ml wody. Otrzymane w ten sposób
zhydrolizowane, kwaśne roztwory wykorzystać do wykonania reakcji na obecność kwasu
fosforowego.
3. Reakcje wykonywane na preparacie DNA niehydrolizowanym.
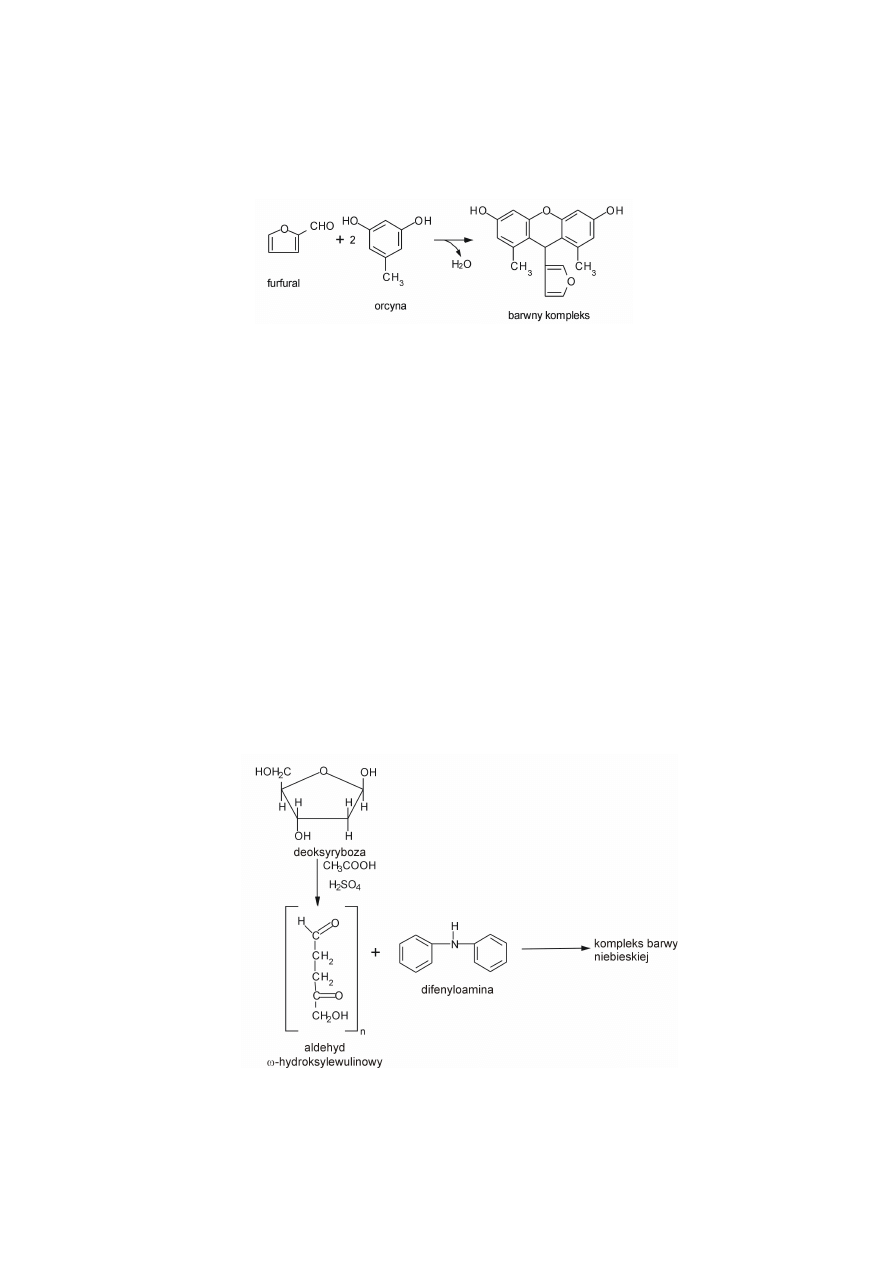
a. Reakcja charakterystyczna dla pentoz – reakcja Biala.
W reakcji Biala pentozy połączone z zasadami purynowymi występujące w nukleotydach
podczas ogrzewania z odczynnikiem Biala przekształcają się w furfural. Powstały furfural
5
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
tworzy z orcyną w obecności jonów Fe
3+
kompleks o trwałej barwie zielonej (rys. 5). W tych
warunkach β-D-2-deoksyryboza reaguje 10-krotnie słabiej od rybozy.
Rysunek 5. Reakcja Biala.
Do dwóch probówek odmierzyć po 2,5 ml odczynnika Biala (4) i wstawić do wrzącej łaźni
wodnej na 5 minut. Następnie do jednej probówki dodać 0,5 ml rozcieńczonego preparatu
kwasów nukleinowych (próba pełna), do drugiej probówki 0,5 ml 0,1-M NaOH (2) (próba
odczynnikowa). Zawartość obu probówek dokładnie wymieszać i wstawić do wrzącej łaźni
wodnej na 5 minut.
b. Reakcja charakterystyczna dla β-D-2-deoksyrybozy – reakcja Dischego.
Reakcja Dischego pozwala odróżnić dwa typy kwasów nukleinowych (DNA i RNA). W
środowisku kwaśnym deoksyryboza tworzy z difenyloaminą produkt kondensacji o barwie
niebieskiej. Ta reakcja barwna jest konsekwencją powstania aldehydu ω-
hydroksylewulinowego z β-D-2-deoksyrybozy pod wpływem działania kwasu siarkowego i
octowego.
Rysunek 6. Reakcja Dischego.
6

Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
Do jednej probówki odmierzyć 0,5 ml rozcieńczonego preparatu kwasów nukleinowych
(próba pełna), do drugiej probówki 0,5 ml 0,1 M NaOH (2) (próba odczynnikowa). Następnie
do obu probówek dodać po 2 ml roztworu difenyloaminy (5), dokładnie wymieszać i wstawić
do wrzącej łaźni wodnej na 5 min.
4. Reakcje wykonywane na preparacie hydrolizowanym DNA.
a. Wykrywanie tyminy.
Reakcja służąca do wykrywania tyminy, odróżniająca oba typy kwasów nukleinowych (DNA
i RNA), polega ona na wytworzeniu przez tyminę z diazową pochodną kwasu sulfanilowego
kompleksu o barwie czerwono-różowej, dodatek hydroksyloaminy, w środowisku zasadowym
wzmacnia barwę kompleksu.
Do dwóch probówek odmierzyć po 2,5 ml Na
2
CO
3
(8) i po 1 ml odczynnika diazowego (9),
zawartość obu probówek dokładnie wymieszać. Następnie do jednej z tych probówek dodać
0,5 ml zobojętnionego hydrolizatu kwasów nukleinowych (próba pełna), a do drugiej 0,5 ml
zobojętnionego roztworu próby odczynnikowej, zawartość obu probówek dokładnie
wymieszać. Po 5 minutach inkubacji w temperaturze pokojowej do obu probówek dodać po 1
ml 3 M NaOH (10) i 2-3 krople hydroksyloaminy (11), zawartość probówek dokładnie
wymieszać i po 5 min obserwować zabarwienia roztworów w próbie pełnej i odczynnikowej.
b. Wykrywanie reszt fosforanowych.
Reakcja charakterystyczna dla fosforanów polega na łączeniu się molibdenianu amonu z
jonem fosforanowym, w wyniku czego powstaje żółty osad fosfomolibdenianu amonu.
Do jednej probówki odmierzyć 1 ml rozcieńczonego kwaśnego hydrolizatu kwasów
nukleinowych, a do drugiej 1 ml rozcieńczonego kwaśnego roztworu próby odczynnikowej.
Następnie do obu probówek dodać po 2 ml roztworu molidbenianu amonu (6), zawartość obu
probówek dokładnie wymieszać.
Opracowanie wyników
W sprawozdaniu należy podać otrzymane zabarwienia po przeprowadzeniu poszczególnych
reakcji oraz opisać zasady metod wykorzystywanych w tych reakcjach. Wyjaśnić celowość
wykonywania prób odczynnikowych.
Pytania
1. Napisać i podać wzory zasad purynowych i pirymidynowych. Podać ich nazwy
systematyczne.
7

Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
2.
Co to jest nukleozyd, a co nukleotyd? Jakie charakterystyczne typy wiązań w nich
występują? Nazwać i przedstawić wzory nukleozydu i nukleotydu, zawierających
odpowiednio β-D-rybozę i β-D-2-deoksyrybozę.
3. Z jakich jednostek strukturalnych zbudowany jest kwas deoksyrybonukleinowy, a z
jakich kwas rybonukleinowy?
4.
Jak można hydrolizować kwasy nukleinowe i w jaki sposób była wykonana hydroliza
na ćwiczeniach?
5.
Jakie związki uwalniają się w wyniku całkowitej hydrolizy DNA, a jakie po hydrolizie
RNA?
6.
Jakie reakcje charakterystyczne są wspólne dla DNA i RNA, a które pozwalają
odróżnić te związki?
Literatura:
J. Marmur (1961) A procedure for the isolation of DNA from microorganisms. J Mol Biol 3: 208-218.
Z. Dische, E.Borenfreund (1951) A new spectrophotometric method for the detection and determination of keto
sugars and trioses. J. Biol. Chem. 192: 583-587.
Z. Dische, E. Landsberg (1957) A color reaction of pentose phosphate esters substituted in position 5.
Biochimica et Biophysica Acta 24: 193-195.
G Miller, R Golder, E Miller (1951) Determination of Pentoses. Effect of Varying Proportions of Components of
Bial's Color Reagent. Anal. Chem. 23: 903–905.
G. Hunter (1936) A test for thymine, with observations on the keto-enolic type of diazo-test. Biochem J. 30:
745–749.
8
Document Outline
- Badanie składników kwasów nukleinowych
- Cel ćwiczenia
- Wprowadzenie
- Odczynniki
- Wykonanie
- Opracowanie wyników
Wyszukiwarka
Podobne podstrony:
Badanie składników kwasów nukleinowych 2011 pdf
14) Badanie składników kwasów nukleinowychid 15604
Badanie składników kwasów nukleinowych
Lekcja I Skladniki i struktura kwasow nukleinowych (powtorzenie podstawowych informacji
Metody badania kwasów nukleinowych - lekcja IV, egzamin biologia molekularna i parazytologia
instr 2011 pdf, Roztw Spektrofoto
Hybrydyzacja kwasów nukleinowych, III rok, Genetyka kliniczna
lipaza 14 04 2011[1] 2011 pdf
BIOCHEMIA KWASOW NUKLEINOWYCH egzamin
dobroszycki,biochemia L, Izolacja kwasów nukleinowych z komórek?kterii
BIOCHEMIA KWASOW NUKLEINOWYCHegz
sprawozdanie 3, Właściwości białek i kwasów nukleinowych
Kartkówka Budowa i rola kwasów nukleinowych
hybrydyzacja kwasów nukleinowych
BIAŁEK I KWASÓW NUKLEINOWYCH REAKCJE CHARAKTERYSTYCZNE
analiza kwasow nukleinowych
budowa i rola kwasów nukleinowych
więcej podobnych podstron