POCZĄTEK
Powłoki: K L M N O P Q, max. Liczba e. na powłokach - 2n2
Typy orbitali: s(2e), p(6e), d(10e), f(14e)
Wyjątki: żelazo, mangan i vanad na ostatniej powłoce mają po 2e. Chrom i miedź na ostatniej powł. mają po 1e. Cząstki elementarne: p=1,0073u,e=0,0005u,n=1,0087u
zaX, a-Liczba masowa=p+n
z-Liczba atomowa=e=p
Atomowa jednostka masy - 1u = 1,66*10-24g; 1g= 6,023*1023u, 1 mol = 6,02·1023 cząstek(NA), 1e·NA=96,3·103C/mol (stała Faraday'a)
Ansztrem1 A = 10-10 m, 1eV = 1e · 1V
1eV=1,602·10-19C·V=1,602·10-19 J
=0,38·10-19 cal, 1eV·NA=96,4 kJ/mol
Izotopy wodoru: Prot 1H, Deuter 2H, Tryt 3H
Thompson- 1897r.- odkrywa elektron. Model atomu to tzw. „babka z rodzynkami”.
Rutherford- 1911r.- planetarny model budowy atomu. Elektrony krążą po powłokach eliptycznych, praktycznie cała masa atomu skupiona w jądrze.
Bohr- elektrony, które mogą się przemieszczać, krążą po orbitach stacjonarnych w kształcie kół.
Współczesny model atomu- w centrum znajdują się protony i neutrony, inaczej nukleony. Wokół jądra krążą elektrony. Cała masa atomu skupiona jest w jądrze. Atom ma ładunek obojętny.Rozmiary jądra w stosunku do rozmiaru atomów są bardzo małe. Heisenberg - 1972r.- zasada nieoznaczoności, która mówi, że nie można jednocześnie dokładnie wyznaczyć położenia i prędkości elektronu w atomie. Elektron wokół jądra porusza się po orbitalu atomowym.
Orbital at. jest to najmniejsza przestrzeń wokół jądra, w której istnieje największe prawdopodobieństwo znalezienia elektronu.
Stan elektronu w atomie opisuje pięć wielkości: energię, moment pędu, rzut momentu pędu na wyróżniony kierunek, spin, rzut spinu na wyróżniony kierunek.
Liczby kwantowe- są to liczby, które ściśle określają wartości, jakie może przyjmować stan elektronu w atomie.
Główna liczba kwantowa - n - energia - od 1 do 7
Poboczna l. kw. - L - moment pędu - od 0 do n-1
Magnetyczna l. kw. - m - rzut pędu na wyróżniony kierunek - 2L+1 w zakresie -L do L
Orbital - zbiór stanów kwantowych o takich samych wartościach n, l, m. W 1 orbitalu mogą znajdować się najwięcej 2e. o przeciwnych spinach.
Zasada minimum energii. Elektrony lokalizują się kolejno na poziomach energetyczne o mozliwie najnizszej wartości energii
Zakaz Pauliego - w 1 atomie nie może być 2 elektronów o tych samych wartościach 4 liczb kwantowych(n, l, m, s)
Reguła Hunda- w orbitalach typu S, P, D, F pary elektronowe powstają dopiero po zapełnieniu orbitali przez pojedyncze elektrony, przy czym niesparowane elektrony mają zgodne spiny.
Przykład: Jaką konfigurację elektronową ma atom lezący w 4 okresie, 8 grupie?
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 - czwarty okres
(4s14s23d13d23d33d43d53d6) - osma grupa
1s22s22p63s23p64s23d6 - szukany pierwiastek ma liczbę atomową 26(Fe) (2+2+6+2+6+2+6= 26)
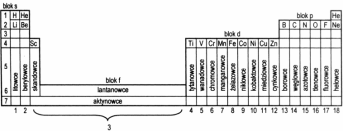
Układ okresowy pierwiastków:
Okresy (1….7) - poziomo
- nr okresu: ilość powłok elektronowych
- w ramach jednego okresu wzrasta ilość elektronow na ostatniej powłoce
Grupy (1….18) - pionowo
-nr grupy: ilość elektronow na ostatniej powłoce
-w ramach 1 grupy wrasta il. zapełnionych powłok
Wartościowość: jest to liczba oddawanych lub przyjmowanych elektronow w procesie tworzenia wiązania chemicznego. -wart.>0: elektr. oddawane, powstają kationy - wart.<0: elektr. przyjmowane, powstają aniony
Promień jonu: - ujemnego: jest większy od promienia(R) atomu macierzystego
- dodatniego: jest znacznie mniejszy od R atomu.
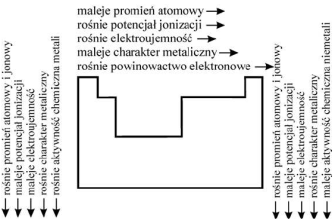
W obrębie okresu - promienie atomow zmniejszają się ze wzrostem liczby atomowej. Wiąze się to ze wzrostem liczby protonow w jądrze.
• W obrębie grup - promienie atomow wzrastają wraz ze wzrostem liczb atomowych.
Promieniotwórczość naturalna- polega na samorzutnym rozpadzie jąder atomowych w wyniku czego powstają jądra lżejsze a procesowi towarzyszy wydzielanie cząstek alfa, beta i promieniowanie gama. 42alfa(zasada zachowania nukleonów), 01beta(zasada zachowania ładunku), 11p, 10n.
Czas połowicznego rozpadu- czas, po którym połowa początkowej liczby jąder ulega rozpadowi.
Równanie Schroedingera- Prawdopodobieństwo (przypadające na jednostkę czasu) wykrycia
cząstki w małej objętości wokoł danego punktu w fali materii jest proporcjonalne do natęzenia fali: P(x, y, z) ~ |ψ(x, y, z)|^2, Jest to tzw. gęstość prawdopodobieństwa (dP/dv)
Energia jonizacji - jest to energia potrzebna do oderwania elektronu najsłabiej związanego z atomem i przeniesienia go poza sferę oddziaływania atomu. Oderwanie kolejnych elektronow wymaga większej energii.
Elektroujemność jest miarą skłonności atomu do przyciągania e. podczas tworzenia wiązania chem.
• Pierwiastki elektroujemne - w reakcjach chem. przyłączają elektrony lub tworzą jony ujemne
• Pierwiastki elektrododatnie - w reakcjach chemicznych oddają elektrony lub tworzą jony +
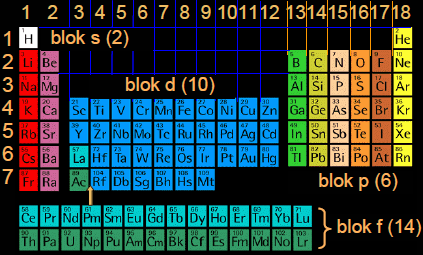
Pierwiastki z bloku s i p - elektroujemność w grupach ↓ w okresach ↑
1
WIAZANIA CHEM., BUDOWA CZAST.
Typy wiązań:
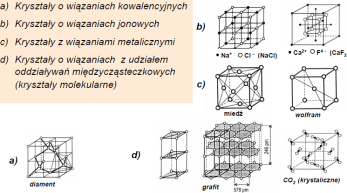
- wiązania kowalencyjne (atomowe) -uwspolnienie e. walencyjnych sąsiadujących atomow
- wiązana jonowe - przeniesienie e. walencyjnych od jednego rodzaju atomow do drugiego
-metaliczne - uwspolnienie części elektronow walencyjnych bardzo wielu atomow
Elektronowa teoria wiązań Levis'a (1916):
Kazdy atom dązy do takiej zmiany zewnętrznej
powłoki elektronowej, aby uzyskać najtrwalszą
konfigurację, tzn. minimum energii. Trwałe
konfiguracje to: s2, s2p6, s2p6d10.Teoria ta dotyczy wiązań kowalencyjnych jak i jonowych.
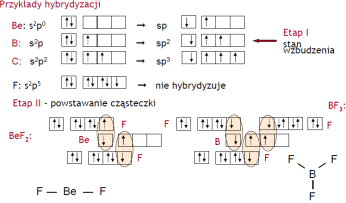
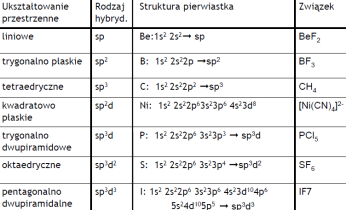
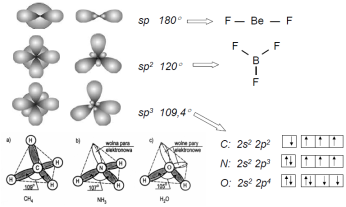
Reguła maksymalnej odległości - przestrzenie orbitalne orbitali shybrydyzowanych są tak rozmieszczone, aby odległości między nimi były jak największe.
Hybrydyzacja orbitali:
•atomy podczas łączenia się w cząsteczki dąŜą do ujednolicenia orbitali elektronowych ostatniej powłoki, •orbitale shybrydyzowane są rozne od orbitali s, p, d, •w powstałej cząsteczce wszystkie orbitale są rownocenne, są one kombinacją liniową funkcji falowych s2, p6,d10, nazywane są orbitalami molekularnymi.
Wiązanie czysto kowalencyjne- wystepuje miedzy atomami tego samego pierwiastka. Wiązania kowalencyjne to wiązania silne i krótkie.
W wyniku osiowego nałozenia się orbitali
atomowych tworzących orbitel molekularny powstają wiązania typu σ (sigma). W wyniku bocznego nakładania się orbitali atomowych powstają wiązania typu π (pi).
Energia wiązania - jest to energia niezbędna do rozerwania wiązania między atomami tworzącymi cząsteczkę. Długość wiązania - odległość między jądrami związanych atomow.
Moment dipolowy (wektor skierowany od „-” do „+” dipola): μ =|q | . d gdzie q- ładunek jednego bieguna, d- odległość biegunow, Moment dipolowy układu atomow tworzących wiązanie - moment dipolowy grupy. Moment dipolowy cząsteczki - wypadkowa momentow grupowych. Cząsteczki polarne: CO, HF, H2O, NH3 (μ≠0),
Cząsteczki niepolarne: - homojądrowe H2, N2, Cl2 (μ=0), niehomojadr:- CH4, CO2, BF3 (Σ μ=0)
Wiązanie donorowo-akceptorowe(kordynacyjne) powstaje wtedy, gdy wiąząca para elektronowa pochodzi od jednego z at. Donor - at. ktory dostarcza wolną parę elektronową, Akceptor -at. ktory przyjmuje parę elektronową na wolny orbital.
Wiązania kowalencyjnel właściwości:
•powstają między atomami o duzej elektroujemności (blok p) •mają charakter kierunkowy •mogą występować w dowolnym stanie skupienia: gazy (H2, N2, O2, NH3) ciecze (H2O, CH3OH, H3PO4, HNO3) ciała stałe (kryształy kowalencyjne: Si, SiO2, GaAs, SiC, kryształy molekularne: lód, cukier, CO2 zestalony)
•tworzą wiązania pojedyncze i wielokrotne •energia wiązania i długość wiązania zaleŜą od krotności wiązania. -róznica elektroujemności tworzących je atomów. Gdy róznica elektroujemności jest < 0,4 - wiązania kowalencyjne, 1,4 - 1,7 - kowalencyjne spolaryzowane, > 1,7 - wiązania jonowe.
Wiązanie jonowe jest wynikiem maksymalnej polaryzacji wiązania kowalencyjnego. Polega ono na przeniesieniu elektronu od atomu mniej elektroujemnego do atomu bardziej elektroujemn.
• występuje tylko w związkach chemicznych, nigdy miedzy atomami tego samego pierwiastka
• tworzą je atomy o duzej roznicy elektroujemności
Wiązania metaliczne występują miedzy atomami metali tworzących sieć krystaliczną, a więc w ciele stałym. Dotyczą duzej liczby pierwiastkow(85%)
• zjonizowane dodatnio atomy metali (kationy) tworzą gęsto upakowaną sieć krystaliczną
• uwolnione przy jonizacji elektrony walencyjne są zdelokalizowane, tworząc tzw. gaz elektronowy
• wiązania metalicznego są wynikiem rownowagi dwoch sił: elektrostatycznego oddziaływania „+” jonow metalu z „chmurą elektronową” i sił odpychania między jednoimiennymi jonami w sieci.
• nie są kierunkowe;dobre przewodn. ciepła i prądu
Siły van der Waalsa- słabe oddziaływania elektrostatyczne miedzy atomami lub cząst., nie mają charakteru wiązania chemicznego
-mają wpływ na stan skupienia materii (topnienie, wrzenie, kondensacja, krystalizacja gazow CO2, N2, skraplanie gazow szlachetnych)
• są odpowiedzialne za adsorpcję fizyczną
• ujawniają się szczegolnie w niskiej temperaturze
• są bardzo słabe, 4-40kJ/mol
• źrodłem wiązania jest trwały lub indukowany moment dipolowy cząsteczek lub fluktuacje ładunku w atomach(cząsteczkach) obojętnych
Siły dyspersyjne: występują między atomami lub cząsteczkami, ktore nie mają trwałych momentow dipolowych Polegają na wzajemnym przyciąganiu się dipoli szybkozmiennych
Siły indukcyjne: występują w układzie dipol cząsteczka obojętna. Wskutek indukcji powstaje oddziaływanie dipol - dipol indukowany.
Siły orientacji: oddziaływania dipoldipol
(woda, amoniak, skroplony HCl).
Wiązanie wodorowe powstaje między atomem wodoru związanym z atomem o duzej elektroujem., a atomem posiadającym wolne pary elektronowe Wskutek tych wiązań w wodzie powstają grupy cząst. wody(asocjaty), złozone średnio z 6 cząst. wody, połączonych tzw. mostkami wodorowymi.

3
ELEMENTY KRYSTALOGRAFII
Ciało stałe-struktura, w której atomy(jony, cząst.) zajmują stałe, określone miejsce w przestrzeni (w przeciwieństwie do gazów i cieczy). Układ taki cechuje się stabilnością kształtu, poniewaz min. energii osiąga przy trwałym połączeniu wszystkich elementów struktury wiązaniami chemicznymi.
W zalezności od uporządkowania struktury wewnętrznej dzielimy je na:
-ciała krystaliczne - wykazują przestrzenne uporządkowanie dalekiego zasięgu,
tworzą sieć krystaliczną: (monokrysztaly lub polikrysztaly),
-ciała bezpostaciowe(amorficzne)- brak uporządkowania dalekiego zasięgu
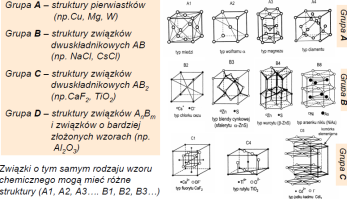
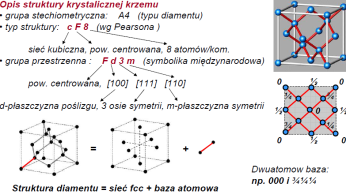
Sieć krystaliczna to regularny i periodyczny układ punktów (węzłów) w przestrzeni.
Struktura krystaliczna=sieć przestrzenna+baza
Sieć translacyjna zdefiniowana jest przez podstawowe wektory translacji sieci pozwalające opisać połozenie dowolnego węzła poprzezwektor
Komórka elementarna (prosta lub złozona) to minimalny obszar mający pełną symetrię sieci, którym mozna wypełnić przestrzeń dokonując translacji. Sieć przestrzenna to nieskończony zbiór takich komórek, ułozonych równolegle wzgl. siebie.
Kom. elementarna+baza = kom.krystaliczna
Sieć przestrzenna+kom.kryst.=struktura kryst.
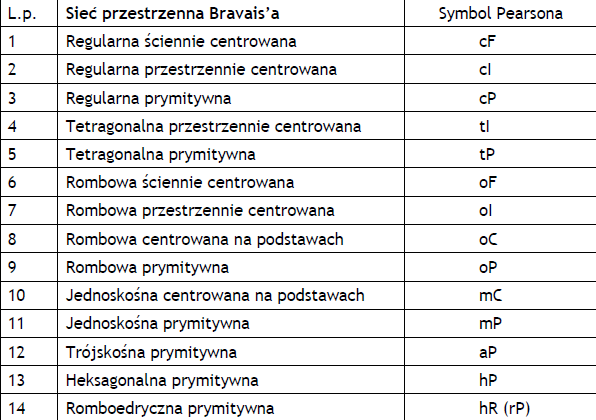
Sieci Bravais'ego definiuja 7 podstawowych układów krystalograficznych(wyk.3. str. 13).
Defekt - zaburzenie idealnego stanu sieci krystalicznej. Przyczyny: 1. Zakłócenia energetyczne - fale sieciowe, zalezą od temp. (A=10-11pm) 2. Zaburzenia struktury kryształu
- defekt Frankla - przesunięcie jonu (zwykle
kationu, jest mały) w pozycję międzywęzłową
- defekt Schottky'ego -występowanie luk
kationowych i anionowych jednocześnie.
Autodyfuzja-ruch atomow-głównych skład. Sieci
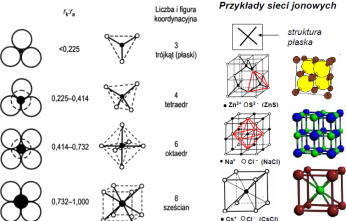
Energia sieci - jest to energia, jak należy doprowadzić do jednego mola substancji krystalicznej, by rozłozyć ją na jony oddalone od siebie nieskończenie daleko, czyli poza strefę ich wzajemnych oddziaływań Dla prostych związków jonowych, przy uwzględnieniu jedynie elektrostat. oddziaływania jonów dodatnich i ujemnych, mozna zapisać uproszczony wzór: U0 = B*(Zk*Za)/(rk+ra), gdzie: Zk, Za - ładunek kationu i anionu rk, ra - promień jonowy kationu i anionu
Kryształy metaliczne charakteryzują się bardzo duzym wypełnieniem przestrzeni przez jony tworzące sieć krystaliczną, duza gęstością upakowania i duzą liczbą koordynacyjną, maja
plastycznosc, sztywność, metaliczny połysk, zdolność do tworzenia stopów i roztworów stałych.
Właściwości kryształów jonowych:
•duza energia wiązania powoduje, ze kryształy są twarde, mają wysoką temperaturę topnienia
•brak swobodnych elektronów sprawia, ze są złymi przewodnikami prądu i ciepła •wiązania nie wykazują kierunkowości, zapełnione zewnętrzne powłoki elektronowe przypominają gazy szlachetne
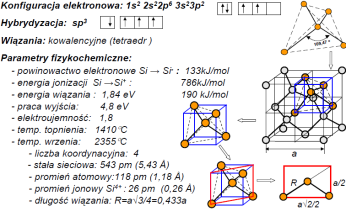
Kryształy kowalencyjne zbudowane są z atomów o duzej elektroujemności. Charakteryzuje je:
•duza energia wiązań a więc duza twardość, odporność termiczna i mechaniczna •kierunkowość wiązań,brak podatności na odkształcenia,kruchość •przewodnictwo typowe dla półprzewodnikow
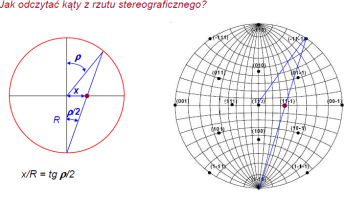
Siatka Wulffa - to zespół równolezników i południków zrzutowanych z powierzchni sfery na pł. rzutu stereograficznego, pozwalających określić kąty między płaszczyznami.
Prawo pasowe Weisa: kazda płaszczyzna nalezy przynajmniej do dwóch pasów
Klasyfikacja półprzewodników:
• półprzewodniki pierwiastkowe • związki półprzewodnikowe • kryształy mieszane
Anizotropia to zalezność właściwości od orientacji krystalograficznej. Wykazują ją następujące właściwości krzemu:
•szybkość trawienia (szczególnie w roztworach zasadowych) •szybkość wzrostu kryształu •współczynnik dyfuzji domieszek •stała segregacji domieszek •szybkość utleniania termicznego •szybkość osadzania warstw epitaksjalnych •zasięg jonów implantowanych •twardość •wytrzymałość na łamanie •moduł sprężystości
Metody wyznaczania szybkości trawienia Si:
•bezpośrednie pomiary głębokości i czasu trawienia •na podstawie podtrawienia maski
•metodą koła wagonowego •metodą trawienia sfery
Szybkość trawienia zalezy od:
• składu roztworu i temp. • rodzaju i szybkości mieszania • dodatków modyfikujących trawienie
2
KRZEM:
4
Wyszukiwarka
Podobne podstrony:
im wersja 1.1, Studia - Mechatronika PWR, Chemia (Irena Zubel)
odpowiedzi -zarządzanie, Studia - Mechatronika PWR, Podstawy zarządzania - wykład (Teresa Maszczak)
odpowiedzi test maszczak (14.01.2013), Studia - Mechatronika PWR, Podstawy zarządzania - wykład (Ter
sciaga wyklad ZPiU, Studia - Mechatronika PWR, Podstawy zarządzania - wykład (Teresa Maszczak)
pp test zima 05 air boratynski, Studia - Mechatronika PWR, Elementy i układy elektroniczne (Bogusław
Podstawy zarzadzania notatki, Studia - Mechatronika PWR, Podstawy zarządzania - wykład (Teresa Maszc
60-pytan-z-zarzadzania, Studia - Mechatronika PWR, Podstawy zarządzania - wykład (Teresa Maszczak)
zadania zestaw 1, Studia - Mechatronika PWR, Podstawy zarządzania - wykład (Teresa Maszczak)
automatyka sciaga na exam(1), Studia - Mechatronika PWR, Podstawy automatyki - wykład (Mirosław Łuko
Strona tytulowa sprawozdania, Studia - Mechatronika PWR, Metrologia elektryczna - laboratorium (Doro
zarzadzanie zaliczenie ost, Studia - Mechatronika PWR, Podstawy zarządzania - wykład (Teresa Maszcza
cw 02 a old, Studia - Mechatronika PWR, Metrologia elektryczna - laboratorium (Dorota Kołakowska)
PA pytania, Studia - Mechatronika PWR, Podstawy automatyki - wykład (Mirosław Łukowicz)
odpowiedzi -zarządzanie, Studia - Mechatronika PWR, Podstawy zarządzania - wykład (Teresa Maszczak)
definicjechem, studia Budwownictwo PWR, b semestr 1, chemia
grupa8, studia Budwownictwo PWR, b semestr 1, chemia
13 Strategia personalna, Studia Zarządzanie PWR, Zarządzanie PWR I Stopień, V Semestr, Zarządzanie p
więcej podobnych podstron