
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
13
3. Sieci metaliczne
Metale mają budowę krystaliczną.
W węzłach sieciowych występują rdzenie atomowe;
są one dodatnio naładowane.
W przestrzeniach międzywęzłowych tych sieci istnieją
swobodne, nie związane z pojedynczymi atomami,
elektrony (elektrony walencyjne).
Cechy wspólne metali:
- dobre przewodnictwo elektryczne,
- dobre przewodnictwo cieplne,
- połysk metaliczny,
- plastyczność,
- niskie ciepło właściwe.
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
14
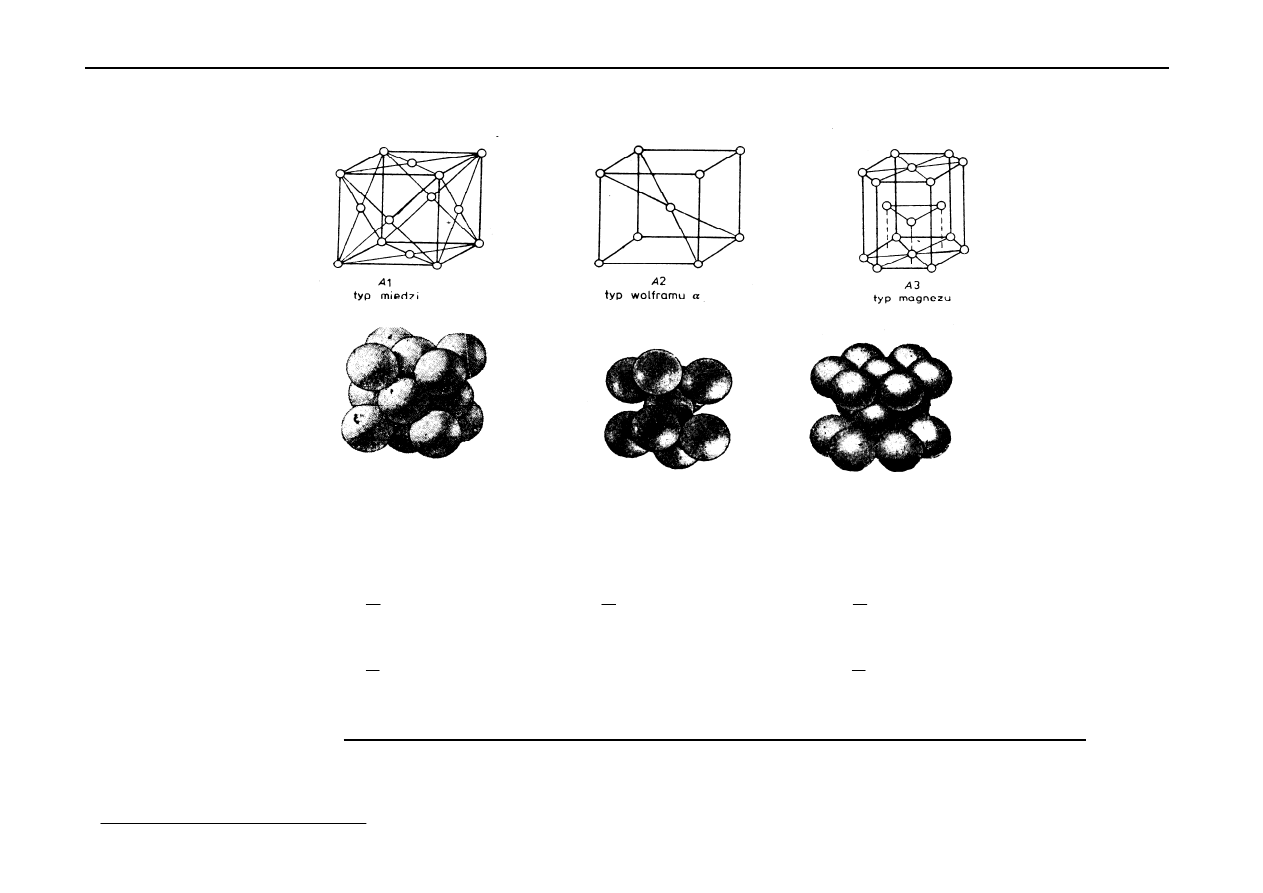
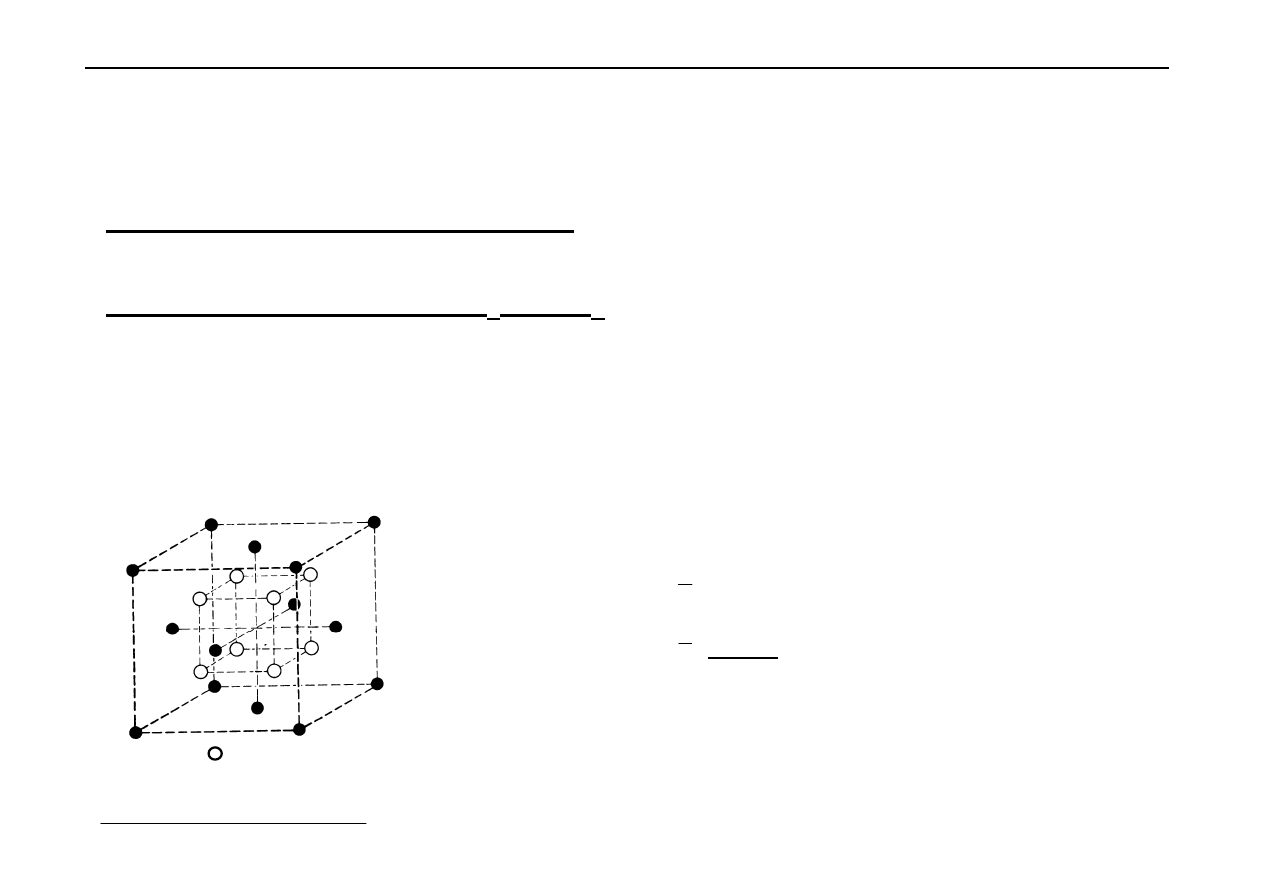
Metale krystalizują w jednej z 3 typów sieci, tj.:
A
1
A
2
A
3
Sieci te są bardzo gęsto upakowane.
Najbardziej zapełnione komórki sieciowe można osiągnąć na
dwa sposoby:
- regularne najgęstsze upakowanie (A
1
),
- heksagonalne najgęstsze upakowanie (A
3
).
Jak to osiągnąć?
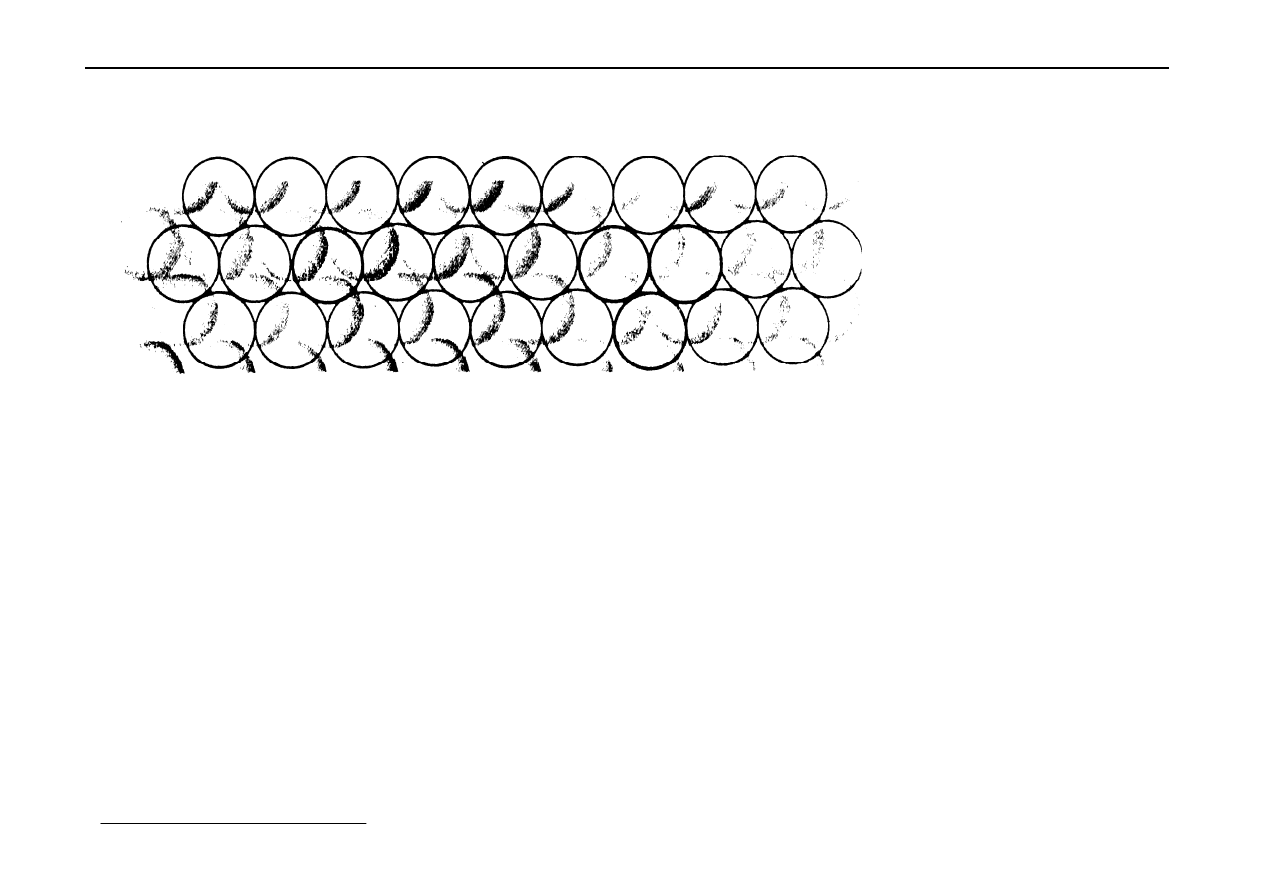
1
o
Umieścić kulę na powierzchni
2
o
Utoczyć ją 6-ma takimi samymi kulami
3
o
Teraz utwórzmy 2-gą warstwę 7 kul, tak aby je
"zagnieździć" w stosunku do pierwszej warstwy (warstwa b)
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
15
Mamy więc ułożenie typu ab
4
o
Trzecią warstwę można ułożyć na dwa sposoby:
a) ta warstwa jest tak samo ułożona jak warstwa a
→
→
→
→
ułożenie ababab....
→
→
→
→
jest prześwit
→
→
→
→
komórka typu A
3
b) warstwa trzecia nie jest ani nad a ani nad b.
Jest to warstwa c
→
→
→
→
ułożenie abcabc....
→
→
→
→
nie ma prześwitu
→
→
→
→
komórka typu A
1
Stopień upakowania w obu typach sieci jest taki sam i wynosi 74 %
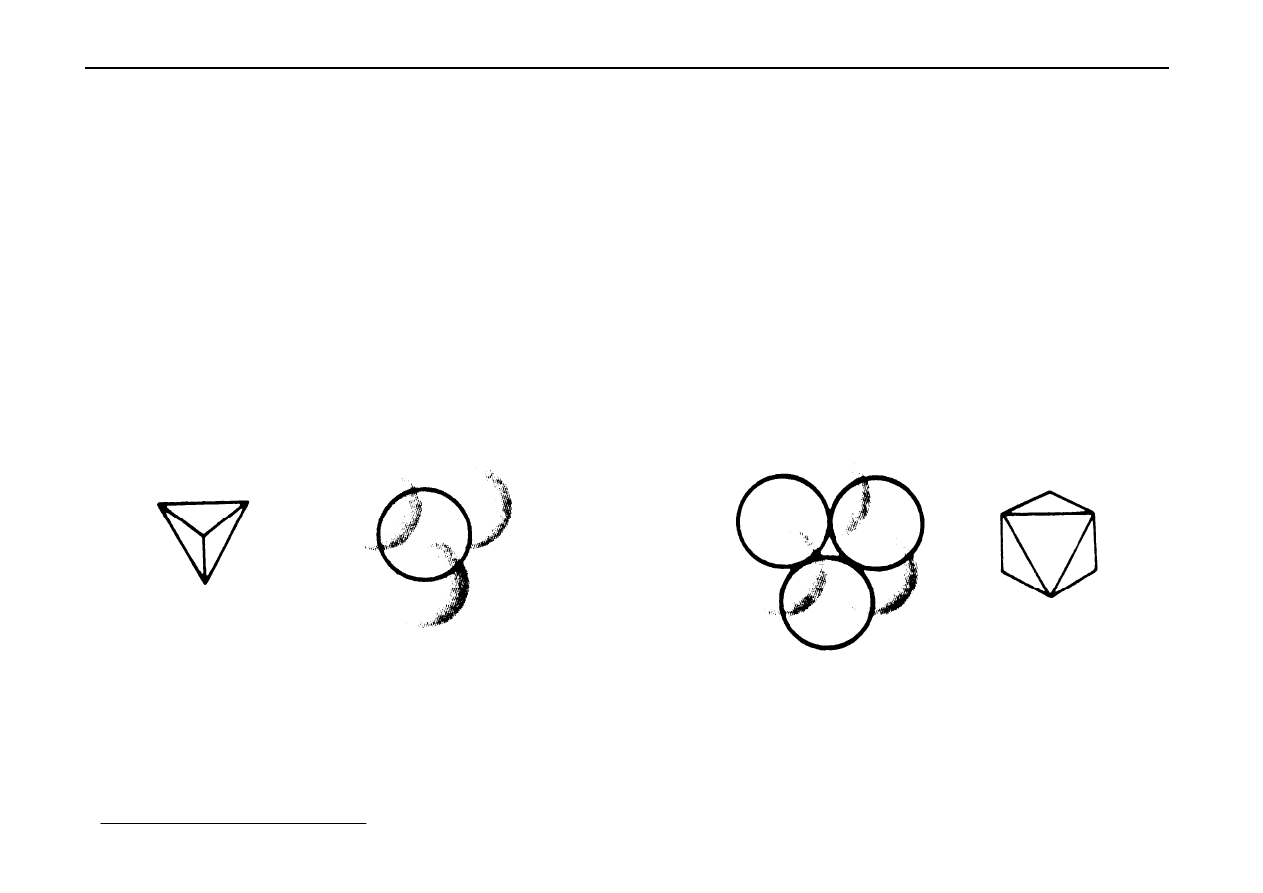
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
16
Luki w przestrzeniach międzywęzłowych dla sieci typu A
1
i A
3
:
- tetraedryczne r = 0,21 r
kuli
2N – luk,
- oktaedryczne r = 0,41 r
kuli
N – luk.
N - liczba kul,
r
kuli
– promień zrębu atomowego
r – promień kuli.
Trzeci typ sieci (A
2
) jest mniej upakowany - 68 %
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
17
Pokażmy te 3 komórki elementarne:
Liczba koord.:
12
8
12
liczba atomów
8 x
1
8
= 1
8 x
1
8
= 1
12 x
1
6
= 2
w kom. elem. :
6 x
1
2
= 3
1 x 1 = 1
2 x
1
2
= 1
3 x 1 = 3
ΣΣΣΣ
= 4
ΣΣΣΣ
= 2
ΣΣΣΣ
= 6
6 : 3 = 2

Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
18
A
1
- sieć regularna zewnętrznie centrowana
Cu, Ag, Ca, Sr, Pd, Ir, Pt,
γγγγ
-Fe,
ββββ
-Co,
ββββ
-Ni
A
2
- sieć regularna wewnętrznie centrowana
αααα
-W, V, Nb, Ta, Mo,
αααα
-Fe
A
3
- sieć heksagonalna
Mg, Zn, Cd, Ti, Zr,
αααα
-Co
Znając parametry komórki elementarnej, np. stałą sieciową
(a), można obliczyć promień tego atomu metalu (rdzenia
atomowego).
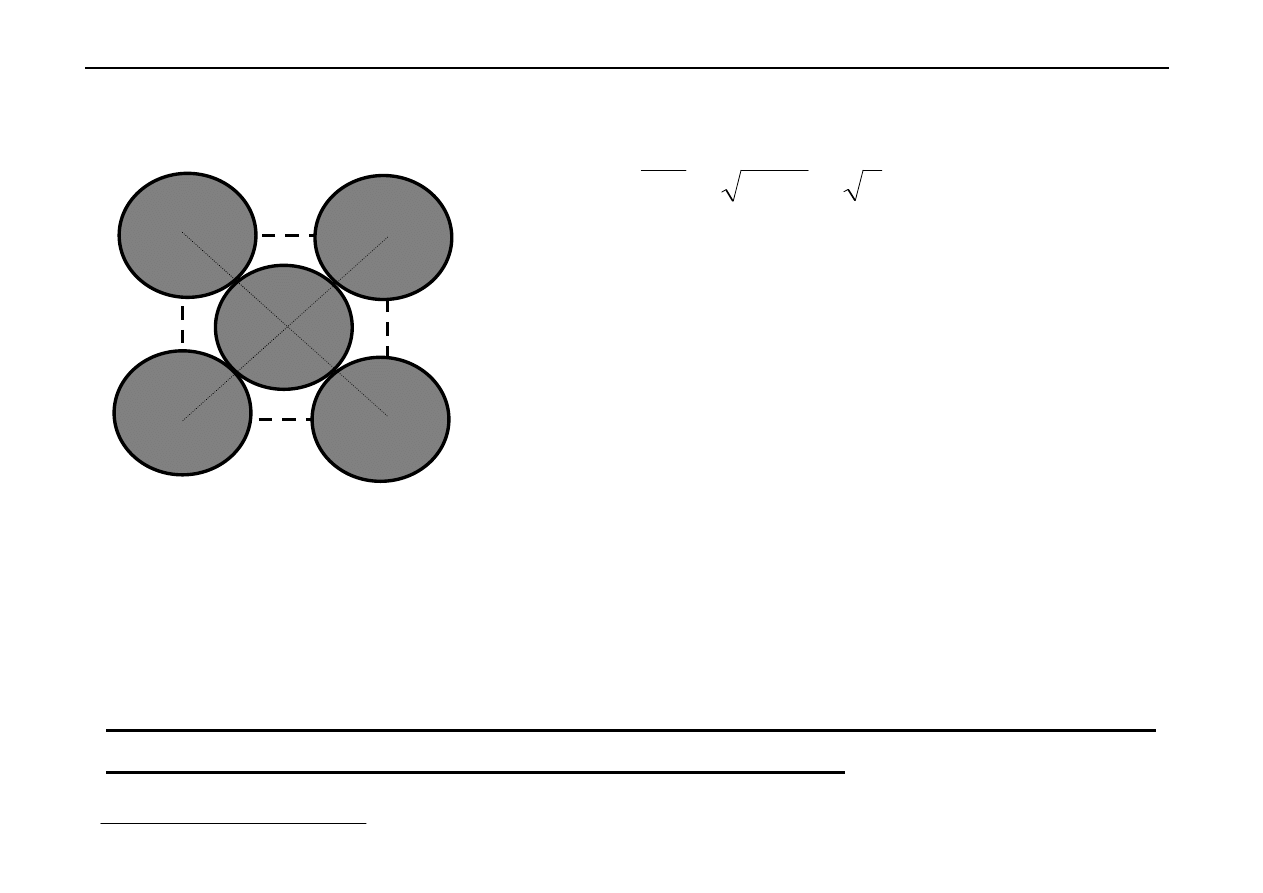
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
19
Dla sieci typu A
1
w przypadku miedzi mamy a = 362 pm.
Komórka elementarna złota (też A
1
) ma a = 407 pm.
Obliczyć promień atomu złota.
Metoda badania struktury kryształów - rentgenografia -
prześwietlanie promieniami rentgenowskimi
B
A
C
pm
128
r
pm
512
r
4
pm
512
pm
362
2
AC
2
AB
====
====
====
⋅⋅⋅⋅
====
====

Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
20
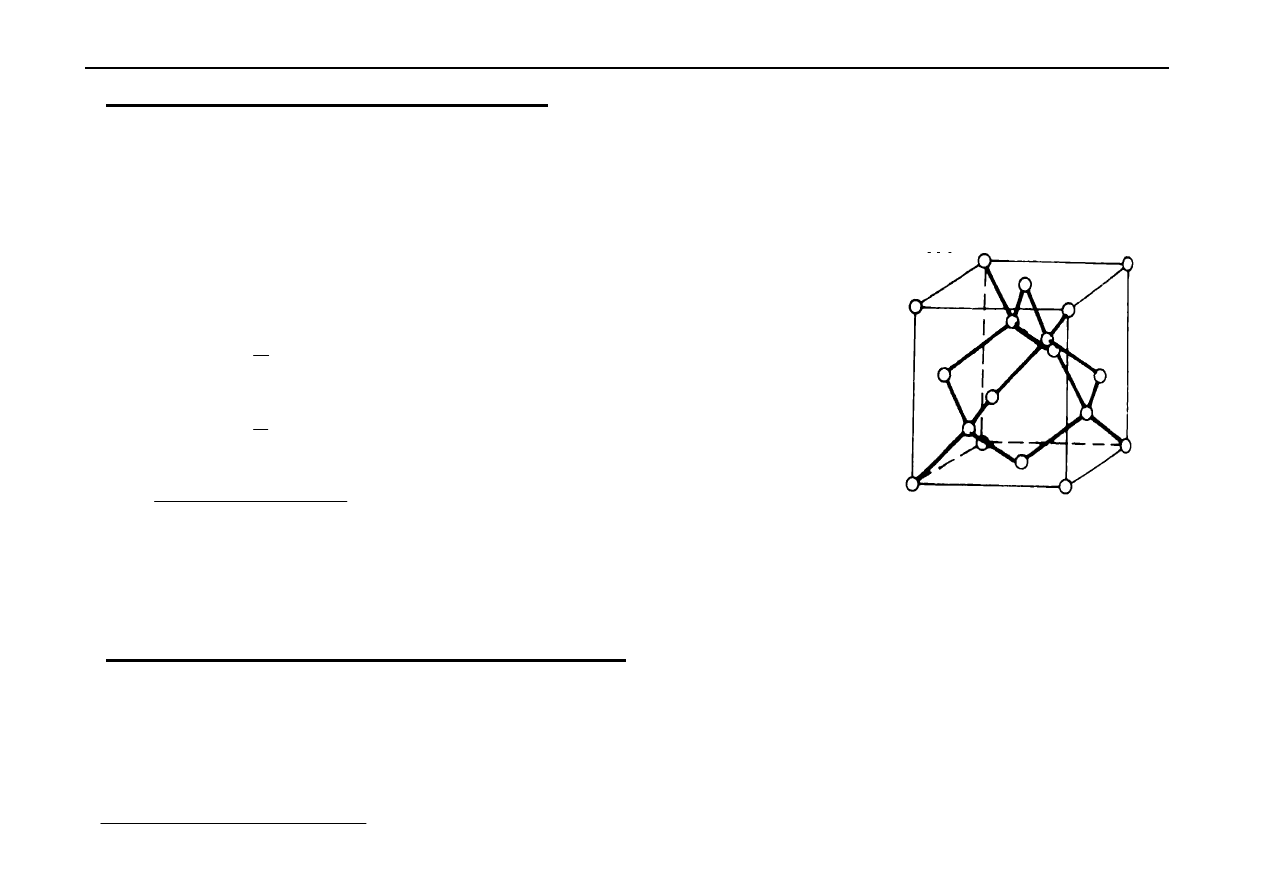
4. Sieci kowalencyjne (atomowe)
Sieć typu - A
4
(sieć diamentu)
Sieć w której krystalizuje diament - sieć regularna
zewnętrznie centrowana z dodatkowymi atomami węgla, które
są na przemian w środku co drugiej kostki (komórkę dzielimy
na 8 równych kostek).
W komórce jest 8 luk tetraedrycznych i połowę z nich
zajmują atomy węgla a druga połowa jest pusta.
Atomy
te
są
silnie
powiązane
tzw.
wiązaniami
kowalencyjnymi.
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
21
Tutaj w węzłach są atomy a nie zręby atomowe - nie ma więc
swobodnych elektronów - jest do dielektryk (słabo przewodzi
prąd elektryczny).
Liczba koordynacyjna - 4 (hybrydyzacja typu sp
3
)
Liczba atomów w komórce elementarnej:
8 x
1
8
= 1
6 x
1
2
= 3
4 x 1 = 4
ΣΣΣΣ
8 atomów C
Przykłady sieci typu diamentu: Si, Ge,
αααα
-Sn
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
22
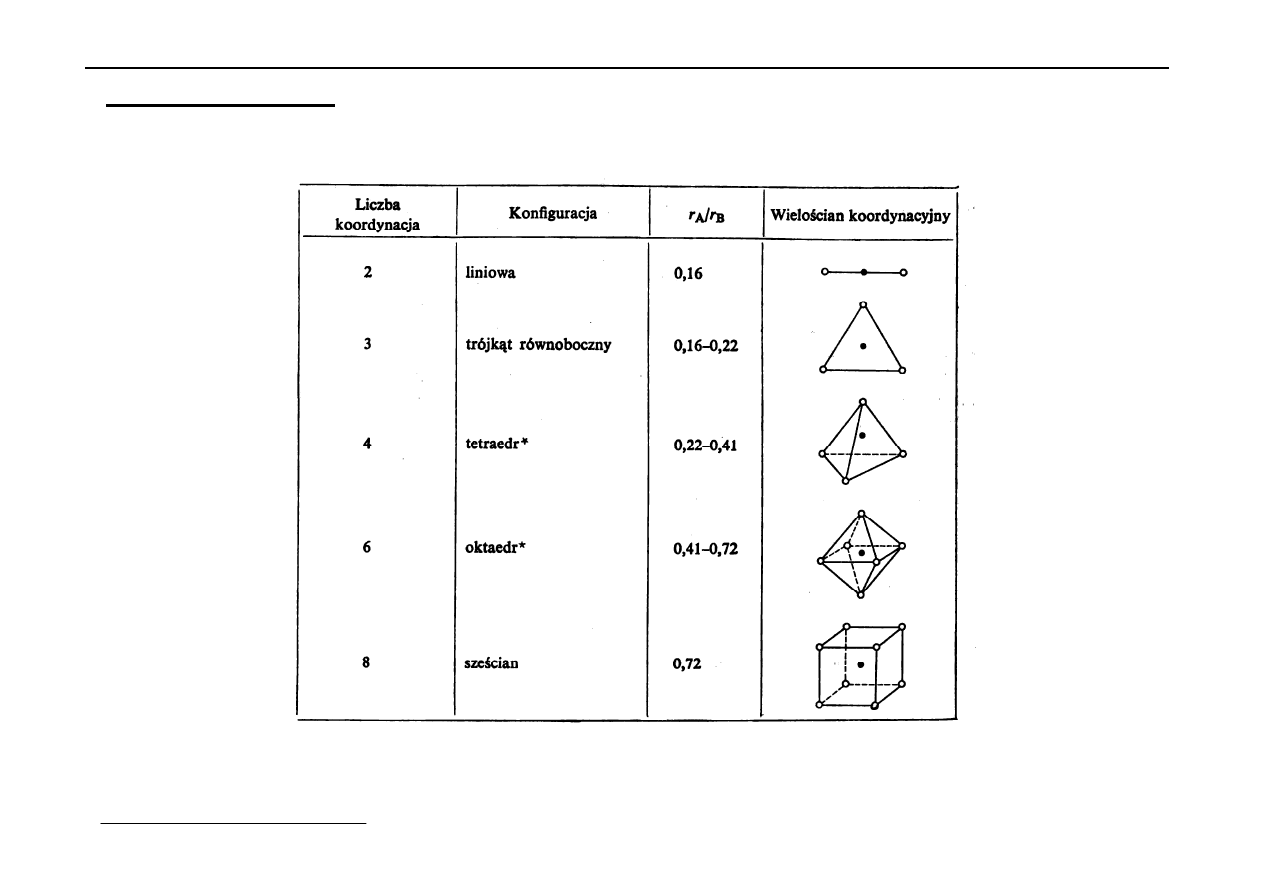
5. Sieci jonowe
W węzłach sieciowych są dodatnie i ujemne jony,
tj. kationy i aniony.
Trwałość zawdzięczają siłom elektrostatycznym,
tj. siłom Coulomba.
Zasada ułożenia jonów w sieci - zapewnić minimum energii
→
→
→
→
każdy jon dąży do największej liczby koordynacji.
Tutaj nie można osiągnąć liczby koordynacji 12 lecz liczby
mniejsze to jest: od 8 do 3.
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
23
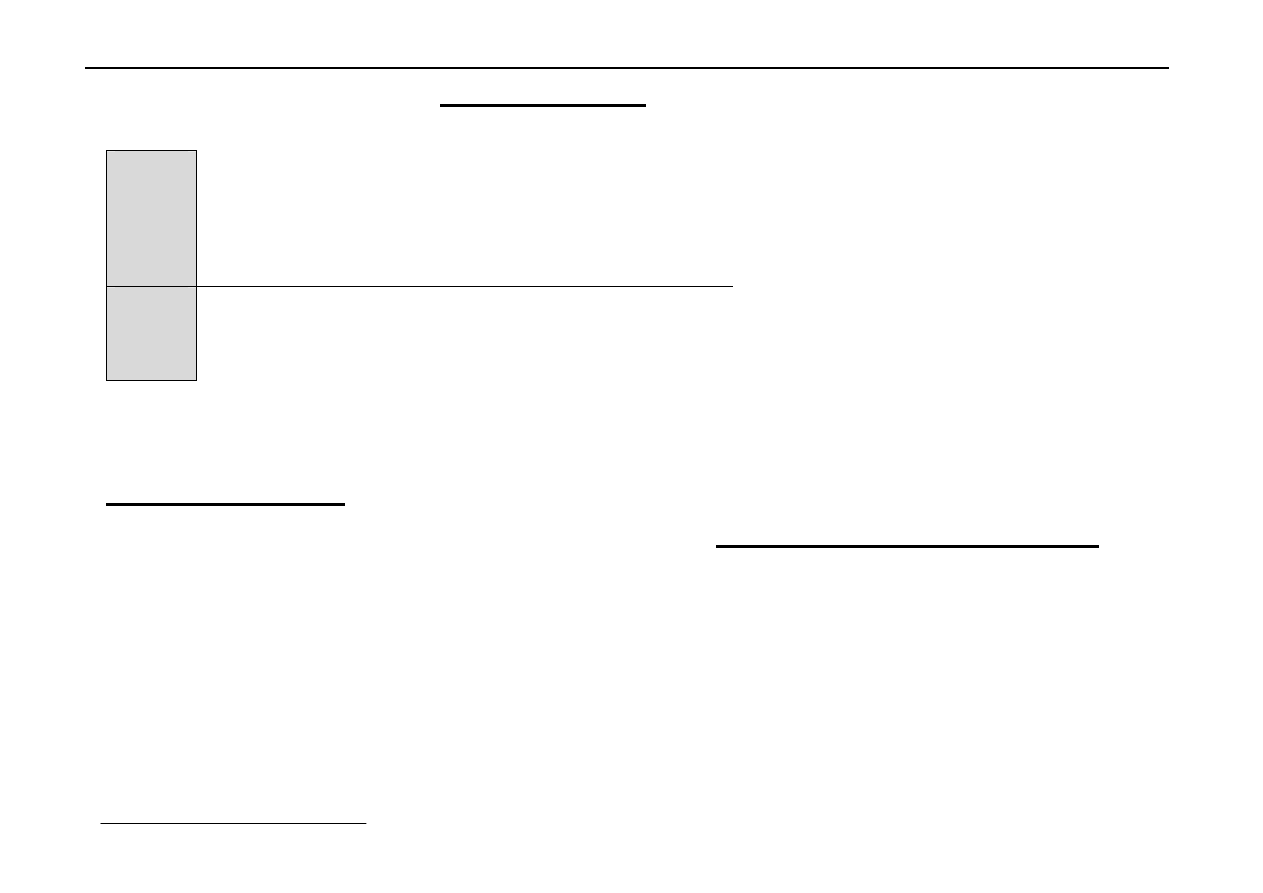
Wg. Magnusa liczba koordynacyjna kationu jest tym większa
im stosunek r
k
/r
A
jest bliższy jedności.
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
24
Najbardziej typowe sieci jonowe:
AB
NaCl
→
→
→
→
B
1
CsCl
→
→
→
→
B
2
αααα
-ZnS (blenda cynkowa)
→
→
→
→
B
3
AB
2
CaF
2
→
→
→
→
C
1
TiO
2
→
→
→
→
C
4
Sieć typu NaCl - regularna zewnętrznie centrowana
Wyprowadzić można z sieci A
1
→
→
→
→
w lukach oktaedrycznych tej
sieci złożonej z anionów Cl
-
są kationy Na
+
. Są to więc dwie
sieci typu A
1
zbudowane z różnych indywiduów, tj. Na
+
i Cl
-
.
{
{
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
25
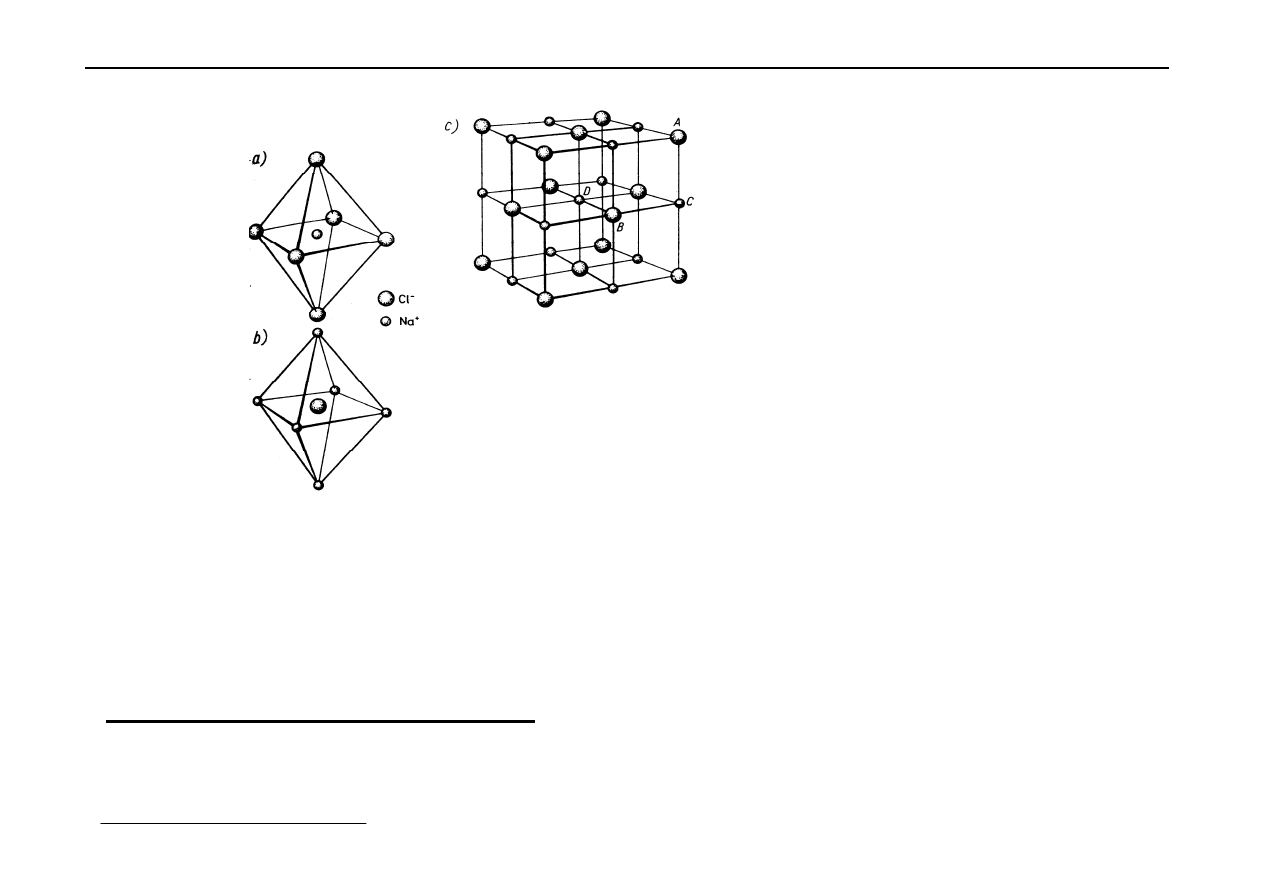
a)
koordynacja kationów Na
+
,
b)
koordynacja anionów Cl
-
,
c)
wycinek sieci przestrzennej – komórka elementarna.
Przykłady sieci typu NaCl: AgCl, AgBr, PbS
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
26
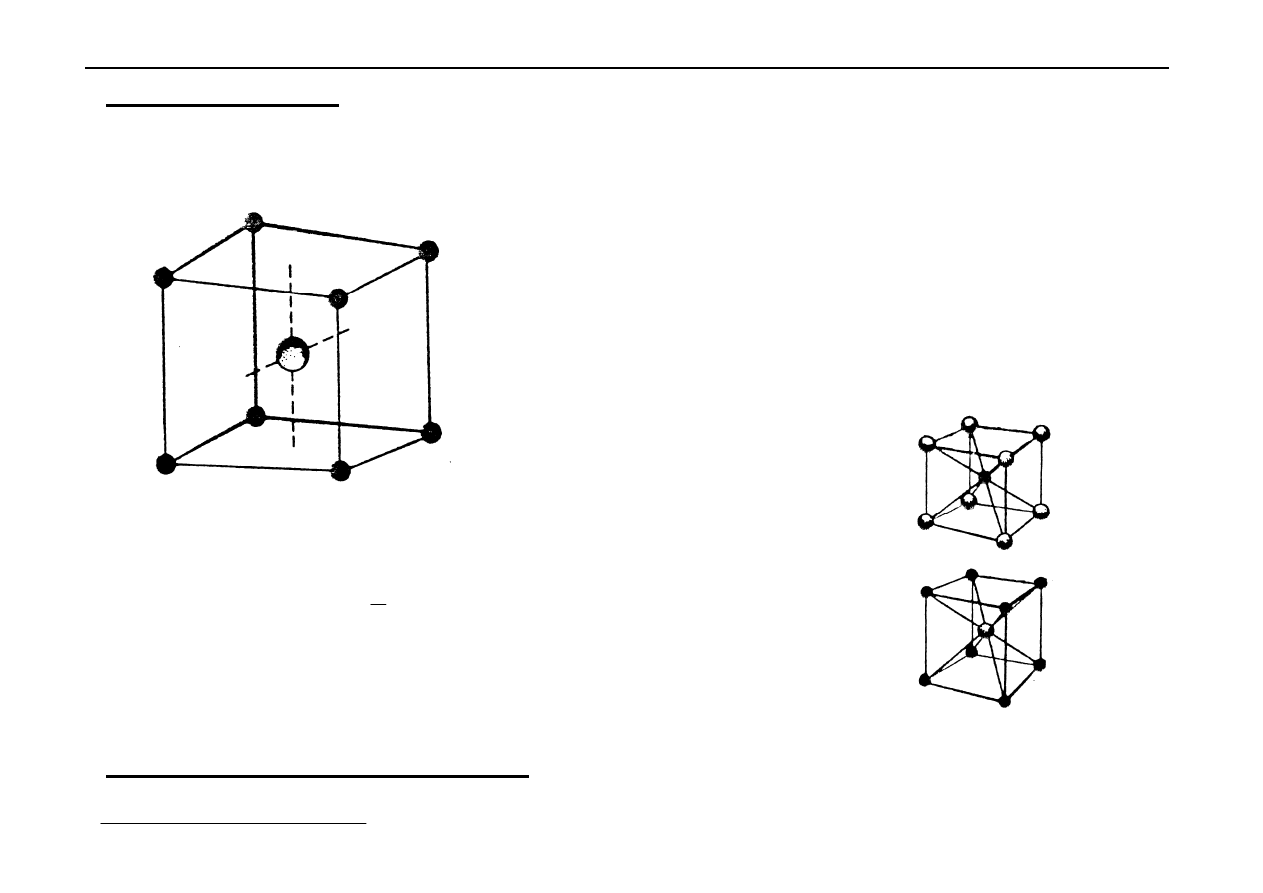
Sieć typu CsCl - regularna wewnętrznie centrowana.
Można ją wyprowadzić z sieci A
2
→
→
→
→
w środku komórki jest
kation Cs
+
, a w narożach aniony Cl
-
(może być odwrotnie).
Liczba jonów w komórce elementarnej :
kationy Cs
+
1 x 1 = 1
aniony Cl
-
8 x
1
8
= 1
Liczby koordynacji:
Cs
+
→
→
→
→
8 Cl
-
→
→
→
→
8
Przykłady sieci typu CsCl: TlCl, NH
4
Cl, NH
4
Br
Ta sieć przestaje być
wewnętrznie centrowana
→
→
→
→
powstają 2 komórki
prymitywne przesunięte
względem siebie.
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
27
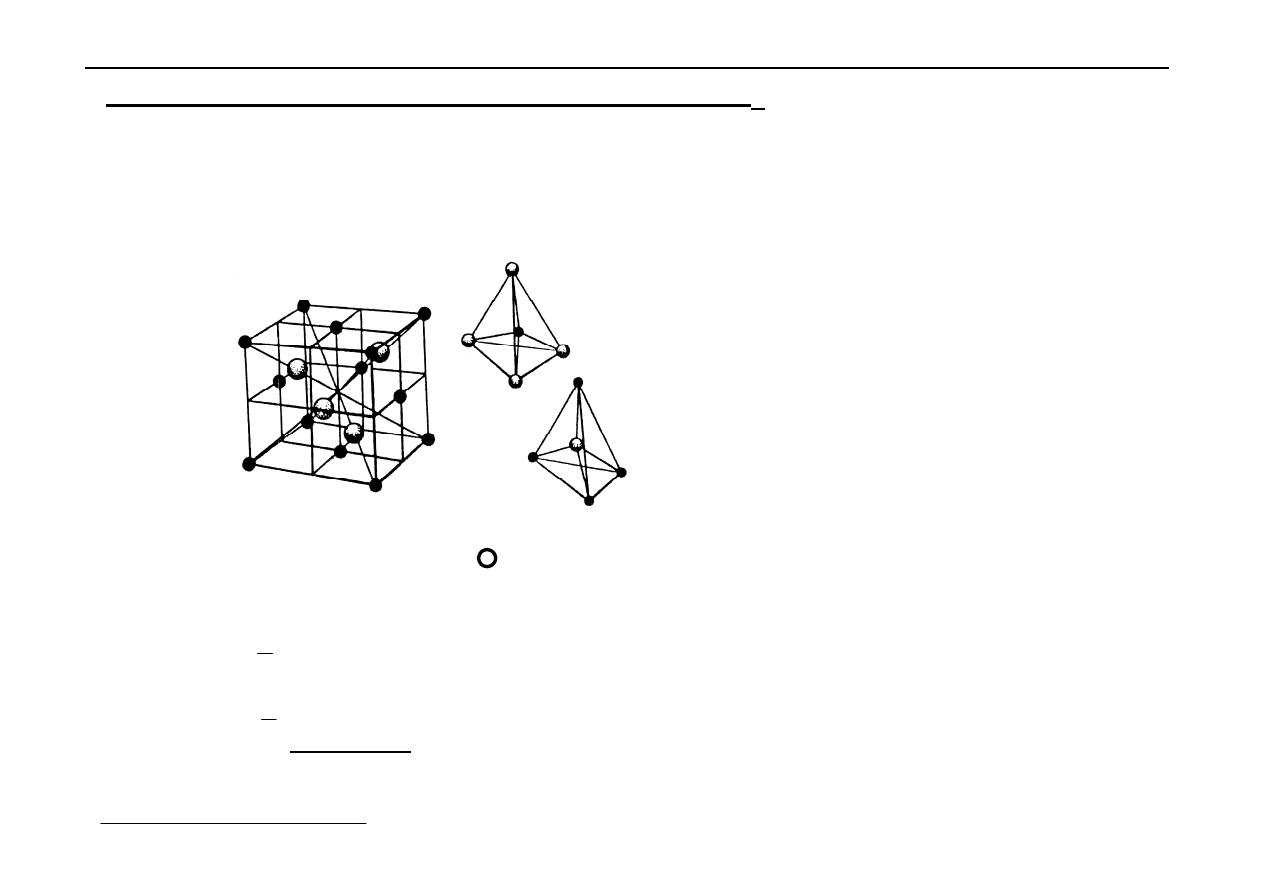
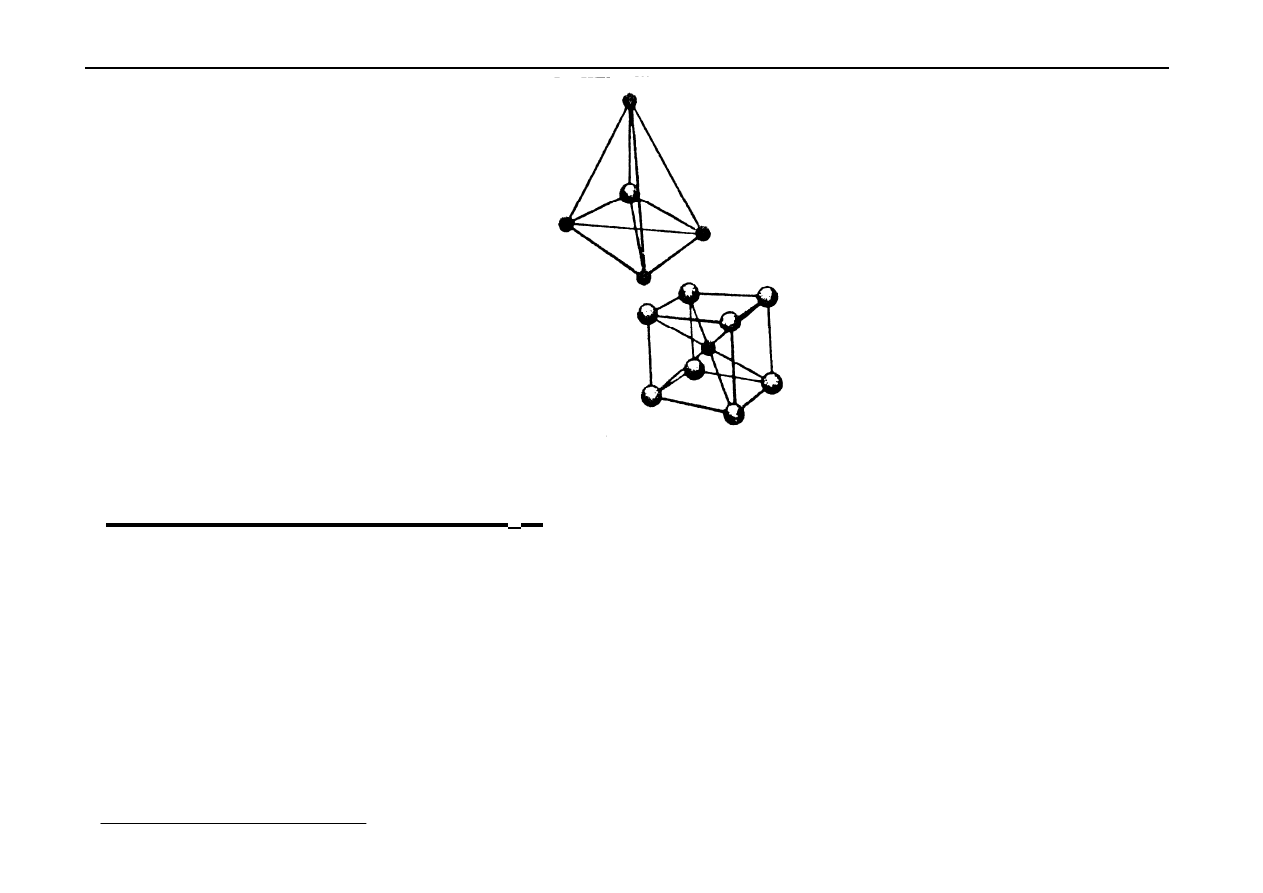
Sieć typu
αααα
-ZnS (blendy cynkowej) - B
3
Jest to sieć typu diamentu. W komórce regularnej zewnętrznie
centrowanej złożonej z kationów Zn
2+
są 4 aniony S
2-
w środkach co drugiej
1
/
8
części komórki.
••••
Zn
2+
, S
2-
Liczebność komórki:
Zn
2+
→
→
→
→
8 x
1
8
= 1
S
2-
→
→
→
→
4 x 1 = 4
6 x
1
2
= 3
4
⇐
⇐
⇐
⇐
liczba koordynacji
Zn
2+
→
→
→
→
4
⇐
⇐
⇐
⇐
liczba koordynacji
S
2-
→
→
→
→
4
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
28
Jest to sieć tworzona gdy różnica elektroujemności anionu
i kationu jest niewielka
→
→
→
→
oprócz wiązania jonowego jest
pewien procent wiązania kowalencyjnego
Przykłady sieci typu
αααα
-ZnS : CuCl, CuBr, AgI, HgS, ZnSe, HgSe
Sieć typu fluorytu (CaF
2
) - C
1
Tą sieć można wyprowadzić z sieci A
1
. W tej sieci naroża
i środki ścian są wypełnione kationami Ca
2+
. Wszystkie luki
tetraderyczne w sieci są zapełnione anionami F
-
.
F
-
→
→
→
→
8 x 1 = 8
••••
Ca
2+
F
-
Liczebność komórki:
Ca
2+
→
→
→
→
8 x
1
8
= 1
6 x
1
2
= 3
4
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
29
Liczby koordynacji:
4 dla F
-
⇒
⇒
⇒
⇒
8 dla Ca
2+
⇒
⇒
⇒
⇒
Przykłady sieci typu CaF
2
: SrF
2
, BaF
2
, PbF
2
, LiO
2
Może też wystąpić sieć odwrotna, tj. kationy będą na miejscu
anionów, a aniony na miejscu kationów - jest to struktura
antyfluorytu.
Przykłady takiej sieci: Li
2
S, Na
2
S, Cu
2
S
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
30
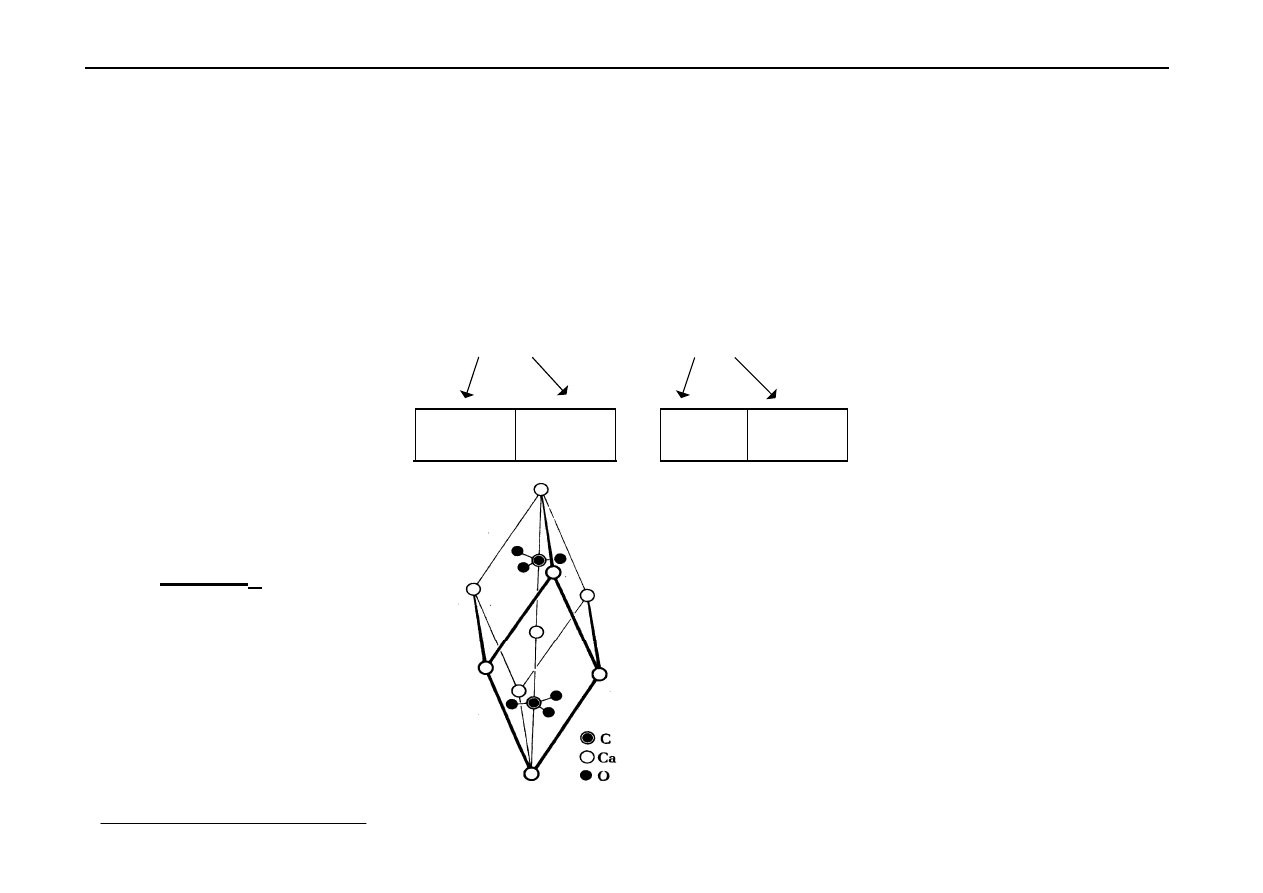
5. Inne sieci jonowe (struktury bardziej złożone)
a) sole kwasów tlenowych zawierają w sieci:
- kationy metali,
- aniony kwasów tlenowych.
CaCO
3
KNO
3
Ca
2+
CO
3
2-
K
+
NO
3
-
-
CaCO
3
:

Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
31
b) związki kompleksowe:
K
2
PtCl
6
[Ni(NH
3
)
6
]Cl
2
↓↓↓↓
↓↓↓↓
K
+
PtCl
6
2-
[Ni(NH
3
)
6
]
2+
Cl
-
struktura oktaedryczna
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
32
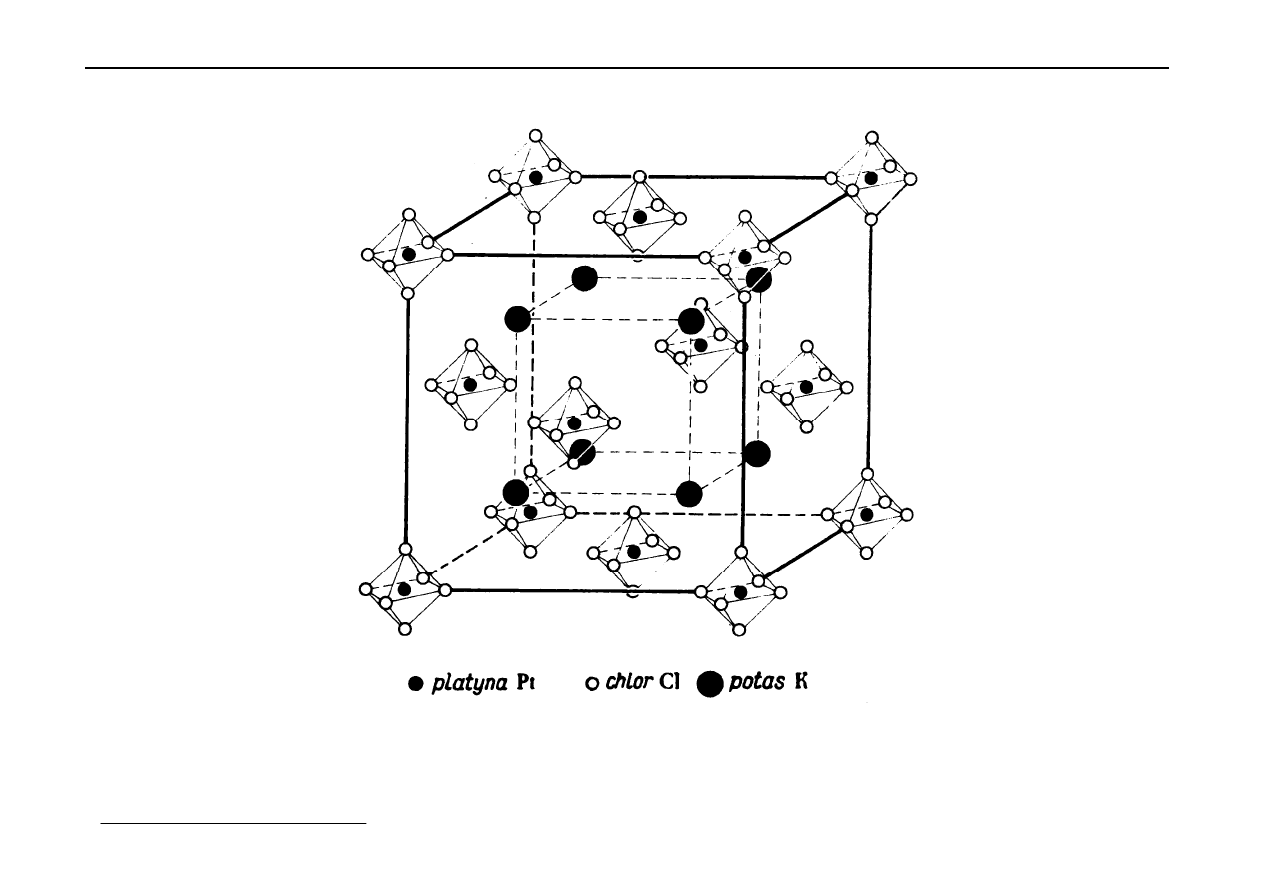
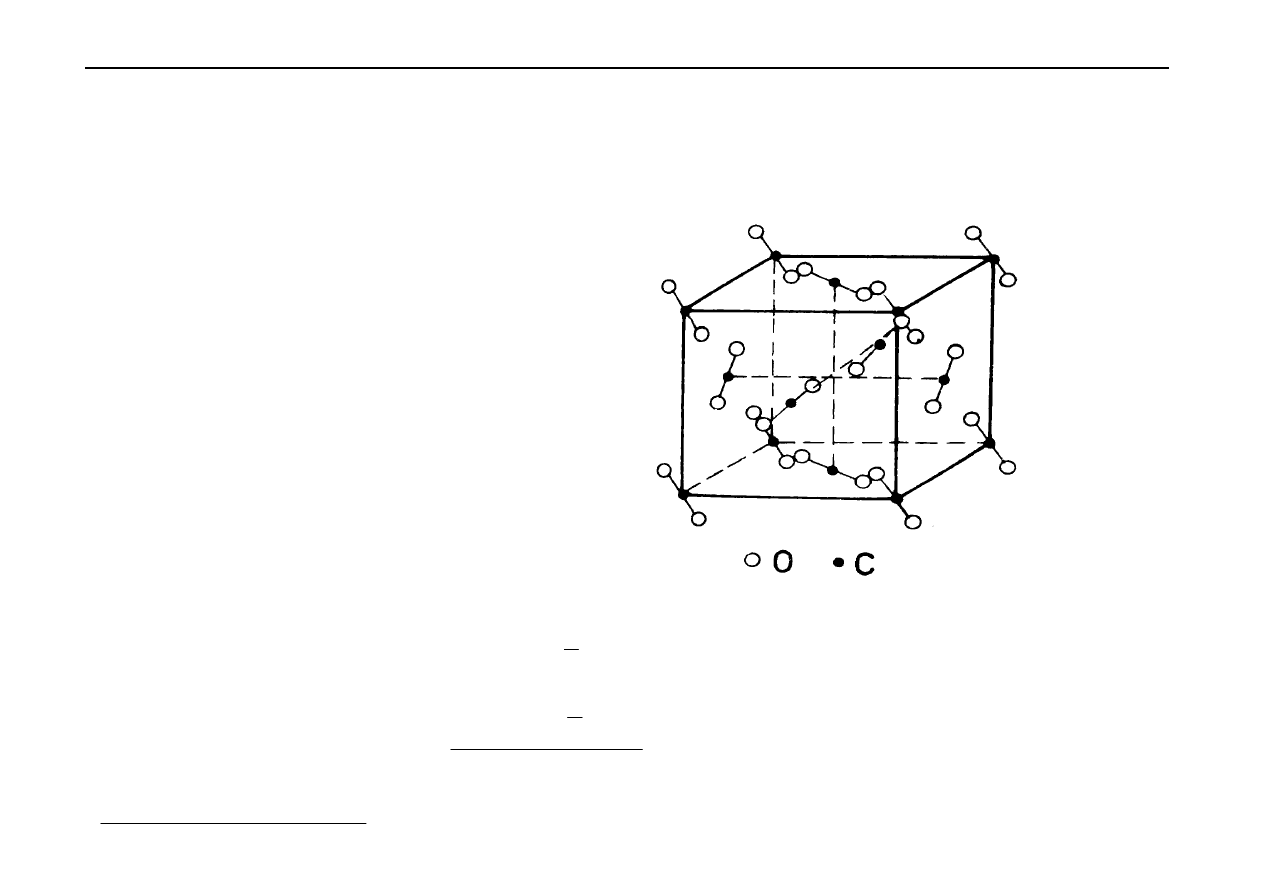
Na rysunku poniżej przedstawiono komórkę elementarną K
2
PtCl
6
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
33
Uwaga: Oprócz soli bezwodnych (np. NaCl, CaF
2
) mamy
jeszcze hydraty (wodziany), na przykład CuSO
4
·5H
2
O (5-cio
wodny siarczan miedzi).
6. Sieci molekularne (cząsteczkowe)
W węzłach sieciowych występują cząsteczki.
Przykładem sieci cząsteczkowej jest sieć stałego chloru,
jodu, azotu, wodoru czy tlenu. Cząsteczki X
2
(X = Cl, Br, N, H,
O). W węzłach sieciowych mogą też występować cząsteczki
wieloatomowe, np.: P
4
, S
8
, B
12
lub C
60
.
Również
gazy
szlachetne
krystalizują
w
sieciach
molekularnych z tym, że w węzłach są pojedyncze atomy.
Wreszcie w sieciach molekularnych występują takie związki
nieorganiczne jak dwutlenek węgla, amoniak czy woda.
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
34
Tutaj w węzłach są cząsteczki, a oddziaływania między nimi
to słabe oddziaływania typu van der Waalsa lub wiązania
wodorowe.
Struktura
krystaliczna
stałego CO
2
- sieć typu A
1
Cząsteczki CO
2
występują:
a) w narożach sześcianu
1
=
8
1
x
8
b) w środkach ścian
3
2
1
x
6
====
Razem 4 cz. CO
2

Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
35
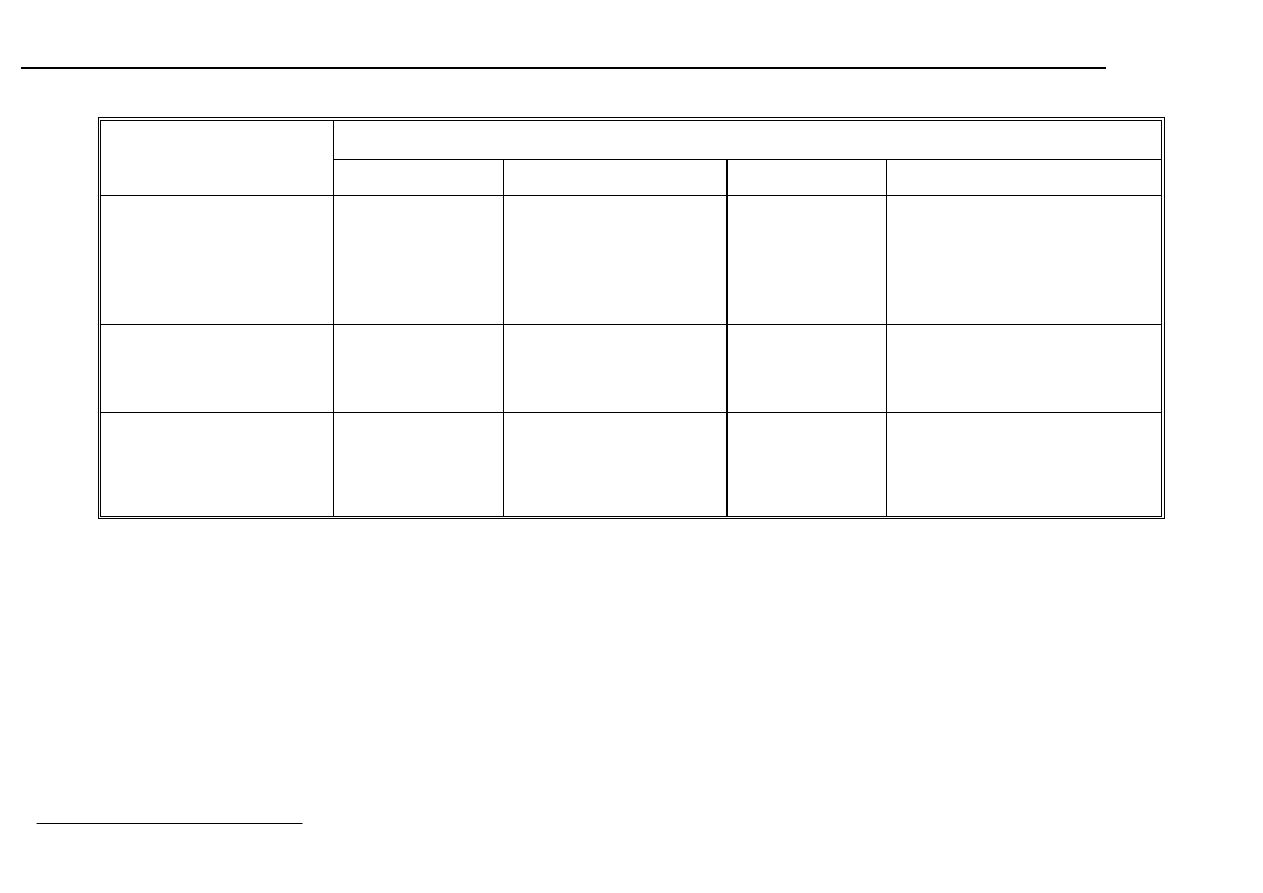
7. Zestawienie typów sieci
Właściwości fizykochemiczne kryształów a rodzaj sieci
Kryształy
molekularne
kowalencyjne
jonowe
metaliczne
Jednostki
cząsteczki
atomy
kationy
i aniony
dodatkowo
naładowane
rdzenie atomowe
i swobodne elektrony
Siły wiążące
Van der
Waalsa
wiązania
kowalencyjne
wiązania
jonowe
oddz. rdzeni
atomowych
z elektronami
Energia
sieciowa,
kJ/mol
He: 2,5
CO
2
: 23,5
H
2
O: 53,5
C (diament): 710
SiO
2
: 1720
NaCl: 770
CaF
2
: 2610
W: 840
Na: 105
Wytrzymałość
mechaniczna
i twardość
mała,
miękkie
duża,
twarde
duża
zazwyczaj duża,
ciągliwe
Temperatura
topnienia
niska
wysoka
wysoka
zmienia się
w szerokich
granicach
Współczynnik
rozszerzalności
cieplnej
duży
mały
mały
duży
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wykład 4B. Budowa ciała stałego
36
Właściwości fizykochemiczne kryształów a rodzaj sieci – cd.
Kryształy
molekularne
kowalencyjne
jonowe
metaliczne
Przewodnictwo
elektryczne w
stanie stałym
małe
(izolatory)
bardzo małe
nie
przewodzą
prądu
w stanie
stałym
(x)
duże
Przewodnictwo
w stanie
stopionym
bardzo
małe
bardzo małe
duże
duże
Przykłady
helowce,
H
2
, O
2
, N
2
,
I
2
, P
4
, C
60
,
CO
2
, H
2
O
C (diament),
Si,
αααα
-Sn, SiC,
SiO
2
NaCl,
CsCl,
KNO
3
,
Na
2
SO
4
Cu, Ag, Au,
W, Mo, Mg
(x)
Przewodzą prąd elektryczny po roztworzeniu w rozpuszczalnikach polarnych,
np. w wodzie.
Wyszukiwarka
Podobne podstrony:
4 Budowa ciala stalego id 3714 Nieznany
Budowa ciała stałego
04b BUDOWA CIALA STALEGOid 53 Nieznany (2)
wykład 8 budowa ciała stałego
WYK-4c.Budowa ciala stalego
Budowa ciała stałego 3
4. Budowa ciala stałego, pwr biotechnologia(I stopień), II semestr, Chemia nieorganiczna, Wykłady Ap
Budowa ciała stałego 2
4 Budowa ciala stalego id 3714 Nieznany
28 Zjawiska towarzyszące bombardowaniu ciała stałego elektro
II 14 Fizyka ciala stalego
Ciżman, fizyka ciała stałego L, sprawozdanie dwójłomność spontaniczna
bryja, fizyka ciała stałego, Równanie kp
więcej podobnych podstron