
Fosfolipidy inozytolowe
w przetwarzaniu
informacji w komórkach
Maja Stokłosa
Agnieszka Szczesna
Gr. 9

Fosfolipidy inozytolowe
Fosfolipidy są to lipidy złożone zawierające kwas
ortofosforowy w postaci mono- lub diestru
Szczególnym rodzajem fosfolipidów są fosfolipidy
inozytolowe. Są to estry glicerolu z kwasami tłuszczowymi
(np.kw.arachidonowy i kw.stearynowy),zawierającymi reszty
kw.fosforowego ( PO32-) oraz inozytol
Inozytol (I)to sześciowodorotlenowy alkohol występujący w
różnych postaciach izomerycznych
Fosfolipidy inozytolowe biorą udział w przekazywaniu
informacji w komórce jako wtórne przekaźniki
Zlokalizowane są po wewnętrznej stronie błony komórkowej
Są to małe komponenty które stanowią mniej niż 10%
fosfolipidów w błonach komórkowych ssaków
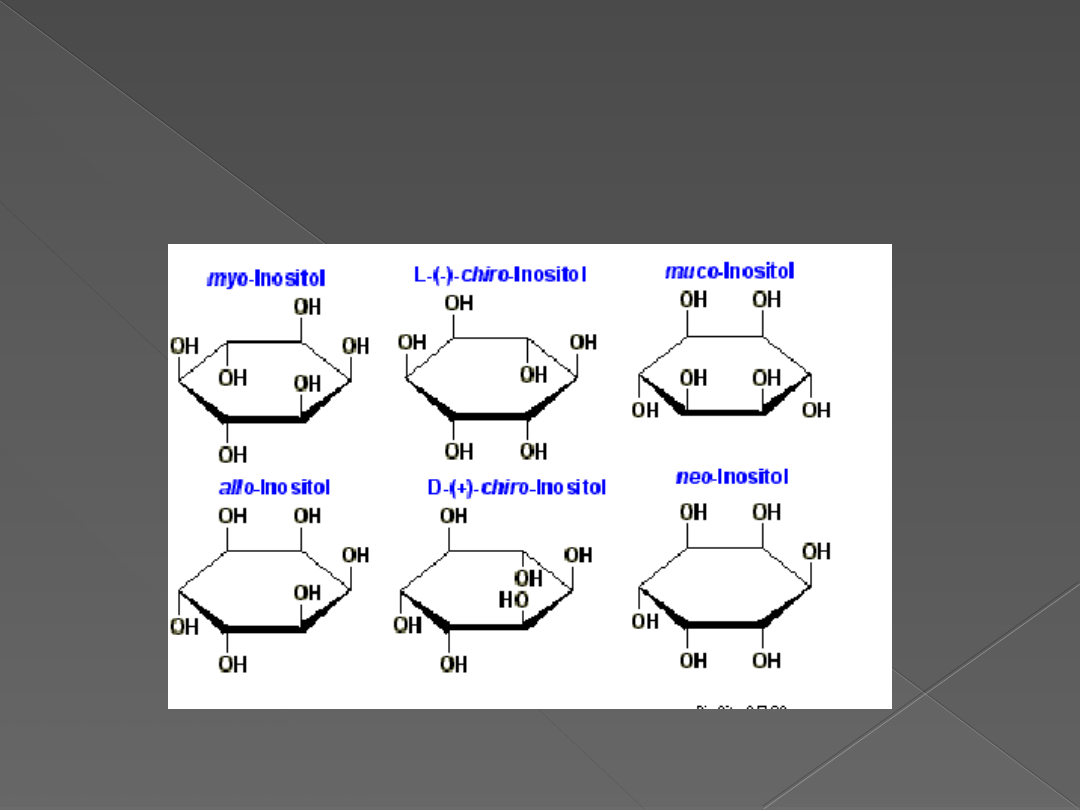
Inozytol
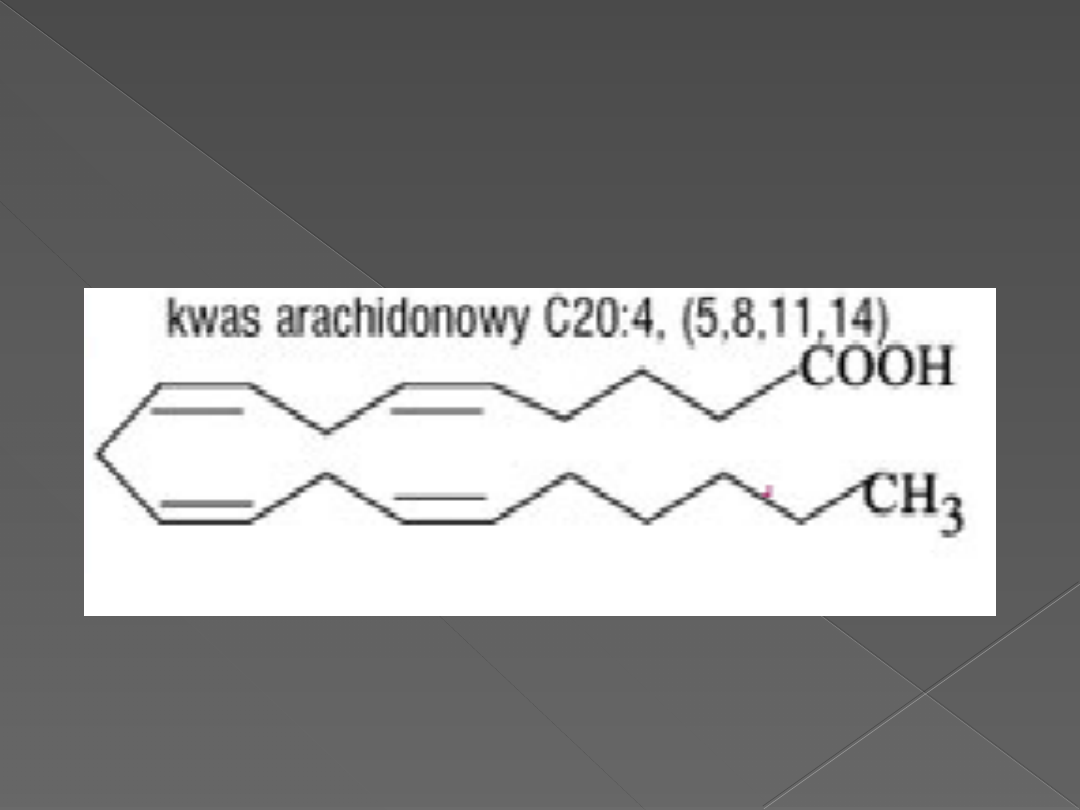
Kwas arachidonowy
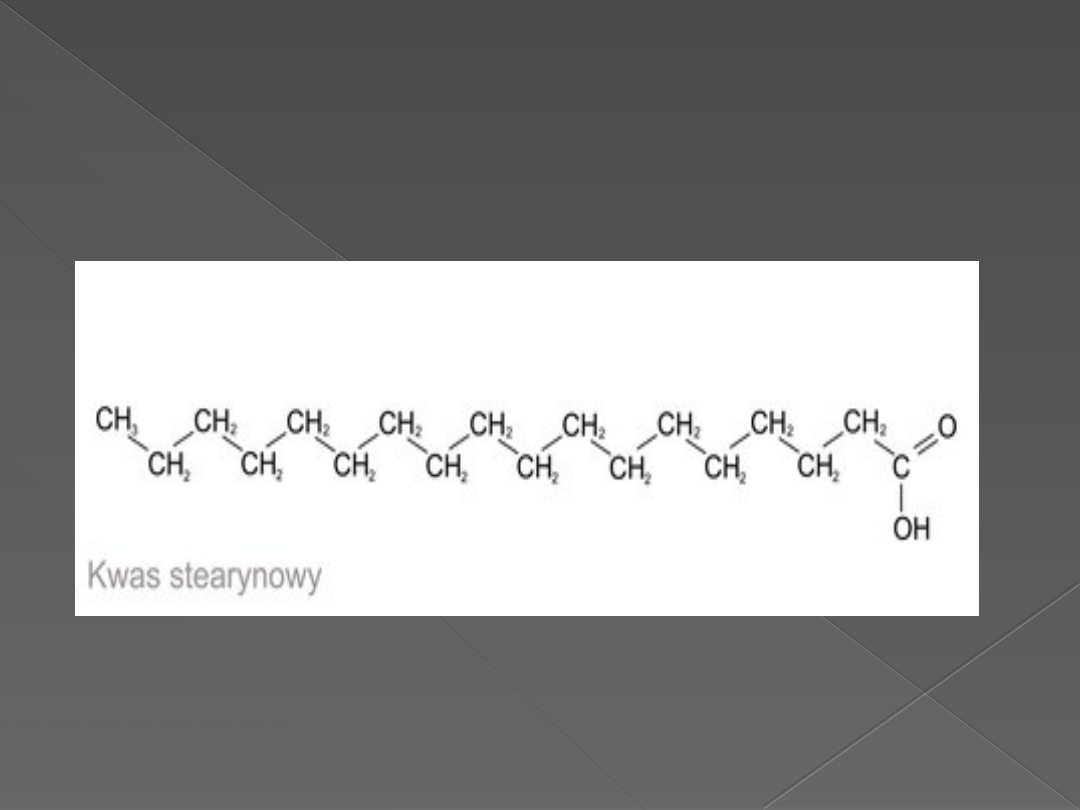
Kwas stearynowy

Fosfolipidy inozytolowe
Występują w trzech formach różniących
się ufosforylowaniem:
Fosfatydyloinozytol - PI
Fosfatydyloinozytolo-4-fosforan – PIP
Fosfatydyloinozytolo-4,5-bifosforan –
PIP2
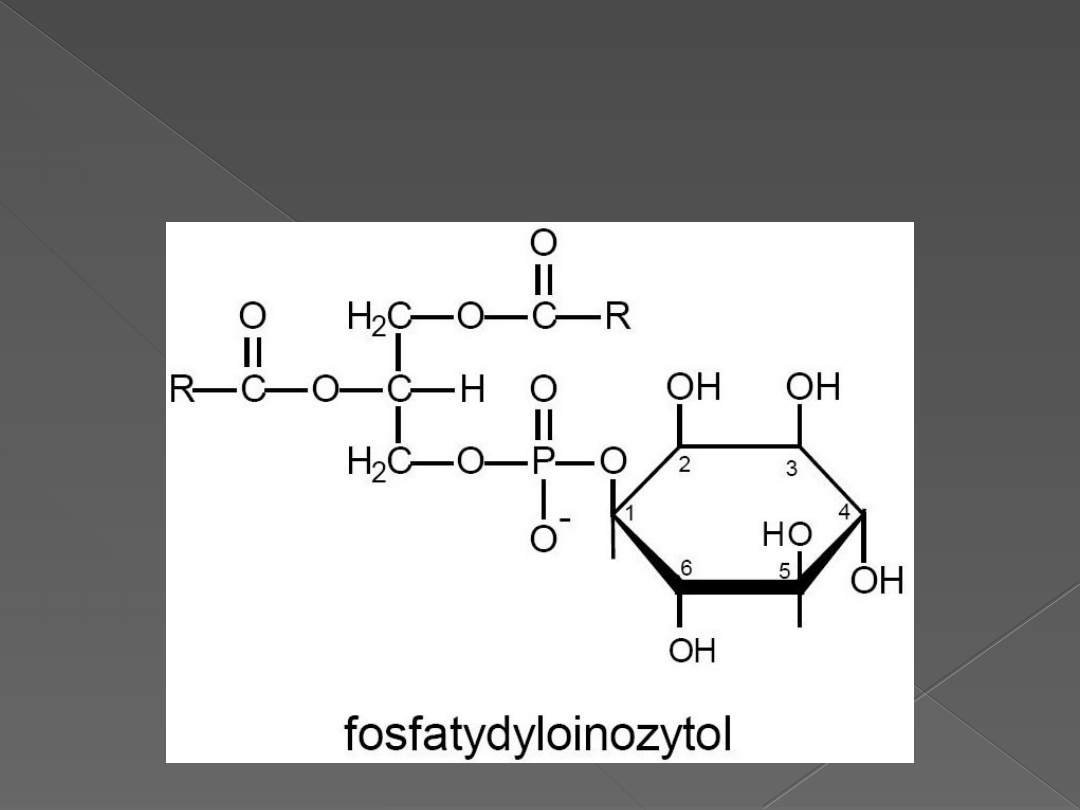
PI
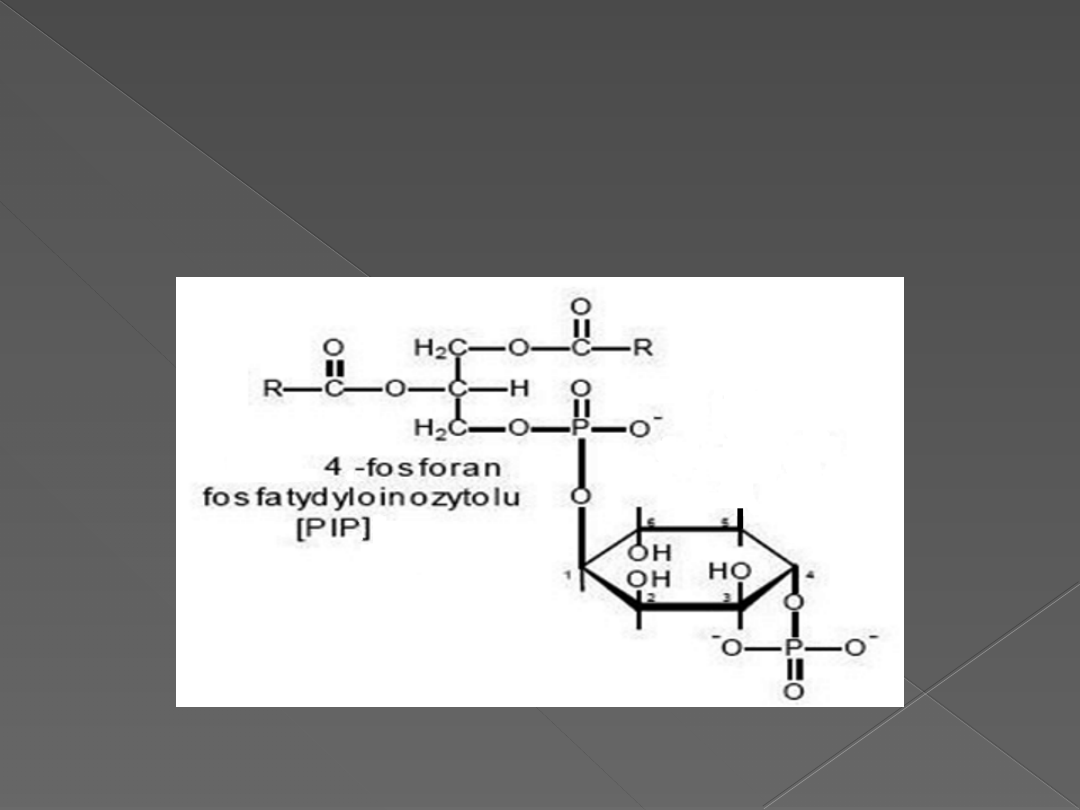
PIP
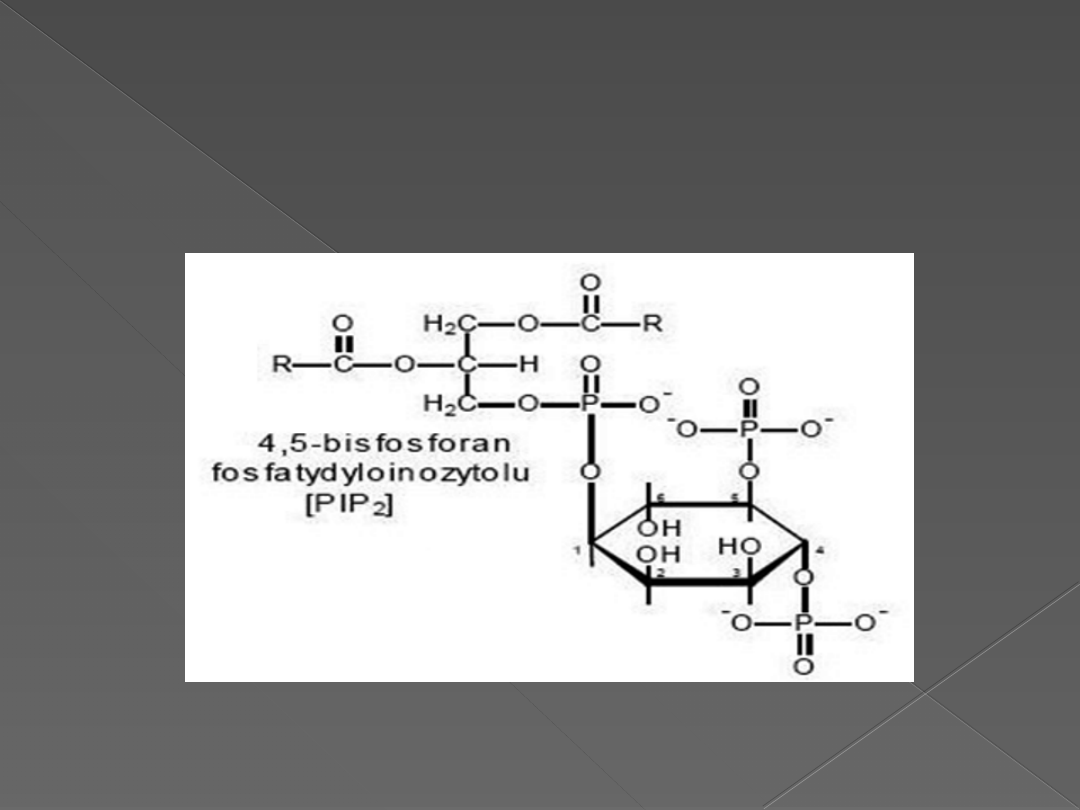
PIP2

Fosfolipidy inozytolowe
Stopień fosforylacji jest regulowany przez
dwa rodzaje enzymów działających w
obecności ATP:
PI-i PIP-kinazy
PIP2- i PIP-fosfomonoesterazy

Hydroliza PIP2
Najważniejszym wydarzeniem dla systemu
przekazującego sygnał hormonalny do wnętrza
komórki jest inicjowana przez receptor
hydroliza PIP2. Powstają 2 cząsteczki wtórnych
przekaźników:
Inozytolo-1,4,5-trifosforan (IP3)
Diacyloglicerol (DAG).
Hydroliza PIP2 jest katalizowana przez
fosfolipazę C, fosfodiesterazę (może ona
także bezpośrednio hydrolizować PI i PIP)
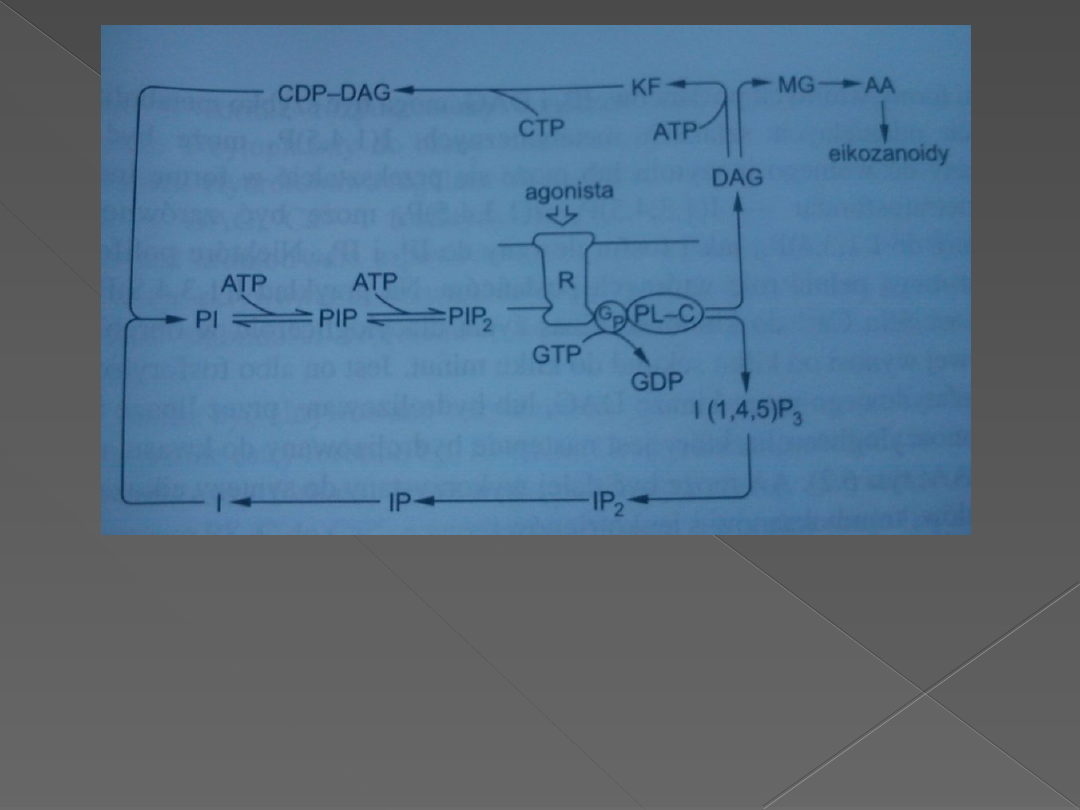
Rozdwojona droga sygnałów zaczyna się od hydrolizy PIP2 do DAG i IP3. Związanie
się hormonu(H) ze swoistym receptorem(R) katalizuje zamianę związanego GTP na
GDP w podjednostce alfa białka G(GP). Uaktywniona podjednostka alfa białka GP
aktywuje następnie fosfolipazę C(PL-C), która hydrolizuje PIP2. Zarówno IP3 jak i
DAG są szybko metabolizowane w dwóch odrębnych szlakach metabolicznych.
AF-kwas fosfatydowy, CDP-DAG-cytozynodifosforan-diacyloglicerol, IP3-inozytolo-
1,4,5-trifosforan, IP2-inozytolobifosforan, IP-inozytolofosforan, I-inozytol, MG-
monoacyloglicerol, AA-kwas arachidonowy.

Hydroliza PIP2 c. d.
IP3 jest przekształcany w inozytolodifosforan
(IP2), następnie w inozytolofosforan (IP), a w
końcu w wolny inozytol.
Powstający w procesie hydrolizy diacyloglicerol
jest przekształcany do kwasu fosfatydowego,
który reaguje z CTP i tworzy CDP-
diacyloglicerol (CDP-DAG).
Inozytol reaguje z CDP-DAG resyntetyzując
fosfatydyloinozytol. Cykl fosfolipidów
inozytolu jest zamknięty po fosforylacji PI do PIP
i PIP2.
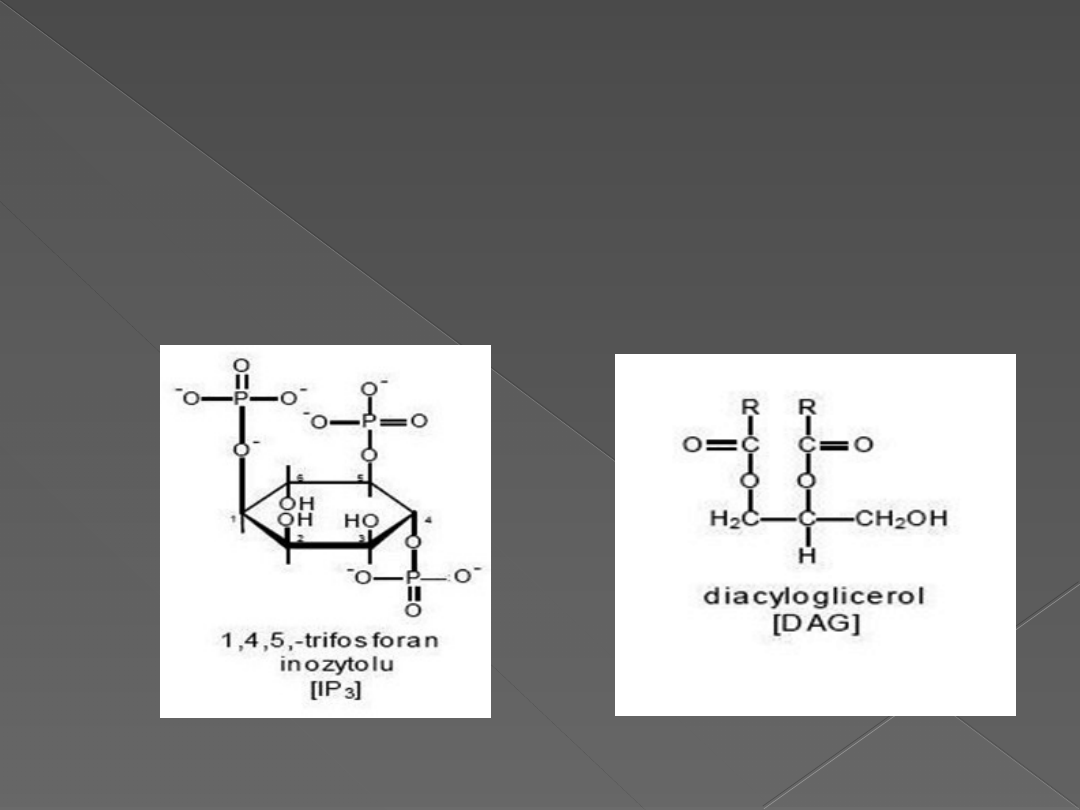
Wtórne przekaźniki:
inozytolo-1,4,5-fosforan (IP3)
i diacyloglicerol (DAG)

Inozytolo-1,4,5-fosforan
(IP3)
IP3 ma właściwości hydrofilne i jest uwalniany
do cytoplazmy.
IP3 ulega defosforylacji co prowadzi do
powstania wolnego inozytolu. Może się również
przekształcić w inozytolo-1,3,4,5-tetrafosforan
– I(1,3,4,5)P4. Ta forma bierze udział w
procesie wnikania jonów wapnia do komórek.
IP3 pełni funkcję aktywatora wapnia z
wewnątrzkomórkowych magazynach poprzez
specyficzny receptor w siateczce
śródplazmatycznej.
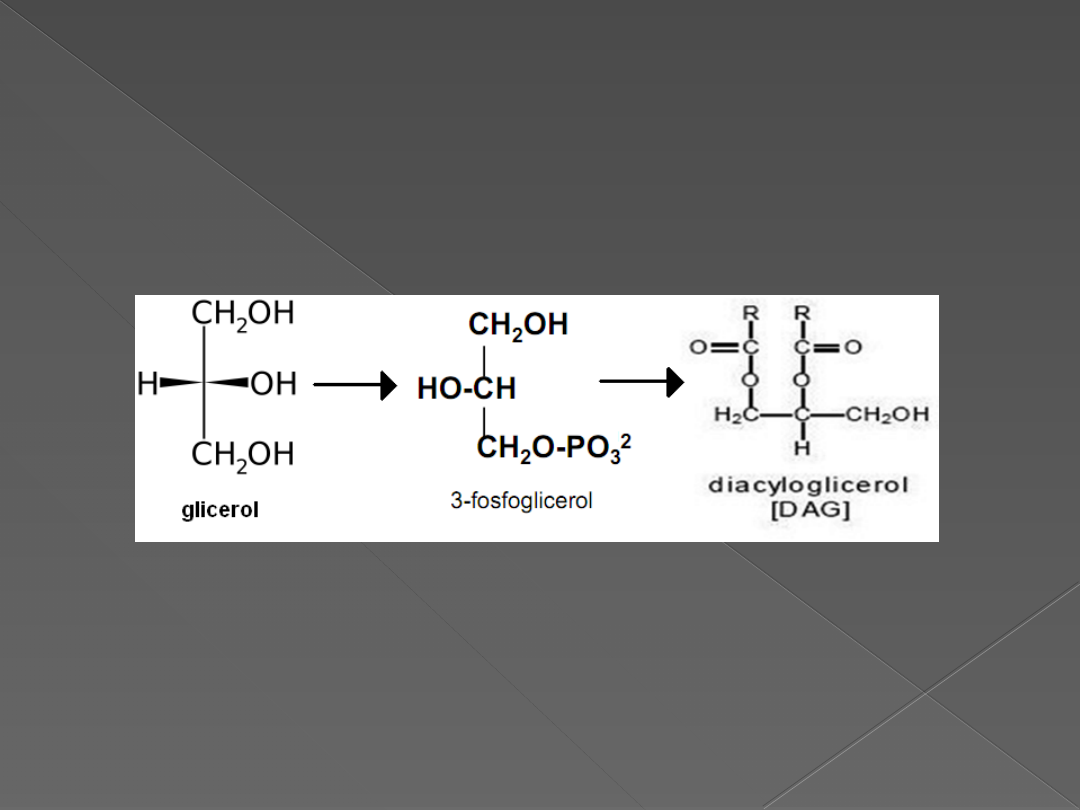
Uproszczony schemat
przekształcenia glicerolu w DAG

Diacyloglicerol (DAG)
DAG ma właściwości hydrofobowe i pozostaje
w obrębie błony komórkowej, gdzie szybko
ulega dalszym przekształceniom.
DAG może ulec ufosforylowaniu do kwasu
fosfatydowego przy udziale kinazy DAG lub
hydrolizie przez lipazę DAG do formy
monoacyloglicerolu, który również ulega
hydrolizie do kwasu arachidonowego.
Służy do aktywacji kinazy białkowej C wraz z
jonami wapnia i fosfatydyloseryną.
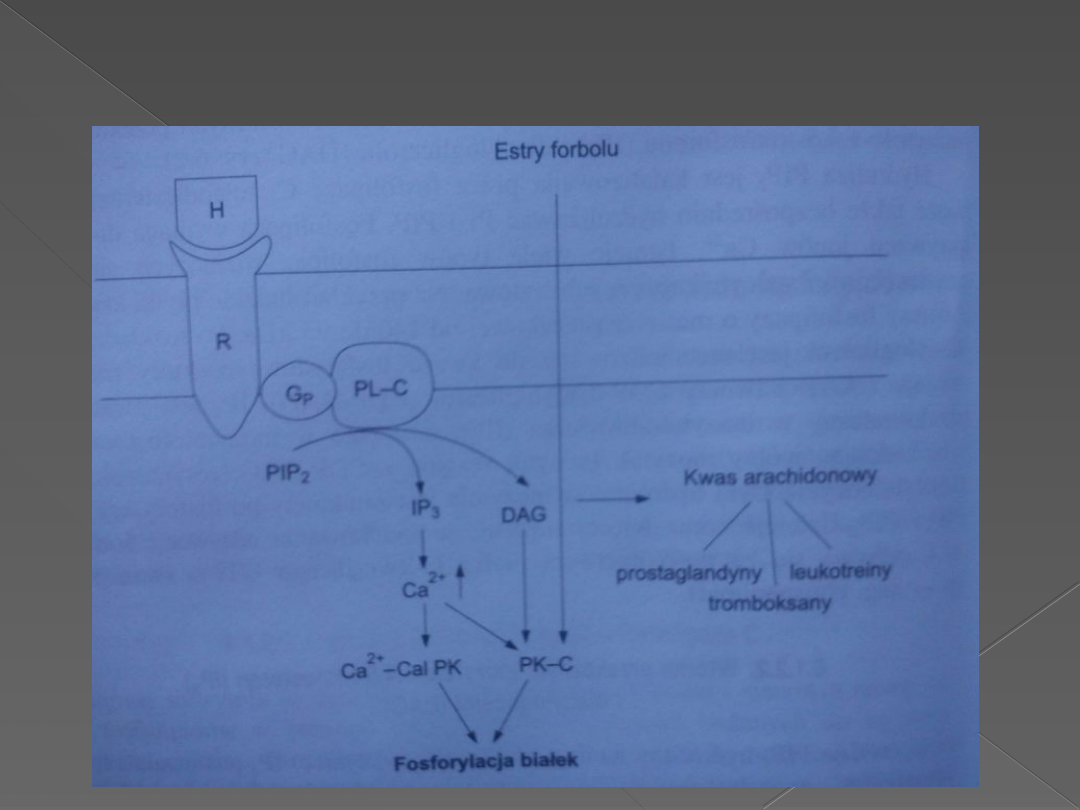
System przekaźnikowy z
udziałem fosfolipidów

Piśmiennictwo
„Biochemia Kręgowców”, W.
Minakowski i S. Weidner, Wydawnictwo
Naukowe PWN, Warszawa 1998
„Biochemia Harpera”, Murray, Granner,
Mayes, Rodwell, Wydawnictwo
Lekarskie PZWL, Warszawa 1995
Document Outline
- Slide 1
- Fosfolipidy inozytolowe
- Inozytol
- Kwas arachidonowy
- Kwas stearynowy
- Fosfolipidy inozytolowe
- PI
- PIP
- PIP2
- Fosfolipidy inozytolowe
- Hydroliza PIP2
- Slide 12
- Hydroliza PIP2 c. d.
- Slide 14
- Inozytolo-1,4,5-fosforan (IP3)
- Uproszczony schemat przekształcenia glicerolu w DAG
- Diacyloglicerol (DAG)
- System przekaźnikowy z udziałem fosfolipidów
- Piśmiennictwo
Wyszukiwarka
Podobne podstrony:
fosfolipidy inozytolowe
Fosfolipidy inozytolowe 3
fosfolipidy inozytolowe
20 Fosfolipidy inozytolowe
Fosfolipid
Witamina B8 (Inozytol), Witaminy
Dwuwarstwa fosfolipidowa
Mezo Inozyt
Mezo Inozyt (2)
6 tłuszcze, nienasycone kwasy tłuszczowe, prostanoidy, woski, fosfolipidy Kopia
fosfolipidy iznozytolowe (2)
Cholina inozytol
4 Oznaczanie składu reszt kwasów tłuszczowych w glicerydach i fosfolipidach
fosfolipaza A2 id 179963 Nieznany
fosfolipidy, Kosmetologia
Fosfolipidy
FOSFOLIPIDY 2
Inozytole
fosfolipidy
więcej podobnych podstron