
Badania klirensowe w
ocenie niewydolności
nerek.
Elektroforeza białek moczu
patologicznego

udowodniona skuteczność:
• ścisła kontrola glikemii w cukrzycy
• ścisła kontrola ciśnienia tętniczego
ACE-I, Xartany
skutecznosc nie rozstrzygnieta:
• ograniczenie białka w diecie
• leczenie hipolipemizujace
• czesciowe wyrównanie niedokrwistosci
Zwolnienie postępu choroby
Pacjenci z najwyższej grupy ryzyka
rozwoju PChN:
• pacjenci z cukrzycą
• pacjenci z nadciśnieniem tętniczym
• pacjenci z PNN w wywiadach rodzinnych
• pacjenci z chorobami układu sercowo-naczyniowego

Przewlekła choroba nerek (PChN)
Proces chorobowy powodujący uszkodzenie funkcji
nerek utrzymujące się przez okres trzech miesięcy i
dłużej. Najczęściej identyfikowany na podstawie
zmienionych wyników testów laboratoryjnych w co
najmniej 2 badaniach, wykonanych w przeciągu 3
miesięcy
GFR < 60 mL/min./1,73 ,m2 (faza 3, 4, 5)
Stosunek albuminy do kreatyniny w moczu >30 mg/g
Nieprawidłowości w osadzie moczu

rozpoznanie i leczenie,
leczenie chorób
współistniejacych,
zwalnianie postępu uszkodzenia
nerek,
zmniejszanie ryzyka chorób
układu sercowonaczyniowego
ocena postepu choroby
Stadia przewlekłej choroby
nerek
Stadium I -
uszkodzenie
nerek z prawidłowym
GFR >90 ml/min/1,73
m2
Stadium II - uszkodzenie
nerek z niewielkim zmniejszeniem GFR
(89-60 ml/min/ 1,73 m2)
ocena postepu choroby
Stadium III -
umiarkowane
zmniejszenie GRF
(59-30ml/min/ 1,73 m2)
ocena i leczenie
powikłan
Stadium IV - duże
zmniejszenie GFR
(15-29ml/min/ 1,73
m2)
leczenie
nerkozastepcze
Stadium V - schyłkowa
niewydolnosc nerek
(GFR <15 ml/min/ 1,73 m2)
przygotowanie do leczenia
nerkozastepczego

Definicja wielkości filtracji
kłębuszkowej
Objętość wody osocza filtrowana przez błonę
kłębuszków w jednostce czasu, w przeliczeniu na
znormalizowaną powierzchnię ciała = 1.73 m2
Mierzona jako klirens nerkowy z osocza do moczu
substancji podlegającej swobodnej filtracji kłębuszkowej
•Nie wiążącej się z białkami
•Nie resorbowanej w kanalikach
•Nie podlegającej sekrecji kanalikowej
•Nie usuwanej z krwi droga pozanerkową
GFR=
stężenie wskaźnika w moczu x objętość moczu
stężenie wskaźnika w osoczu
• Właściwe nawodnienie pacjenta i odpowiednio
długi okres zbiórki dla prawidłowej oceny funkcji
filtracyjnej nerek (przepływ moczu kilka mL/min.).
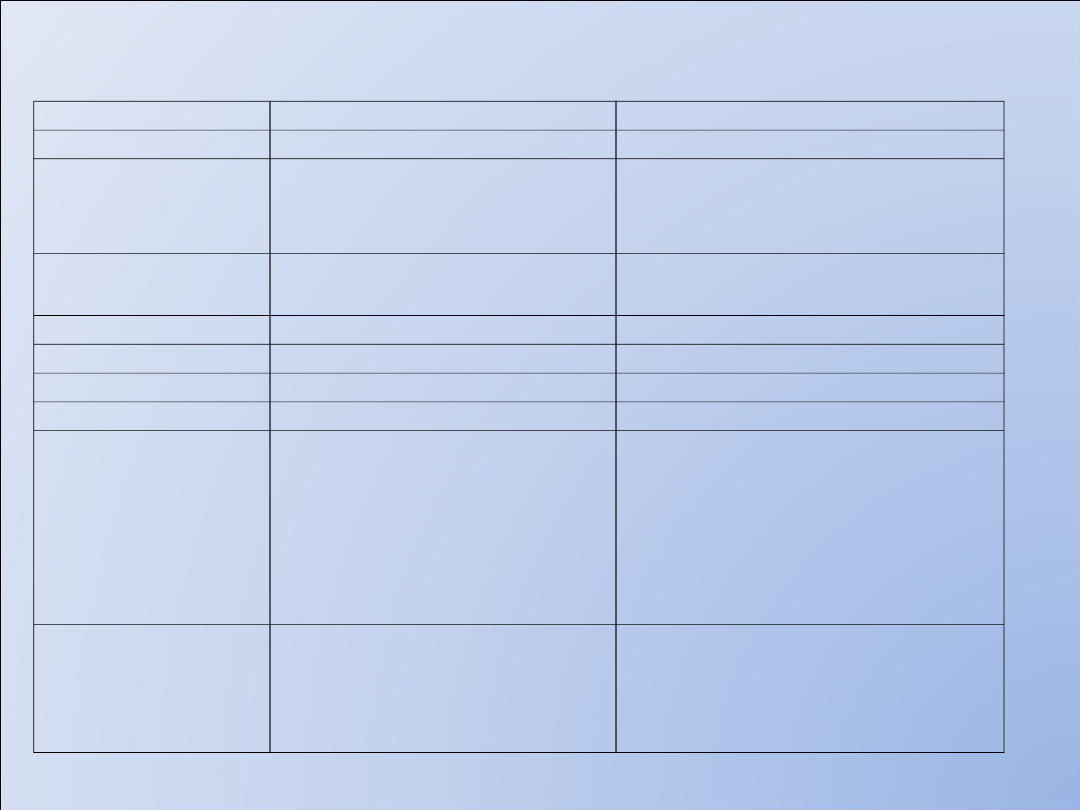
Egzogenne
Egzogenne
Inulina
Złoty standard
Czasochłonna, niska
specyficznosc
oznaczen,
51Cr-EDTA
Izotopowa
( prosty pomiar)
Czasochłonna, Klir=0,79
mL/min/10 kg
131J-jodooctan
Izotopowa
Czasochłonna
Jodoheksol
nieizotopowa
Klir=0,83 mL/min/10 kg
Endogenne
kreatynina
tania
Niska czułość i specyficzność
_b2-
mikroglobulina,
_Białko wiazące
retinol
_a1-
mikroglobulina
Nie ulega sekrecji i
reabsorpcji
Czynniki nienerkowe
wpływające na
szybkość produkcji
Cystatyna C
Nie ulega sekrecji i
reabsorpcji, stała
szybkosc produkcji,
Czuła i specyficzna
Oznaczenia immunochemiczne
Markery filtracji kłębuszkowej

Inulina
jest naturalny wielocukier roślinny swobodnie przesącza się w nerkach,
nie ulega zwrotnemu wchłanianiu i cały przesączony ładunek substancji
wydziela się do moczu.
Złoty standard jednak nie stosowany w badaniach rutynowych
-konieczność wprowadzenia do krwiobiegu drogą
iniekcji
-czasochłonna metoda oznaczeń
Cystatyna
C- białko o m.cz. 13 kDa, inhibitor proteaz cysteinowych jest produkowany
ze stałą szybkość syntezy przez wszystkie komórki jądrzaste. Ponieważ
cystatyna C jest swobodnie filtrowana przez kłębuszki nerkowe, a następnie
ulega reabsorbcji i całkowitemu rozkładowi, jej poziom we krwi koreluje ze
wskaźnikiem filtracji kłębuszkowej. Dodatkowym atutem tego pomiaru jest
to że nie jest on zależny od płci, wagi, wzrostu, masy mięśniowej i wieku
(powyżej 1. roku.
Nie znane są czynniki nienerkowe wpływające na stężenie.
Oznaczenia – immunoturbidymetryczne z użyciem lateksu
Powtarzalność ±3%, odtwarzalność ±4%. Zakres referencyjny ~1.00 mg/L
Stężenie niezależne od masy mięśniowej, diety, płci
Markery filtracji kłębuszkowej
•endogenny metabolit, produkowany ze stała szybkością, którego stężenie w
osoczu pozostaje w wąskich granicach, dieta modyfikuje około 10% puli
osoczowej
•obecna we wszystkich płynach ustrojowych, podlega filtracji kłebuszkowej i
jej
klirens może być mierzony jako wskaźnik filtracji kłębuszkowej
•nie podlega resorpcji zwrotnej,
•7-10% kreatyniny ulega sekrecji
(wartośćklirensu wyższa 1,1-1,2 razy od klirensu inuliny)
-udział sekrecji rosnie ze wzrostem stężenia kreatyniny w osoczu,
(wartość
klirensu może być > 2x wyższa od klirensu inuliny), podanie
cymetydyny
hamuje sekrecje i koryguje różnice pomiędzy klirensem kreatyniny i
inuliny
•szybkość produkcji kreatyniny spada ze wzrostem stężenia w osoczu
(konwersja
do kreatyny i innych metabolitów, zahamowanie przemiany z kreatyny)
kreatynina
Powstaje w organizmie w wyniku nieenzymatycznego rozpadu fosforanu
kreatyny, jest wydalana z organizmu przez nerki z moczem stanowiąc oprócz
mocznika jeden z głównych związków azotowych

Metody chemiczne:
Metoda Jaffe’go (1886 rok) – reakcja kreatyniny z pikrynianem w środowisku
alkalicznym, w wyniku której powstaje pomarańczowoczerwony kompleks.
Mechanizm reakcji i struktura produktu pozostają niewyjaśnione
• Reakcja niespecyficzna – substancje Jaffe-dodatnie: białka, glukoza, kwas
askorbinowy, aceton, acetooctan, pirogronian, gunidyna i cefalosporyny.
-wielkosc interferencji zalena od warunków reakcji (np. dla 8 mmo/L
acetooctanu od 0 do 310 μmol/L jednostek kreatyninowych)
Metody oznaczania
kreatyniy
Uspecyficznienie metody:
• absorpcja kreatyniny na krzemianie glinu, wymycie i dalej oznaczanie
uwolnionej, niezanieczyszczonej kreatyniny lub zastosowanie chromatografii
jonowymiennej-
• poprawa czułości przez dodawanie do reakcji np.: boranu, fluorku, zmiana pH
> 10
• utlenienie interferentów do form nieaktywnych w reakcji Jaffe’go
• oznaczanie kinetyczne kreatyniny

•oznaczanie kinetyczne kreatyniny
pomiar w „okienku” pomiędzy 25 i 60 sekunda reakcji – wzrost
specyficzności i szybkości oznaczeń
• dobór optymalnego stężenia odczynników;
•dobór optymalnej długosci fali
- maksimum dla reakcji 490 – 500 nm,
wzrost liniowosci spadek absorbancji ślepej
• dodatek utleniaczy
-(żelazicyjanek) – wyeliminowanie interferencji bilirubiny
- oksydazy askorbinianowej – wyeliminowanie interferencji witaminy C
•kontrola temperatury
-
wzrost powtarzalności w wyniku
Metody oznaczania
kreatyniy c.d.

Metody oznaczania
kreatyniy c.d.
•kinetyka reakcji słaba,
• wymagana 30-minutowa inkubacja przy odczycie w punkcie
końcowym
reakcji,
• odczyt kinetyczny – niska czułość i precyzja oznaczeń,
• relatywnie wysoki koszt oznaczenia
Metody
enzymatyczne
:
reakcja właściwa
reakcja wskaźnikowa

Metody oznaczania
kreatyniy c.d.
Metody
enzymatyczne
:
reakcja właściwa
reakcja wskaźnikowa
•interferencja na etapie reakcji wskaźnikowej
(żelazicyjanek potasu lub
oksydaza bilirubiny w celu wyeliminowania interferencji
bilirubiny i oksydaza askorbinianowa by wyeliminować wit.
C)
• preinkubacja w celu wyeliminowania endogennej
kreatyny i mocznika
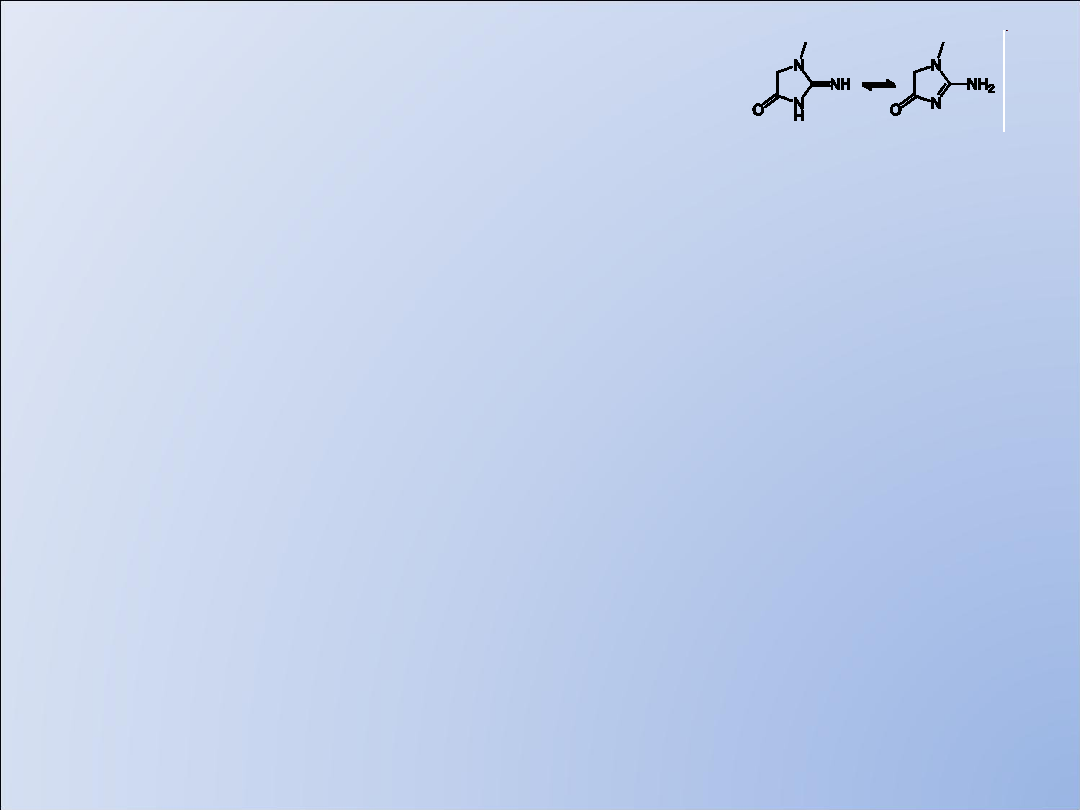
Metody oznaczania
kreatyniy c.d.
Metody
enzymatyczne
:
reakcja właściwa
reakcje wskaźnikowe
1)elektroda polarograficzna do detekcji H2O2
2)elektroda amonowa do detekcji amoniaku
3)

• Różne warianty oznaczeń metoda Jaffe’go są najczęściej
wykorzystywane w „mokrej chemii”.
• Sucha chemia - metody enzymatyczne
• Wybór metody oznaczeń powinien być poprzedzony oceną jej
wrażliwości na interferencje bilirubiny, białka, glukozy, ciał
ketonowych.
•Interferencja bilirubiny jest szczególnie istotna w metodach
peroksydazowych
•Kalibracja oznaczeń w surowicy (osoczu) powinna być w oparciu o
surowicę kalibracyjną lub materiał na bazie białkowej
• Metoda definitywna – spektroskopia masowa
(IDMS spektroskopia mas. rozcieńczenia izotopowego)
• Metoda referencyjna – HPLC z detekcja przy 234 nm
Dokładność – bardzo ważna w ocenie klirensu i stosunku azot
mocznika/kreatynina
!!!
uwagi
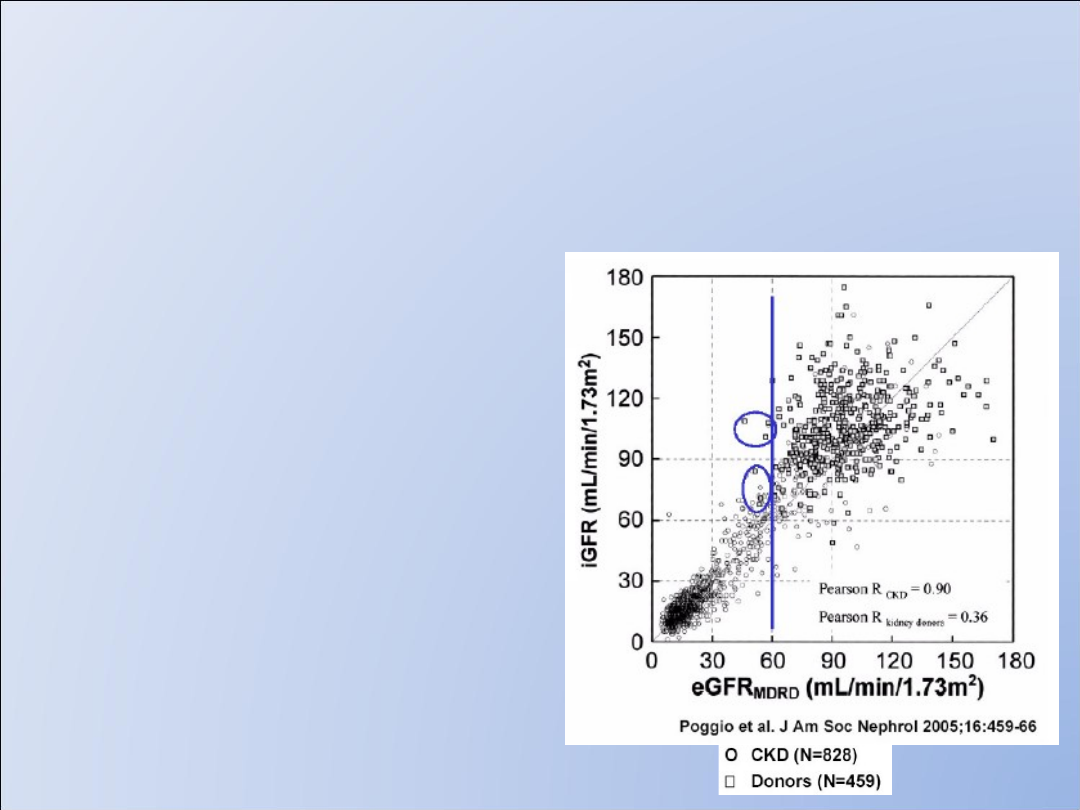
Obliczenia GFR na podstawie wzoru
MDRD
(modyfication of diet in renal disease)
GFR (mL/min/1.73 m2) =186 x kreatynina (surowica)
–1.154
x wiek
-0.203
x 0.742 (w przypadku kobiet)
x 1.210 (w przypadku Afro-Amerykanów)
•
wzór oparty na badaniu populacji
dorosłych osób (białych i Afroamerykanów)
w granicach wieku 18-70 lat, z GFR < 90
ml/min/1.73 m2
•dobra zgodność w przypadku cukrzyków
•słaba zgodność z badaniami klirensowymi
GFR w przypadku:
- ostrej niewydolności nerek
- normalnej funkcji nerek
•słaba zgodność z iGFR przy prawidłowej
funkcji nerek
•wymagane dodatkowe badania w
przypadku innych grup etnicznych, innych
grup pacjentów i u osób z prawidłowa
funkcja nerek

NKDEP akcentuje znaczenie jakości oznaczeń kreatyniny w
surowicy
Dlaczego?
1. Oznaczanie kreatyniny w surowicy jest zlecane znacznie częściej niż
albuminy w moczu
2. Interpretacja wyników kreatyniny w surowicy jest stawiana wyżej niż
albuminurii
3. Oznaczenie albuminy w moczu zazwyczaj zlecane jest w celu
potwierdzenia już występującej PCHN
NKDEP (National Kidney Disease Education Program)
Program mający na celu propagowanie wiedzy na
temat wykrywania i możliwości leczenia chorób nerek
• szczególnie istotna jest identyfikacja ludzi z chorobami nerek,
nieświadomych faktu występowania choroby

•Niespecyficznosc reakcji kreatyniny z pikrynianem sodu –
obecność substancji Jaffe–dodatnich
•Brak standaryzacji kalibracji rutynowych metod oznaczeń
kreatyniny
•Zbyt duży udział błędów systematycznego i precyzji w
zmienności wyników obliczeń eGFR (MDRD)
Ograniczenia oznaczeń kreatyniny w ocenie GFR
Optymalizacja oznaczeń kreatyniny
•Bład całkowity w oznaczeniach kreatyniny nie powinien podwyższać
zmienności oznaczeń GFR (MDRD) o więcej niż 10%, w zakresie stężeń 1.00-
1.50 mg/dL
•Porównywalna jakość oznaczeń powinna być uzyskana w zakresie 0.60-1.00
mg/dL, w przypadku pacjentów <18 r.ż.
•Ograniczenie wpływu niespecyficzności analitycznej na wyniki oznaczeń
kreatyniny, w obecnie stosowanych metodach rutynowych
•Wyeliminowanie błędu systematycznego pomiędzy różnymi metodami:
-uzyskanie spójności pomiarowej w odniesieniu do metody
referencyjnej IDMS (złoty standard) (spektroskopii mas. rozcieńczenia
izotopowego)
•Poprawa dokładności i zgodności oceny GFR (MDRD)
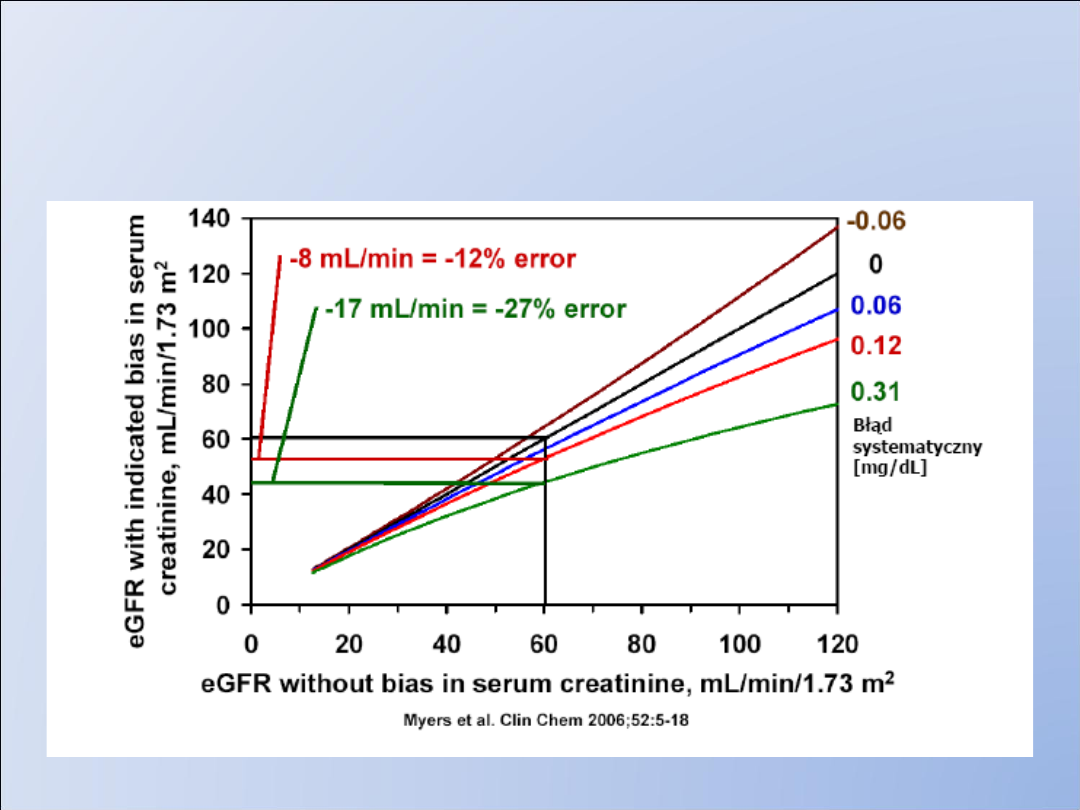
Wpływ błędu systematycznego przy oznaczeniu
kreatyniny na ocenę GFR
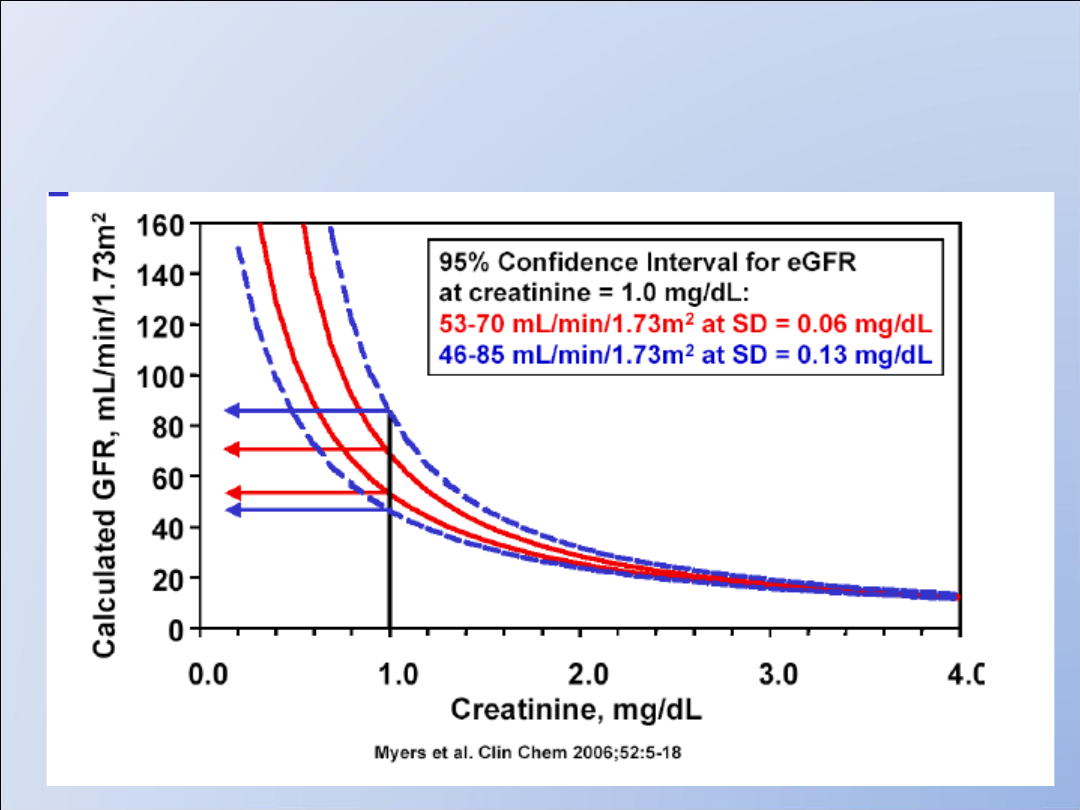
Wpływ błędu precyzji przy oznaczeniu
kreatyniny na ocenę GFR

NKDEP LABORATORYJNA GRUPA ROBOCZA
ZALECENIA W CELU POPRAWY OZNACZEŃ
KREATYNINY W SUROWICY
Zalecenia długoterminowe:
•Producenci i laboratoria kliniczne powinny koordynować
wprowadzenie rekalibracji oznaczeń kreatyniny w surowicy
wobec IDMS, z korekta równania do wyliczania GFR
•Laboratoria kliniczne powinny podawać wynik GFR, obliczony
na podstawie równania MDRD, w postaci:
>60 ml/min./1,73 m2,jeżeli uzyskana wartość jest powyżej
60
bądź liczbowo, jeżeli uzyskana wartość jest < 60
ml/min./1,73 m2
•Podawać wyniki stężenia kreatyniny w surowicy w mg/dL
do drugiego miejsca po przecinku. Wartości w μmol/L
powinny być podawane jako liczby całkowite.
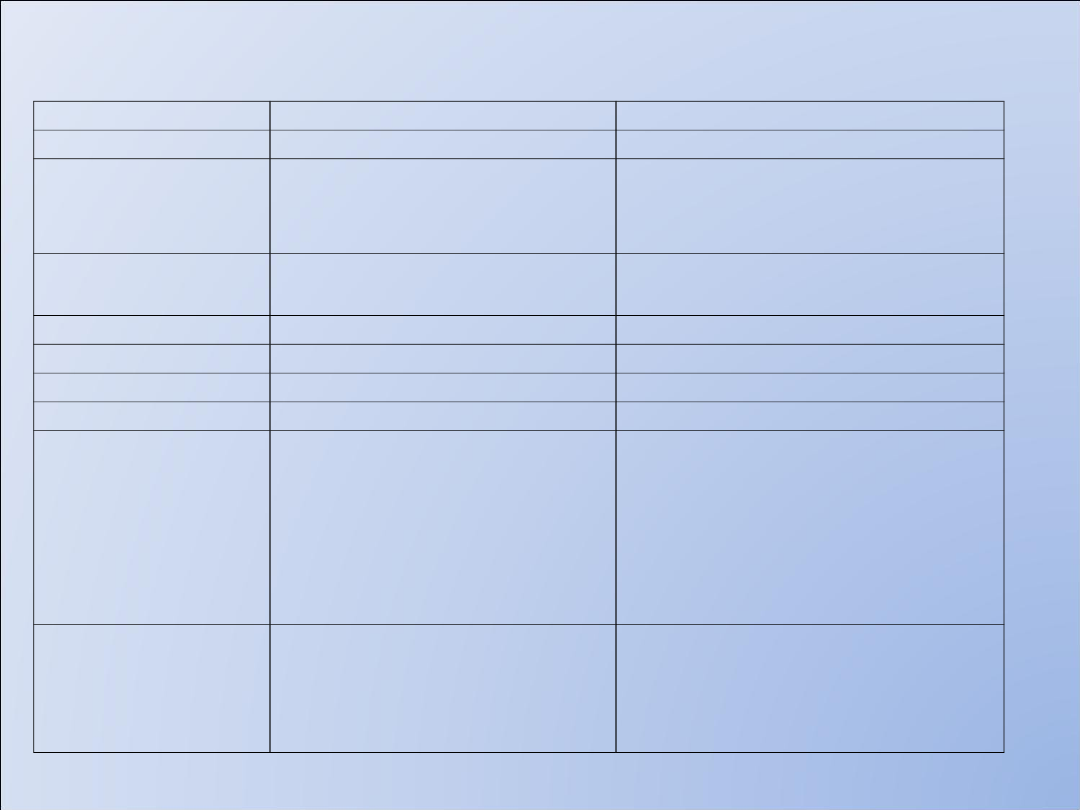
Egzogenne
Egzogenne
Inulina
Złoty standard
Czasochłonna, niska
specyficznosc
oznaczen,
51Cr-EDTA
Izotopowa
( prosty pomiar)
Czasochłonna, Klir=0,79
mL/min/10 kg
131J-jodooctan
Izotopowa
Czasochłonna
Jodoheksol
nieizotopowa
Klir=0,83 mL/min/10 kg
Endogenne
kreatynina
tania
Niska czułość i specyficzność
_b2-
mikroglobulina,
_Białko wiazące
retinol
_a1-
mikroglobulina
Nie ulega sekrecji i
reabsorpcji
Czynniki nienerkowe
wpływające na
szybkość produkcji
Cystatyna C
Nie ulega sekrecji i
reabsorpcji, stała
szybkosc produkcji,
Czuła i specyficzna
Oznaczenia immunochemiczne
Markery filtracji kłębuszkowej

Inulina
jest naturalny wielocukier roślinny swobodnie przesącza się w nerkach,
nie ulega zwrotnemu wchłanianiu i cały przesączony ładunek substancji
wydziela się do moczu.
Złoty standard jednak nie stosowany w badaniach rutynowych
-konieczność wprowadzenia do krwiobiegu drogą
iniekcji
-czasochłonna metoda oznaczeń
Cystatyna
C- białko o m.cz. 13 kDa, inhibitor proteaz cysteinowych jest produkowany
ze stałą szybkość syntezy przez wszystkie komórki jądrzaste. Ponieważ
cystatyna C jest swobodnie filtrowana przez kłębuszki nerkowe, a następnie
ulega reabsorbcji i całkowitemu rozkładowi, jej poziom we krwi koreluje ze
wskaźnikiem filtracji kłębuszkowej. Dodatkowym atutem tego pomiaru jest
to że nie jest on zależny od płci, wagi, wzrostu, masy mięśniowej i wieku
(powyżej 1. roku)
Nie znane są czynniki nienerkowe wpływające na stężenie.
Oznaczenia – immunoturbidymetryczne z użyciem lateksu
Powtarzalność ±3%, odtwarzalność ±4%. Zakres referencyjny ~1.00 mg/L
Stężenie niezależne od masy mięśniowej, diety, płci
Markery filtracji kłębuszkowej

MOCZNIK
Biochemia i fizjologia
Podstawowy produkt metaboliczny zawierający azot (> 75% azotu
niebiałkowego)
• ~ 90 % wydala nerka, pozostałe 10% wydalane jest przez jelito i
skórę
• Podlega filtracji kłębuszkowej, nie jest aktywnie reabsorbowany i
nie ulega sekrecji w nerce
• 40-70% stanowi wysoce dyfundującą frakcję, przechodzącą
ze światła
kanalika do tkanki śródmiąszowej i na powrót do osocza
• Szybkość odwrotnej dyfuzji jest uzależniona od szybkości
przesączania – im nisza przepływ tym większą dyfuzja
• W PNN diureza osmotyczna w pozostałych czynnych nefronach
ogranicza dyfuzje powrotna tak, że klirens mocznika odpowiada
klirensowi inuliny

MOCZNIK –
Kliniczna użyteczność oznaczeń
Osocze:
Czynniki przed-nerkowe wpływające na stężenie mocznika (kreatynina
bz) :
• Dieta wysokobiałkowa
• Zwiększony katabolizm białek
• Absorpcja białek krwi po krwotoku dojelitowym
• Leczenie kortizolem i syntetycznymi analogami
• Niektóre przypadki przewlekłych chorób wątroby
• Obniżona perfuzja nerek
• Stopień nawodnienia organizmu
•Czynniki pozanerkowe wpływające na stężenie mocznika
(mocznik/kreatynina ):
• Zablokowanie dróg moczowych (nowotwór, kamica, powiększenie
prostaty)
Mocz:
• Pomiar stężenia – znikome znaczenie diagnostyczne
Równowaga azotowa - jeden z wielu związków niebiałkowych
w moczu zawierających azot

Oznaczanie mocznika enzymatyczną metodą Berthelot’a
reakcja właściwa
reakcja wskaźnikowa
Zakres referencyjny:
• Dorośli < 60 lat: 6-20 mg/dL (2,1-7,1 mmol/L) wyrażony jako mocznik
• Dorośli > 60 lat: 8-23 mg/dL (2,9-8,2 mmol/L) 1-tyg. Noworodki: 3-25 mg/dL (1,1-8,9
mmol/L
• Wyższe stężenia: M>K, dieta wysokobiałkowa
• Średnie wydalanie azotu mocznikowego: 12-20 g/dobę
• 108 – 135 mg/dL (40 – 50 mmol/L) u pacjentów z nie leczoną przewlekłą
niewydolnością nerek

BIAŁKOMOCZ - PROTEINURIA
1,5 g białka/dobę przesącza się przez kłębki nerkowe
150 mg/dobę wydalane z moczem:
PRZYCZYNY BIAŁKOMOCZU
BIAŁKOMOCZ NERKOPOCHODNY
– pochodzenia kłebuszkowego - glomerulopatie (od znikomego do masywnego)
– pochodzenia cewkowego - tubulopatie - zmniejszenie reabsorpcji cewkowej
– cewkowo-kłębuszkowy (zaawansowane stadia chorób nerek)
– wydzielanie białek przez komórki kanalika
BIAŁKOMOCZ POZANERKOWY (najczęściej <2 g/dobę + leukocyturia)
stany zapalne dróg moczowych
nowotwory dróg moczowych
BIAŁKOMOCZ Z PRZEŁADOWANIA (prowadzi do uszkodzenia bariery filtracyjnej)
szpiczak mnogi
rabdomioliza, hemoliza
W PRZEBIEGU NIEKTÓRYCH CHORÓB
niewydolność krążenia (zmiany hemodynamiczne w nerkach)
wysoka gorączka
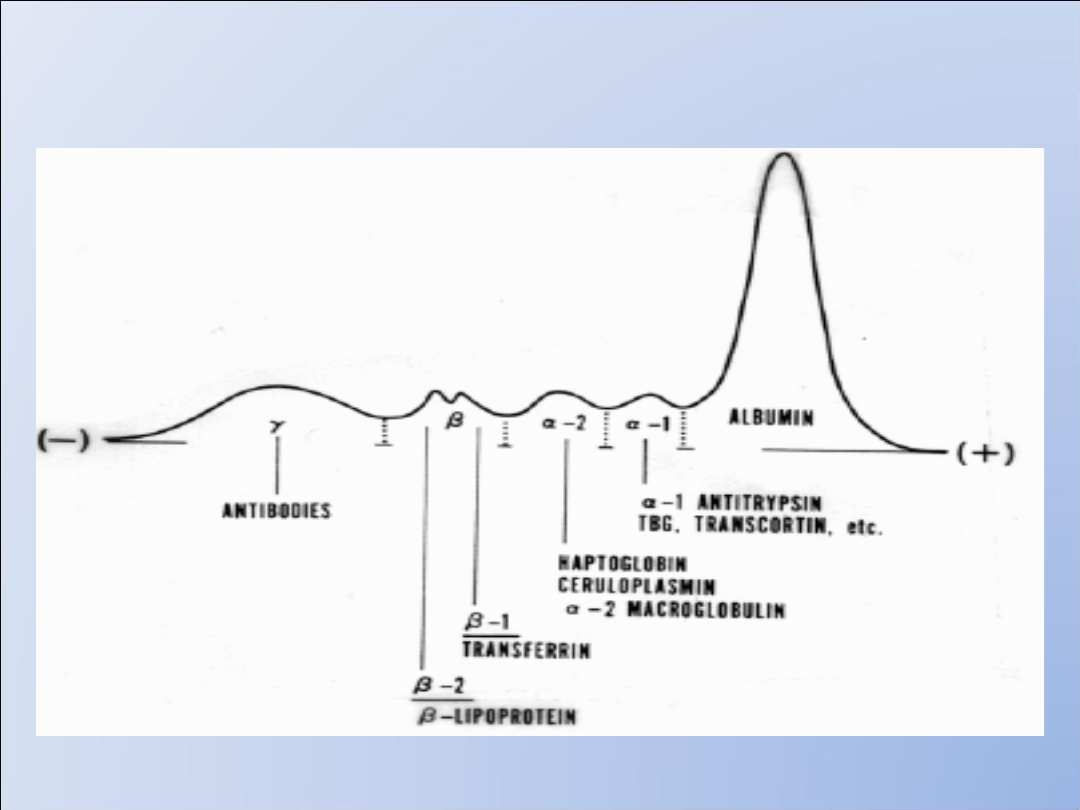
BIAŁKA OSOCZA

RODZAJE BIAŁKOMOCZU NERKOPOCHODNEGO
1 Białkomocz kłębuszkowy - zazwyczaj znaczny, może prowadzić do zespołu
nerczycowego
– obserwuję się w stanach przebiegających z uszkodzeniem błony filtracyjnej
kłębuszków nerkowych (kłębuszkowe zapalenia nerek, nefropatia cukrzycowa).
selektywny - odpowiada wcześniejszym stadiom zaawansowania zmian
chorobowych, gdy do moczu przedostają się jedynie białka o niewielkiej masie
cząsteczkowej (albumina, transferyna),
nieselektywny - w późniejszych stadiach choroby nerek, gdy w moczu obecne
są białka o większej masie cząsteczkowej (globuliny).
2. Białkomocz cewkowy - początkowo występuje jako mikrobiałkomocz, może
także wywołać białkomocz kliniczny
– w nefropatiach cewkowo-śródmiąższowych, na skutek uszkodzenia cewek
dochodzi do zmniejszenia wchłaniania zwrotnego białek drobnocząsteczkowych:
α1-mikroglobulina, β2-mikroglobulina, rybonukleazy, GGTP, lizozym, insulina.
3. Białkomocz mieszany (kłębuszkowo-cewkowy) – zaawansowane stadia chorób
nerek niezależnie od przyczyny

BIAŁKOMOCZ POZANERKOWY
1. Białkomocz z przeładowania (nadmiarowy) - wywołany przedostawaniem się
do moczu znajdujących się w nadmiarze w surowicy białek; ich przesączanie w
kłębuszkach przekracza zdolności zwrotnego wchłaniania w cewkach.
2. Białkomocz wywołany przenikaniem białek do moczu w drogach
moczowych:
- w przebiegu zakażeń i stanów zapalnych nabłonek wyściełający całe drogi
moczowe wydziela do moczu białka takie jak: IgA, mukoproteiny, białko C-reaktywne,
lizozym,
- u mężczyzn do moczu mogą przedostawać się białka pochodzące z jąder, najądrzy,
pęcherzyków nasiennych i gruczołu sterczowego.
3. Krwawienia z dróg moczowych - w moczu obecne są erytrocyty i osocze, ( w
elektroforezie obraz białek moczu taki jak białek osocza);
Markerami krwawienia są białka o dużych cząsteczkach: apolipoproteina A-I,
α2-makroglobulina.

BIAŁKOMOCZ POZANERKOWY cd.
4. Białkomocz w przebiegu zaburzeń odpływu chłonki (chyluria) lub krwi
żylnej
(zakrzepica żył nerkowych).
5. Białkomocz czynnościowy:
- w chorobach gorączkowych, po przegrzaniu organizmu,
- po dużym wysiłku fizycznym,
- w stanach stresowych,
- przy lordozie lędźwiowej,
- przy długim przebywaniu w pozycji stojącej (b.ortostatyczny)
Zespół Münchhausena - badany symuluje chorobę przez dodawanie do
moczu
zewnątrzpochodnego białka (b. kurze, Żelatyna); białko wykrywa się w dużych
ilościach
metodą biuretową, podczas gdy test paskowy daje wynik ujemny, lub słabo dodatni

BIAŁKOMOCZ NADMIAROWY
Najczęściej spotykany jest w:
• szpiczaku mnogim – produkowane w nadmiarze białko Bence-Jonesa
(łańcuchy lekkie kappa i lambda immunoglobulin)
• nasilonej hemolizie – hemoglobina
• zespole zmiażdżenia, rabdomiolizie – mioglobina
• zapaleniu trzustki – amylaza
• zespole wykrzepiania śródnaczyniowego (DIC) – produkty rozpadu
Fibryny
UWAGA!
Przedłużający się białkomocz nadmiarowy prowadzi zazwyczaj do
uszkodzenia błony filtracyjnej i pojawienia się białkomoczu
kłębuszkowego.
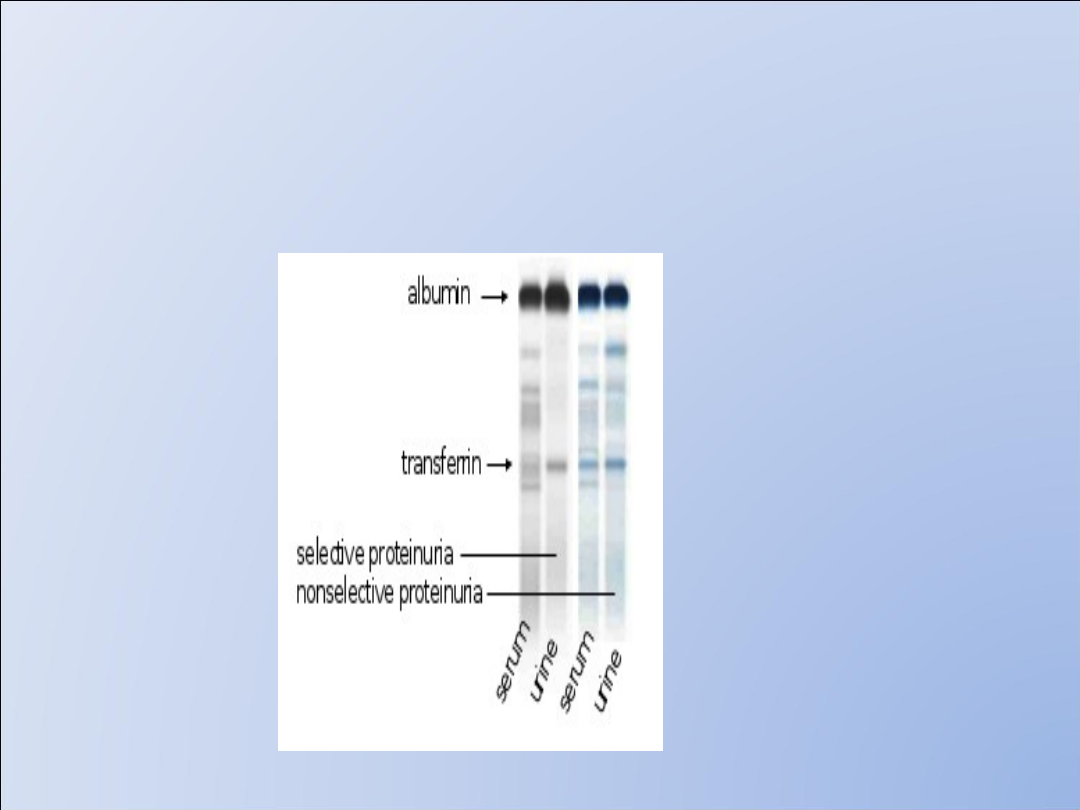
BIAŁKOMOCZ SELEKTYWNY I NIESEKTYWNY
• Albuminy + 1 globuliny - białkomocz wysoko selektywny
• Albuminy + 1 globuliny + globuliny - białkomocz umiarkowanie
selektywny
• Wszystkie frakcje białek surowicy -białkomocz niesektywny
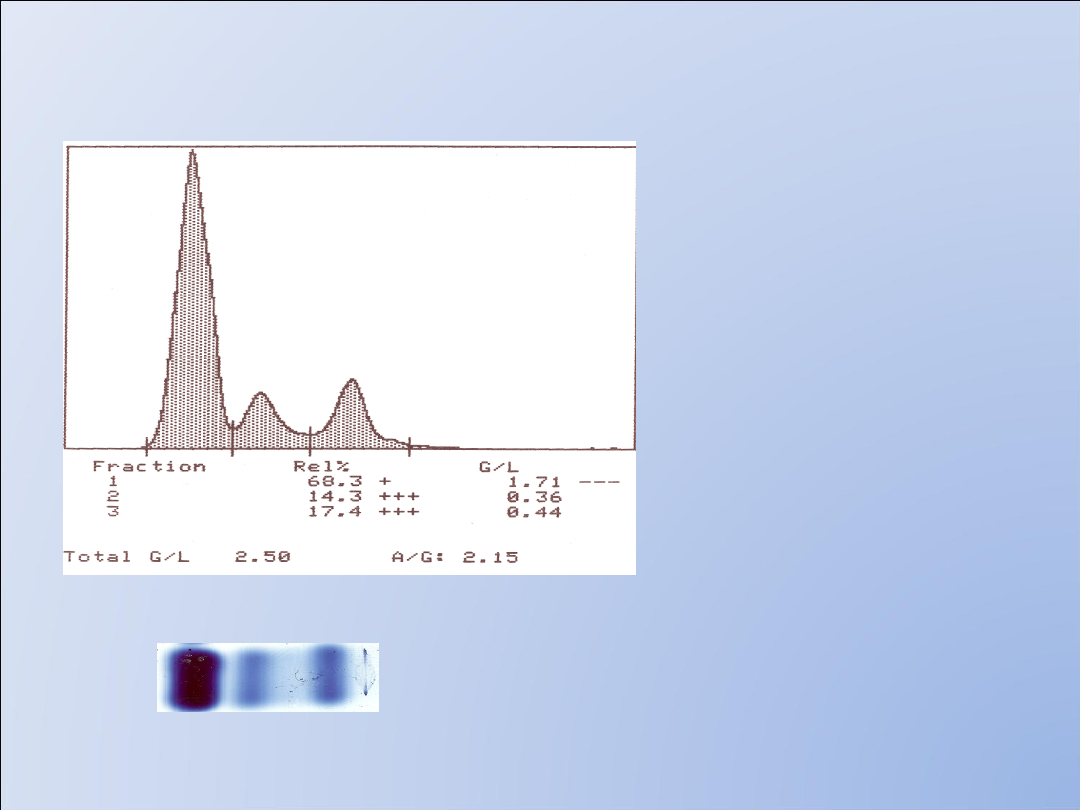
Białkomocz
selektywny
•białkomocz minimalny 30-
300mg/L
•białkomocz zawansowany
300-3000mg/L
Wzrost przepuszczalności
błony filtracyjnej dla
anionowych białek o
średniej cząsteczce 50-70
kDa
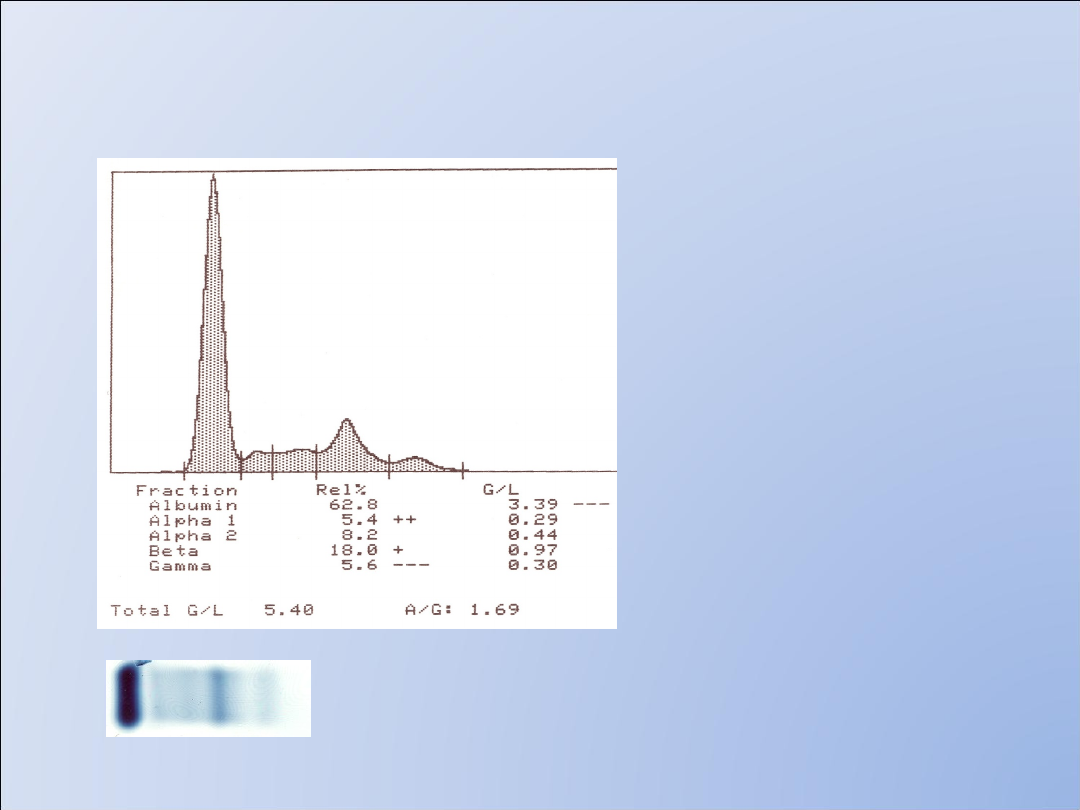
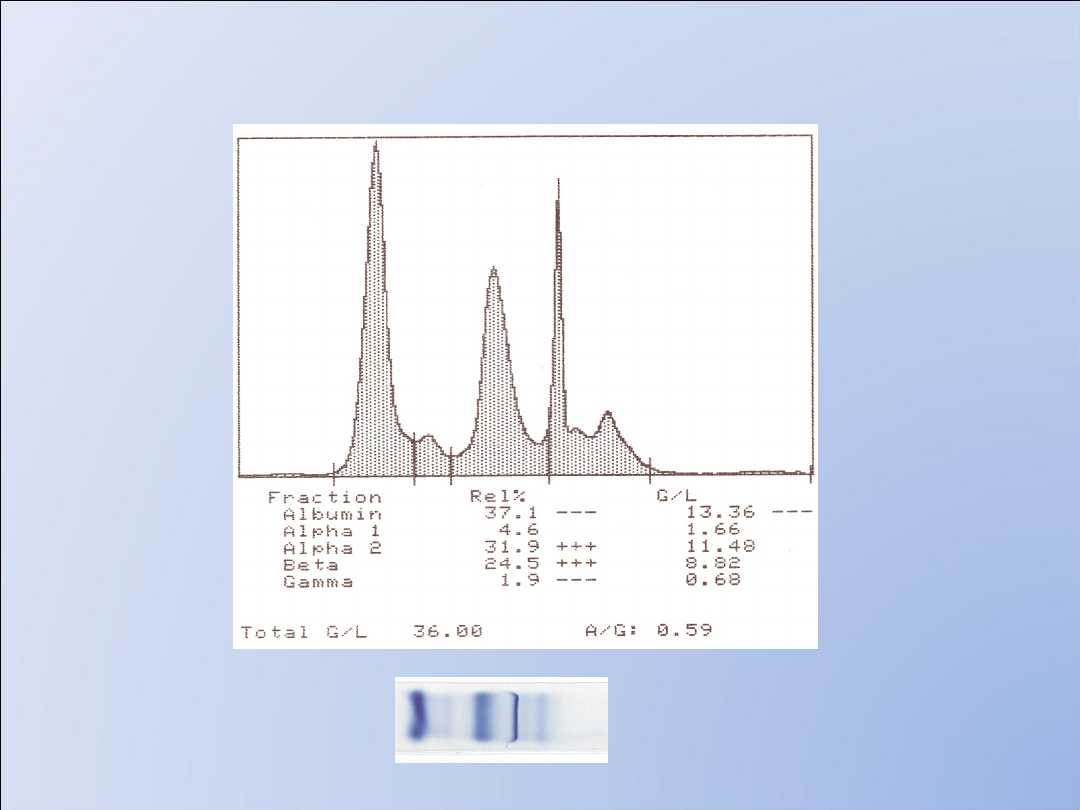
Białkomocz nieselektywny
Białkomocz> 300-
3000mg/24h
Wzrost przepuszczalności
błony filtracyjnej dla
anionowych białek o dużej
cząsteczce 50-150 kDa
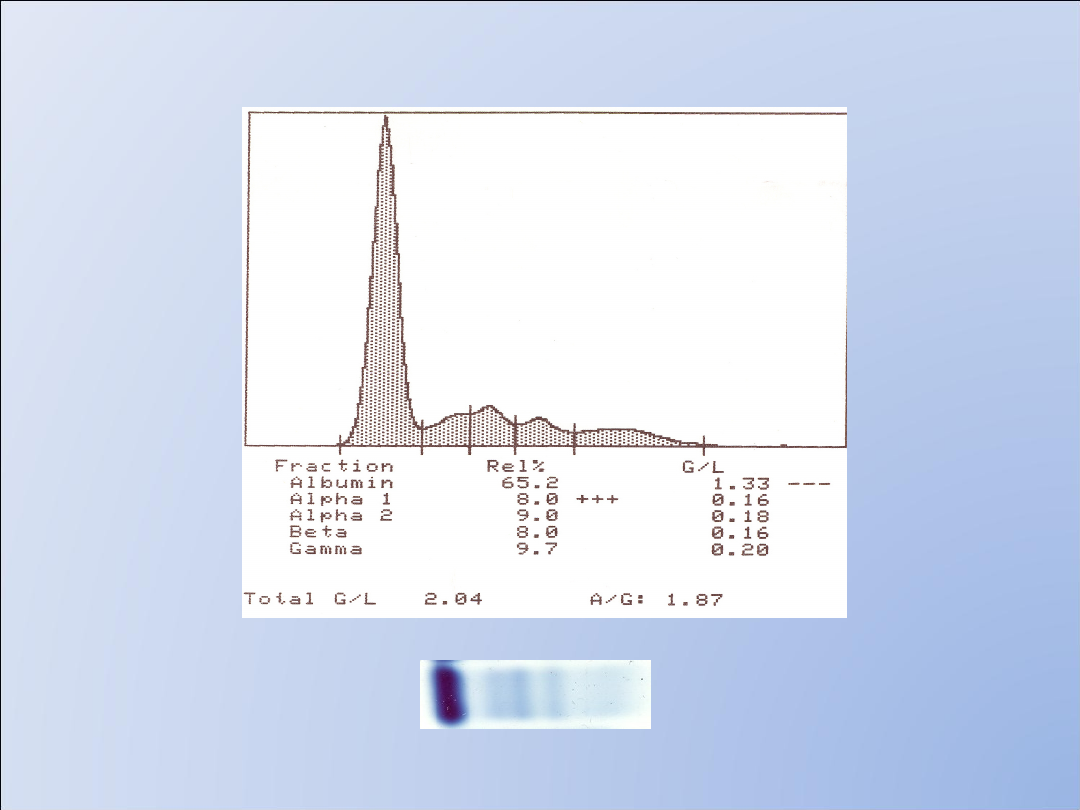
Białkomocz nieselektywny
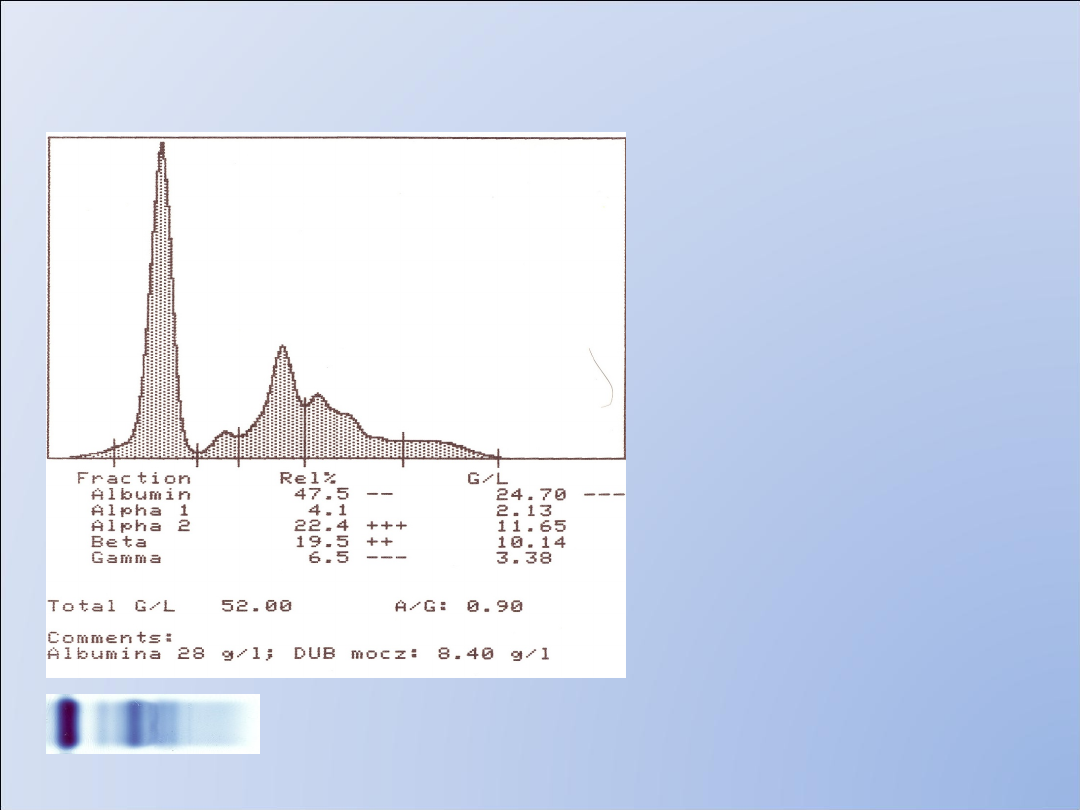
Zespół nerczycowy
Białkomocz> 3g/24h
Wzrost przepuszczalności
błony filtracyjnej dla
anionowych białek o
dużej cząsteczce 50-150
kDa
Zespół nerczycowy
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
Wyszukiwarka
Podobne podstrony:
3 ćwiczenia BADANIE asfaltów
BADANIEepipelne
BADANIA 3
BADANIA PRZESIEWOWE 2
badania laboratoryjne 6
Badania obserwacyjne prospektywne (kohortowe)
Badanie korelacji zmiennych
badanie dla potrzeb fizjoterapii
05 Badanie diagnostyczneid 5649 ppt
Badanie nerwow czaszkowych
Badanie Prezentacja
003 Badania marketingowe
więcej podobnych podstron